El origen del color en la naturaleza. Una introducción a la química ...
El origen del color en la naturaleza. Una introducción a la química ...
El origen del color en la naturaleza. Una introducción a la química ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
7 Ricardo Rafael Contreras<br />
Continuación Tab<strong>la</strong> 7.3<br />
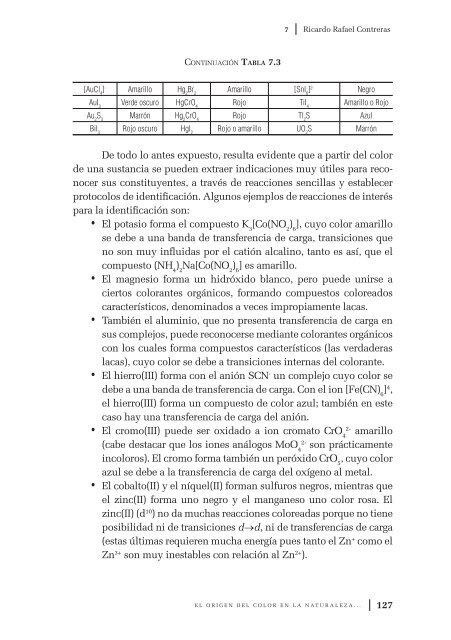
[AuCl 4<br />
] - Amarillo Hg 2<br />
Br 2<br />
Amarillo [SnI 6<br />
] 2- Negro<br />
AuI 3<br />
Verde oscuro HgCrO 4<br />
Rojo TiI 4<br />
Amarillo o Rojo<br />
Au 2<br />
S 3<br />
Marrón Hg 2<br />
CrO 4<br />
Rojo Tl 2<br />
S Azul<br />
BiI 3<br />
Rojo oscuro HgI 2<br />
Rojo o amarillo UO 2<br />
S Marrón<br />
De todo lo antes expuesto, resulta evid<strong>en</strong>te que a partir <strong>del</strong> <strong>color</strong><br />
de una sustancia se pued<strong>en</strong> extraer indicaciones muy útiles para reconocer<br />
sus constituy<strong>en</strong>tes, a través de reacciones s<strong>en</strong>cil<strong>la</strong>s y establecer<br />
protocolos de id<strong>en</strong>tificación. Algunos ejemplos de reacciones de interés<br />
para <strong>la</strong> id<strong>en</strong>tificación son:<br />
. <strong>El</strong> potasio forma el compuesto K 3<br />
[Co(NO 2<br />
) 6<br />
], cuyo <strong>color</strong> amarillo<br />
se debe a una banda de transfer<strong>en</strong>cia de carga, transiciones que<br />
no son muy influidas por el catión alcalino, tanto es así, que el<br />
compuesto (NH 4<br />
) 2<br />
Na[Co(NO 2<br />
) 6<br />
] es amarillo.<br />
. <strong>El</strong> magnesio forma un hidróxido b<strong>la</strong>nco, pero puede unirse a<br />
ciertos <strong>color</strong>antes orgánicos, formando compuestos <strong>color</strong>eados<br />
característicos, d<strong>en</strong>ominados a veces impropiam<strong>en</strong>te <strong>la</strong>cas.<br />
. También el aluminio, que no pres<strong>en</strong>ta transfer<strong>en</strong>cia de carga <strong>en</strong><br />
sus complejos, puede reconocerse mediante <strong>color</strong>antes orgánicos<br />
con los cuales forma compuestos característicos (<strong>la</strong>s verdaderas<br />
<strong>la</strong>cas), cuyo <strong>color</strong> se debe a transiciones internas <strong>del</strong> <strong>color</strong>ante.<br />
. <strong>El</strong> hierro(III) forma con el anión SCN - un complejo cuyo <strong>color</strong> se<br />
debe a una banda de transfer<strong>en</strong>cia de carga. Con el ion [Fe(CN) 6<br />
] 4 ,<br />
el hierro(III) forma un compuesto de <strong>color</strong> azul; también <strong>en</strong> este<br />
caso hay una transfer<strong>en</strong>cia de carga <strong>del</strong> anión.<br />
. <strong>El</strong> cromo(III) puede ser oxidado a ion cromato CrO 4<br />
2-<br />
amarillo<br />
(cabe destacar que los iones análogos MoO 4<br />
2-<br />
son prácticam<strong>en</strong>te<br />
in<strong>color</strong>os). <strong>El</strong> cromo forma también un peróxido CrO 5<br />
, cuyo <strong>color</strong><br />
azul se debe a <strong>la</strong> transfer<strong>en</strong>cia de carga <strong>del</strong> oxíg<strong>en</strong>o al metal.<br />
. <strong>El</strong> cobalto(II) y el níquel(II) forman sulfuros negros, mi<strong>en</strong>tras que<br />
el zinc(II) forma uno negro y el manganeso uno <strong>color</strong> rosa. <strong>El</strong><br />
zinc(II) (d 10 ) no da muchas reacciones <strong>color</strong>eadas porque no ti<strong>en</strong>e<br />
posibilidad ni de transiciones d→d, ni de transfer<strong>en</strong>cias de carga<br />
(estas últimas requier<strong>en</strong> mucha <strong>en</strong>ergía pues tanto el Zn + como el<br />
Zn 3+ son muy inestables con re<strong>la</strong>ción al Zn 2+ ).<br />
E L O R I G E N D E L C O L O R E N L A N A T U R A L E Z A . . .<br />
127