Tema 13. Compuestos 1,6-difuncionalizados. Empleo de la reacción ...
Tema 13. Compuestos 1,6-difuncionalizados. Empleo de la reacción ...
Tema 13. Compuestos 1,6-difuncionalizados. Empleo de la reacción ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Síntesis Orgánica<br />
<strong>Tema</strong> <strong>13.</strong> <strong>Compuestos</strong> 1,6-<strong>difuncionalizados</strong>. <strong>Empleo</strong> <strong>de</strong> <strong>la</strong> <strong>reacción</strong> <strong>de</strong><br />
Baeyer-Villiger.<br />
.<br />
La estrategia más usual para el análisis los compuestos 1,6<strong>difuncionalizados</strong><br />
es <strong>la</strong> reconexión <strong>de</strong> los carbonos en posición re<strong>la</strong>tiva 1,6 en<br />
forma <strong>de</strong> doble en<strong>la</strong>ce:<br />
R 1<br />
O<br />
1<br />
2<br />
3<br />
4<br />
5<br />
6<br />
O<br />
R 2<br />
reconexión<br />
Por ejemplo, el 6-fenil-6-oxo-hexanoato <strong>de</strong> etilo es un compuesto 1,6difuncionalizado<br />
que se pue<strong>de</strong> analizar mediante <strong>la</strong> estrategia <strong>de</strong> reconexión:<br />
Retrosíntesis<br />
O<br />
1<br />
2<br />
6-fenil-6-oxohexanoato <strong>de</strong> etilo<br />
3<br />
4<br />
5<br />
HO<br />
6<br />
O<br />
OEt<br />
reconexión<br />
La reconexión <strong>de</strong> los dos carbonos carbonílicos, en forma <strong>de</strong> en<strong>la</strong>ce<br />
doble, lleva al 1-fenilciclohexeno. Este compuesto se podría obtener en <strong>la</strong><br />
<strong>de</strong>shidratación <strong>de</strong>l 1-fenilciclohexan-1-ol, que a su vez se <strong>de</strong>sconecta a un<br />
sintón catiónico, cuyo equivalente sintético es <strong>la</strong> ciclohexanona, y a un sintón<br />
aniónico, cuyo equivalente sintético es un reactivo organometálico, por ejemplo<br />
el fenil-litio o el bromuro <strong>de</strong> fenilmagnesio.<br />
La síntesis se podría formu<strong>la</strong>r <strong>de</strong>l siguiente modo:<br />
3<br />
4<br />
2<br />
5<br />
3<br />
4<br />
1<br />
6<br />
2<br />
5<br />
R 1<br />
R 2<br />
HO<br />
1<br />
6<br />
H<br />
IGF<br />
1
<strong>Tema</strong> 13<br />
Síntesis<br />
Ph<br />
O<br />
Br<br />
+ Mg<br />
O<br />
OEt<br />
THF<br />
EtOH<br />
H<br />
Ph<br />
O<br />
MgBr<br />
O<br />
OH<br />
O<br />
1º. O 3<br />
2º. H 2O 2<br />
OH<br />
H 3PO 4<br />
calor<br />
La <strong>reacción</strong> entre el bromuro <strong>de</strong> fenilmagnesio y <strong>la</strong> ciclohexanona daría<br />
lugar al 1-fenilciclohexan-1-ol. La <strong>de</strong>shidratación <strong>de</strong> este compuesto, por<br />
<strong>reacción</strong> con un ácido no nucleofílico, como el H3PO4, conduciría al 1fenilciclohexeno.<br />
La ozonolisis seguida <strong>de</strong> tratamiento <strong>de</strong>l ozónido con H2O2<br />
permitiría <strong>la</strong> obtención <strong>de</strong>l ácido 6-fenil-6-oxohexanoico, que mediante un<br />
proceso <strong>de</strong> esterificación <strong>de</strong> tipo Fischer proporcionaría el cetoéster <strong>de</strong>seado.<br />
La reconexión <strong>de</strong> compuestos 1,6-<strong>difuncionalizados</strong> conduce a anillos<br />
ciclohexénicos. Un método que permite <strong>la</strong> obtención <strong>de</strong> este tipo <strong>de</strong> sistemas<br />
es <strong>la</strong> <strong>reacción</strong> <strong>de</strong> Diels-Al<strong>de</strong>r. A continuación, se propone un esquema<br />
retrosintético para un compuesto <strong>la</strong>ctónico bicíclico que presenta en su análisis<br />
una re<strong>la</strong>ción 1,6-difuncionalizada.<br />
Retrosíntesis<br />
MeOOC<br />
H<br />
O<br />
O<br />
H<br />
+<br />
MeOOC<br />
C-O<br />
éster<br />
OH<br />
6<br />
H<br />
5<br />
O<br />
2<br />
1<br />
4<br />
3<br />
H<br />
Diels-Al<strong>de</strong>r<br />
OH<br />
OR<br />
6<br />
MeOOC<br />
OH<br />
1<br />
2<br />
ROOC OH<br />
1,6-diCO<br />
1<br />
6<br />
5<br />
2<br />
H<br />
3<br />
H<br />
4<br />
2<br />
reconexión<br />
5<br />
H<br />
H<br />
3<br />
4<br />
OH
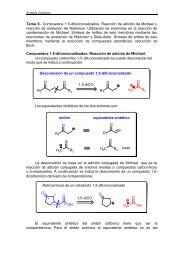
Síntesis Orgánica<br />
La <strong>de</strong>sconexión <strong>de</strong>l en<strong>la</strong>ce C-O <strong>de</strong> <strong>la</strong> <strong>la</strong>ctona lleva a un hidroxidiéster que,<br />
mediante <strong>la</strong> reconexión 1,6, lleva a un compuesto bicíclico que contiene un<br />
anillo ciclohexénico. Este sustrato se pue<strong>de</strong> analizar mediante <strong>la</strong> <strong>reacción</strong> <strong>de</strong><br />
Diels-Al<strong>de</strong>r, lo que conduce al ciclopentadieno y al alcohol alílico<br />
(CH2=CHCH2OH), que <strong>de</strong>bería ser el dienófilo <strong>de</strong> <strong>la</strong> <strong>reacción</strong>. Sin embargo,<br />
este compuesto no es un buen dienófilo porque el doble en<strong>la</strong>ce no está<br />
conjugado con un grupo electrón-atrayente. Un equivalente sintético para el<br />
dienófilo podría ser <strong>la</strong> acroleína. De acuerdo con estas i<strong>de</strong>as, el esquema<br />
sintético sería:<br />
Síntesis<br />
+<br />
MeOOC<br />
MeOOC<br />
NaBH 4,<br />
EtOH<br />
MeOOC<br />
MeOOC<br />
O<br />
H<br />
HO<br />
H<br />
CHO<br />
H<br />
H<br />
O<br />
H<br />
estado <strong>de</strong> transición<br />
endo<br />
H 2O<br />
H<br />
H<br />
calor<br />
MeOOC<br />
MeOOC<br />
H<br />
MeOOC<br />
O<br />
O<br />
O<br />
H<br />
O<br />
H<br />
CHO<br />
MeOOC<br />
HO OH<br />
KHCO 3<br />
MeI<br />
H<br />
H<br />
O<br />
1º. O 3<br />
2º. H 2O 2<br />
HOOC<br />
HOOC<br />
La síntesis se iniciaría con <strong>la</strong> <strong>reacción</strong> <strong>de</strong> Diels-Al<strong>de</strong>r entre el<br />
ciclopentadieno y <strong>la</strong> acroleína. Los tres estereocentros que presenta el<br />
producto final <strong>de</strong> <strong>la</strong> síntesis se crearían <strong>de</strong> forma estereocontro<strong>la</strong>da en <strong>la</strong><br />
<strong>reacción</strong> <strong>de</strong> Diels-Al<strong>de</strong>r merced a <strong>la</strong> aproximación endo entre el dieno y el<br />
dienófilo. Antes <strong>de</strong> proce<strong>de</strong>r a <strong>la</strong> ruptura oxidativa <strong>de</strong>l doble en<strong>la</strong>ce, en el<br />
aducto <strong>de</strong> Diels-Al<strong>de</strong>r, sería conveniente proteger <strong>la</strong> función al<strong>de</strong>hído para<br />
evitar su posible oxidación. Esta protección se podría llevar a cabo mediante <strong>la</strong><br />
<strong>reacción</strong> con etilenglicol , bajo catálisis ácida, lo que convertiría al al<strong>de</strong>hído en<br />
un acetal. A continuación, se sometería el compuesto protegido a <strong>la</strong> <strong>reacción</strong><br />
<strong>de</strong> ozonolisis y subsiguiente tratamiento oxidativo con H2O2. Esto daría un<br />
H<br />
O<br />
H<br />
O<br />
O<br />
H<br />
H<br />
O<br />
O<br />
3
<strong>Tema</strong> 13<br />
diácido que se podría convertir en el diester metílico mediante <strong>reacción</strong> con<br />
carbonato sodico y yoduro <strong>de</strong> metilo. Este método <strong>de</strong> esterificación evitaría <strong>la</strong><br />
<strong>de</strong>sprotección <strong>de</strong>l acetal puesto que se lleva a cabo en condiciones básicas. A<br />
continuación, se proce<strong>de</strong>ría a <strong>la</strong> <strong>de</strong>sprotección <strong>de</strong>l acetal por hidrólisis acuosa.<br />
Por último, <strong>la</strong> reducción <strong>de</strong> al<strong>de</strong>hído a alcohol y <strong>la</strong> <strong>reacción</strong> <strong>de</strong> <strong>la</strong>ctonización<br />
proporcionarían <strong>la</strong> <strong>la</strong>ctona bicíclica.<br />
La <strong>reacción</strong> <strong>de</strong> esterificación por tratamiento <strong>de</strong> los correspondientes<br />
ácidos carboxílicos con una base y un haluro <strong>de</strong> alquilo es una alternativa al<br />
tradicional método <strong>de</strong> esterificación <strong>de</strong> Fischer, y su empleo es conveniente<br />
cuando el sustrato que se va a esterificar presenta funciones sensibles a<br />
ácidos. El mecanismo <strong>de</strong> <strong>la</strong> esterificación con base y haluros <strong>de</strong> alquilo es muy<br />
simple. En primer lugar se produce <strong>la</strong> <strong>reacción</strong> entre el ácido carboxílico y <strong>la</strong><br />
base, lo cual genera el correspondiente carboxi<strong>la</strong>to. Este compuesto es una<br />
especie nucleofílica que reacciona, mediante un mecanismo SN2, con haluros<br />
<strong>de</strong> alquilo primarios para dar el éster.<br />
O<br />
R OH<br />
O<br />
R O<br />
Na<br />
Mecanismo <strong>de</strong> <strong>la</strong> esterificación en medio básico<br />
+ Na 2CO 3<br />
CH 3<br />
I<br />
O<br />
O<br />
R O<br />
R O<br />
CH 3<br />
Na<br />
+ NaHCO 3<br />
+ NaI<br />
4
Síntesis Orgánica<br />
La <strong>reacción</strong> <strong>de</strong> baeyer-Villiger<br />
La <strong>reacción</strong> <strong>de</strong> al<strong>de</strong>hídos y cetonas con perácidos proporciona ésteres.<br />
Este proceso oxidativo se conoce como <strong>reacción</strong> <strong>de</strong> Baeyer-Villiger.<br />
R<br />
O<br />
R<br />
al<strong>de</strong>hído o<br />
cetona<br />
+<br />
O<br />
R´ O O H<br />
O<br />
R O R<br />
O<br />
+<br />
R´<br />
H<br />
O<br />
perácido éster ácido carboxílico<br />
El mecanismo <strong>de</strong> <strong>la</strong> <strong>reacción</strong> <strong>de</strong> Baeyer-Villiger se inicia con <strong>la</strong> adición<br />
nucleofílica <strong>de</strong>l perácido al compuesto carbonílico. A continuación, se produce<br />
<strong>la</strong> etapa c<strong>la</strong>ve <strong>de</strong>l proceso que es <strong>la</strong> transposición que experimenta el<br />
intermedio tetraédrico para formar el éster y el ácido carboxílico que es <strong>la</strong> forma<br />
reducida <strong>de</strong>l perácido.<br />
R<br />
O<br />
R<br />
H O O R´<br />
Mecanismo <strong>de</strong> <strong>la</strong> <strong>reacción</strong> <strong>de</strong> Baeyer-Villiger<br />
O<br />
R<br />
H<br />
O<br />
R<br />
O<br />
O R´<br />
O<br />
O<br />
R O R<br />
+ R´ O H<br />
O<br />
Cuando <strong>la</strong> <strong>reacción</strong> <strong>de</strong> Baeyer-Villiger se efectúa sobre cetonas simétricas<br />
sólo es posible <strong>la</strong> formación <strong>de</strong> un éster:<br />
O<br />
O<br />
MCPBA<br />
CH 2Cl 2<br />
MCPBA<br />
CH 2Cl 2<br />
MCPBA = ácido m-cloroperoxibenzoico<br />
Sin embargo, si <strong>la</strong> <strong>reacción</strong> se lleva a cabo sobre cetonas<br />
asimétricamente sustituidas se pue<strong>de</strong>n formar, a priori, dos ésteres, puesto que<br />
los grupos R que pue<strong>de</strong>n migrar son diferentes:<br />
O<br />
O<br />
O<br />
O<br />
5
<strong>Tema</strong> 13<br />
O<br />
MCPBA<br />
CH 2Cl 2<br />
Este falta <strong>de</strong> regioselectividad en <strong>la</strong> migración <strong>de</strong> los grupos R pue<strong>de</strong> ser<br />
un inconveniente en <strong>de</strong>terminadas reacciones <strong>de</strong> Baeyer-Villiger, como en el<br />
caso <strong>de</strong> <strong>la</strong> 3-hexanona. Sin embargo, muchos grupos R muestran una c<strong>la</strong>ra<br />
aptitud migratoria que <strong>de</strong>pen<strong>de</strong>, fundamentalmente, <strong>de</strong> factores electrónicos.<br />
La aptitud migratoria <strong>de</strong> diferentes grupos en <strong>la</strong> <strong>reacción</strong> <strong>de</strong> Baeyer-Villiger es<br />
<strong>la</strong> siguiente:<br />
Aptitud migratoria en <strong>la</strong> <strong>reacción</strong> <strong>de</strong> Baeyer-Villiger<br />
H > fenilo > alquilo 3º > alquilo 2º > alquilo 1º > metilo<br />
En el siguiente esquema se dan algunos ejemplos <strong>de</strong> reacciones <strong>de</strong><br />
Baeyer-Villiger regioselectivas:<br />
O<br />
O<br />
O<br />
O<br />
O<br />
MCPBA O<br />
CH 2Cl 2<br />
MCPBA<br />
CH 2Cl 2<br />
MCPBA<br />
CH 2Cl 2<br />
A continuación, se indica <strong>la</strong> retrosíntesis <strong>de</strong> un diol mediante <strong>la</strong> aplicación,<br />
entre otras estrategias, <strong>de</strong> <strong>la</strong> <strong>reacción</strong> <strong>de</strong> transposición <strong>de</strong> Baeyer-Villiger.<br />
O<br />
O<br />
O<br />
O<br />
+<br />
O<br />
O<br />
O<br />
6
Síntesis Orgánica<br />
Retrosíntesis:<br />
OH<br />
OH<br />
+<br />
OH<br />
O<br />
CH 2<br />
C<br />
O<br />
OR<br />
D-A<br />
OH<br />
reconexión<br />
COOR O O<br />
O<br />
Baeyer-Villiger<br />
La retrosíntesis se inicia con <strong>la</strong> <strong>de</strong>sconexión <strong>de</strong>l sistema <strong>de</strong> alcohol<br />
terciario a un éster. El compuesto resultante <strong>de</strong> este análisis, un hidroxiéster,<br />
se pue<strong>de</strong> reconectar a una <strong>la</strong>ctona, que se podría obtener mediante <strong>la</strong> <strong>reacción</strong><br />
<strong>de</strong> Baeyer-Villiger <strong>de</strong> una cetona bicíclica. Este compuesto, mediante <strong>la</strong> adición<br />
<strong>de</strong> un doble en<strong>la</strong>ce, se <strong>de</strong>sconecta al 1,4-ciclohexadieno y a <strong>la</strong> cetena cuyo<br />
equivalente sintético pue<strong>de</strong> ser el nitroetileno.<br />
La síntesis se formu<strong>la</strong>ria <strong>de</strong>l siguiente modo:<br />
Síntesis:<br />
O 2N<br />
OH<br />
H<br />
OH<br />
NO 2<br />
TiCl 3<br />
H 2O<br />
OH<br />
O<br />
O<br />
AGF<br />
H 2, Pd/C<br />
CH 3MgI<br />
(exceso)<br />
THF<br />
MCPBA<br />
O<br />
O<br />
O O<br />
7
<strong>Tema</strong> 13<br />
La síntesis se iniciaría con <strong>la</strong> <strong>reacción</strong> <strong>de</strong> Diels-Al<strong>de</strong>r entre el 1.4ciclohexadieno<br />
y el nitroetileno, el equivalente sintético <strong>de</strong> <strong>la</strong> cetena. La<br />
conversión <strong>de</strong>l grupo nitro en cetona, mediante <strong>la</strong> <strong>reacción</strong> <strong>de</strong> Nef, seguida <strong>de</strong><br />
hidrogenación <strong>de</strong>l doble en<strong>la</strong>ce llevaría a una cetona bicíclica. La <strong>reacción</strong> <strong>de</strong><br />
Baeyer-Villiger <strong>de</strong> este compuesto daría lugar, <strong>de</strong> forma regioselectiva a una<br />
<strong>la</strong>ctona bicíclica. La <strong>reacción</strong> <strong>de</strong> <strong>la</strong> <strong>la</strong>ctona con un exceso <strong>de</strong> un reactivo metilmetálico,<br />
por ejemplo yoduro <strong>de</strong> metilmagnesio, proporcionaría, a través <strong>de</strong> <strong>la</strong><br />
hidroxicetona indicada entre los corchetes, el producto <strong>de</strong>seado.<br />
8