capitulo_muestra_c03.pdf (10642.0K)
capitulo_muestra_c03.pdf (10642.0K) capitulo_muestra_c03.pdf (10642.0K)
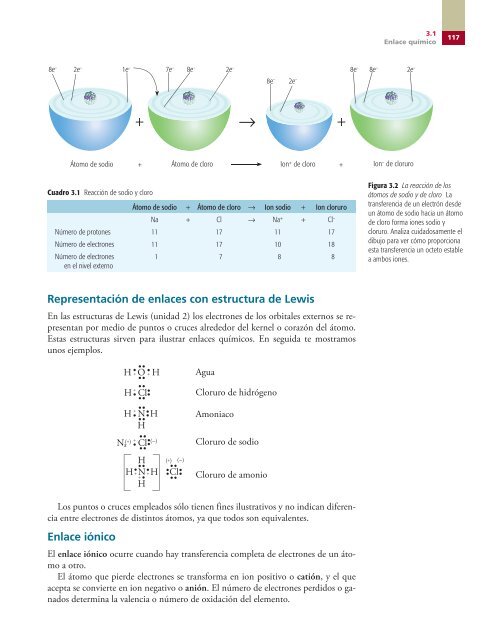
8e – 2e – 1e – 7e – 8e – 2e – Cuadro 3.1 Reacción de sodio y cloro Átomo de sodio + Átomo de cloro → Ion sodio + Ion cloruro Na + Cl → Na + + Cl – Número de protones 11 17 11 17 Número de electrones 11 17 10 18 Número de electrones en el nivel externo 1 7 8 8 Representación de enlaces con estructura de Lewis En las estructuras de Lewis (unidad 2) los electrones de los orbitales externos se representan por medio de puntos o cruces alrededor del kernel o corazón del átomo. Estas estructuras sirven para ilustrar enlaces químicos. En seguida te mostramos unos ejemplos. Los puntos o cruces empleados sólo tienen fines ilustrativos y no indican diferencia entre electrones de distintos átomos, ya que todos son equivalentes. Enlace iónico + + + El enlace iónico ocurre cuando hay transferencia completa de electrones de un átomo a otro. El átomo que pierde electrones se transforma en ion positivo o catión, y el que acepta se convierte en ion negativo o anión. El número de electrones perdidos o ganados determina la valencia o número de oxidación del elemento. 8e – 2e – + 8e – 8e – 3.1 Enlace químico Átomo de sodio Átomo de cloro Ion + de cloro Ion – de cloruro H • •• O • + + H •• + H • Cl •• •• H N H H •• + • •••• •• Na Cl (–) •• + (+) • •• H H • •• N • + + +• H H •• •••• •• (+) (–) Cl •• Agua Cloruro de hidrógeno Amoniaco Cloruro de sodio Cloruro de amonio 2e – 117 Figura 3.2 La reacción de los átomos de sodio y de cloro La transferencia de un electrón desde un átomo de sodio hacia un átomo de cloro forma iones sodio y cloruro. Analiza cuidadosamente el dibujo para ver cómo proporciona esta transferencia un octeto estable a ambos iones. 03-RECIO_QUIMICA_INORG.indd 117 15/3/08 13:56:28
118 Unidad 3 Enlace químico: modelos de enlaces e interacciones intermoleculares ¿Sabías que...? Cuando el átomo es neutro se indica con cero (0) en el ángulo superior derecho. Figura 3.3 Disposición de iones de sodio y de cloruro en las moléculas del NaCl. Na – 1e – Na + • •• •• •• •• •• •• •• Mg – 2e – Mg2+ Al – 3e – Al3+ N + 3e – N3– O + 2e – O2– F + 1e – F1– • • •• •• •• • La fuerza de atracción de iones de distinta carga es de carácter electrostático y por eso el enlace iónico se llama también electrovalente. Observa los siguientes ejemplos de formación de compuestos electrovalentes: Na0 + F Na1+ + F 1– 1s22s22p63s1 + 1s22s22p5 1s22s22p6 + 1s22s22p6 2Na0 + O 2Na1+ + O 2– Mg + 2 F Mg2+ + 2 F 1– Na0 + Cl Na1+ + Cl 1– •• • •• •• • •• • •• •• • •• •• • •• •• °° •• • •• •• •• ° •• •• •• •• •• •• ° •• •• •• •• ° ° • Respecto de los anteriores compuestos no podemos hablar de moléculas sencillas, por ejemplo, el cloruro de sodio Na + Cl – , en realidad es una combinación de muchos iones sodio con muchos iones cloruro. En estado sólido se encuentran acomodados de tal forma que cada ion sodio está rodeado por seis iones cloruro y, a su vez, cada ion cloruro está rodeado por seis iones sodio (figura 3.3). Ion cloruro Ion sodio Celda unitaria Ion sodio 5.64 Å Ion cloruro 03-RECIO_QUIMICA_INORG.indd 118 15/3/08 13:56:30
- Page 1 and 2: Unidad 3 Enlace químico: modelos d
- Page 3 and 4: ¿Cuánto sabes? 1. ¿Qué signi ca
- Page 5: 116 Unidad 3 Enlace químico: model
- Page 9 and 10: 120 Unidad 3 Enlace químico: model
- Page 11 and 12: 122 Unidad 3 Enlace químico: model
- Page 13 and 14: 124 Manos a la obra Unidad 3 Enlace
- Page 15 and 16: 126 e - e - Unidad 3 Enlace químic
- Page 17 and 18: 128 Unidad 3 Enlace químico: model
- Page 19 and 20: 130 Investiga Unidad 3 Enlace quím
- Page 21 and 22: 132 Unidad 3 Enlace químico: model
- Page 23 and 24: 134 Unidad 3 Enlace químico: model
- Page 25 and 26: 136 Investiga Unidad 3 Enlace quím
- Page 27 and 28: 138 Unidad 3 Enlace químico: model
- Page 29 and 30: 140 Unidad 3 Enlace químico: model
8e – 2e – 1e – 7e – 8e – 2e –<br />
Cuadro 3.1 Reacción de sodio y cloro<br />
Átomo de sodio + Átomo de cloro → Ion sodio + Ion cloruro<br />
Na + Cl → Na + + Cl –<br />
Número de protones 11 17 11 17<br />
Número de electrones 11 17 10 18<br />
Número de electrones<br />
en el nivel externo<br />
1 7 8 8<br />
Representación de enlaces con estructura de Lewis<br />
En las estructuras de Lewis (unidad 2) los electrones de los orbitales externos se representan<br />
por medio de puntos o cruces alrededor del kernel o corazón del átomo.<br />
Estas estructuras sirven para ilustrar enlaces químicos. En seguida te mostramos<br />
unos ejemplos.<br />
Los puntos o cruces empleados sólo tienen fines ilustrativos y no indican diferencia<br />
entre electrones de distintos átomos, ya que todos son equivalentes.<br />
Enlace iónico<br />
+<br />
<br />
+ +<br />
El enlace iónico ocurre cuando hay transferencia completa de electrones de un átomo<br />
a otro.<br />
El átomo que pierde electrones se transforma en ion positivo o catión, y el que<br />
acepta se convierte en ion negativo o anión. El número de electrones perdidos o ganados<br />
determina la valencia o número de oxidación del elemento.<br />
8e –<br />
2e –<br />
+<br />
8e – 8e –<br />
3.1<br />
Enlace químico<br />
Átomo de sodio Átomo de cloro Ion + de cloro Ion – de cloruro<br />
H •<br />
••<br />
O • + + H<br />
••<br />
+<br />
H • Cl<br />
••<br />
••<br />
H N H<br />
H ••<br />
+<br />
•<br />
••••<br />
••<br />
Na Cl (–)<br />
•• + (+)<br />
•<br />
••<br />
H<br />
H •<br />
••<br />
N • + +<br />
+•<br />
H<br />
H<br />
••<br />
••••<br />
••<br />
(+) (–)<br />
Cl<br />
••<br />
Agua<br />
Cloruro de hidrógeno<br />
Amoniaco<br />
Cloruro de sodio<br />
Cloruro de amonio<br />
2e –<br />
117<br />
Figura 3.2 La reacción de los<br />
átomos de sodio y de cloro La<br />
transferencia de un electrón desde<br />
un átomo de sodio hacia un átomo<br />
de cloro forma iones sodio y<br />
cloruro. Analiza cuidadosamente el<br />
dibujo para ver cómo proporciona<br />
esta transferencia un octeto estable<br />
a ambos iones.<br />
03-RECIO_QUIMICA_INORG.indd 117 15/3/08 13:56:28