SÓLIDOS
SÓLIDOS SÓLIDOS
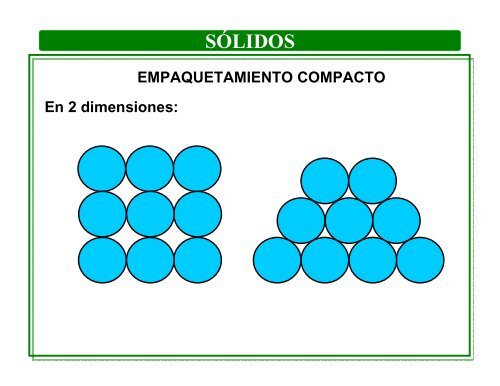
En 2 dimensiones: SÓLIDOS EMPAQUETAMIENTO COMPACTO
- Page 2 and 3: En 3 dimensiones: SÓLIDOS EMPAQUET
- Page 4 and 5: SÓLIDOS EMPAQUETAMIENTO COMPACTO
- Page 6 and 7: SÓLIDOS EMPAQUETAMIENTO COMPACTO H
- Page 8 and 9: SÓLIDOS EMPAQUETAMIENTO COMPACTO C
- Page 10 and 11: SÓLIDOS EMPAQUETAMIENTO COMPACTO C
- Page 12 and 13: HUECO CÚBICO SÓLIDOS CELDA CÚBIC
- Page 14 and 15: SÓLIDOS CRISTALES METALICOS
- Page 16 and 17: Redes típicas r ( + ) r ( −) SÓ
- Page 18 and 19: Redes típicas SÓLIDOS Estructura
- Page 20 and 21: Redes típicas SÓLIDOS Estructura
- Page 22 and 23: SÓLIDOS Redes típicas Estructura
- Page 24 and 25: SÓLIDOS Ejercicio 2: Sabiendo que
- Page 26 and 27: SÓLIDOS ENERGÍA RETICULAR − ΔH
- Page 28 and 29: Born - Mayer SÓLIDOS ENERGÍA RETI
- Page 30 and 31: SÓLIDOS ENERGÍA RETICULAR ( kJ/mo
- Page 32 and 33: Ejercicio 3: ¿Cuál de los siguien
- Page 34 and 35: DIFRACCION DE RAYOS X SÓLIDOS ECUA
- Page 36 and 37: SÓLIDOS ECUACIÓN DE BRAGG n. λ =
En 2 dimensiones:<br />
<strong>SÓLIDOS</strong><br />
EMPAQUETAMIENTO COMPACTO
En 3 dimensiones:<br />
<strong>SÓLIDOS</strong><br />
EMPAQUETAMIENTO COMPACTO
<strong>SÓLIDOS</strong><br />
EMPAQUETAMIENTO COMPACTO<br />
A B<br />
CÚBICO HEXAGONAL
<strong>SÓLIDOS</strong><br />
EMPAQUETAMIENTO COMPACTO
<strong>SÓLIDOS</strong><br />
EMPAQUETAMIENTO COMPACTO<br />
HEXAGONAL
<strong>SÓLIDOS</strong><br />
EMPAQUETAMIENTO COMPACTO<br />
HEXAGONAL
<strong>SÓLIDOS</strong><br />
EMPAQUETAMIENTO COMPACTO<br />
HEXAGONAL<br />
Número de coordinación = 12<br />
Eficacia = 74 %
<strong>SÓLIDOS</strong><br />
EMPAQUETAMIENTO COMPACTO<br />
CÚBICO
<strong>SÓLIDOS</strong><br />
EMPAQUETAMIENTO COMPACTO<br />
CÚBICO
<strong>SÓLIDOS</strong><br />
EMPAQUETAMIENTO COMPACTO<br />
CÚBICO<br />
Número de coordinación = 12<br />
Eficacia = 74 %
<strong>SÓLIDOS</strong><br />
Estructuras de empaquetamiento compacto de esferas<br />
rígidas idénticas es adoptada por la mayoría de los sólidos<br />
monoatómicos:<br />
METALES y GASES NOBLES<br />
En el caso de compuestos binarios del tipo AB, AB 2, A 2B<br />
donde A y B tienen tamaños distintos, es necesario describir<br />
lo que se llama formación de “sitios intersticiales”:<br />
CRISTALES IÓNICOS
HUECO<br />
CÚBICO<br />
<strong>SÓLIDOS</strong><br />
CELDA CÚBICA SIMPLE<br />
1 PARTÍCULA : 1 HUECO
HUECO<br />
OCTAÉDRICO<br />
<strong>SÓLIDOS</strong><br />
CELDA CÚBICA COMPACTA<br />
HUECO<br />
TETRAÉDRICO<br />
1 PARTÍCULA : 1 HUECO OCTAÉDRICO : 2 HUECOS TETRAÉDRICOS
<strong>SÓLIDOS</strong><br />
CRISTALES METALICOS
<strong>SÓLIDOS</strong><br />
Ejercicio 1: Cuando la plata cristaliza forma celdas<br />
cúbicas centradas en las caras. La longitud de la arista<br />
de la celda unitaria es de 409 pm. Calcule la densidad de<br />
la plata.
Redes típicas<br />
r<br />
( + )<br />
r<br />
( −)<br />
<strong>SÓLIDOS</strong><br />
CRISTALES IÓNICOS<br />
Red típica N°de coord.<br />
0,22-0,41 ZnS (blenda) 4:4<br />
0,41-0,73 NaCl 6:6<br />
0,73-1,00 CsCl 8:8<br />
0,73 y 1,00 CaF 2 8:4
Redes típicas<br />
<strong>SÓLIDOS</strong><br />
Estructura del NaCl
Redes típicas<br />
<strong>SÓLIDOS</strong><br />
Estructura del NaCl
Redes típicas<br />
<strong>SÓLIDOS</strong><br />
Estructura del ZnS (blenda)
Redes típicas<br />
<strong>SÓLIDOS</strong><br />
Estructura del CsCl
Redes típicas<br />
<strong>SÓLIDOS</strong><br />
Estructura del CsCl
<strong>SÓLIDOS</strong><br />
Redes típicas Estructura del CaF 2 (fluorita)<br />
Empaquetamiento cúbico compacto de Ca 2+ , con los F - en<br />
todos los huecos tetraédricos<br />
Coord (F - ) = 4<br />
Coord (Ca 2+ ) = 8
<strong>SÓLIDOS</strong><br />
Redes típicas Estructura del CaF 2 (fluorita)<br />
r<br />
( + )<br />
Especies 1:2 con entre 0,73 y 1,00<br />
r<br />
( −)
<strong>SÓLIDOS</strong><br />
Ejercicio 2: Sabiendo que los radios iónicos del Sr 2+ y el<br />
Se 2- son 1.13 y 1.98 Å respectivamente. Predecir en qué<br />
red cristalizará el SrSe.
<strong>SÓLIDOS</strong><br />
ENERGÍA RETICULAR<br />
Energía reticular (ΔH LAT ): energía liberada al formarse un<br />
mol de un compuesto iónico a partir de sus iones en<br />
estado gaseoso.<br />
NaCl(s) Na + (g) + Cl - (g)
<strong>SÓLIDOS</strong><br />
ENERGÍA RETICULAR<br />
− ΔH LAT
Aproximación coulómbica<br />
<strong>SÓLIDOS</strong><br />
ENERGÍA RETICULAR<br />
ΔH ∝<br />
LAT<br />
q × q<br />
( + ) ( −)<br />
( r +<br />
r )<br />
( + ) ( −)
Born - Mayer<br />
<strong>SÓLIDOS</strong><br />
ENERGÍA RETICULAR<br />
q × q<br />
ΔH ∝ A<br />
( + ) ( −)<br />
LAT<br />
( r + r )<br />
A: constante de Madelung<br />
Red típica A<br />
ZnS (blenda) 1.638<br />
NaCl 1.748<br />
CsCl 1.763<br />
CaF2 2.519<br />
( + ) ( −)
Kaputinskii<br />
<strong>SÓLIDOS</strong><br />
ENERGÍA RETICULAR<br />
ΔH ∝ n<br />
LAT<br />
κ<br />
q × q<br />
( + ) ( −)<br />
( r + r )<br />
( + ) ( −)<br />
κ (constante de Kaputinskii) = 1.21 MJ Å mol -1<br />
n: cantidad de iones en la fórmula<br />
Plantea una red de NaCl hipotética energéticamente<br />
equivalente a la estructura real del sólido
<strong>SÓLIDOS</strong><br />
ENERGÍA RETICULAR<br />
( kJ/mol )<br />
ΔH ∝<br />
LAT<br />
F - Cl - Br - I -<br />
Li + 1036 853 807 757<br />
Na + 923 787 747 704<br />
K + 821 715 682 649<br />
Rb + 785 689 660 630<br />
Cs + 740 659 631 604<br />
q × q<br />
( + ) ( −)<br />
( r +<br />
r )<br />
( + ) ( −)
<strong>SÓLIDOS</strong><br />
ENERGÍA RETICULAR<br />
( kJ/mol )<br />
OH - O 2-<br />
Na + 900 2481<br />
Mg 2+ 3006 3791<br />
Al 3+ 5627 15.916<br />
ΔH ∝<br />
LAT<br />
q × q<br />
( + ) ( −)<br />
( r +<br />
r )<br />
( + ) ( −)
Ejercicio 3: ¿Cuál de los siguientes compuestos iónicos<br />
tendrá la mayor energía reticular?<br />
1. MgCl 2<br />
2. MgBr 2<br />
3. NaBr<br />
4. CaCl 2<br />
5. CaBr 2<br />
ΔH ∝<br />
LAT<br />
q × q<br />
( + ) ( −)<br />
( r +<br />
r )<br />
( + ) ( −)<br />
<strong>SÓLIDOS</strong>
DIFRACCION DE RAYOS X<br />
<strong>SÓLIDOS</strong><br />
ECUACIÓN DE BRAGG<br />
Cuando la radiación electromagnética pasa a través de, o es<br />
reflejada por una estructura periódica (que tiene una<br />
característica que se repite regularmente) puede ocurrir el<br />
fenómeno de interferencia constructiva-destructiva y,<br />
consecuentemente ocurre difracción.<br />
En una red cristalina, que es una estructura periódica<br />
tridimensional, la distancia de repetición es aproximadamente<br />
del orden de algunos Å, por lo tanto es de esperar que<br />
cuando la radiación X pase a través de una red cristalina se<br />
produzca el fenómeno de difracción.
DIFRACCION DE RAYOS X<br />
<strong>SÓLIDOS</strong><br />
ECUACIÓN DE BRAGG
DIFRACCION DE RAYOS X<br />
<strong>SÓLIDOS</strong><br />
ECUACIÓN DE BRAGG<br />
Las ondas difractadas están en fase (interferencia constructiva)<br />
si:<br />
n. λ = 2. d. sen θ
<strong>SÓLIDOS</strong><br />
ECUACIÓN DE BRAGG<br />
n. λ = 2. d. sen θ
<strong>SÓLIDOS</strong><br />
Ejercicio 4: Un cristal difracta los rayos X de longitud de<br />
onda igual a 0.154 nm con un ángulo de 14.17 0 .<br />
Suponiendo que n = 1, ¿cuál es la distancia (en pm) entre<br />
las capas del cristal?