Enlace covalente no polar
Enlace covalente no polar
Enlace covalente no polar
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
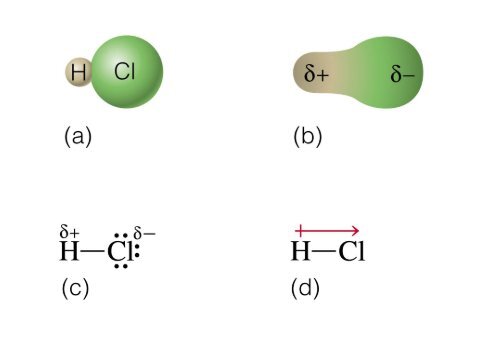
<strong>Enlace</strong> <strong>covalente</strong> <strong>polar</strong><br />
Los electrones del enlace son atraídos más fuertemente<br />
por el Cl que por el H
<strong>Enlace</strong> <strong>covalente</strong> <strong>no</strong> <strong>polar</strong><br />
Los electrones se comparten p de<br />
igual manera<br />
Diferencia de<br />
electronegatividades<br />
ionic_vs_covalent.swf<br />
<strong>Enlace</strong> <strong>covalente</strong> <strong>polar</strong> <strong>Enlace</strong> iónico<br />
Los electrones se comparten p de Los electrones se<br />
manera desigual transfieren<br />
Aumenta el carácter iónico
nico<br />
ácter ió<br />
de cará<br />
centaje<br />
Porc<br />
Diferencia de electronegatividad
Iónico<br />
(especies cargadas)<br />
Covalente <strong>polar</strong><br />
(cargas parciales)<br />
Covalente <strong>no</strong> <strong>polar</strong><br />
(electrónicamente simétricas)
Polarizabilidad (α): ): medida de la tendencia a distorsionarse<br />
dde una nube b electrónica l t ó i al l ser sometida tid a un campo eléctrico. lé t i<br />
EEspecies i <strong>polar</strong>izables: l i bl SSon aquellos ll át átomos cuya nube b<br />
electrónica experimenta fácilmente grandes deformaciones.<br />
Especies <strong>polar</strong>izantes: Son átomos o iones que pueden inducir<br />
grandes g deformaciones en las nubes electrónicas de otros<br />
átomos o iones.<br />
catión<br />
<strong>polar</strong>izante<br />
nube electrónica<br />
distorsionada<br />
anión<br />
<strong>polar</strong>izable
Modelo<br />
iónico<br />
Aumento de la<br />
diferencia de<br />
electronegatividad<br />
Modelo<br />
<strong>covalente</strong><br />
Modelo<br />
iónico<br />
Aumento del poder<br />
<strong>polar</strong>izante del catión y de<br />
la <strong>polar</strong>izabilidad del anión.<br />
Modelo<br />
<strong>covalente</strong>
Estructura de Lewis de moléculas poliatómicas
Geometría molecular.<br />
Las estructuras de Lewis <strong>no</strong> indican la forma de las moléculas, sólo<br />
indica el número y tipo de enlaces.<br />
Longitud de enlace C-Cl: 1.78 A<br />
Ángulo de enlace: 109,5º
H<br />
H<br />
H<br />
H<br />
Compuestos del tipo AB n
AB<br />
AB 2<br />
AB 3<br />
SO SO3 NH NH3
Geometrías moleculares<br />
lineal angular triangular plana pirámide<br />
ti triangular l<br />
d d l<br />
hamaca cuadrado plana bipirámide<br />
triangular<br />
pirámide<br />
cuadrada<br />
triangular tetraédrica<br />
octaédrica bipirámide<br />
pentagonal
Teoría de repulsión de pares de electrones de valencia<br />
(TRPEV)<br />
La mejor manera de acomodar pares de electrones es aquella<br />
que minimiza la repulsión.
Posiciones de las regiones g con alta densidad electrónica<br />
bipirámide<br />
triangular<br />
lineal triangular plana tetraédrica<br />
octaédrica bipirámide<br />
pentagonal
AB 4 AB AB3L 3L AB AB2L 2L 2<br />
109,5º 107º 104,5º<br />
meta<strong>no</strong> amoníaco agua<br />
tetraédrica piramidal trigonal<br />
angular
pares de e - <strong>no</strong><br />
enlazantes<br />
pares dde<br />
e- enlazantes<br />
Repulsiión<br />
par libre – par libre<br />
par libre – par enlazante<br />
par enlazante l t – par enlazante l t
•Las regiones g de alta densidad electrónica adoptan p pposiciones qque<br />
maximizan sus separaciones.<br />
•Todos los enlaces (simples (simples, dobles o triples) se repelen de igual<br />
manera.<br />
•El enlace alrededor de un átomo central es independiente de si la<br />
molécula tiene más de un átomo central.<br />
•Los pares solitarios contribuyen a la forma de la molécula<br />
(geometría electrónica), aunque <strong>no</strong> están incluidos en la<br />
descripción de la forma molecular (geometría molecular).<br />
•Los pares solitarios se repelen con mayor intensidad que los<br />
Los pares solitarios se repelen con mayor intensidad que los<br />
pares enlazantes y por lo tanto tienden a comprimir los ángulos de<br />
enlace.
1- Dibujar la estructura de Lewis de la molécula.<br />
2- Identificar la geometría electrónica , contando las regiones con<br />
pares de electrones (los enlaces dobles y triples se cuentan como<br />
una úúnica i región). ió )<br />
3- Ubicar los átomos y clasificar la geometría g molecular.<br />
4- Identificar la intensidad de las repulsiones y permitir que la<br />
molécula se distorsione de acuerdo a ellas ellas.<br />
Recordar que las repulsiones son:<br />
pl – pl > pl – pe > pe – pe
Nº de regiones<br />
electrónicas<br />
Geometría electrónica Ángulo de enlace<br />
lineal<br />
triangular<br />
plana<br />
tetraédrica<br />
bipirámide 054 05 _VSEPR.mov o<br />
base<br />
triangular<br />
octaédrica<br />
Trpev.flv
Polaridad de las moléculas.<br />
Molécula <strong>polar</strong>: molécula con momento di<strong>polar</strong> permanente <strong>no</strong> nulo nulo.<br />
Todas las moléculas diatómicas son <strong>polar</strong>es p si sus enlaces son<br />
<strong>polar</strong>es.<br />
Todas las moléculas diatómicas homonucleares (2 átomos iguales)<br />
son <strong>no</strong> <strong>polar</strong>es, debido a que sus enlaces son <strong>no</strong> <strong>polar</strong>es.<br />
Moléculas poliatómicas:<br />
<strong>Enlace</strong>s <strong>polar</strong>es<br />
<strong>Enlace</strong>s <strong>polar</strong>es<br />
Polares<br />
Asimétricas Simétricas<br />
No <strong>polar</strong>es
<strong>Enlace</strong>s <strong>polar</strong>es <strong>Enlace</strong>s <strong>polar</strong>es<br />
Momento di<strong>polar</strong> p neto (μ)<br />
= 0<br />
Momento di<strong>polar</strong><br />
neto (μ) ≠ 0<br />
Rojo: regiones de mayor densidad electrónica<br />
Azul: regiones de me<strong>no</strong>r densidad electrónica
tipo No <strong>polar</strong> Polar tipo No <strong>polar</strong> Polar tipo No <strong>polar</strong> Polar