Descargar PDF Nutri Info 03 - Fresenius Kabi España
Descargar PDF Nutri Info 03 - Fresenius Kabi España
Descargar PDF Nutri Info 03 - Fresenius Kabi España
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Nutri</strong> info 3<br />
<strong>Nutri</strong> info<br />
3<br />
La nutrición<br />
parenteraL<br />
pediátrica a<br />
través de un<br />
caso cLínico<br />
cecilia Martínez costa.<br />
Hospital Clínico Universitario. Valencia.<br />
consuelo pedrón Giner.<br />
Hospital Infantil Universitario Niño Jesús. Madrid.
<strong>Nutri</strong> info 3<br />
<strong>Nutri</strong> info 3<br />
1 introducción<br />
......................................................................................................................................................................................................................................... 3<br />
2 coMposición de La nutrición parenteraL<br />
2.1. energía ........................................................................................................................................................................................................................................................ 3<br />
................................................................................................................................. 3<br />
2.2. proteínas ............................................................................................................................................................................................................................................... 3<br />
2.3. Lípidos y carbohidratos (Kcal no proteicas) ..................................................................................................................................... 4<br />
2.4. Líquidos ................................................................................................................................................................................................................................................... 5<br />
2.5. requerimientos de electrolitos ............................................................................................................................................................................. 5<br />
2.6. requerimientos de minerales, vitaminas y oligoelementos ......................................................................................... 5<br />
3 adMinistración de La nutrición parenteraL ..................................................................................................................... 6<br />
3.1 inicio de la np .................................................................................................................................................................................................................................. 6<br />
3.2 tipo de infusión .............................................................................................................................................................................................................................. 6<br />
3.3 cuidados y monitorización ............................................................................................................................................................................................. 6<br />
4 vías de adMinistración .................................................................................................................................................................................................... 7<br />
4.1 periférica ............................................................................................................................................................................................................................................... 7<br />
4.2 central ....................................................................................................................................................................................................................................................... 7<br />
5 retirada de La nutrición parenteraL ............................................................................................................................................. 8<br />
6 coMpLicaciones Más frecuentes de La nutrición parenteraL ..................................................... 8<br />
6.1 relacionadas con el catéter ....................................................................................................................................................................................... 8<br />
6.2 complicaciones metabólicas ...................................................................................................................................................................................... 8<br />
7 caso cLínico ............................................................................................................................................................................................................................................. 9<br />
8 concLusiones ........................................................................................................................................................................................................................................ 10<br />
9 BiBLioGrafía ............................................................................................................................................................................................................................................ 11<br />
fresenius <strong>Kabi</strong> españa, s.a.u.<br />
Torre Mapfre - Vila Olímpica C/ Marina, 16-18 08005 Barcelona<br />
Tel. 93 225 65 65 Fax 93 225 65 75<br />
www.fresenius-kabi.es<br />
Depósito legal: B-20965-2010<br />
ISSN 2013-8199
En pediatría la nutrición parenteral (NP) debe<br />
ser planteada en aquellos niños que por su<br />
enfermedad (aguda o crónica) presenten desnutrición<br />
o alto riesgo de padecerla y no haya<br />
posibilidad de emplear la vía digestiva de forma<br />
completa o parcial. Esta circunstancia se puede<br />
plantear asociada a cualquier enfermedad digestiva<br />
o extradigestiva. La finalidad principal de la<br />
NP se centra en asegurar las necesidades nutritivas<br />
que mantengan la salud y/o el crecimiento<br />
del niño.<br />
La nutrición parenteral pediátrica a través de un caso clínico<br />
La nutrición parenteraL<br />
pediátrica a través de un caso<br />
cLínico<br />
cecilia Martínez costa. Profesora Titular de Pediatría. Universidad de Valencia.<br />
Sección de Gastroenterología y <strong>Nutri</strong>ción Pediátrica. Hospital Clínico Universitario. Valencia.<br />
consuelo pedrón Giner. Doctora en Medicina. Facultativo especialista de Área. Sección de Gastroenterología y<br />
<strong>Nutri</strong>ción. Hospital Infantil Universitario Niño Jesús. Madrid.<br />
1<br />
2<br />
introducción<br />
De forma específica, las indicaciones de la np serán:<br />
- En caso de ayuno absoluto durante un periodo<br />
igual o superior a 5 días.<br />
- Cuando no sea posible la vía enteral, con una<br />
ingesta inferior al 50% de sus necesidades<br />
durante 7 días o antes si ya era un paciente<br />
desnutrido.<br />
- En recién nacidos pretérmino, especialmente<br />
en prematuros extremos en los que deberá iniciarse<br />
la NP en las primeras 24 horas de vida.<br />
coMposición de La nutrición parenteraL<br />
2.1. energía<br />
Calcularemos los requerimientos de energía según<br />
el GER (Gasto Energético en Reposo) y se aplicará<br />
el factor de 1,1 o 1,2, que incluye el factor de actividad<br />
y el de estrés. Si el paciente no está desnutri-<br />
El cálculo de los<br />
requerimientos energéticos<br />
debe realizarse de forma<br />
individualizada, según edad,<br />
estado nutricional y<br />
enfermedad subyacente<br />
do no necesita un aporte adicional y tenemos que<br />
mantenerle sin necesidad de sobrealimentarle<br />
durante este periodo. En general, el cálculo de los<br />
requerimientos energéticos debe realizarse de<br />
forma individualizada, según edad, estado nutricional<br />
y enfermedad subyacente. (Tabla 1)<br />
2.2. proteínas<br />
En niños, y especialmente en recién nacidos, se<br />
recomienda el uso de soluciones de aminoácidos<br />
específicas, adaptadas a las necesidades que<br />
condicionan la inmadurez de sus sistemas enzimáticos.<br />
En niños de mayor edad no existen estudios<br />
sobre cómo se ajustan estas soluciones a sus<br />
necesidades, ni tampoco sobre si son mejores los<br />
preparados para adultos. (Tabla 2)<br />
3
4<br />
<strong>Nutri</strong> info 3<br />
tabla 1. cálculo de los requerimientos energéticos en np<br />
cálculo del Ger<br />
Existen varias soluciones pediátricas de aminoácidos<br />
(Aminoven Infant 10% ® , Primene 10% ® ,<br />
Trophamine 6% ® ).<br />
Las necesidades por edad se recogen en la tabla 2.<br />
Se debe guardar una relación Kcal no proteicas/g N<br />
en torno a 150, aproximadamente 12 a 15 % del<br />
valor calórico total (VCT).<br />
2.3. Lípidos y carbohidratos<br />
(Kcal no proteicas)<br />
schofield<br />
con el peso con el peso y la talla<br />
Deben guardar una relación entre 25-40% lípidos/75-60%<br />
carbohidratos.<br />
Como hidrato de carbono, en pediatría se usa<br />
exclusivamente D-glucosa. En cuanto al aporte<br />
graso se emplearán soluciones al 20% que sean<br />
mixtas (LCT/MCT), o bien elaboradas a base de<br />
ácido oleico, con aceite de pescado o mezclas de<br />
estos ingredientes. Es imprescindible asegurar un<br />
aporte mínimo de ácidos grasos esenciales y<br />
oMs<br />
niños:<br />
0-3 años 59,48 x P – 30,33 0,167 x P + 1517,4 x T – 617,6 60,9 x P - 54<br />
3-10 años 22,7 x P + 505 19,6 x P + 130,3 x T + 414,9 22,7 x P + 495<br />
10-18 años<br />
niñas:<br />
13,4 x P + 693 16,25 x P + 137,2 x T + 515,5 17,5 x P + 651<br />
0-3 años 58,29 x P – 31,05 16,25 x P + 1023,2 x T -413,5 61 x P - 51<br />
3-10 años 20,3 x P + 486 16,97 x P + 161,8 x T + 371,2 22,4 x P + 499<br />
10-18 años<br />
P = peso; T = talla (en metros)<br />
17,7 x P + 659 8,365 x P + 465 x T + 200 12,2 x P + 746<br />
tabla 2. necesidades de aminoácidos en np según la edad<br />
edad<br />
Gramos/kg peso/día<br />
pacientes estables<br />
Límites recomendaciones<br />
Recién nacido pretérmino 1,5-4 2,5-3,5<br />
Recién nacido a término 1,5-3 2,3-2,7<br />
2º mes a 3 años 1,0-2,5 2,0-2,5<br />
3-5 años 1,0-2,0* 1,5-2<br />
6-12 años 1,0-2,0* 1-1,5<br />
Adolescentes 1,0-2,0 1-1,5<br />
* En pacientes críticos se puede incrementar hasta 3 g/kg/día<br />
semiesenciales (EPA y DHA). De las soluciones<br />
disponibles, las mixtas como Lipofundina LCT/<br />
MCT ® se han usado en pediatría habiéndose mostrado<br />
seguras y bien toleradas incluso en pretérminos.<br />
Igualmente, las soluciones elaboradas a<br />
base de aceite de oliva y soja (Clinoleic ® ) parecen<br />
útiles porque reducen la peroxidación al disminuir<br />
la proporción de ácidos grasos poliinsaturados,<br />
pero no aportan cantidades adecuadas de la serie<br />
ω-3 quedando la relación ω-6: ω-3 en 9:1.<br />
Formulaciones a base de aceite de pescado (ω-3)<br />
se han empleado con éxito en lactantes mejorando<br />
considerablemente la hepatopatía relacionada<br />
con la NP. Las mezclas de aceite de soja, Mct,<br />
aceite de oliva y aceite de pescado (sMoflipid ® )<br />
son seguras y bien toleradas mejorando el perfil<br />
hepático, guardan una relación óptima ω-6 y<br />
ω-3 entre ambas de 2,5:1 y contienen aportes<br />
suficientes de alfa-tocoferol para evitar la<br />
peroxidación (consúltese <strong>Nutri</strong><strong>Info</strong> nº 2,<br />
Emulsiones lipídicas en nutrición parenteral).
Las mezclas de aceite de<br />
soja, MCT, aceite de oliva y<br />
aceite de pescado<br />
(SMOFlipid ® ) son seguras y<br />
bien toleradas mejorando el<br />
perfil hepático, guardan una<br />
relación óptima ω-6 y ω-3<br />
entre ambas de 2,5:1 y<br />
contienen aportes suficientes<br />
de alfa-tocoferol para evitar<br />
la peroxidación<br />
2.4. Líquidos<br />
Si el paciente no tiene aumento de las pérdidas,<br />
el volumen de la NP debe hacer frente a sus<br />
necesidades de mantenimiento. Las pérdidas, si<br />
las hubiera, deben corregirse independiente-<br />
tabla 3. necesidades de líquidos según la<br />
fórmula de Holliday-segar<br />
peso necesidades<br />
1-10 kg 100 mL/kg/día<br />
11-20 kg<br />
> 20 kg<br />
1000 mL más 50 mL/kg por cada kg por encima<br />
de 10 kg<br />
1500 mL más 20 mL/kg por cada kg por encima<br />
de 20 kg<br />
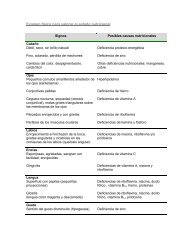
tabla 5. requerimientos de minerales.<br />
La nutrición parenteral pediátrica a través de un caso clínico<br />
mente de la NP. Habrá que considerar para ello<br />
la composición de los sueros en los que se administran<br />
las medicaciones (tabla 3).<br />
2.5. requerimientos de electrolitos<br />
El aporte se establecerá dentro de los rangos<br />
normales y las posibles pérdidas se compensarán<br />
mediante reposición específica. En caso de no<br />
realizar una reposición específica, se ajustarán<br />
los aportes según los controles iónicos en sangre<br />
y orina. (Tabla 4).<br />
2.6. requerimientos de minerales,<br />
vitaminas y oligoelementos<br />
Se ajustarán en función de la edad y el peso<br />
(tablas 5 y 6). En pediatría se recomienda el uso<br />
de fosfato orgánico para poder alcanzar los<br />
requerimientos del niño sin que se produzca precipitación<br />
con el calcio. El glicerofosfato sódico<br />
(Glycophos ® ) es un compuesto seguro y eficaz.<br />
Habrá que considerar la suplementación específica<br />
de Zn en caso de pérdidas aumentadas por<br />
diarrea cuando se reinicie la realimentación.<br />
tabla 4. requerimientos de electrolitos<br />
electrolitos<br />
1º mes – 1 año<br />
/kg/d<br />
> 1 año – 12 años<br />
/kg/d<br />
Sodio (mEq) 2-3 2-3<br />
Cloro (mEq) 2-3 2-3<br />
Potasio (mEq) 1-3 1-3<br />
rnpt/kg/d rn/kg/d
6<br />
<strong>Nutri</strong> info 3<br />
3<br />
tabla 6. requerimientos y preparados farmacológicos de vitaminas en np<br />
vitamina<br />
3.1. inicio de la np<br />
rnpt<br />
(dosis/kg/día)<br />
adMinistración de La nutrición<br />
parenteraL<br />
El objetivo terapéutico nutricional se alcanzará en<br />
2-3 días, cuidando que la administración de líquidos<br />
sea la adecuada en todo momento. Si se tratara de<br />
un caso en un paciente desnutrido, y para evitar el<br />
síndrome de realimentación, la NP se completará<br />
en un plazo mayor de tiempo (5-7 días).<br />
3.2. tipo de infusión<br />
Lactante-niño<br />
(dosis/día)<br />
La perfusión se realizará de forma continua<br />
administrando todos los componentes en la<br />
misma bolsa (3 en 1). El ciclado de la NP se planteará<br />
en aquellos casos en que exista previsión de<br />
que la duración vaya a ser prolongada y o en caso<br />
de alteración hepática. De forma generalizada las<br />
NP en pediatría y neonatos se realizan en campana<br />
y según prescripción individualizada, pero<br />
según la edad del niño, nos podemos plantear la<br />
utilización de bolsas preparadas comerciales, ya<br />
que a partir de la edad escolar (6 años) éstas se<br />
adaptan bastante a las necesidades del paciente.<br />
soluvit ® + vitalipid<br />
infantil ®<br />
3,8+10mL<br />
soluvit ® + vitalipid<br />
infantil ®<br />
10+10mL<br />
infuvite<br />
pediátrico ®<br />
5 ml<br />
Vitamina A (UI) 700-1.500 1 1.500-2.300 2300 2300 2.300<br />
Vitamina E (mg) 3,5 7-10 6,4 6,4 7<br />
Vitamina K (mcg) 8-10 50-200 200 200 200<br />
Vitamina D (UI) 40-160 400 400 400 400<br />
Ascórbico (mg) 15-25 80-100 37,7 100 80<br />
Tiamina (mg) 0,35-0,5 1,2 0,94 2,5 1,2<br />
Riboflavina (mg) 0,15-0,2 1,4 1,35 3,6 1,4<br />
Piridoxina (mg) 0,15-0,2 1 1,5 4 1<br />
Niacina (mg) 4-6,8 17 15,08 40 17<br />
Pantoténico (mg) 1-2 5 5.65 15 5<br />
Biotina (mcg) 5-8 20 22,62 60 20<br />
Folato (mcg) 56 140 150,8 400 140<br />
Vitamina B12 (mcg) 0,3 1 1,88 5 1<br />
El Soluvit ® (vitaminas hidrosolubles) y Vitalipid Infantil ® (vitaminas liposolubles) se presentan en ampollas de 10mL. El Infuvite Pediátrico ® (no<br />
comercializado en <strong>España</strong>) consta de dos viales, uno de 1mL que contiene Folato, biotina y vitamina B12 y otro de 4mL con el resto de vitaminas.<br />
Equivalencias: 1 mcg de vitamina A = 3,3 UI; 1 mcg de vitamina D = 10 UI<br />
1 RNPT (recién nacido pretérmino) con enfermedad pulmonar: 1.500-2.800 UI<br />
Dosis Infuvite Pediatrico ® : RNPT
inicial. Peso diario. Los controles analíticos incluirán:<br />
En sangre hemograma con recuento diferencial;<br />
electrólitos, urea/creatinina, glucosa en sangre,<br />
equilibrio ácido-base, calcio/fósforo, proteí-<br />
4<br />
vías de adMinistración<br />
Para la nutrición parenteral disponemos de dos<br />
tipos de vías:<br />
4.1. periférica<br />
Se indican en NP de corta duración (< de 10 días).<br />
Tiene las limitaciones de la osmolaridad que no<br />
debe sobrepasar a 600-800 mOsm/L, necesidad<br />
de cambio de vía cada 3-4 días y la limitación de<br />
flujo. Las venas periféricas más accesibles se<br />
localizan a nivel del espacio ante-cubital (basílica<br />
o cefálica). Son venas pequeñas que precisan<br />
catéteres de tamaño apropiado (3-6 Fr).<br />
4.2. central<br />
Se plantean en NP que no tenga limitación de flujo<br />
y de media-larga duración. La vena subclavia es el<br />
acceso más utilizado. Pueden ser de varios tipos:<br />
a) Percutáneos-cava; b) Centrales de inserción<br />
periférica; c) Centrales para tratamientos domiciliarios<br />
o de larga duración (superior a 3-4 semanas).<br />
Se distinguen: a) Tunelizados: tipo Hickman ® ,<br />
Broviac ® , Groshong ® ; b) Reservorios subcutáneos<br />
o catéteres implantados (Port-a-cath) (tabla 7).<br />
Un aspecto fundamental es que antes de iniciar la<br />
NP comprobaremos la correcta colocación del<br />
extremo del catéter. (figura 1).<br />
tabla 7. catéteres para acceso venoso central<br />
La nutrición parenteral pediátrica a través de un caso clínico<br />
nas totales/albúmina, prealbúmina, enzimas<br />
hepáticos y bilirrubina, colesterol y triglicéridos.<br />
En orina: glucosa y cuerpos cetónicos.<br />
La localización radiológica adecuada de los catéteres<br />
es:<br />
- Niños pequeños: 0,5 cm por encima de la línea<br />
cardíaca.<br />
edad ccip * tunelizados reservorios subcutáneos<br />
< 1 año 2,0 - 5,0 Fr, 1-2-3 luces 2,7 - 4,2 Fr, 1 luz Usados raramente<br />
1- 3 años 4,0-5,5 Fr, 1-2-3 luces 3,0-5,0 Fr, 1 luz Preferible usar catéteres<br />
Escolares (4-11 años) 5,0-7,0 Fr, 2-3 luces 4,2-7,0 Fr, 1-2 luces 0,6-1,0 mm de diámetro interior<br />
Adolescentes 5,0-8,5 Fr, 2-3 luces 5,0-12,5 Fr, 1-2-3 luces 0,8-1,4 mm de diámetro interior<br />
Adultos 5,0-8,5 Fr, 2-3 luces 7,0-13,0 Fr, 1-2-3 luces 0,8-1,4 mm de diámetro interior<br />
* CCIP = catéteres centrales de inserción periférica<br />
figura 1 - esquema de la localización radiológica<br />
de la punta de los catéteres<br />
catéter<br />
silueta<br />
cardíaca<br />
tráquea<br />
carina<br />
Línea<br />
cardíaca<br />
7
8<br />
<strong>Nutri</strong> info 3<br />
5<br />
- Niños mayores: 1,0 cm por encima de la línea<br />
cardíaca.<br />
- Niños mayores y adultos: la punta del catéter<br />
debe situarse por encima de la carina (4ª costilla<br />
en neonatos) lo que indica que está localiza-<br />
en general la np debe retirarse lo antes posible<br />
siempre y cuando puedan administrarse los<br />
nutrientes por vía digestiva.<br />
Por ello, hay que valorar la conveniencia de iniciar<br />
ne por sonda o no, en función de la evolución<br />
clínica del paciente. Es posible y muy fre-<br />
6<br />
6.1. relacionadas con el catéter<br />
- complicaciones mecánicas: pueden producirse<br />
durante la inserción (neumotórax, laceración<br />
de un vaso, perforación cardíaca, taponamiento<br />
cardíaco, etc.); o por colocación anómala, rotura<br />
o desplazamiento accidental del catéter.<br />
- oclusión trombótica y no trombótica del<br />
catéter: debe sospecharse cuando se observen<br />
fugas alrededor del catéter o cuando se active<br />
la alarma por presión de la bomba de infusión.<br />
Habrá que descartar en primer lugar una oclusión<br />
no trombótica y tratarla de forma adecuada.<br />
El tratamiento fibrinolítico se empleará en<br />
la obstrucción trombótica, pudiendo utilizarse<br />
estreptoquinasa natural o recombinante, uroquinasa<br />
o factor activador del plasminógeno<br />
(alteplasa o reteplasa).<br />
- trombosis venosa y tromboembolismo pulmonar<br />
(tep): muy graves, sobretodo el TEP ya<br />
que puede ser mortal. Ante la sospecha de éste<br />
se debe iniciar tratamiento trombolítico o anticoagulante<br />
y retirar el catéter.<br />
- infecciones relacionadas con el catéter (sepsis<br />
y otras): son una de las complicaciones<br />
más frecuentes sobre todo en los niños meno-<br />
da en la vena cava superior por encima del saco<br />
pericárdico.<br />
La punta de los catéteres femorales: debe localizarse<br />
por encima de las venas renales o por encima<br />
del fémur en neonatos.<br />
retirada de La nutrición parenteraL<br />
cuente que la alimentación oral con una fórmula<br />
hidrolizada sea rechazada por boca por lo que la<br />
consecución de los objetivos terapéuticos por<br />
sonda puede lograrse mucho antes y, por tanto,<br />
retirar la NP.<br />
coMpLicaciones Más frecuentes de La<br />
nutrición parenteraL<br />
res de 2 años. Debe sospecharse si el niño presenta<br />
fiebre superior a 38,5º, acidosis metabólica,<br />
trombocitopenia o inestabilidad en la<br />
homeostasis de la glucosa, en ausencia de otro<br />
foco en la exploración. Deben realizarse hemocultivos<br />
simultáneos de sangre periférica y<br />
central extraídos a través de cada una de las<br />
luces del catéter, y, posteriormente, comenzar<br />
antibioterapia de amplio espectro de forma<br />
empírica de acuerdo con las pautas de cada<br />
institución. Cuando la diferencia en el tiempo<br />
de crecimiento de los hemocultivos obtenidos<br />
de la vía central frente a la vía periférica es<br />
mayor a 2 horas a favor la vía central, podemos<br />
asumir que el origen de la infección es el catéter.<br />
Una vez conocido el resultado del hemocultivo<br />
y del antibiograma se modificará, si es<br />
preciso, la pauta antibiótica. La duración del<br />
tratamiento dependerá del germen aislado.<br />
6.2. complicaciones metabólicas<br />
- déficit o exceso de líquidos, macro y micronutrientes:<br />
es lo más frecuente. Es importante<br />
ajustar los nutrientes y los líquidos a las necesidades<br />
del paciente teniendo en cuenta también<br />
los aportes enterales.
7<br />
- retraso de crecimiento: su prevención es fundamental.<br />
En cada visita clínica es preciso realizar<br />
controles clínicos, antropométricos y bioquímicos.<br />
- enfermedad metabólica ósea: es de causa<br />
multifactorial y está relacionada con el exceso<br />
de aportes de micronutrientes (aluminio, fósforo<br />
y vitamina D), macronutrientes (aminoácidos)<br />
y energía.<br />
- enfermedad hepática asociada a np (eHnp):<br />
generalmente se manifiesta en forma de<br />
colestasis, a diferencia de los adultos en los<br />
que la esteatosis es más frecuente. Existe<br />
mayor riesgo de EHNP en casos de sepsis de<br />
caso cLínico<br />
María es una niña de 4,5 años de edad, sin antecedentes<br />
familiares ni personales de interés, que<br />
24 horas antes de su ingreso comienza con un<br />
cuadro de dolor abdominal y vómitos inicialmente<br />
alimentarios y, posteriormente, biliosos, sugestivo<br />
de obstrucción intestinal. Se somete a cirugía<br />
de urgencia apreciándose un divertículo de<br />
Meckel con brida intestinal distal e isquemia y<br />
necrosis de los últimos 60 cm del íleon terminal<br />
hasta la válvula ileocecal. Se practica resección<br />
del tramo de intestino afecto, de la válvula ileocecal,<br />
el ciego y el apéndice y se realiza anastomosis<br />
término-terminal. Al ingreso se constata un<br />
peso de 17 kg (percentil 47 equivalente a un<br />
z-score de -0,47 DE) y talla de 107 cm (percentil<br />
39, equivalente a z-score de -0,26 DE).<br />
Las cuestiones que se plantean en este caso<br />
son:<br />
1. ¿tenemos una vía digestiva funcionante?<br />
¿cuánto tiempo se estima que el paciente<br />
debe estar en ayunas?<br />
La respuesta será negativa ya que la resección<br />
intestinal impedirá la alimentación enteral<br />
como mínimo 5-7 días o por un tiempo más<br />
prolongado, si surgen complicaciones.<br />
2. ¿está desnutrida la paciente?<br />
No está desnutrida pero tiene riesgo de estarlo<br />
por la edad y gravedad de las lesiones que traducen<br />
un moderado-grave grado de estrés.<br />
La nutrición parenteral pediátrica a través de un caso clínico<br />
repetición o desnutrición. En su génesis están<br />
implicados: factores relacionados con la enfermedad<br />
de base y las características del paciente<br />
(prematuridad y bajo peso, infección y/o<br />
inflamación crónica, uso de fármacos hepatotóxicos,<br />
etc.); la falta de estímulo enteral; la<br />
existencia de sobrecrecimiento bacteriano y<br />
factores relacionados con la NP bien por aportes<br />
excesivos (calorías, aminoácidos o glucosa,<br />
fitosteroles, Mn, etc.), o por defecto (ácidos<br />
grasos esenciales, taurina, carnitina o colina).<br />
un factor que reduce el daño hepático es el<br />
ciclado de la np en cuanto lo permita el<br />
paciente.<br />
3. ¿Qué acceso venoso debemos plantear?<br />
En el caso de María, elegiremos una vía central<br />
porque precisamos administrarle una NP completa<br />
y medicación intravenosa sin limitación<br />
de flujo. Pero como la duración de la NP no va<br />
a ser prolongada, solicitaremos un catéter<br />
percutáneo del tamaño adecuado a su edad o<br />
un CCIP (catéter central de inserción periférica),<br />
si es posible de 2 luces para reservar una<br />
para la NP.<br />
el siguiente paso es realizar la prescripción de<br />
np y nos la plantearemos según tres factores:<br />
estado de nutrición, enfermedad de base y si<br />
existe incremento de pérdidas. Esta paciente no<br />
está desnutrida, tiene una enfermedad que no<br />
supone un aumento del gasto y no tienen aumento<br />
de las pérdidas salvo las que puedan ocurrir<br />
por la sonda nasogástrica de descompresión. Por<br />
ello, plantearemos la siguiente NP:<br />
- energía. Primero calcularemos sus requerimientos<br />
de energía según su GER y le aplicaremos<br />
el factor de 1,1 o 1,2, que incluye el factor de<br />
actividad (está en la cama) y el de estrés. Como<br />
la paciente no está desnutrida no necesita un<br />
aporte adicional y tenemos que mantenerle sin<br />
necesidad de sobrealimentarle durante este<br />
periodo. Como hemos planteado en el caso de<br />
María, en pacientes con enfermedades que conlleven<br />
alto riesgo de desnutrición y en los hos-<br />
9
10<br />
<strong>Nutri</strong> info 3<br />
pitalizados, se obtendrá el cálculo del GER<br />
basados en la Tabla 1 quedando:<br />
GER = 16,97 x peso + 161,8 x talla (en metros) +<br />
371,2 = 833 kcal<br />
GER x 1,2 = 1000 kcal.<br />
- proteínas. Como hemos comentado en el apartado<br />
2.1., en niños, y especialmente en recién<br />
nacidos, se recomienda el uso de soluciones de<br />
aminoácidos específicas, adaptadas a las necesidades<br />
que condicionan la inmadurez de sus<br />
sistemas enzimáticos.<br />
Se debe guardar una relación Kcal no proteicas/g<br />
N en torno a 150, aproximadamente 12 a 15 %<br />
VCT.<br />
En el caso de María calculamos (tabla 2): 2 g x<br />
17 kg = 34 g de aminoácidos al día. Calóricamente<br />
supondrán: 34 g x 4 kcal = 136 kcal en forma de<br />
aminoácidos. Para obtener los gramos de nitrógeno<br />
dividimos: 34 g / 6,25 = 5,44 g de nitrógeno.<br />
Con estos datos ya podemos calcular las<br />
Kcal no proteicas que serán:<br />
Kcal totales – Kcal proteicas: 864 kcal. Y finalmente,<br />
obtendremos la siguiente relación: Relación<br />
Kcal no proteicas /g N = 864/5,44 = 159.<br />
- Lípidos y carbohidratos (Kcal no proteicas).<br />
Deben guardar una relación entre 25-40% lípidos<br />
/ 75-60% carbohidratos. Si realizamos el<br />
cálculo de nuestra paciente: suponemos que las<br />
grasas son 30% de las Kcal/no proteicas. Si las<br />
dividimos por 9 obtendremos los gramos de<br />
grasa y si los dividimos por el número de kg (17<br />
kg) , tendremos los gramos de grasa por kg.<br />
8<br />
concLusiones<br />
• La nutrición parenteral es una forma de<br />
nutrición artificial eficaz que se debe indicar<br />
cuando no es posible o resulta insuficiente<br />
la nutrición enteral.<br />
• Aunque el niño/a presente buen estado de<br />
nutrición hay que plantearla si el proceso que<br />
padece conlleva alto riesgo de desnutrición.<br />
El 30% de las 864 Kcal no proteicas de María<br />
será 259 kcal.<br />
Dividimos 259 kcal/ 9 = 28,8 g de lípidos; a su<br />
vez 28,8 g /17 = 1,7 g/kg de lípidos<br />
Respecto a los carbohidratos serán el 70% de<br />
las Kcal/no proteicas restante lo que supondrá<br />
605 Kcal. Si las dividimos por 4 obtendremos<br />
los gramos de carbohidratos (151) y si los dividimos<br />
por el número de kg, tendremos los gramos<br />
de carbohidratos por kg de peso (151 g/17 =<br />
9 g/kg de peso de carbohidratos).<br />
- Líquidos. Si aplicamos la fórmula de Holliday-<br />
Segar (tabla 3), las necesidades de líquidos<br />
serán 1000 + 7 x 50 = 1350 mL al día.<br />
- requerimientos de electrolitos. Como hemos<br />
comentado en el apartado 2.5 el aporte de<br />
electrolitos se establecerá dentro de los rangos<br />
normales y las posibles pérdidas por la SNG se<br />
compensarán mediante reposición específica.<br />
En caso de no realizar una reposición específica,<br />
se ajustarán los aportes según los controles<br />
iónicos en sangre y orina. (tabla 4).<br />
- requerimientos de minerales, vitaminas y<br />
oligoelementos. Serán los normales para la<br />
edad (tablas 5 y 6). En pediatría se recomienda<br />
el uso de fosfato orgánico para poder alcanzar<br />
los requerimientos del niño sin que se produzca<br />
precipitación con el calcio. El glicerofosfato<br />
sódico (Glycophos ® ) es un compuesto seguro y<br />
eficaz. Habrá que considerar la suplementación<br />
específica de Zn en caso de pérdidas aumentadas<br />
por diarrea cuando se reinicie la realimentación.<br />
• una np bien calculada (sin exceso calórico)<br />
y equilibrada en Kcal proteicas/Kcal no<br />
proteicas es fundamental para reducir el<br />
riesgo de complicaciones. Igualmente, se<br />
debe de ciclar la NP en cuanto lo permita el<br />
paciente para reducir las complicaciones<br />
hepáticas.
7<br />
BiBLioGrafía<br />
1. AGA Technical review on parenteral nutrition. Gastroenterology. 2001; 121:<br />
970-1001.<br />
2. American Gastroenterological Association Medical Position Statement:<br />
Parenteral nutrition. Gastroenterology 2001; 121: 966-9.<br />
3. ASPEN Board of Directors and the Clinical Guidelines Task Force. Guidelines<br />
for the use of parenteral and enteral nutrition in adult and pediatric<br />
patients. JPEN J Parenter Enteral Nutr 2002; 26 (suppl 1): 1SA-138SA.<br />
4. Baker SB, Baker RD, Davis A, eds. Pediatric nutrition. Boston: Jones and<br />
Bartlett, 2007.<br />
5. Caruso LJ, Gravenstein N, Layon AJ, Peters K, Gabrielli A. A better landmark<br />
for positioning a central venous catheter. J Clin Monit Comput 2002;17(6):331-<br />
4.<br />
6. Collier S, Gura KM, Richardson DS, Duggan CH. Parenteral <strong>Nutri</strong>tion. In:<br />
Hendricks KM, Duggan CH. Manual of Pediatric <strong>Nutri</strong>tion. 4ª ed. London: Bc<br />
Decker; 2005. p. 317-75.<br />
7. Cuerda C, Bretón I, Bonada A, Planas M, y grupo NADYA. Protocolo para el<br />
diagnóstico y tratamiento de las infecciones relacionadas con el catéter en<br />
el paciente con nutrición parenteral domiciliaria. Rev Clin Esp<br />
2005;205(8):386-91.<br />
8. Fusch C, Bauer K, Böhles HJ, Jochum F, Koletzko B, Krawinkel M, Krohn K,<br />
Mühlebach S, Working Group for developing guidelines for parenteral<br />
nutrition of the German Society for <strong>Nutri</strong>tional Medicine, Neonatology/<br />
Paediatrics. Guidelines on Parenteral <strong>Nutri</strong>tion, Chapter 13. GMS Ger Med Sci<br />
2009; 7: doc 15.<br />
9. Gomis Muñoz P, Gómez López L, Martínez Costa C, Moreno Villares JM,<br />
Pedrón Giner C, Pérez-Portabella Maristany C, et al. Documento de consenso<br />
SENPE/SEGHNP/SEFH sobre nutrición parenteral pediátrica. Nutr Hosp<br />
2007;22(6):710-9. Texto completo disponible en: http://www.nutricionhospi-<br />
La nutrición parenteral pediátrica a través de un caso clínico<br />
talaria.com/Documento_de_Consenso.pdf y http://www.gastroinf.com/ ;<br />
Documentos y protocolos.<br />
10. Goulet O, Antebi H, Wolf C, Talbotec C, Aleindor LG, Corriol O, et al. A new<br />
intravenous fat emulsion containing soybean oil, medium-chain triglycerides,<br />
olive oil and fish oil: A single-center, double-blind randomized study on<br />
efficacy and safety in pediatric patients receiving home parenteral nutrition.PEN<br />
2010 ; 34: 485-95.<br />
11. Gura KM, Duggan CP, Collier SB, Jennings RW, Folkman J, Bristian B, et al.<br />
Reversal of parenteral nutrition-associated liver disease in two infants with<br />
short bowel syndrome using parenteral fish oil: Implications for future<br />
management. Pediatrics 2006; 118: e197-e201.<br />
12. Kerner JA. Parenteral <strong>Nutri</strong>tion. En: Walker WA, Watkins JB, Duggan Ch.<br />
<strong>Nutri</strong>tion in Pediatrics. 3th ed. London: BC Decaer Inc; 20<strong>03</strong>. p. 957-85.<br />
13. Kerner JA, Garcia-Careaga MG, Fisher AA, Poole RL. Treatment of catheter<br />
occlusion in pediatrics patients. JPEN J Parenter Enteral Nutr 2006;30:S73-<br />
81.<br />
14. Koletzko B, Goulet O, Hunt J, Krohn K, Shamir R. Guidelines on Paediatric<br />
Parenteral <strong>Nutri</strong>tion of the European Society of Paediatric Gastroenterology,<br />
Hepatology and <strong>Nutri</strong>tion (ESPGHAN) and the European Society for Clinical<br />
<strong>Nutri</strong>tion and Metabolism (ESPEN), Supported by the European Society of<br />
Paediatric Research (ESPR). J Pediatr Gastroenterol Nutr 2005;41(Suppl<br />
2):S1-87.<br />
15. Gómez López L, Gutiérrez Suárez M. Programa de nutrición parenteral<br />
domiciliaria pediátrica. Cuaderno de información para las familias. Valencia:<br />
Gráficas Diamante 2008. Disponible en http://www.nadya-senpe.com/public/<br />
elementos.htm y http://www.gastroinf.com/; Documentos y protocolos.<br />
16. Mateu de Antonio X. Emulsiones lipídicas en nutrición parenteral. <strong>Nutri</strong>info2.<br />
Barcelona: <strong>Fresenius</strong> <strong>Kabi</strong>.<br />
17. Martínez Costa C, Sierra Salinas C, Pedrón Giner C, Moreno Villares JM, Lama<br />
R, Codoceo R. <strong>Nutri</strong>ción enteral y parenteral en pediatría. An Esp Pediatr<br />
2000; 52(Supl 3):1-33.<br />
18. Monreal M, Alastrue A, Rull M, Mira X, Muxart J, Rosell R, et al. Upper extremity<br />
deep venous thrombosis in cancer patients with venous access devices--prophylaxis<br />
with a low molecular weight heparin (Fragmin). Thromb<br />
Haemost 1996;75:251–3.<br />
19. Moreno Villares JM. Complicaciones hepáticas asociadas al uso de nutrición<br />
parenteral,. Nutr Hosp 2008;23(Supl 2):25-33.<br />
20. Moreno Villares JM, Pedrón Giner C. <strong>Nutri</strong>ción artificial en el paciente<br />
pediátrico. En: Gil Hernández A, coordinador. Tratado de <strong>Nutri</strong>ción 2ª ed.<br />
Tomo IV <strong>Nutri</strong>ción Clínica. Madrid: Panamericana; 2010. P.171-200.<br />
21. O’Grady NP, Alexander M, Dellinger EP, Gerberding JL, Heard SO, Maki DG, et<br />
al. The Hospital Infection Control Practices Advisory Committee, Center for<br />
Disese Control and Prevention. Guidelines for the Prevention of intravascular<br />
catheter-related infections. [Monografía en Internet]; 2002 Disponible<br />
en: http://www.cdc.gov/mmwr/pdf/rr/rr5110.pdf<br />
22. Pedrón-Giner C, Martínez-Costa C, Gómez-López L, Navas López VM,<br />
Redecillas Ferrero S, Moreno-Villares JM et al. Home Parenteral <strong>Nutri</strong>tion in<br />
Children: procedures, experiences and reflections. Nutr Hosp 2010; 25 (5):<br />
705-11. Disponible en castellano: http://www.gastroinf.com/; Documentos y<br />
protocolos.<br />
23. Shulman RJ, Phillips S. Parenteral nutrition in infants and children. J Pediatr<br />
Gastroenterol Nutr 20<strong>03</strong>; 36:587-607.<br />
24. Veerabagu MP, Tuttle-Newhall J, Maliakkal R, Champagne C, Mascioli EA.<br />
Warfarin and reduced central venous thrombosis in home total parenteral<br />
nutrition patients. <strong>Nutri</strong>tion 1995;11:142–4.<br />
11
12<br />
<strong>Nutri</strong> info 3<br />
ficHas técnicas:<br />
Aminoven® infAnt<br />
10% 1. nomBRe De LA eSPeCiALiDAD fARmACÉUtiCA. Aminoven Infant 10%<br />
Solución para perfusión. 2. ComPoSiCiÓn CUALitAtivA Y CUAntitAtivA. 1000<br />
ml de solución contienen: L-isoleucina: 8,000 g; L-leucina: 13,000 g; L-lisina<br />
monoacetato = L-lisina 8,51 g: 12,000 g; L-metionina: 3,120 g; L-fenilalanina: 3,750 g;<br />
L-treonina: 4,400 g; L-triptófano: 2,010 g; L-valina: 9,000 g; L-arginina: 7,500 g;<br />
L-histidina: 4.760 g; Glicina: 4,150 g; L-alanina: 9,300 g; L-prolina: 9,710 g; L-serina:<br />
7,670 g; Taurina: 0,400 g N-acetil-L-tirosina = L-tirosina 4,20 g: 5,176 g; N-acetil-Lcisteína<br />
= L-cisteína 0,52 g: 0,700 g; Ácido L-málico: 2,620 g: Aminoácidos totales:<br />
100 g/l; Nitrógeno total: 14,9 g/l; Energía total: 1675 kJ/l = 400 Kcal/l; Osmolaridad<br />
teórica: 885 mosm/l; Acidez titulable: 25-45 mmol/NaOH/l; Valor pH: 5,5 – 6,0;<br />
Excipientes: Agua para inyección, Nitrogeno. 3. foRmA fARmACÉUtiCA Solución<br />
para perfusión Solución transparente e incolora. 4. DAtoS CLÍniCoS 4.1<br />
Indicaciones terapéuticas Solución de aminoácidos al 10% para nutrición<br />
parenteral parcial en pacientes pediátricos. Esta solución puede utilizarse para<br />
nutrición parenteral total conjuntamente con las cantidades correspondientes de<br />
carbohidratos y lípidos como fuente de energía, así como de vitaminas, electrolitos<br />
y elementos traza. 4.2 Posología y método de administración Aminoven<br />
Infant 10% debe ser administrado mediante perfusión intravenosa continua a<br />
través de una vena central. Velocidad máxima de perfusión: Hasta 0,1 g<br />
aminoácidos/ Kg peso corporal/ hora = 1,0 ml/ kg peso corporal/ hora Dosis<br />
máxima diaria: -1 año de edad: 1,5-2,5 g aminoácidos/ kg peso corporal= 15-25 ml/<br />
Kg peso corporal -2-5 años de edad: 1,5 g aminoácidos/ kg peso coporal= 15 ml / Kg<br />
peso corporal -6-14 años de edad: 1,0 g aminoácidos/ kg peso corporal= 10 ml/ Kg<br />
peso corporal La solución debe ser administrada tanto tiempo como se requiera la<br />
nutrición parenteral. 4.3 Contraindicaciones Como ocurre con todas las<br />
soluciones de aminoácidos Aminoven Infant 10% no debe ser administrado en las<br />
condiciones siguientes: Hipersensibilidad a algún aminoácido presente en la<br />
solución Alteraciones del metabolismo de los aminoácidos. Acidosis metabólica.<br />
Hipokalemia Shock Hipoxia. Contraindicaciones generales de la terapia de perfusión:<br />
Insuficiencia cardíaca descompensada Edema pulmonar agudo Hiperhidratación<br />
4.4 Advertencias y precauciones especiales de uso En la nutrición<br />
parenteral en niños se recomienda una evaluación y determinación frecuente de<br />
los siguientes valores de laboratorio: nitrógeno-urea, amonio, electrolitos, glucosa<br />
y triglicéridos (en el caso en que se administre una emulsión lipídica), equilibrio<br />
ácido base y balance hídrico, enzimas hepáticos y osmolalidad sérica. La perfusión<br />
a través de venas periféricas puede causar irritación de la íntima de la vena, y<br />
tromboflebitis. Para minimizar el riesgo de irritación de la vena, se recomienda<br />
llevar a cabo controles diarios del punto de perfusión. Aminoven Infant 10% puede<br />
utilizarse como parte de un régimen de nutrición parenteral total, en combinación<br />
con cantidades adecuadas de aporte de energía (soluciones de carbohidratos,<br />
emulsiones lipídicas), electrolitos, vitaminas y elementos traza. Debe prestarse<br />
atención en caso de hiponatremia. Los pacientes con insuficiencia renal o hepática<br />
requieren una dosis individualizada. 4.5 Interacciones con otros<br />
medicamentos y otras formas de interacción No se conocen. Por favor,<br />
consultar la sección 6.2 “Incompatibilidades”. 4.6 Embarazo y lactancia No<br />
procede. 4.7 Efectos sobre la capacidad de conducir y utilizar máquinas<br />
No procede. 4.8 Reacciones adversas Como con todas las soluciones para<br />
perfusión hipertónicas, puede aparecer tromboflebitis si se utilizan venas<br />
periféricas. Reacciones adversas que aunque no están específicamente relacionadas<br />
con el producto, sin embargo, se pueden producir en general en nutrición<br />
parenteral, especialmente en el inicio de la nutrición parenteral. Poco comunes (<<br />
1:100, ≥ 1:1000 de pacientes tratados): Alteraciones gastrointestinales: Náuseas,<br />
vómitos Alteraciones generales: cefalea, escalofríos, fiebre 4.9 Sobredosis Como<br />
en el caso de otras soluciones de aminoácidos pueden presentarse: escalofríos,<br />
vómitos, náuseas y pérdidas renales incrementadas de aminoácidos, cuando se<br />
administra una sobredosis de Aminoven Infant 10% o si se excede la velocidad de<br />
perfusión recomendada. En este caso, la perfusión debe detenerse inmediatamente.<br />
Es posible continuar con una dosis reducida. En el caso de hiperkalemia, es<br />
aconsejable la perfusión de 200 a 500 ml de solución de glucosa al 10% añadiendo<br />
de 1-3 U de insulina modificada/ 3-5 g de glucosa. 5. PRoPieDADeS<br />
fARmACoLÓGiCAS. 5.1 Propiedades farmacodinámicas Los aminoácidos<br />
incluidos en Aminoven Infant 10% son todos componentes fisiológicos naturales. Al<br />
igual que los aminoácidos derivados de la ingestión y asimilación de las proteínas<br />
de la dieta, los aminoácidos administrados por vía parenteral pasan al “pool”<br />
corporal de aminoácidos libres y por consiguiente a todas las vías metabólicas. Los<br />
aminoácidos son elementos necesarios para la síntesis de proteínas. La<br />
biodisponibilidad de Aminoven Infant 10% es del 100%. Los aminoácidos de<br />
Aminoven Infant 10% entran en el “pool” plasmático de los aminoácidos libres<br />
correspondientes. A partir del espacio intravasal, los aminoácidos se distribuyen al<br />
fluido intersticial y, mediante una regulación individual para cada aminoácido, al<br />
espacio intracelular de los diferentes tejidos según se requiera.Las concentraciones<br />
de aminoácidos libres en plasma y a nivel intracelular, son reguladas endógenamente<br />
dentro de unos estrechos márgenes, dependiendo de la edad, el estado nutricional<br />
y la situación patológica del paciente. Las soluciones de aminoácidos equilibradas<br />
como Aminoven Infant 10%, no alteran de forma significativa el “pool” fisiológico<br />
de aminoácidos, cuando se infunden a una velocidad lenta y constante. Los cambios<br />
característicos del “pool” fisiológico de aminoácidos del plasma, sólo ocurren<br />
cuando la función reguladora de los órganos esenciales como hígado o riñones,<br />
está gravemente alterada. En estos casos se recomiendan soluciones de<br />
aminoácidos con una formulación especial, para restablecer la homeostasis. Sólo<br />
una pequeña proporción de los aminoácidos infundidos es eliminada por los<br />
riñones, dependiendo de la madurez de los riñones del niño y de la situación clínica<br />
general. Las vidas medias biológicas de los aminoácidos en plasma dependen de la<br />
edad y de la condición metabólica del paciente pediátrico. 5.3 Datos de<br />
seguridad preclínica No se han reportado en la bibliografía, efectos tóxicos de<br />
las soluciones de aminoácidos para nutrición parenteral. Teniendo en cuenta que<br />
los aminoácidos son componentes fisiológicos, no es previsible que aparezca<br />
toxicidad cuando se siguen las recomendaciones de dosificación y contraindicaciones.<br />
Los datos con respecto a DL50, toxicidad aguda o toxicidad sub-aguda, que están<br />
disponibles para aminoácidos aislados, no son transferibles a las mezclas de<br />
aminoácidos en soluciones como Aminoven Infant 10%. La toxicidad de los<br />
aminoácidos aislados, depende principalmente de los desequilibrios con otros<br />
aminoácidos, y por tanto el efecto tóxico apenas existe con mezclas de todos los<br />
aminoácidos fisiológicos indispensables, como es el caso de proteínas o de<br />
soluciones de aminoácidos para nutrición. 6. DAtoS fARmACÉUtiCoS 6.1 Lista<br />
de excipientes Agua para inyección. Nitrógeno 6.2 Incompatibilidades<br />
Debido al riesgo incrementado de contaminación microbiológica y a las<br />
incompatibilidades, las soluciones de aminoácidos no deberían ser mezcladas con<br />
otros medicamentos. Por tanto en el caso en que sea necesario añadir otros<br />
nutrientes como carbohidratos, emulsiones lipídicas, electrolitos, vitaminas o<br />
elementos traza a Aminoven Infant 10% para una nutrición parenteral completa,<br />
deberán tomarse precauciones como realizar una mezcla higiénica, llevar a cabo<br />
una buena mezcla y en particular conocer la compatibilidad. Aminoven Infant 10%<br />
no debe ser almacenado después de la adición de otros componentes. Este<br />
medicamento no debe mezclarse con otros excepto con los mencionados en la<br />
sección 6.6 6.3 Periodo de validez a) Período de validez del medicamento<br />
envasado para la venta Aminoven Infant 10% tiene un período de validez de 3<br />
años. b) Período de validez después de la apertura del envase Desde un<br />
punto de vista microbiológico, a no ser que el método de apertura evite el riesgo<br />
de contaminación microbiológica, el producto debe utilizarse inmediatamente. b)<br />
Período de validez después de la mezcla con otros componentes La<br />
adición de otros componentes a la solución de Aminoven Infant 10% previamente a<br />
la administración, debería tener lugar bajo condiciones higiénicas para garantizar<br />
que la solución se dispensa correctamente. A no ser que se disponga de más datos,<br />
las mezclas deben utilizarse dentro de las siguientes 24 horas desde su preparación.<br />
6.4 Precauciones especiales de conservación No conservar a temperatura<br />
superior a 25 °C No congelar. Conservar protegido de la luz. 6.5 Naturaleza y<br />
contenido del envase Frascos de vidrio de 100 ml y 250 ml 6.6 Instrucciones<br />
de uso/manipulación Utilizar inmediatamente después de la apertura del frasco.<br />
No utilizar Aminoven Infant 10% después de la fecha de caducidad. Utilizar<br />
únicamente soluciones transparentes y con envases intactos. Para nutrición<br />
parenteral de larga duración con Aminoven Infant 10%, deberán aportarse ácidos<br />
grasos esenciales, vitaminas y elementos traza. La eliminación del medicamento no<br />
utilizado y de todos los materiales que hayan estado en contacto con él, se<br />
realizará de acuerdo con la normativa local. 7. titULAR De LA AUtoRiZACiÓn De<br />
ComeRCiALiZACiÓn FRESENIUS KABI ESPAÑA S.A. C/ Marina 16-18, planta 17<br />
08005-Barcelona (<strong>España</strong>) 8. nÚmeRo De LA AUtoRiZACiÓn De<br />
ComeRCiALiZACiÓn 59.628 9. feCHA De LA PRimeRA AUtoRiZACiÓn De<br />
ComeRCiALiZACiÓn / RevALiDACiÓn De LA AUtoRiZACiÓn De<br />
ComeRCiALiZACiÓn 24-05-1993/ 29-02-2008 10. feCHA De ReviSiÓn (PARCiAL)<br />
DeL teXto Marzo 2009. 11. RÉGimen De PReSCRiPCiÓn Y DiSPenSACiÓn. Con<br />
receta médica. Uso hospitalario. medicamento ético. 12. ConDiCioneS De LA<br />
PReStACiÓn fARmACÉUtiCA DeL SnS. no finAnCiADo.<br />
Smoflipid 20%<br />
1. nomBRe DeL meDiCAmento. SMOFlipid 200 mg/ml emulsión para perfusión.<br />
2. ComPoSiCiÓn CUALitAtivA Y CUAntitAtivA. 1000 ml de emulsión para<br />
perfusión contienen: Aceite de soja, refinado: 60,0 g; Triglicéridos de cadena media:<br />
60,0 g; Aceite de oliva, refinado: 50,0 g; Aceite de pescado, rico en ácidos omega-3:<br />
30,0 g. Aporte energético total: 8,4 MJ/l (=2000 kcal/l). Valor del pH: aprox. 8.<br />
Osmolalidad: aprox. 380 mosm/kg. Para consultar la lista completa de excipientes<br />
ver sección 6.1. 3. foRmA fARmACÉUtiCA. Emulsión para perfusión. Emulsión<br />
blanca homogénea. 4. DAtoS CLÍniCoS. 4.1 indicaciones terapéuticas. Aporte de<br />
energía, ácidos grasos esenciales y ácidos grasos omega-3 en pacientes, como<br />
parte de un régimen de nutrición parenteral, cuando la nutrición oral o enteral es<br />
imposible, insuficiente o está contraindicada. 4.2 Posología y forma de<br />
administración. La dosificación y velocidad de perfusión deberán establecerse en<br />
función de la capacidad del paciente para eliminar la grasa infundida (ver sección<br />
4.4). Adultos. La dosis estándar es 1,0-2,0 g de grasa/kg de peso corporal (p.c.)/día,<br />
correspondiente a 5-10 ml/kg de p.c./día. La velocidad de perfusión recomendada es<br />
0,125 g de grasa/kg p.c./hora, equivalente a 0,63 ml de Smoflipid/kg p.c./hora y no
debe sobrepasar 0,15 g de grasa/kg p.c./hora, equivalente a 0,75 ml de Smoflipid/kg<br />
p.c./hora. Población pediátrica. Neonatos y bebés. La dosis inicial debe ser 0,5-1,0 g<br />
grasa/kg p.c./ día, seguida de un incremento sucesivo de 0,5-1,0 g grasa/kg p.c./día<br />
hasta 3,0 g grasa/ kg p.c./día. Se recomienda no exceder la dosis diaria de 3 g<br />
grasa/kg p.c./día, correspondiente a 15 ml de Smoflipid/ kg p.c./día. La velocidad de<br />
perfusión no debe exceder 0,125 g grasa/ kg p.c./día. En prematuros y neonatos con<br />
bajo peso de nacimiento, Smoflipid debe ser infundido de forma continua durante<br />
24 horas. Niños. Se recomienda no exceder la dosis diaria máxima de 3 g grasa/ kg<br />
p.c./día, correspondiente a 15 ml de Smoflipid/ kg p.c./día. La dosis diaria debe ser<br />
incrementada gradualmente durante la primera semana de administración. La<br />
velocidad de perfusión no debe exceder 0,15 g grasa/ kg p.c./día. Forma de<br />
administración. Perfusión intravenosa en una vena periférica o central.<br />
4.3 Contraindicaciones. Hipersensibilidad a la proteína de pescado, de huevo, de<br />
soja o de cacahuete, o a cualquiera de las sustancias activas o excipientes.<br />
Hiperlipidemia grave. Insuficiencia hepática grave. Alteraciones graves de la<br />
coagulación sanguínea. Insuficiencia renal grave sin posibilidad de hemofiltración<br />
o diálisis. Shock agudo. Contraindicaciones generales de una terapia de perfusión:<br />
edema pulmonar agudo, hiperhidratación e insuficiencia cardiaca descompensada.<br />
Condiciones inestables (por ejemplo, condiciones post-traumáticas graves, diabetes<br />
mellitus descompensada, infarto agudo de miocardio, ictus, embolia, acidosis<br />
metabólica, sepsis grave y deshidratación hipotónica). 4.4 Advertencias y<br />
precauciones especiales de empleo. La capacidad para la eliminación de lípidos<br />
es una característica individual y, por tanto, deberá monitorizarse de acuerdo con<br />
las rutinas clínicas. Esto se lleva a cabo generalmente comprobando los niveles de<br />
triglicéridos. Debe prestarse especial atención a pacientes con un marcado riesgo<br />
de hiperlipidemia (como pacientes con dosificación elevada de lípidos, sepsis grave<br />
y bebés con peso de nacimiento extremadamente bajo). Durante la perfusión, la<br />
concentración de triglicéridos séricos, en general, no deberá exceder 3 mmol/l.<br />
Deberá considerarse una reducción de la dosis o una interrupción de la emulsión<br />
lipídica, si las concentraciones de triglicéridos en suero o en plasma, durante o<br />
después de la perfusión, exceden 3 mmol/L. Una sobredosis puede dar lugar a un<br />
síndrome de sobrecarga lipídica, (ver sección 4.8). Hasta el momento actual existe<br />
poca experiencia en tratamientos con Smoflipid durante más de 14 días. Este<br />
producto contiene aceite de soja, aceite de pescado y fosfolípidos de huevo, que<br />
muy raramente pueden causar reacciones alérgicas. Se han observado reacciones<br />
alérgicas cruzadas entre la soja y el cacahuete. Smoflipid deberá administrarse con<br />
precaución si el metabolismo lipídico está alterado, como en casos de insuficiencia<br />
renal, diabetes mellitus, pancreatitis, alteración de la función hepática,<br />
hipotiroidismo y sepsis. Existe una experiencia limitada en el tratamiento de<br />
pacientes con diabetes mellitus o con insuficiencia renal. La administración de<br />
ácidos grasos de cadena media de forma aislada, puede provocar acidosis<br />
metabólica. Este riesgo se reduce en una gran parte mediante la perfusión<br />
simultánea de los ácidos grasos de cadena larga incluidos en Smoflipid. La<br />
administración concomitante de carbohidratos eliminará este riesgo. Por lo tanto,<br />
se recomienda la perfusión simultánea de carbohidratos o una solución de<br />
aminoácidos que contenga carbohidratos. Deben realizarse análisis de laboratorio<br />
de forma regular, generalmente asociados con la monitorización de la nutrición<br />
intravenosa. Esto incluye niveles de glucosa en sangre, pruebas de función<br />
hepática, equilibrio ácido base, balance de fluidos, recuento sanguíneo y electrolitos.<br />
Ante cualquier signo o síntoma de reacción anafiláctica (como fiebre, escalofríos,<br />
erupción cutánea o disnea) debe interrumpirse inmediatamente la perfusión.<br />
Smoflipid debe administrarse con precaución en neonatos y prematuros con<br />
hiperbilirrubinemia, y en casos de hipertensión pulmonar. En neonatos,<br />
particularmente en prematuros con nutrición parenteral de larga duración, deberá<br />
monitorizarse el recuento sanguíneo de plaquetas, los ensayos de la función<br />
hepática, y los triglicéridos en suero. Los altos niveles de lípidos en plasma pueden<br />
interferir con algunos análisis sanguíneos de laboratorio, ej. Hemoglobina. Debe<br />
evitarse la adición de otros medicamentos o sustancias a Smoflipid si no se conoce<br />
la compatibilidad (ver secciones 6.2 y 6.6). 4.5 interacción con otros<br />
medicamentos y otras formas de interacción. La heparina, administrada a dosis<br />
clínicas, produce un aumento transitorio de la liberación de lipoproteinlipasa a la<br />
circulación. Esto provoca inicialmente un aumento de la lipólisis plasmática,<br />
seguido de una disminución transitoria en el aclaramiento de triglicéridos. El aceite<br />
de soja tiene un contenido natural en vitamina K1. Sin embargo, el contenido en<br />
Smoflipid es tan bajo que no se espera una influencia significativa en el proceso de<br />
coagulación en pacientes tratados con derivados de la cumarina. 4.6 fertilidad,<br />
embarazo y lactancia. No existen datos disponibles sobre la administración de<br />
Smoflipid en mujeres embarazadas o en periodo de lactancia. No se dispone de<br />
estudios en animales sobre toxicidad durante la reproducción. La nutrición<br />
parenteral puede ser necesaria durante el embarazo y la lactancia. Smoflipid sólo<br />
deberá administrarse a mujeres embarazadas o en periodo de lactancia después de<br />
una cuidadosa consideración. 4.7 efectos sobre la capacidad para conducir y<br />
utilizar máquinas. No procede. 4.8 Reacciones adversas. Reacciones adversas<br />
observadas durante la administración de emulsiones grasas: Trastornos<br />
respiratorios, torácicos y mediastínicos. Raras (≥1/10.000 a
14<br />
<strong>Nutri</strong> info 3<br />
el producto debería utilizarse inmediatamente. Si no es utilizado inmediatamente,<br />
el tiempo de conservación hasta su utilización y las condiciones previas a su uso<br />
son responsabilidad del usuario y normalmente no deberían ser superiores a 24<br />
horas, conservándose entre 2-8 °C. 6.4 Precauciones especiales de conservación.<br />
No conservar a temperatura superior a 25ºC. No congelar. Período de validez<br />
después de mezclar Desde un punto de vista microbiológico, si se realizan<br />
adiciones a Smoflipid, el producto debería utilizarse inmediatamente. Si la mezcla<br />
no es utilizada inmediatamente, el tiempo de conservación hasta su utilización y<br />
las condiciones previas a su uso son responsabilidad del usuario y normalmente no<br />
deberían ser superiores a 24 horas, conservándose entre 2-8 °C, a no ser que las<br />
adiciones hayan sido realizadas bajo condiciones asépticas controladas y validadas.<br />
6.5 naturaleza y contenido del envase y de los equipos especiales para su<br />
utilización, administración o implantación. Frascos de vidrio (tipo II, incoloro)<br />
con tapón de caucho butilo. Bolsa Excel. La bolsa Excel consta de una bolsa interna<br />
(envase primario) con una sobrebolsa. Entre la bolsa interna y la sobrebolsa se<br />
coloca un absorbente de oxígeno y un indicador de integridad (Oxalert TM ). La bolsa<br />
interna Excel consta de un copolímero de poli(propileno/etileno), un elastómero<br />
termoplástico y un copoliéster. La sobrebolsa consta de polietileno tereftalato y<br />
poliolefina, o polietileno tereftalato, poliolefina y copolímero etilen-vinil alcohol<br />
(EVOH). El absorbente de oxígeno consta de polvo de hierro en un sobrecito de<br />
polímero. El indicador de integridad consta de una solución sensible al oxígeno<br />
dentro de un sobrecito de polímero. La sobrebolsa, el absorbente de oxígeno y el<br />
indicador de integridad deben desecharse después de la apertura de la sobrebolsa.<br />
El indicador de integridad (Oxalert TM ) reacciona con el oxígeno libre y cambia de<br />
color de transparente a negro en caso de que la sobrebolsa esté dañada. Tamaños<br />
de envase. Frascos de vidrio: 100 ml; 10 x 100 ml; 250 ml; 10 x 250 ml; 500 ml; 10 x<br />
500 ml. Bolsa Excel: 100 ml; 10 x 100 ml; 250 ml; 10 x 250 ml; 500 ml; 12 x 500 ml.<br />
Puede que solamente estén comercializados algunos tamaños de envases.<br />
6.6 Precauciones especiales de eliminación y otras manipulaciones. Utilizar<br />
sólo si la emulsión es homogénea. Para la bolsa Excel: El indicador de integridad<br />
(Oxalert) deberá ser inspeccionado antes de retirar la sobrebolsa. Si el indicador es<br />
negro, es que el oxígeno ha penetrado en la sobrebolsa y el producto debe<br />
desecharse. Inspeccionar la emulsión visualmente por si aparece separación de<br />
fases antes de la administración. Asegurar que la emulsión final para perfusión no<br />
muestre ninguna señal de separación de fases. Para un solo uso. Cualquier resto de<br />
emulsión sobrante debe desecharse. Aditivos Smoflipid puede mezclarse<br />
asépticamente con aminoácidos, glucosa y soluciones de electrolitos para formar<br />
mezclas de <strong>Nutri</strong>ción Parenteral Total (NPT) “Todo-En-Uno”. La compatibilidad de<br />
los diferentes aditivos y el tiempo de almacenamiento de las diferentes mezclas,<br />
están disponibles por parte del titular de la autorización de comercialización a<br />
petición de los interesados. Las adiciones deben realizarse asépticamente. Debe<br />
rechazarse cualquier mezcla sobrante después de la perfusión. La eliminación del<br />
medicamento no utilizado y de todos los materiales que hayan estado en contacto<br />
con él, se realizará de acuerdo con la normativa local. 7. titULAR De LA<br />
AUtoRiZACiÓn De ComeRCiALiZACiÓn. Titular: <strong>Fresenius</strong> <strong>Kabi</strong> AB. 751 74<br />
Uppsala. Suecia. Representante Local: <strong>Fresenius</strong> <strong>Kabi</strong> <strong>España</strong> S.A.U. C/Marina 16-18.<br />
08005 Barcelona. <strong>España</strong>. 8. nÚmeRo De AUtoRiZACiÓn De ComeRCiALiZACiÓn.<br />
66.581. 9. feCHA De LA PRimeRA AUtoRiZACiÓn/RenovACiÓn De LA<br />
AUtoRiZACiÓn. 6-Febrero- 2004/ 1-Octubre-2008. 10. feCHA De LA ReviSiÓn<br />
DeL teXto. Mayo 2010. 11. RÉGimen De PReSCRiPCiÓn Y DiSPenSACiÓn. Con<br />
receta médica. Uso hospitalario. medicamento ético. 12. ConDiCioneS De LA<br />
PReStACiÓn fARmACÉUtiCA DeL SnS. No financiado.<br />
vitALiPiD® infAntiL<br />
1. NOMBRE DEL MEDICAMENTO. VITALIPID INFANTIL. 2. COMPOSICIÓN<br />
CUALITATIVA Y CUANTITATIVA. 1 ml de VITALIPID INFANTIL contiene:<br />
Retinolpalmitato 135,3 μg. (equivalente a Retinol 69 μg). Fitomenadiona 20 μg.<br />
Ergocalciferol 1,0 μg. dl-α-Tocoferol 0,64 mg. Los ingredientes activos en 1 ml de<br />
VITALIPID INFANTIL corresponden a: Vitamina A 69 μg (230 UI). Vitamina D2 1,0 μg<br />
(40 UI). Vitamina E 0,64 mg (0,7 UI). Vitamina K1 20 μg. Características del producto.<br />
pH: aprox. 8. Osmolalidad: aprox. 300 mosm/kg agua. Para la lista completa de<br />
excipientes, ver sección 6.1. 3. FORMA FARMACÉUTICA. Concentrado para<br />
solución para perfusión. VITALIPID INFANTIL es una emulsión aceite-en-agua estéril<br />
conteniendo vitaminas liposolubles en la fase oleosa. 4. DATOS CLÍNICOS.<br />
4.1 Indicaciones terapéuticas. VITALIPID INFANTIL está indicado en niños hasta<br />
los 11 años de edad como suplemento en nutrición intravenosa para cubrir las<br />
necesidades de vitaminas liposolubles A, D2, E y K1. 4.2 Posología y forma de<br />
administración. Dosificación. 4 ml/kg peso corporal/día en bebés prematuros<br />
y bebés de bajo peso hasta 2,5 kg peso corporal, y 10 ml/día para bebés y niños de<br />
más de 2,5 kg y hasta los 11 años de edad. Ver sección 6.6. 4.3 Contraindicaciones.<br />
Hipersensibilidad a la proteína de huevo, de soja o de cacahuete, o a cualquiera de<br />
las sustancias activas o excipientes. Hipervitaminosis correspondientes.<br />
4.4 Advertencias y precauciones especiales de empleo. Este producto<br />
contiene aceite de soja y fosfolípidos de huevo, que muy raramente pueden causar<br />
reacciones alérgicas. Se han observado reacciones alérgicas cruzadas entre la soja<br />
y el cacahuete. VITALIPID INFANTIL no deberá ser administrado sin diluir.<br />
4.5 Interacción con otros medicamentos y otras formas de interacción.<br />
En raras ocasiones se han reportado interacciones de vitaminas liposolubles con<br />
otros componentes en regímenes de nutrición parenteral. La presencia de<br />
oligoelementos puede causar alguna degradación de la vitamina A. El Retinol<br />
(vitamina A) puede romperse por la exposición a la luz ultravioleta. La vitamina K1<br />
interacciona con anticoagulantes del tipo cumarínico. 4.6 Embarazo y lactancia.<br />
No procede. 4.7 Efectos sobre la capacidad para conducir y utilizar<br />
maquinaria. No procede. 4.8 Reacciones adversas. No se han reportado<br />
reacciones adversas relacionadas con VITALIPID INFANTIL. 4.9 Sobredosificación.<br />
La sobredosis de vitaminas liposolubles puede dar lugar a síndromes de toxicidad<br />
aunque no existe evidencia de toxicidad a las dosis recomendadas. Si VITALIPID<br />
INFANTIL se administra a la dosis recomendada en un régimen de nutrición<br />
parenteral completa, no tienen que aparecer signos ni síntomas de intoxicación. No<br />
es necesario instaurar ningún tratamiento específico. Después de una perfusión<br />
prolongada con sobredosificación de Vitamina D, pueden aparecer concentraciones<br />
séricas elevadas de los metabolitos de la Vitamina D. Esto puede causar osteopenia.<br />
La perfusión rápida de Vitamina K1 en solución acuosa de coloides, puede provocar<br />
sofocos, broncoespasmo, taquicardia e hipotensión. Estos trastornos no han sido<br />
reportados después de las infusiones con Vitalipid Infantil. 5. PROPIEDADES<br />
FARMACOLÓGICAS. 5.1 Propiedades farmacodinámicas. Grupo<br />
farmacoterapéutico: Concentrado para solución para perfusión. Código ATC: B05X<br />
C. VITALIPID INFANTIL es una mezcla de vitaminas liposolubles en cantidades<br />
normalmente absorbidas por dieta oral y no debería haber otros efectos<br />
farmacodinámicos además del mantenimiento o reposición del estado nutricional.<br />
5.2 Propiedades farmacocinéticas. En perfusión intravenosa las vitaminas<br />
liposolubles de VITALIPID INFANTIL son metabolizadas de forma similar a las<br />
ingeridas por dieta oral. 5.3 Datos preclínicos sobre seguridad. La evaluación<br />
de seguridad de VITALIPID INFANTIL está basada principalmente en la experiencia<br />
clínica. 6. DATOS FARMACÉUTICOS. 6.1 Relación de excipientes. 1 ml de<br />
VITALIPID INFANTIL contiene: Aceite de soja purificado 100 mg. Fosfolípidos de<br />
huevo purificados 12 mg. Glicerol (anhidro) 22 mg. Hidróxido sódico 1 M c.s.p. para<br />
pH 8. Agua para inyección c.s.p. 1 ml. 6.2 Incompatibilidades. VITALIPID INFANTIL<br />
puede ser añadido o mezclado únicamente con productos medicinales cuya<br />
compatibilidad haya sido documentada. Ver sección 6.6. 6.3 Período de validez.<br />
Período de validez del producto envasado para la venta. 24 meses.<br />
6.4 Precauciones especiales de conservación. Conservar por debajo de<br />
25 ºC. Proteger de la luz. No congelar. Ver sección 6.6. 6.5 Naturaleza y<br />
contenido del envase. Ampollas de vidrio tipo I. Envase con 10 ampollas de 10<br />
ml. 6.6 Instrucciones de uso y manipulación. Administración. VITALIPID<br />
INFANTIL no debe ser administrado sin diluir. Compatibilidad e instrucciones<br />
de uso. Todas las adiciones deben realizarse de forma aséptica. 10 ml (1 ampolla)<br />
de VITALIPID INFANTIL deberá añadirse a Intralipid ® 10% o 20% o a otras emulsiones<br />
lipídicas cuya compatibilidad haya sido estudiada previamente. Para asegurar una<br />
mezcla homogénea la botella deberá ser invertida un par de veces inmediatamente<br />
antes de la perfusión. En niños de más de 10 kg de peso VITALIPID INFANTIL puede<br />
ser utilizado para disolver Soluvit ® . En niños de menos de 10 kg/peso corporal, la<br />
disolución con Soluvit ® no está recomendada debido a diferencias en los regímenes<br />
de dosificación. Estabilidad después de la mezcla. La adición de VITALIPID<br />
INFANTIL a Intralipid 10% o 20% deberá ser realizada una hora antes del comienzo<br />
de la perfusión, y ésta deberá ser utilizada dentro de las 24 horas siguientes a la<br />
preparación para prevenir contaminación microbiana. El contenido restante de las<br />
botellas/viales/ampollas deberá ser desechado y no podrá ser utilizado de nuevo.<br />
6.7 Nombre o razón social y domicilio permanente. FRESENIUS KABI<br />
ESPAÑA, S.A.U. Marina 16-18. 08005 Barcelona. 7. TITULAR DE LA AUTORIZACIÓN<br />
DE COMERCIALIZACIÓN. FRESENIUS KABI ESPAÑA S.A.U. C/ Marina 16-18. 08005<br />
Barcelona. 8. NÚMERO DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN.<br />
61.021. 9. FECHA DE LA PRIMERA AUTORIZACIÓN DE COMERCIALIZACIÓN/<br />
REVALIDACIÓN DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN. 28-Julio-<br />
1997. 10. FECHA DE REVISIÓN (PARCIAL) DEL TEXTO. Marzo 2008.<br />
11. RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN. Con receta ordinaria.<br />
Medicamento ético. 12. CONDICIONES DE LA PRESTACIÓN FARMACÉUTICA<br />
DEL SNS. No financiado.<br />
SoLUvit ®<br />
1. nomBRe DeL meDiCAmento SOLUVIT 2. ComPoSiCiÓn CUALitAtivA Y<br />
CUAntitAtivA Un vial de producto liofilizado contiene: Principios activos:<br />
Mononitrato de tiamina 3,1 mg (correspondiendo a Vit. B1 2,5 mg); Fosfato sódico de<br />
riboflavina 4,9 mg (correspondiendo a Vit. B2 3,6 mg); Nicotinamida 40,0 mg;<br />
Clorhidrato de piridoxina 4,9 mg (correspondiendo a Vit. B6 4,0 mg); Pantotenato<br />
sódico 16,5 mg (correspondiendo a ácido pantoténico 15,0 mg); Ascorbato sódico<br />
113,0 mg (correspondiendo a Vit. C 100 mg); Biotina 60,0 μg; Ácido fólico 0,40 mg;<br />
Cianocobalamina 5,0 μg; * Osmolalidad en 5 ml de agua: 1.000 mosm/kg agua. * pH<br />
en 10 ml de agua: 5,8 3. foRmA fARmACÉUtiCA Polvo liofilizado. 4. DAtoS<br />
CLÍniCoS 4.1 Indicaciones terapéuticas Soluvit está indicado en pacientes<br />
adultos y niños para cubrir las necesidades diarias de vitaminas hidrosolubles en<br />
nutrición parenteral. 4.2 Posología y forma de administración Posología En<br />
pacientes adultos y niños con peso superior a 10 kg, la dosis diaria recomendada<br />
corresponde al contenido de un vial. A niños con peso inferior a 10 kg se les<br />
administrará 1/10 del contenido de un vial reconstituido por kg de peso y día. Forma<br />
de administración Soluvit una vez reconstituido el vial según el apartado 6.6<br />
(Instrucciones de uso), deberá añadirse a la solución a infundir por vía intravenosa.<br />
4.3 Contraindicaciones Hipersensibilidad conocida a cualquiera de los<br />
componentes. No inyectar a personas que hayan presentado signos de intolerancia
a la tiamina (B1) 4.4 Advertencias y precauciones especiales de empleo El<br />
ácido fólico puede disminuir la concentración en suero de fenitoína y enmascarar<br />
una anemia perniciosa. Algunas neuropatías ópticas podrían verse afectadas por la<br />
administración de cianocobalamina. 4.5 Interacciones con otros<br />
medicamentos y otras formas de interacción La vitamina B6 puede reducir<br />
el efecto de la levodopa. Se ha indicado que el ácido fólico es inestable en<br />
presencia de sales de calcio como el gluconato cálcico. 4.6 Embarazo y<br />
lactancia No se han llevado a cabo estudios sobre reproducción en animales con<br />
Soluvit. Pero la experiencia clínica y los datos publicados no han puesto en<br />
evidencia riesgo en este grupo de población al igual que en mujeres en el período<br />
de lactancia. 4.7 Efectos sobre la capacidad de conducir y utilizar<br />
maquinaria No procede. 4.8 Reacciones adversas Pueden aparecer reacciones<br />
alérgicas (rash, prurito, etc.) en pacientes con hipersensibilidad a algún componente<br />
de la preparación, por ejemplo tiamina o parahidroxibenzoato de metilo. 4.9<br />
Sobredosificación No se han observado efectos adversos como consecuencia de<br />
una sobredosificación de vitaminas hidrosolubles. 5 PRoPieDADeS<br />
fARmACoLÓGiCAS 5.1 Propiedades farmacodinámicas Soluvit es una<br />
mezcla de vitaminas hidrosolubles en cantidades normalmente administradas por<br />
la dieta oral. Las vitaminas que integran este medicamento, son sustancias<br />
fisiológicas que se encuentran en el organismo y cuyas acciones y efectos son bien<br />
conocidos. 5.2 Propiedades farmacocinéticas El producto está concebido<br />
como una solución inyectable para administración intravenosa e incorporación a la<br />
nutrición parenteral, pasando directamente al torrente circulatorio y<br />
distribuyéndose rápidamente por los órganos más irrigados: corazón, hígado,<br />
riñón, encéfalo y otros. Las vitaminas hidrosolubles se excretan por la orina. 5.3<br />
Datos preclínicos de seguridad La seguridad de la administración de las<br />
vitaminas hidrosolubles está basada principalmente en la experiencia clínica y en<br />
la documentación existente sobre las mismas, no existiendo datos relevantes de<br />
toxicidad de este medicamento. 6. DAtoS fARmACÉUtiCoS 6.1 Relación de<br />
excipientes Glicina (ácido aminoacético) 300 mg Edetato disódico 0,5 mg<br />
Parahidroxibenzoato de metilo 0,5 mg 6.2 Incompatibilidades Soluvit debe ser<br />
añadido o mezclado solamente con otros productos medicinales cuya compatibilidad<br />
haya sido comprobada. 6.3 Período de validez 30 meses, en las condiciones de<br />
conservación recomendadas. 6.4 Precauciones especiales de conservación<br />
Almacenar a una temperatura inferior a 30ºC. Proteger de la luz. Soluvit deberá ser<br />
disuelto antes de su empleo. Cuando se diluya Soluvit en soluciones con base<br />
acuosa, la mezcla deberá estar protegida de la luz. Esto no será necesario si Soluvit<br />
se diluye con emulsiones lipídicas, por los efectos protectores de la emulsión<br />
grasa. 6.5 Naturaleza y contenido del recipiente Vial de vidrio tipo I con<br />
producto liofilizado. Envase conteniendo 10 viales. 6.6 Instrucciones de uso y<br />
manipulación Para su utilización el vial de Soluvit debe ser reconstituido de<br />
forma aséptica de la siguiente manera: Adultos y niños mayores de 11 años: El<br />
contenido de un vial de Soluvit puede ser disuelto añadiendo 10 ml de una de las<br />
siguientes soluciones: 1. Vitalipid adultos 2. Intralipid 10% - Intralipid 20% 3. Agua<br />
para inyección 4. Solución de glucosa para infusión, sin electrolitos (5% - 70%) Las<br />
mezclas disueltas en 1 ó 2 pueden ser añadidas solamente a Intralipid o a otras<br />
emulsiones lipídicas cuya compatibilidad haya sido estudiada previamente. Niños<br />
de edad inferior a 11 años: El contenido de un vial puede ser disuelto añadiendo 10<br />
ml de una de las siguientes soluciones: 1. Vitalipid infantil 2. Intralipid 10% -<br />
Intralipid 20% 3. Agua para inyección 4. Solución de glucosa para infusión, sin<br />
electrolitos (5% - 70%) Las mezclas disueltas 1 y 2 pueden ser añadidas solamente<br />
a Intralipid o a otras emulsiones lipídicas cuya compatibilidad haya sido estudiada<br />
previamente. A niños de edad inferior a 11 años, con un peso inferior a 10 kg se les<br />
administrará 1 ml de la mezcla reconstituida por Kg de peso corporal y día. A los<br />
niños con un peso superior a 10 kg se les administrará 10 ml de la misma (1 vial al<br />
día). Soluvit puede formar parte de mezclas nutritivas en las que se asocien<br />
glúcidos, lípidos, aminoácidos y electrolitos tras haber comprobado previamente la<br />
compatibilidad y estabilidad en cada caso. Soluvit disuelto deberá ser añadido a la<br />
solución de infusión en un plazo no superior a una hora antes del comienzo de la<br />
misma y ésta deberá ser utilizada dentro de las 24 horas siguientes a su<br />
preparación. 6.7 Nombre o razón social y domicilio permanente FRESENIUS<br />
KABI ESPAÑA, S.A. Marina 16-18 planta 17 08005 – Barcelona. 7. feCHA De ReviSiÓn<br />
DeL teXto. 1997. 8. RÉGimen De PReSCRiPCiÓn Y DiSPenSACiÓn. Con receta<br />
médica. Uso hospitalario. medicamento ético. 10. ConDiCioneS De LA<br />
PReStACiÓn fARmACÉUtiCA DeL SnS. No financiado.<br />
GLYCoPHoS ® (KP-242)<br />
1. nomBRe DeL meDiCAmento GLYCOPHOS ® 2. ComPoSiCiÓn CUALitAtivA Y<br />
CUAntitAtivA 1 ml de GLYCOPHOS contiene: Ingrediente activo Glicerofosfato<br />
sódico x 5H2O 306,1 mg = 216 mg Glicerofosfato sódico anhidro Los ingredientes<br />
activos en 1 mi de GLYCOPHOS corresponden a: Fosfato 1 mmol Sodio 2 mmol<br />
Osmolalidad teórica: 2.760 mosm/kg agua pH: 7,4 Excipientes: Ver apartado 6.1 3.<br />
La nutrición parenteral pediátrica a través de un caso clínico<br />
foRmA fARmACÉUtiCA Concentrado para solución para perftisión 4. DAtoS<br />
CLÍniCoS 4.1 Indicaciones terapéuticas GLYCOPHOS está indicado en pacientes<br />
adultos como suplemento en nutrición intravenosa para cubrir las necesidades de<br />
fosfato. 4.2 Posología y forma de administración GLYCOPHOS no debe ser<br />
administrado sin diluir. La dosificación recomendada es individual. La dosis diaria<br />
recomendada de fosfato durante lanutrición intravenosa es de unos 10-20 mmol.<br />
Ello puede obtenerse añadiendo 10-20 mi deGLYCOPHOS a la solución de perfusión<br />
o a la mezcla cuya compatibilidad ha sidocomprobada. La solución se administrará<br />
mediante perfusión intravenosa. El tiempo de perfusión de lasolución no debe ser<br />
inferior a 8 horas. Para información sobre las incompatibilidades y las instrucciones<br />
de uso, ver el apartado 6.6. 4.3 Contraindicaciones GLYCOPHOS no debe ser<br />
administrado a pacientes en estado de deshidratación o conhipematremia,<br />
hiperfosfatemia, insuficiencia renal grave o estado de shock. 4.4 Advertencias y<br />
precauciones especiales de empleo GLYCOPHOS deberá ser utilizado con<br />
precaución en pacientes con la función renal dañada. Elnivel de fosfato de todos<br />
los pacientes deberá ser monitorizado regularmente.GLYCOPHOS no debe ser<br />
administrado sin diluir. 4.5 Interacción con otros medicamentos y otras<br />
formas de interacción No se han observado interacciones con otros<br />
medicamentos aunque se ha visto una moderadadisminución de fosfato sérico<br />
durante inftisiones de carbohidratos 4.6 Embarazo y lactancia No se dispone<br />
de datos adecuados extraídos del uso de GLYCOPHOS en mujeres embarazadas,ni se<br />
han realizado estudios de reproducción en animales. Sin embargo, las necesidades<br />
defosfato de una mujer embarazada disminuyen ligeramente en comparación a<br />
mujeres noembarazadas. GLYCOPHOS no debe utilizarse durante el embarazo a no<br />
ser que sea claramente necesario. 4.7 Efectos sobre la capacidad para<br />
conducir y utilizar maquinaria No se han observado 4.8 Reacciones<br />
adversas No se han comunicado reacciones adversas relacionadas con<br />
glicerofosfatos. 4.9 Sobredosificación No se han observado efectos adversos<br />
causados por una sobredosificación. La mayoría de los pacientes necesitados de<br />
nutrición intravenosa tienen un aumento en la capacidad de admitir glicerofosfatos.<br />
Ver también “Contraindicaciones”. 5. PRoPieDADeS fARmACoLÓGiCAS 5.1<br />
Propiedades farmacodinámicas El glicerofosfato es un metabolito intermedio<br />
en el metabolismo graso y es improbable cualquier otro efecto farmacodinámico.<br />
5.2 Propiedades farmacocinéticas Para ser efectivo, es necesario que el<br />
grupo de fosfatos sea hidrolizado a partir de la moléculaglicerofosfato. La<br />
hidrólisis sucede principalmente a una concentración de plasma de > 0,7mmol/1.<br />
Suponiendo que toda la hidrólisis del glicerofosfato tenga lugar en el plasma, unos<br />
12-15 mmol de glicerofosfato sódico son hidrolizados cada día en individuos con<br />
fosfatasa alcalinasérica normal. El fosfato administrado por vía intravenosa no es<br />
absorbido por el tejido y es excretado casitotalmente por la orina. 5.3 Datos<br />
preclinicos sobre seguridad Los datos preclinicos obtenidos en los estudios de<br />
seguridad convencionales realizados no hanindicado que exista un riesgo para los<br />
seres humanos. 6. CARACteRÍStiCAS fARmACÉUtiCAS 6.1 Lista de<br />
excipientes Ácido clorhídrico c.s.p. pH 7,4 (Ph.Eur.) Agua para inyección c.s.p. 1 mi<br />
(Ph.Eur.) 6.2 Incompatibilidades GLYCOPHOS puede ser añadido o mezclado<br />
solamente con otros productos medicinales cuyacompatibilidad haya sido<br />
documentada. Ver 6.6. 6.3 Periodo de validez 36 meses 6.4 Precauciones<br />
especiales de conservación Conservar por debajo de 25 °C. No congelar. 6.5<br />
Naturaleza y contenido del recipiente Viales para inyección de polipropileno<br />
de 20 ml. Presentación en cajas con 10 viales de 20 ml. 6.6 Instrucciones de<br />
uso/manipulación GLYCOPHOS no debe ser administrado sin diluir. Antes de usar,<br />
comprobar que la solución es homogénea y que el vial no está dañado.<br />
COMPATIBILIDAD Las adiciones deben realizarse de forma aséptica. 120 ml de<br />
GLYCOPHOS y 48 mmol de calcio (CaCy pueden añadirse a 1000 ml de Vamin<br />
Glucosa, Vamin 14, Vaminl4 sin electrolitos y Vamin 18 sin electrolitos. 10 ml de<br />
GLYCOPHOS y 10 mmol de calcio (CaClz) pueden añadirse a 1000 mi de Glucosa 50<br />
mg/ml. 20 ml de GLYCOPHOS y 20 mmol de calcio (CaCli) pueden añadirse a 1000 mi<br />
de Glucosa 200 mg/ml. 60 ml de GLYCOPHOS y 24 mmol de calcio (CaClz) pueden<br />
añadirse a 1000 mi de Glucosa 500 mg/ml. TIEMPO DE PERFUSIÓN El tiempo de<br />
perfusión no debe ser inferior a 8 horas. ESTABILIDAD Cuando se realizan adiciones<br />
a una solución para perfusión, la perfusión deberá ser administrada dentro de las<br />
24 horas siguientes a su preparación para prevenir contaminación microbiana. El<br />
contenido sobrante de frascos/viales/ampollas abiertos deberá ser desechado y no<br />
podrá guardarse para uso posterior. 7. titULAR De LA AUtoRiZACiÓn De<br />
ComeRCiALiZACiÓn Nombre y razón social del titular de la autorización<br />
de comercialización <strong>Fresenius</strong> <strong>Kabi</strong> <strong>España</strong> S.A. c ) Marina 16-18, planta 17 Torre<br />
Mapfre - Villa Olímpica 08005-BARCELONA 8. nÚmeRo De LA AUtoRiZACiÓn De<br />
ComeRCiALiZACiÓn 9. feCHA De LA PRimeRA AUtoRiZACiÓn / RenovACiÓn<br />
De LA AUtoRiZACiÓn 10. feCHA De LA ReviSiÓn (PARCiAL) DeL teXto<br />
Octubre 2.001. 11. RÉGimen De PReSCRiPCiÓn Y DiSPenSACiÓn. Con receta<br />
médica. Uso hospitalario. 12 ConDiCioneS De LA PReStACiÓn fARmACÉUtiCA<br />
DeL SnS. No financiado.<br />
15
nutrición parenteraL<br />
La llevamos en la sangre<br />
A cada paso del camino<br />
Desde prematuros hasta niños<br />
Prematuros<br />
fresenius <strong>Kabi</strong> españa, s.a.u.<br />
Torre Mapfre - Vila Olímpica<br />
C/ Marina, 16-18 08005 Barcelona<br />
Tel. 93 225 65 65 Fax 93 225 65 75<br />
www.fresenius-kabi.es<br />
Recién nacidos<br />
Aminoven ®<br />
SMOFlipid ®<br />
Niños<br />
Vitaminas para<br />
prevenir o corregir las deficiencias en bebés y niños:<br />
Soluvit ®<br />
Vitaminas hidrosolubles<br />
20%<br />
Emulsión lipídica similar al patrón de los ácidos grasos<br />
de la leche materna, con los beneficios del ω-3.<br />
Glycophos ®<br />
(KP-242)<br />
Concentrado de glicerofosfato sódico (fuente orgánica).<br />
Reduce el riesgo de precipitación con el calcio. (1)<br />
(1) Documento de consenso SENPE/SEPGHNP/SEFH sobre <strong>Nutri</strong>ción Parenteral Pediátrica. <strong>Nutri</strong>ción Hospitalaria 2007; 22 (6): 710-19<br />
Bebés<br />
Infant 10%<br />
INDICACIÓN PEDIÁTRICA<br />
Desde prematuros hasta niños<br />
Solución de aminoácidos diseñada específicamente para cubrir<br />
los requerimientos de prematuros, bebés y niños.<br />
Vitalipid Infantil ®<br />
Vitaminas hidrosolubles<br />
2080 ED: 12/10