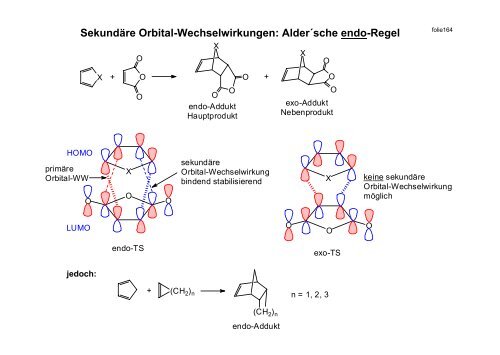
Sekundäre Orbital-Wechselwirkungen: Alder´sche ... - bei DuEPublico
Sekundäre Orbital-Wechselwirkungen: Alder´sche ... - bei DuEPublico
Sekundäre Orbital-Wechselwirkungen: Alder´sche ... - bei DuEPublico
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Sekundäre</strong> <strong>Orbital</strong>-<strong>Wechselwirkungen</strong>: <strong>Alder´sche</strong> endo-Regel<br />
jedoch:<br />
O<br />
X + O<br />
O<br />
+ (CH 2) n<br />
X<br />
O<br />
O<br />
endo-Addukt<br />
Hauptprodukt<br />
O +<br />
(CH 2) n<br />
endo-Addukt<br />
X<br />
O<br />
O<br />
O<br />
exo-Addukt<br />
Nebenprodukt<br />
HOMO<br />
primäre<br />
<strong>Orbital</strong>-WW<br />
X<br />
sekundäre<br />
<strong>Orbital</strong>-Wechselwirkung<br />
bindend stabilisierend<br />
X<br />
LUMO<br />
O<br />
O O<br />
endo-TS<br />
O O<br />
O<br />
exo-TS<br />
n = 1, 2, 3<br />
folie164<br />
keine sekundäre<br />
<strong>Orbital</strong>-Wechselwirkung<br />
möglich
HOMO<br />
LUMO<br />
<strong>Sekundäre</strong> <strong>Orbital</strong>-<strong>Wechselwirkungen</strong>: Cope-Umlagerung<br />
HOMO<br />
LUMO<br />
Sessel-TS<br />
~<br />
Boot-TS<br />
sekundäre<br />
<strong>Orbital</strong>-Wechselwirkung<br />
antibindend<br />
destabilisierend<br />
<strong>Sekundäre</strong> <strong>Orbital</strong>-<strong>Wechselwirkungen</strong>: [6+4]-Cycloaddition<br />
O<br />
O<br />
exo-TS<br />
keine sekundäre<br />
<strong>Orbital</strong>-Wechselwirkung<br />
möglich<br />
~<br />
~<br />
X O<br />
O<br />
folie165<br />
sekundäre<br />
<strong>Orbital</strong>-Wechselwirkung<br />
antibindend<br />
destabilisierend<br />
endo-TS
R<br />
Regiochemie der Diels-Alder-Reaktion<br />
k k<br />
x y<br />
x+n<br />
CHO<br />
y+m<br />
g g<br />
WW der <strong>Orbital</strong>koeffizienten c: gg – kk<br />
+<br />
R = Me: 130°C, 80%<br />
R = OMe : 130°C, 80%<br />
R<br />
+<br />
CHO<br />
R = Me: 130°C, 80%<br />
R = OSiMe 3 : 110°C, 81%<br />
xy + (x+n) (y+m) =<br />
xy + xy + xm + yn + nm<br />
R<br />
CHO<br />
regioselektiv<br />
nicht<br />
R<br />
CHO<br />
CHO<br />
R<br />
nicht<br />
R CHO<br />
><br />
k<br />
x<br />
x+n<br />
g<br />
y+m<br />
y<br />
g<br />
k<br />
x (y+m) + (x+n) y =<br />
xy + xm + yx + yn<br />
OMe<br />
HOMO LUMO<br />
kg – gk gg – kk<br />
folie166<br />
CHO
jedoch: (M. J. S. Dewar, J. Molecular Structure (Theochem) 1989, 200, 301-323)<br />
CO2H (0.568)<br />
HOMO LUMO<br />
CO2H (-0.539) (-0.477)<br />
1<br />
=<br />
EHO (Dien) – ELU (Dphil)<br />
Experimentell:<br />
CO 2H<br />
(0.660)<br />
+<br />
1<br />
-9.90 + 0.11<br />
CO 2H<br />
= -0.102<br />
∆T<br />
(0.476)<br />
LUMO<br />
(0.483)<br />
1<br />
CO 2H<br />
E HO (Dphil) – E LU (Dien)<br />
CO2H (0.678)<br />
=<br />
(0.644)<br />
CO2H CO2H CO2H +<br />
CO2H o- m-Addukt<br />
83 : 17<br />
HOMO<br />
folie167<br />
1<br />
= -0.095<br />
-11.19 + 0.69
Erklärung der Regioselektivität von Diels-Alder-Reaktionen mit Hilfe<br />
von Resonanzstrukturen des pericyclischen Übergangszustandes<br />
OR<br />
OR<br />
+<br />
+<br />
CN<br />
CN<br />
C N<br />
OR OR<br />
OR<br />
CN<br />
O<br />
OH<br />
C O<br />
C<br />
CO 2H<br />
OR<br />
OH<br />
CN<br />
CN<br />
OR<br />
OR<br />
CN<br />
m-Addukt<br />
nicht beobachtet<br />
CO2H CO2H CO 2H<br />
C N<br />
OR<br />
CO 2H<br />
Nebenprodukt<br />
CN<br />
o-Addukt<br />
beobachtet<br />
CO2H CO2H C OH O<br />
CO2H Hauptprodukt<br />
+<br />
CO2H CO2H CO2H folie168
Zweistufige Diels-Alder-Reaktionen in Konkurrenz zur<br />
zweistufigen [2+2]Cycloaddition<br />
Cl<br />
Cl<br />
folie169
Analyse des stereochemischen Verlaufs der zweistufigen<br />
Diels-Alder-Dimerisierung von Chloropren<br />
Cl D<br />
H<br />
D<br />
H<br />
folie170<br />
Cl
Zweistufige Diels-Alder-Reaktionen<br />
[4+2]-Cycloadditionen zwischen 1-(Dimethylamino)-1,3-butadien und den <strong>bei</strong>den<br />
isomeren Dicyanethylendicarbonestern<br />
folie171
Zweistufige Diels-Alder-Reaktionen<br />
[4+2]-Cycloaddition zwischen 1-(Dimethylamino)-1,3-butadien und cis-Dicyanethylendicarbonester<br />
folie172
A<br />
Volumes of Activation and Reaction<br />
B<br />
A<br />
B<br />
Forward reaction: decrease of volume (∆V, ∆V ≠ < 0) ⇒ accelerated by pressure<br />
Reverse reaction: increase of volume (∆V, ∆V ≠ > 0) ⇒ retarded by pressure<br />
∆V<br />
= ⎛<br />
⎜<br />
⎝<br />
∂∆<br />
∂<br />
G<br />
p<br />
⎞ K<br />
⎟ =<br />
⎠ p<br />
− ⎛ ∂ln<br />
⎜<br />
⎝ ∂<br />
T<br />
p<br />
⎞<br />
⎟ ⋅ RT<br />
⎠<br />
T<br />
∆V<br />
≠<br />
≠<br />
∆G<br />
=<br />
p<br />
⎛ ∂<br />
⎜<br />
⎝ ∂<br />
≠<br />
A<br />
⎞ k<br />
⎟ =<br />
⎠ p<br />
− ⎛ ∂ln<br />
⎜<br />
⎝ ∂<br />
∆V, ∆V ≠ : volumes of reactions and activation;<br />
K p : equilibrium constant at pressure p;<br />
k p : rate constant at p;<br />
∆G, ∆G ≠ : Gibbs enthalpy and Gibbs enthalpy of activation.<br />
∆V = V(A-B) – [V(A) + V(B)]<br />
∆V ≠ = V( [A-----B] ≠ ) – [V(A) + V(B)]<br />
T<br />
p<br />
B<br />
⎞<br />
⎟ ⋅ RT<br />
⎠<br />
T<br />
folie173
Relationship between the Rate of Reaction and Volume of Activation<br />
K (p) / k (1bar) = exp (-∆V ≠ ∆p / RT)<br />
∆V ≠ [cm 3 /mol]<br />
p [bar] +10 -10 -30<br />
1000 0.7 1.5 3.4<br />
7000 0.06 17 5000<br />
10000 0.02 56 200000<br />
T = 298 K; R = 83.14 [cm 3 bar / K mol]<br />
1000 bar = 1 kbar = 100 MPa = 0.1 GPa<br />
= 1013 atm = 14500 p.s.i.<br />
folie174
folie175<br />
Van Der Waals Volumes, Partial Molar Volumes and Packing Coefficients<br />
V W : van-der-Waals volume [cm 3 mol -1 ] (intrinsic molar volume of ground and transition structures)<br />
V M : molar volume [cm 3 mol -1 ] (empty space included) V M = M<br />
d<br />
VM : partial molar volume [cm3 mol-1 ] VM = lim<br />
c→0 η: packing coefficient<br />
η = V<br />
V<br />
M [g mol –1 ]: molar mass of the solute<br />
d [g cm –3 ]: density of the solution<br />
d 0 [g cm –3 ]: density of the pure solvent<br />
c [mol l –1 ]: concentration of the solute<br />
W<br />
M<br />
Φ Φ= − ⋅ − M 1 d d<br />
d c d<br />
0<br />
0<br />
0
_<br />
The Effect of Electrostriction on Heterolytic Dissoziations<br />
+<br />
+ _<br />
+<br />
_<br />
+<br />
_<br />
+<br />
_<br />
+<br />
A B<br />
_<br />
+<br />
_<br />
+<br />
_<br />
+<br />
_<br />
+<br />
_<br />
Decrease of Volume (∆V and ∆V ≠ < 0) ⇒ Process accelerated and equilibrium<br />
shifted toward products by pressure<br />
+<br />
+<br />
_<br />
_<br />
+<br />
_<br />
A +<br />
_<br />
+<br />
_<br />
_<br />
+<br />
+<br />
_<br />
+<br />
B-<br />
+<br />
_<br />
+ _<br />
+<br />
folie176<br />
_
Effect of Pressure on Diels-Alder-Reactions<br />
Acyclic Diene Dienophile<br />
+<br />
X +<br />
Cyclic Diene<br />
∆V ≠ = -25 to -45 cm 3 /mol<br />
∆V = -30 to -45 cm 3 /mol<br />
R<br />
R<br />
Transition State<br />
∆V ≠ / ∆V ≤ 1 (or even > 1)<br />
R van Eldik, T. Asano, W. J. le Noble et al., Chem. Rev. 1989, 89, 549, 1998, 98, 2167-2289<br />
F.-G. Klärner, M. K. Diedrich, A. E. Wigger, Effect of Pressure on Organic Reactions, Chapter 3 in<br />
„Chemistry under Extreme and Non-Classical Conditions“ (ed. R. van Eldik, C. D. Hubbard)<br />
Wiley Spektrum 1997<br />
R<br />
R<br />
endo<br />
X<br />
≠<br />
≠<br />
X<br />
X = CH 2, CH 2-CH 2, O, NR<br />
R<br />
R<br />
folie177
product ratio:<br />
Pericyclic Reaction<br />
+<br />
Stepwise Reaction<br />
⎛<br />
⎜<br />
⎝<br />
[ 4+ 2]<br />
[ 2+ 2]<br />
⎞<br />
⎟ =<br />
⎠<br />
Transition State<br />
⎛<br />
⎜<br />
⎝<br />
+<br />
[ 4+ 2]<br />
[ 2+ 2]<br />
⎞<br />
⎟ ⋅<br />
⎠<br />
p p=<br />
1<br />
exp<br />
≠ ⎛ −∆∆V ⋅∆p⎞<br />
⎜<br />
⎟<br />
⎝ R ⋅ T ⎠<br />
[4+2]<br />
[2+2]<br />
∆∆V ≠ = ∆V ≠ (pericyclic) - ∆V ≠ (stepwise) = - (9.8 ± 4.5) cm 3 mol -1<br />
(average of seven competitive reactions)<br />
≠<br />
Reactive Intermediate<br />
folie178<br />
F.-G. Klärner, B. Krawczyk, V. Ruster, U. K. Deiters,<br />
J. Am. Chem. Soc. 1994, 116, 7646-7657.
2<br />
Cl<br />
Aktivierungsvolumina der Chloropren-Dimerisierung<br />
23°C<br />
1 bar - 10 kbar<br />
Cl<br />
Diels-Alder-[4+2] Cycloaddukte<br />
Cl<br />
∆V [cm 3 /mol] -31 -29 -22<br />
∆V [cm 3 /mol] -22 -22<br />
Cl<br />
Cl<br />
+<br />
+<br />
Cl<br />
[2+2] Cycloaddukte<br />
Cl<br />
Cl<br />
Cl<br />
+<br />
Cl<br />
Cl<br />
Cl<br />
Cl<br />
Diradikal-Zwischenstufe<br />
folie179
Der Einfluss von Lewissäuren auf die Geschwindigkeit und die<br />
Regioselektivität von Diels-Alder-Reaktionen<br />
Me<br />
H<br />
E<br />
H<br />
endo-TS<br />
O<br />
OMe<br />
+ AlCl 3 OMe<br />
O AlCl 3<br />
Absenkung von LUMO (Dienophil)<br />
folie180
Der Einfluss von Lewissäuren auf die Geschwindigkeit und die<br />
Regioselektivität von Diels-Alder-Reaktionen<br />
folie181
C 2 -Symmetrische, kationische Kupfer(II)-Komplexe als chirale Lewis-<br />
Säuren- Einfluss des Gegenions <strong>bei</strong> enantioselektiven Diels-Alder-Reaktionen<br />
folie182<br />
David A. Evans, Jerry A. Murry, Peter von Matt, Roger D. Norcross und Scott J. Miller<br />
Angew. Chem. 1995, 107, Nr. 7, 864-867
X - = SbF 6 - X - = - OTf<br />
folie183
Grenzorbital-<strong>Wechselwirkungen</strong> im Übergangszustand der<br />
1,3-dipolaren Cycloaddition von Diazomethan an Ethylen<br />
CH 2 N N<br />
CH 2 N N<br />
Allyl-Anion<br />
LU (MO)<br />
HO (MO)<br />
folie184
Grenzorbital-<strong>Wechselwirkungen</strong> <strong>bei</strong> 1,3-dipolaren Cycloadditionen<br />
unterschiedlichen Elektronenbedarfs<br />
folie185
Geschwindigkeitskonstanten 1,3-dipolarer Cycloadditionen von Diazomalonester,<br />
aufgetragen als Funktion der HOMO- bzw. LUMO-Energien des Dipolarophils<br />
folie186
Carben-Addition<br />
H<br />
H<br />
+ C X<br />
cis-Addition<br />
X<br />
Insertion mit Retention<br />
C<br />
H<br />
+<br />
X<br />
C X<br />
Cheletrope Reaktionen<br />
H<br />
H<br />
C<br />
X<br />
X<br />
C X<br />
H X<br />
p LUMO<br />
lone pair HOMO<br />
FMOe von Singulett-Carben<br />
folie187
a) Lineare cheletrope Reaktion<br />
HOMO<br />
(π)<br />
~<br />
X<br />
C X<br />
LUMO<br />
(p)<br />
antibindend<br />
thermisch: orbitalsymmetrie-verboten<br />
b) nicht-lineare cheletrope Reaktion<br />
HOMO<br />
(π)<br />
X X<br />
C<br />
LUMO<br />
(p)<br />
thermisch: orbitalsymmetrie-erlaubt<br />
HOMO<br />
(π*)<br />
LUMO<br />
(π*)<br />
antibindend<br />
~<br />
X<br />
LUMO<br />
(lp)<br />
C<br />
X<br />
HOMO<br />
(lp)<br />
X<br />
C X<br />
C X<br />
π2s + ω2s bzw. π2s + ω0a 1 + 1 = 2 1 + 1 = 2<br />
X<br />
C<br />
X<br />
X<br />
π2s + ω0s bzw. π2s + ω2a 1 1<br />
folie188
X = H, Alkyl, Halogen:<br />
HOMO (π) – LUMO (p): entscheidende WW ⇒ diese Carbene sind elekrophil<br />
HOMO<br />
(π)<br />
Beispiel:<br />
X X<br />
C<br />
LUMO<br />
(p)<br />
> > > > ><br />
Reaktivität gegenüber CX 2 (X = F, Cl, Br)<br />
CCl 2<br />
Cl<br />
Cl<br />
folie189
trans<br />
+ SO 2<br />
LUMO<br />
(ψ 3*)<br />
SO 2<br />
∆T<br />
disrot.<br />
Lineare cheletrope Reaktion<br />
∆T<br />
konrot.<br />
- SO2 S<br />
O<br />
S<br />
O<br />
HOMO<br />
(lp)<br />
O<br />
HOMO LUMO<br />
SO 2<br />
O<br />
+ SO 2<br />
HOMO<br />
(ψ 2)<br />
π 2 s+ π 2 s + ω 2 s 3 bzw. π 2 s + π 2 s + ω 0 a 3<br />
E, Z, E<br />
π2s+ π2s + π2a + ω0a bzw. π2s + π2s + π2a + ω2s 1 + 1 + 0 + 1 = 3 1 + 1 + 0 + 1 = 3<br />
cis<br />
SO 2<br />
LUMO<br />
∆T<br />
disrot.<br />
∆T<br />
- SO 2<br />
S<br />
O<br />
O<br />
LUMO<br />
SO 2<br />
E, Z, Z<br />
S<br />
O<br />
HOMO<br />
O<br />
folie190