Selektive katalytische Reduktion von Stickoxiden in Kraftfahrzeugen ...
Selektive katalytische Reduktion von Stickoxiden in Kraftfahrzeugen ... Selektive katalytische Reduktion von Stickoxiden in Kraftfahrzeugen ...
3Tropfen Abbildung 3.12 zeigt den Vergleich des berechneten Umsatzes zu NH3 mit den ex- perimentellen Daten für Tg = 573 K, Tg = 623 K und Tg = 673 K bei verschiedenen Gasgeschwindigkeiten. Der Umsatz ist dabei definiert als das Verhältnis von gemessenem bzw. berechnetem Ammoniakgehalt zur möglichen Maximalkonzentration, wenn der Harnstoff komplett zu NH3 umgewandelt ist. Umsatz NH 3 [−] 1 0.8 0.6 0.4 0.2 0 Experiment Simulation u g = 9.0 m/s u g = 6.6 m/s T g = 573 K 0.2 0.4 0.6 0.8 1 Verweilzeit [s] Umsatz NH 3 [−] 1 0.8 0.6 0.4 0.2 0 Umsatz NH 3 [−] 1 0.8 0.6 0.4 0.2 0 u g = 10.8 m/s 0.2 0.4 0.6 0.8 1 Verweilzeit [s] u = 6.4 m/s g u = 9.1 m/s g Experiment Simulation u = 6.0 m/s g u = 8.3 m/s g u = 10.8 m/s g Experiment Simulation T g = 623 K 0.2 0.4 0.6 0.8 1 Verweilzeit [s] T g = 673 K Abbildung 3.12: Berechneter Umsatz zu NH3 für verschiedene Gasgeschwindigkeiten und Gastemperaturen im Vergleich mit den experimentellen Daten von Kim et al. [57] Bei einer Gastemperatur von 623 K zeigt sich eine gute Übereinstimmung von Simulation und Experiment. Während die Messwerte durch die Simulation bei Tg = 573 K eher unterschätzt werden, zeigen sich in der Simulation bei Tg = 673 K etwas zu hohe Umsätze. Dabei muss man jedoch beachten, dass die Freisetzung von Ammoniak sowohl direkt durch die Thermolyse von Harnstoff als auch durch die Hydrolyse von Isocyansäure erfolgt. Unsicherheiten können in der Beschreibung beider Reaktionen auftreten. Für niedrige Temperaturen kleiner 573 K läuft die Hydrolyse nur sehr langsam ab und trägt kaum zum Umsatz bei. 40
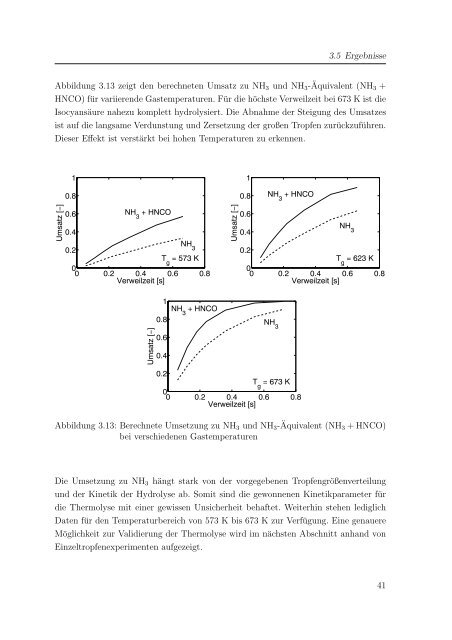
3.5 Ergebnisse Abbildung 3.13 zeigt den berechneten Umsatz zu NH3 und NH3-Äquivalent (NH3 + HNCO) für variierende Gastemperaturen. Für die höchste Verweilzeit bei 673 K ist die Isocyansäure nahezu komplett hydrolysiert. Die Abnahme der Steigung des Umsatzes ist auf die langsame Verdunstung und Zersetzung der großen Tropfen zurückzuführen. Dieser Effekt ist verstärkt bei hohen Temperaturen zu erkennen. Umsatz [−] 1 0.8 0.6 0.4 NH 3 + HNCO 0.2 NH 3 0 0 T = 573 K g 0.2 0.4 0.6 0.8 Verweilzeit [s] Umsatz [−] 1 0.8 0.6 0.4 NH 3 + HNCO Umsatz [−] 1 0.8 0.6 0.4 NH 3 + HNCO 0.2 T = 673 K g 0 0 0.2 0.4 0.6 0.8 Verweilzeit [s] NH 3 0.2 T = 623 K g 0 0 0.2 0.4 0.6 0.8 Verweilzeit [s] Abbildung 3.13: Berechnete Umsetzung zu NH3 und NH3-Äquivalent (NH3 + HNCO) bei verschiedenen Gastemperaturen Die Umsetzung zu NH3 hängt stark von der vorgegebenen Tropfengrößenverteilung und der Kinetik der Hydrolyse ab. Somit sind die gewonnenen Kinetikparameter für die Thermolyse mit einer gewissen Unsicherheit behaftet. Weiterhin stehen lediglich Daten für den Temperaturbereich von 573 K bis 673 K zur Verfügung. Eine genauere Möglichkeit zur Validierung der Thermolyse wird im nächsten Abschnitt anhand von Einzeltropfenexperimenten aufgezeigt. NH 3 41
- Seite 5: Kurzfassung Die selektive katalytis
- Seite 9 und 10: Inhaltsverzeichnis Formel- und Abk
- Seite 11 und 12: Symbol- und Abkürzungsverzeichnis
- Seite 13 und 14: Formel- und Abkürzungsverzeichnis
- Seite 15 und 16: T Wärmetransport th Thermolyse vap
- Seite 17 und 18: 1 Einleitung Bei der motorischen Ve
- Seite 19 und 20: Diesel-Oxidationskatalysator (DOC)
- Seite 21: für die Einhaltung der Abgasnormen
- Seite 24 und 25: 2 Einspritzung von Reduktionsmittel
- Seite 26 und 27: 2 Einspritzung von Reduktionsmittel
- Seite 28 und 29: 2 Einspritzung von Reduktionsmittel
- Seite 31 und 32: 3 Tropfen In diesem Kapitel wird di
- Seite 33 und 34: 3.2 Tropfenverdunstung bei denen di
- Seite 35 und 36: 3.2 Tropfenverdunstung allerdings b
- Seite 37 und 38: ˙Qcond = − ˙mvap � cp,vap,ref
- Seite 39 und 40: 3.2 Tropfenverdunstung Die Konzentr
- Seite 41 und 42: 3.3 Thermische Zersetzung von Harns
- Seite 43 und 44: 3.3 Thermische Zersetzung von Harns
- Seite 45 und 46: 3.3 Thermische Zersetzung von Harns
- Seite 47 und 48: Dampfdruck [Pa] x 104 10 8 6 4 2 Wa
- Seite 49 und 50: 3.5.1 Verdunstung 3.5 Ergebnisse Be
- Seite 51 und 52: 3.5 Ergebnisse dunstungsdauer. Dadu
- Seite 53 und 54: 3.5 Ergebnisse Die unterschiedliche
- Seite 55: 3.5 Ergebnisse Die Tropfengrößen
- Seite 59 und 60: 3.5 Ergebnisse Änderung der Steigu
- Seite 61: τ vap,HWL /τ vap,Wasser [−] 3.5
- Seite 64 und 65: 4 Spray Den Mittelwert der Transpor
- Seite 66 und 67: 4 Spray berücksichtigt die Konzent
- Seite 68 und 69: 4 Spray Insgesamt besteht das Berec
- Seite 70 und 71: 4 Spray Lamellenzerfall deformiert
- Seite 72 und 73: 4 Spray Der Einfluss der turbulente
- Seite 74 und 75: 5 Spray/Wand-Interaktion ein Dampfp
- Seite 76 und 77: 5 Spray/Wand-Interaktion hierfür i
- Seite 78 und 79: 5 Spray/Wand-Interaktion treffwinke
- Seite 80 und 81: 5 Spray/Wand-Interaktion Rebound Be
- Seite 82 und 83: 5 Spray/Wand-Interaktion mit ⎧
- Seite 84 und 85: 5 Spray/Wand-Interaktion Bei Kenntn
- Seite 86 und 87: 5 Spray/Wand-Interaktion chung (5.1
- Seite 88 und 89: 5 Spray/Wand-Interaktion durch Sied
- Seite 90 und 91: 5 Spray/Wand-Interaktion Die Kontak
- Seite 92 und 93: 5 Spray/Wand-Interaktion durch die
- Seite 94 und 95: 5 Spray/Wand-Interaktion 5.4.1 Film
- Seite 96 und 97: 5 Spray/Wand-Interaktion 5.4.2 Spez
- Seite 98 und 99: 5 Spray/Wand-Interaktion Der Wärme
- Seite 100 und 101: 5 Spray/Wand-Interaktion zwischen F
- Seite 102 und 103: 5 Spray/Wand-Interaktion f = 3 2 uD
- Seite 104 und 105: 5 Spray/Wand-Interaktion Um sicherz
3.5 Ergebnisse<br />
Abbildung 3.13 zeigt den berechneten Umsatz zu NH3 und NH3-Äquivalent (NH3 +<br />
HNCO) für variierende Gastemperaturen. Für die höchste Verweilzeit bei 673 K ist die<br />
Isocyansäure nahezu komplett hydrolysiert. Die Abnahme der Steigung des Umsatzes<br />
ist auf die langsame Verdunstung und Zersetzung der großen Tropfen zurückzuführen.<br />
Dieser Effekt ist verstärkt bei hohen Temperaturen zu erkennen.<br />
Umsatz [−]<br />
1<br />
0.8<br />
0.6<br />
0.4<br />
NH 3 + HNCO<br />
0.2<br />
NH<br />
3<br />
0<br />
0<br />
T = 573 K<br />
g<br />
0.2 0.4 0.6 0.8<br />
Verweilzeit [s]<br />
Umsatz [−]<br />
1<br />
0.8<br />
0.6<br />
0.4<br />
NH 3 + HNCO<br />
Umsatz [−]<br />
1<br />
0.8<br />
0.6<br />
0.4<br />
NH 3 + HNCO<br />
0.2<br />
T = 673 K<br />
g<br />
0<br />
0 0.2 0.4 0.6 0.8<br />
Verweilzeit [s]<br />
NH 3<br />
0.2<br />
T = 623 K<br />
g<br />
0<br />
0 0.2 0.4 0.6 0.8<br />
Verweilzeit [s]<br />
Abbildung 3.13: Berechnete Umsetzung zu NH3 und NH3-Äquivalent (NH3 + HNCO)<br />
bei verschiedenen Gastemperaturen<br />
Die Umsetzung zu NH3 hängt stark <strong>von</strong> der vorgegebenen Tropfengrößenverteilung<br />
und der K<strong>in</strong>etik der Hydrolyse ab. Somit s<strong>in</strong>d die gewonnenen K<strong>in</strong>etikparameter für<br />
die Thermolyse mit e<strong>in</strong>er gewissen Unsicherheit behaftet. Weiterh<strong>in</strong> stehen lediglich<br />
Daten für den Temperaturbereich <strong>von</strong> 573 K bis 673 K zur Verfügung. E<strong>in</strong>e genauere<br />
Möglichkeit zur Validierung der Thermolyse wird im nächsten Abschnitt anhand <strong>von</strong><br />
E<strong>in</strong>zeltropfenexperimenten aufgezeigt.<br />
NH 3<br />
41