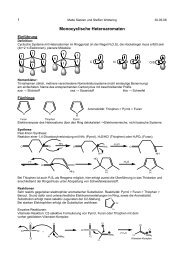
Cyclophane
Cyclophane
Cyclophane
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Vortrag im Rahmen des OC-F Praktikums WS 2007/08 09.11.2007<br />
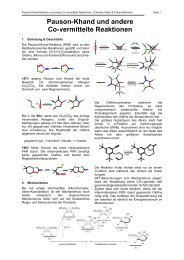
1. Einleitung<br />
<strong>Cyclophane</strong><br />
Eigenschaften, Synthesen, Reaktionen<br />
gehalten von<br />
Muxin Han und Vanessa Maria Brake<br />
1.1 Definition: Phane und <strong>Cyclophane</strong><br />
Als Phane werden Moleküle bezeichnet, die aus einem Aromaten bestehen, der durch eine<br />
zumeist aliphatische Kette überbrückt ist. Damit gehören zu den so genannten ansa-Verbindungen.<br />
Nach der Definition von Vögtle & Neumann werden Systeme, in denen der Aromat ein Benzolring<br />
ist, als <strong>Cyclophane</strong> bezeichnet. Allerdings hat sich eingebürgert, den Begriff „Cyclophan“ speziell<br />
für solche Moleküle zu verwenden, in denen zwei Benzolringe über mindestens zwei aliphatische<br />
Ketten miteinander verbrückt sind. Enthalten Phane Heteroatome im aromatischen Ring nennt man<br />
sie Heterophane. Sind die Heteroatome in der Brücke lokalisiert, spricht man von Heteraphanen.<br />
Das bekannteste Cyclophan ist das [2.2]Paracyclophan.<br />
1.2 Nomenklatur<br />
Neben der üblichen IUPAC-Nomenklatur existiert eine von Cram und anderen begründete<br />
Benennung für <strong>Cyclophane</strong>. Hinter den Namen des Aromaten wird die Silbe „phan“ angehängt.<br />
Benzenophane werden per Konvention auch „<strong>Cyclophane</strong>“ genannt. In eckigen Klammeren wird<br />
die Anzahl der Atome der Brücke nach absteigender Kettenlänge vor den Namen gesetzt. Die<br />
Positionen der Brücken werden entweder durch die Angaben ortho, meta und para vor den Namen<br />
gestellt oder als Zahlen in runden Klammern. Bsp.: [2.2]Paracyclophan = [2.2](1,4)Cyclophan.<br />
Wenn für ein Cyclophan die maximal mögliche Anzahl an Verbrückungen realisiert worden ist,<br />
bezeichnet man es als „Superphan“.<br />
[CH2] 4 [CH<br />
NH<br />
2] 6<br />
2<br />
22-Amino[6.4]orthometacyclophan<br />
1<br />
10 11<br />
9<br />
6<br />
12<br />
16 7<br />
5<br />
13<br />
15<br />
8<br />
4<br />
14<br />
3<br />
2<br />
10<br />
9<br />
(6)<br />
7<br />
15<br />
N<br />
12<br />
(2)<br />
5 4<br />
[2.2.0]Metacyclophan [2 2](1,4)Cyclophan [2]Paracyclo-<br />
[2](2,6)pyridinophan<br />
1<br />
8<br />
1<br />
2
Vortrag im Rahmen des OC-F Praktikums WS 2007/08 09.11.2007<br />
1.3 Optische Aktivität bei <strong>Cyclophane</strong>n – planare Chiralität<br />
Substituierte <strong>Cyclophane</strong> können je nach Substitutionsmuster optische Aktivität aufweisen. Diese<br />
häufig bei ansa-Verbindungen auftretende Chiralität wird als planare Chiralität bezeichnet. Als<br />
Beispiel für eine solche Verbindung ist die Paracyclophancarbonsäure dargestellt. In dieser<br />
Verbindung ist x die Gruppe mit der höchsten Priorität nach den CIP-Regeln, die mit der<br />
Chiralitätsebene verbunden ist, das sog. „pilot atom“. Von diesem ausgehend, werden die Atome in<br />
der Ebene betrachtet.<br />
Je nachdem welche Drehrichtung sich ergibt, wird Rp oder Sp als Stereodeskriptor verwendet.<br />
b<br />
a<br />
X<br />
c<br />
c<br />
Sp COOH<br />
HOOC<br />
Rp<br />
2. [2.2]<strong>Cyclophane</strong>: Synthesen, Reaktionen und Eigenschaften<br />
Besonders gut charakterisiert sind die [2.2]<strong>Cyclophane</strong>, die im Zentrum der Cyclophanchemie<br />
stehen. Von den 6 möglichen Kombinationen konnte nur das Orthoparacyclophan noch nicht<br />
synthetisiert werden. Die bekanntesten Phane dieser Gruppe sind das [2.2]Paracyclophan und das<br />
[2.2]Metacyclophan.<br />
2.1 Verschiedene Synthesewege<br />
• Pyrolyse von p-Xylol (Swarc-Pyrolyse)<br />
H3C CH3 H2C CH2 -2H<br />
• Wurtz-Kupplung<br />
Br<br />
Br<br />
Δ<br />
Na in THF, -80 C<br />
TPE<br />
77% Ausbeute<br />
TPE = Tetraphenylethylen<br />
2<br />
X<br />
2×<br />
a<br />
550 C<br />
b
Vortrag im Rahmen des OC-F Praktikums WS 2007/08 09.11.2007<br />
• Hoffmann-Eliminierung von p-Methylbenzylammoniumhydroxiden<br />
H 3C<br />
H 3C<br />
NH 2<br />
N[CH 3] + HO -<br />
• Synthese über Dithiaphan<br />
Br<br />
Br<br />
+<br />
a) Sulfonpyrolyse<br />
S S<br />
SH<br />
SH<br />
H 2O 2<br />
3 CH 3I<br />
-2 HI<br />
H 3C<br />
-H 2O<br />
-N(CH 3) 3<br />
Base,<br />
Ethanol, Benzol<br />
b) Ramberg-Bäcklund-Umlagerung<br />
O<br />
S S<br />
O<br />
mCPBA<br />
Cl<br />
O<br />
O<br />
mCPBA<br />
O<br />
O<br />
S S<br />
S S<br />
S S<br />
3<br />
N[CH 3] + I -<br />
H 2C CH 2<br />
S S<br />
O<br />
O<br />
350 C<br />
-2 SO 2<br />
AgO, H 2O<br />
SO<br />
O<br />
2Cl2 S S O O S S O<br />
O<br />
O<br />
O<br />
O<br />
Cl<br />
-2 SO 2<br />
Base<br />
Cl<br />
Cl<br />
O<br />
CH<br />
O<br />
S<br />
O<br />
HC<br />
S<br />
O<br />
Cl<br />
H 2/Raney-Ni<br />
Cl
Vortrag im Rahmen des OC-F Praktikums WS 2007/08 09.11.2007<br />
c) Thio-Stevens-Umlagerung<br />
S S<br />
Umlagerung<br />
AgO<br />
-2SMe 2<br />
S<br />
H 3C<br />
CH 3I<br />
H 3C<br />
S S<br />
CH 3<br />
S<br />
CH 3I<br />
H 2/Raney-Ni<br />
4<br />
CH 3<br />
H 3C<br />
S<br />
H 3C<br />
Base<br />
CH<br />
H3C S<br />
HC<br />
S<br />
CH<br />
3<br />
2.2 Molekülgeometrie und Eigenschaften<br />
Eine Besonderheit der [2.2]<strong>Cyclophane</strong> besteht darin, dass hier hochgespannte Systeme vorliegen<br />
Außerdem wechselwirken beide π-Systeme der Ringe miteinander, was sich stark auf die<br />
Reaktivität auswirkt. Als Beispiel soll hier [2.2]Paracyclophan vorgestellt werden.<br />
Kristallstrukturanalysen zeigen, dass die aromatischen Brückenkopfatome aus der Ebene der<br />
Ringe hinaus gebogen sind, so dass der Ring in eine Wannen-Konformation gezwungen wird, d.h.<br />
dass die Planarität des Systems aufgehoben wird.<br />
Während der Abstand der π-Systeme in Graphit noch 340 pm beträgt, beträgt er zwischen den<br />
„mittleren“ C-Atomen 309 pm und zwischen den Brückenkopfatomen nur noch 278 pm. Dies lässt<br />
darauf schließen, dass es zwischen den π-<br />
Systemen zu erheblichen transannularen<br />
Überlappungen kommt. Die p-Orbitale der<br />
Ringsysteme sind hier parallel zu C-C-<br />
Einfachbindungen der Brückenatome, so<br />
dass es zu π-σ-Wechselwirkungen kommt.<br />
So entsteht ein über das gesamte Molekül<br />
ausgedehntes π-System. Je länger die Ketten werden, desto geringer werden diese<br />
Wechselwirkungen, in [3.3]<strong>Cyclophane</strong>n sind sie noch schwach, in [4.4]<strong>Cyclophane</strong>n gar nicht<br />
mehr vorhanden. Das Molekül ist aber nicht vollkommen starr: die Benzolringe können entlang der<br />
Längsachse aufeinander zu und von einander weg schwingen (sog. Akkordeonschwingung). Auch<br />
die Ringe selbst können sich gegen einander verdrehen und eine Torsionsschwingung ausführen.<br />
Trotz der Verzerrung der Ringe bleibt die Aromatizität erhalten. NMR-Daten zeigen, dass die<br />
Benzol-Protonen auch im aromatischen Bereich zu finden sind. Vielfach zeigen <strong>Cyclophane</strong> auch<br />
eine aromatische Reaktivität.<br />
CH 3<br />
S<br />
CH 3
Vortrag im Rahmen des OC-F Praktikums WS 2007/08 09.11.2007<br />
2.3 Reaktivität im Ringsystem<br />
Bei einfach substituierten <strong>Cyclophane</strong>n kann beobachtet werden, dass die Zweitsubstitution fast<br />
ausschließlich in den unsubstituierten Ring erfolgt. Folgende Substitutionsmuster sind möglich:<br />
X<br />
pseudogeminal<br />
X<br />
Y<br />
pseudoorthol<br />
Y<br />
X<br />
Y<br />
pseudopara<br />
5<br />
X<br />
Y<br />
pseudometa<br />
X X<br />
Welches Produkt gebildet wird, hängt von der Natur des Substituenten ab. Nach Cram sind<br />
transannular dirigierende Effekte entscheidend. Durch ein Deuterierungs-Experiment konnte ein<br />
Mechanismus entwickelt werden.<br />
Br<br />
D<br />
H<br />
E<br />
Br<br />
E<br />
D<br />
H<br />
langsam<br />
Br<br />
σ-Komplex<br />
Im substituierten Ring sind die p- und o-Position basischer als die m-Position. Greift ein Elektrophil<br />
am gegenüberliegenden Ring an, entsteht oben gezeigter σ-Komplex. Nun findet ein<br />
Deuteriumaustausch mit dem ersten Ring statt was durch Mesomerie stabilisierte Grenzstrukturen<br />
führt. Durch Protonenabspaltung erhält man schließlich das neutrale disubstituierte Cyclophan.<br />
Ist der Substituent im ersten Ring selbst basisch (z.B. Ether-, Amino- oder Esterfunktionen)<br />
werden nach gleichem Mechanismus bevorzugt pseudo-geminale Produkte (pseudo-geminaler<br />
Effekt) gebildet.<br />
3. Highlights der Cyclophanchemie<br />
3.1 Maximal mögliche Verbrückungen – Das Superphan<br />
In einem Superphan ist die maximal mögliche Verbrückung erreicht. Am bekanntesten ist das [26]-<br />
Superphan. Zwar gibt es für viele dieser Verbindungen keine praktischen Anwendungen, sie liefern<br />
aber vor allem theoretisch wertvolle Erkenntnisse. Beim [26]-Superphan, handelt es sich um ein<br />
hochsymmetrisches Molekül der Punktgruppe D6h. Mit 262 pm unterschreitet der Abstand beider<br />
Ringsysteme den in [2.2]Paracyclophan. Aufgrund der hohen Symmetrie kann hier keine<br />
Verzerrung der Benzoleinheiten beobachtet werden.<br />
Die bekannteste Synthese stammt von Boekelheide, der auf den o-Xylol-Syntheseweg zurückgreift:<br />
E<br />
D<br />
H<br />
rasch<br />
-H<br />
Br<br />
E<br />
D<br />
Y<br />
para
Vortrag im Rahmen des OC-F Praktikums WS 2007/08 09.11.2007<br />
H 3C<br />
H 3C<br />
H 3C<br />
H 3C<br />
CH 2Cl<br />
CH 3<br />
a<br />
H 3C<br />
H 3C<br />
b<br />
1 2 3 4<br />
CH 2Cl CH 2Cl<br />
7<br />
f<br />
CH§<br />
CH§<br />
CH 3<br />
CH 3<br />
d, e<br />
g, h, i<br />
H 3C<br />
H 3C<br />
H 3C<br />
H 3C<br />
CHO CHO<br />
ClH 2C<br />
ClH 2 C<br />
8 9 10<br />
(a) 750 C, 10 -3 Torr (53%); (b) 400 C, N 2, 1 atm (63%); (c) Cl 2CHOCH 3, SnCl 4 (60% 6); (d) NaBH 4, CH 3OH (100%); (e) SOCl 2, Benzol (100%);<br />
(f) 700 C, 10 -2 Torr (40%); (g) Cl 2CHOCH 3, SnCl 4 (98%); (h) LiAlH 4, Ether (96%); (i) SOCl 2, Pyridin (93%): (j) 650 C, 10 -2 Torr (57%)<br />
Über den Thiaphanweg ist es auf Grund zu hoher Spannung nicht möglich, Superphane zu<br />
synthetisieren.<br />
3.2 Doppeldecker-Phane<br />
Sogenannte Doppeldecker-Phane sind Phane, die mehr als ein „Benzol-Deck“ enthalten. Sie sind<br />
von besonderem Interesse für die Erforschung transannularer Effekte. Bei diesem Typ der Phane<br />
wurde erstmals gefunden, dass die in der Mitte liegenden Benzolringe in eine Twist-Konformation<br />
verzerrt werden, wogegen die äußeren in der Wannen-Konformation verbleiben.<br />
Als Syntheseweg wählt man die Hofmann-Eliminierung quartärer Ammoniumhydroxide.<br />
1. NBS,<br />
2. NMe 3,<br />
3. OH -<br />
R<br />
R = CH 2-NMe 3 + OH -<br />
6<br />
6<br />
CH§<br />
CH§<br />
2x<br />
CH 3<br />
CH 3<br />
CH 2NMe 3<br />
OH<br />
j<br />
H 3C<br />
H 3C<br />
H 3C<br />
H 3C<br />
CHO<br />
5<br />
c<br />
CHO<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3
Vortrag im Rahmen des OC-F Praktikums WS 2007/08 09.11.2007<br />
3.3 Metallacyclophane<br />
<strong>Cyclophane</strong> können auch an Übergangsmetalle komplexiert werden.<br />
ML n<br />
π<br />
π<br />
ML n<br />
π<br />
π<br />
ML<br />
MLn n X<br />
Neben der Möglichkeit solche Sandwichkomplexe (D) über Metall-Ligand-Co-Kondensation<br />
dazustellen, was bspw. mit Chrom und [2.2]Paracyclophan in guten Ausbeuten funktinioniert,<br />
lassen sich einige Verbindungen auch stufenweise aufbauen wie an einem Rutheniocenophan<br />
demonstriert werden soll.<br />
Trifluoressigs ure<br />
2<br />
Ru<br />
RuCl 2(DMSO) 4<br />
O<br />
- 4 DMSO<br />
- 2 Cl -<br />
LiAlH4, AlCl3/Et2O<br />
Ru<br />
Ru<br />
7<br />
M'<br />
π<br />
π<br />
1. N-Methylformamid, POCl 3<br />
2. Malons ure, Piperidine<br />
3. H 2/PtO 2/EtOH<br />
Eine besonders interessante Synthese ist zum Abschluss in folgender Abbildung dargestellt, bei<br />
der sich das Metallion quasi selbst in den Cyclophankäfig einschließt.<br />
t-Bu<br />
4. Literatur<br />
n<br />
Co<br />
OC CO<br />
n<br />
t-Bu<br />
Dekalin, 190 C<br />
(1) F. Vögtle, Cyclophan Chemie, B.G. Teubner Stuttgart, 1990.<br />
(2) R. Gleiter, H. Hopf, Modern <strong>Cyclophane</strong> Chemistry, Wiley-VCH Verlag, 2004.<br />
(3) H. Hopf, Classics in Hydrocarbon Chemistry, Wiley-VCH Verlag, 2000.<br />
(4) H. Hopf, Angew. Chem., 1972, 84, 471-476.<br />
(5) F. Vögtle, Angew. Chem., 1969, 81, 258-262.<br />
(6) R. H. Mitchell, J. Am. Chem. Soc., 1974, 96, 1558-1559.<br />
(7) D. J. Cram, J. M Cram, Acc. Chem. Res., 1971, 4, 204-213.<br />
(8) D. J. Cram, H. Steinberg, J. Am. Chem. Soc., 1948, 73, 5691-5704.<br />
t-Bu<br />
n<br />
Co<br />
O<br />
Ru<br />
π<br />
M<br />
π<br />
HOOC<br />
n<br />
t-Bu