Oxidationen und Ozonolyse
Oxidationen und Ozonolyse
Oxidationen und Ozonolyse
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Oxidationen</strong> <strong>und</strong> <strong>Ozonolyse</strong><br />
von Ella Kriemen <strong>und</strong> Martin Pawliczek<br />
Oxidationsmittel <strong>und</strong> ihre Chemoselektivität<br />
Chrom(VI)-Verbindungen<br />
wasserhaltige Verbindungen<br />
K2Cr2O7, verd. H2SO4<br />
CrO3, verd. H2SO4, Aceton<br />
Oxidieren:<br />
� Prim. Alkohole � Aldehyd �Carbonsäuren<br />
� Sek. Alkohole � Ketonen<br />
Die Weiteroxidation vom Aldehyd erfolgt aufgr<strong>und</strong> der Bildung eines Aldehydhydrats, welches<br />
wiederum vom Chrom(VI) oxidiert werden kann.<br />
wasserfreie Verbindungen<br />
Collins Reagenz<br />
PCC (Pyridiniumchlorochromat)<br />
PDC (Pyridiniumdichromat)<br />
Oxidieren:<br />
� Prim. Alkohole � Aldehyden<br />
� Sek. Alkohole � Ketonen<br />
Chrom(VI)-Verbindungen sind sehr giftig<br />
Swern-Oxidation<br />
Oxidiert:<br />
� Prim. Alkohole � Aldehyden<br />
� Sek. Alkohole � Ketonen<br />
Reagenzien: DMSO, Oxalylchlorid, Triethylamin<br />
Verläuft über aktiviertes DMSO<br />
O<br />
S<br />
Cl<br />
O<br />
O<br />
Cl<br />
Cl<br />
1<br />
O<br />
Cl<br />
S O<br />
O<br />
"aktiviertes DMSO"<br />
"aktiviertes DMSO"<br />
S<br />
Cl<br />
CO 2 CO Cl<br />
Es handelt sich hierbei um eine milde Reaktion, die zwischen -78 °C <strong>und</strong> 20 °C ausgeführt wird,<br />
wodurch auch empfindliche Verbindungen oxidiert werden. Handelt es sich jedoch um basenlabile<br />
Verbindungen, so besitzt die Swearn-Oxidation den Nachteil der Racemisierung aufgr<strong>und</strong> der Enol-<br />
Bildung.<br />
OBn<br />
OH<br />
O<br />
R 2 H<br />
H 2O<br />
1) DMSO, (COCl) 2, -60°C<br />
2) Et3N OH<br />
R 2 H<br />
OH<br />
OBn<br />
O<br />
OBn<br />
O
Dess-Martin-Oxidation <strong>und</strong> IBX als Alternative<br />
Die Dess-Martin-Oxidation nutzt das Dess-Martin-Periodinan (DMP) als Reagenz<br />
� Fast neutrale Arbeitsbedingungen (etwas sauer, da AcOH entsteht)<br />
� Keine Oxidation von Sulfiden, Enolethern, Epoxiden, Furanen <strong>und</strong> sek. Aminen<br />
� Benzylische Alkohole werden gegenüber aliphatischen selektiv oxidiert<br />
IBX (2-Iodoxybenzoesäure) ist eine kostengünstige Alternative<br />
� IBX ist eine Zwischenstufe bei der DMP-Synthese ist.<br />
� Viele Modifikationen möglich, wodurch sich die Chemoselektivität ändert.<br />
� Etherspaltung<br />
� Alkohole zu Carbonsäuren oxidieren.<br />
� Diole zu Lactonen (falls möglich)<br />
� Cyclisierungen<br />
TPAP-Oxidation<br />
Oxidiert:<br />
� Prim. Alkohole � Aldehyden<br />
� Sek. Alkohole � Ketonen<br />
Reagenz:Tetrapropylammoniumperruthenate<br />
� Sehr teuer, daher nur katalytisch<br />
� Cooxidans z.B. N-Methylmorpholin-N-oxid<br />
� Benötigt Molekularsieb zum Binden von Wasser<br />
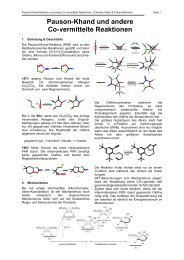
Baeyer-Villiger-Oxidation / [1,2]-Umlagerung<br />
Oxidiert:<br />
� Ketone � Ester<br />
� Cyclische Ketone � Lactonen<br />
O<br />
O<br />
� Reagenz: Persäuren z.B mCPBA (meta-Chlorperbezoesäure)<br />
� Reaktionsgeschwindigkeit abhängig von:<br />
� � Lewis-Säuren, Abgangsgruppe, Wandernde Gruppe<br />
Epoxidierung von π -Bindungen mit Dioxiran<br />
� Mit Persäuren nicht immer möglich z.B wegen Bayer-Villiger-Oxidation<br />
� Reaktion im Neutralen möglich<br />
� Enantioselektivität durch optisch aktive Mangan(III)-Salze möglich<br />
� Aceton ist einziges Abfallprodukt<br />
O<br />
O O<br />
I<br />
OH<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
2<br />
O O<br />
O O<br />
Pr4N Ru<br />
O O<br />
O<br />
O<br />
O<br />
AcO<br />
O N O<br />
O<br />
AcO<br />
I<br />
O<br />
O<br />
OAc<br />
O
MeO<br />
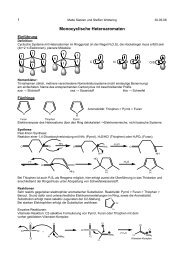
<strong>Ozonolyse</strong><br />
Mechanismus<br />
O<br />
C C<br />
O<br />
OH<br />
O<br />
O<br />
C R 2<br />
R 1<br />
O<br />
C C<br />
O<br />
O<br />
Hydroperoxid-/<br />
Carbonylverbindungs-<br />
Gemisch<br />
R 3<br />
O<br />
C<br />
R 4<br />
MeOH<br />
O<br />
O<br />
R 2<br />
R 4<br />
3<br />
C<br />
O<br />
Olefin<br />
O 3<br />
R 1<br />
O<br />
O<br />
R 3<br />
O<br />
C<br />
O<br />
in CH 2Cl 2<br />
Tetroxan-/<br />
Keton-Gemisch<br />
R 3<br />
O<br />
C<br />
R 4<br />
O<br />
C<br />
O<br />
C<br />
O<br />
Sek<strong>und</strong>ärozonid-<br />
Gemisch<br />
O<br />
C C<br />
O O<br />
(Sek<strong>und</strong>är)Ozonid<br />
Primärozonid<br />
Aceton Carbonyloxid<br />
-H2O2 H2O • 1,3-dipolare Cycloaddition des Ozons an die Doppelbindung<br />
• Primärozonid (1,2,3-Trioxalan) zerfällt durch eine 1,3-dipolare Cycloreversion in eine O<br />
Carbonylverbindung <strong>und</strong> Carbonyloxid (Criegee-Intermediat)<br />
2<br />
• 1,3-dipolare Cycloaddition<br />
• Sek<strong>und</strong>är-Ozonid � stabiler als Primärozonid<br />
Primärprodukte<br />
Aufarbeitung<br />
• Mit NaBH4 oder LiAlH4: O-O-haltige <strong>und</strong> C=O-haltige Primärprodukte werden zu Alkoholen<br />
reduziert<br />
• Mit Me2S, Ph3P oder Zn/HOAc: reduziert nur O-O-haltige Primärprodukte zu<br />
Carbonylverbindungen<br />
• Mit H2O2: Oxidation zu Carbonsäuren<br />
Beispiele<br />
Alken<br />
Aromat<br />
H 2C<br />
H 3C<br />
CH<br />
O<br />
CH 3<br />
CH 3<br />
1. O 3<br />
2.(CH 3) 2S<br />
1.O 3<br />
2.Me 2S<br />
H 3C<br />
O<br />
O<br />
H H<br />
CH 3<br />
H 3C<br />
H<br />
H 3C<br />
O<br />
O<br />
O<br />
1 : 2 :<br />
3<br />
O<br />
O<br />
H<br />
H<br />
O<br />
O<br />
H
Dihydroxylierung von Alkenen<br />
• Darstellung von cis-Diolen mit KMnO4, OsO4 oder RuO4<br />
• OsO4 ist teuer, sehr giftig <strong>und</strong> flüchtig (Kp = 130 °C)<br />
� nur noch katalytisch <strong>und</strong> Einsatze von anderen Oxidationsmitteln<br />
• KMnO4 neigt zur Überoxidation<br />
• Bei RuO4 bzw. RuCl3 sind eingesetzte Verbindungen nicht giftig, billig <strong>und</strong> leicht zu<br />
handhaben. RuO4 ist sehr reaktiv ist � nur kleine Mengen für die Reaktion benötigt<br />
Me<br />
O N<br />
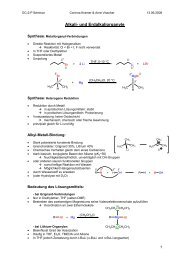
Glykolspaltung mit Iodat<br />
O<br />
• 1,2-Diole lassen sich mit NaIO4 zu Carbonylverbindungen spalten<br />
• intermediär bildet sich ein Diester der Iod(VII)säure, welcher einstufig zerfällt<br />
• Iod(VII) wird zu Iod(V) reduziert<br />
R<br />
NaIO 4,<br />
H 2O, MeOH<br />
Lemieux-Johnson-Oxidation<br />
• OsO4 wird als Cooxidans eingesetzt. Es führt zu einer<br />
Dihydroxylierung der Doppelbindung.<br />
• NaIO4 bewirkt eine Rückoxidation des Os(VI) zum Os(VIII)<br />
<strong>und</strong> spaltet die Glykole zu den Aldehyden bzw. Ketonen<br />
Lemieux-von-Rudloff-Oxidation<br />
• aus RuO2 oder RuCl3 gebildetes RuO4 bewirkt Dihydroxylierung<br />
• Periodat spaltet dann die Glykole zu den<br />
Carbonylverbindungen<br />
Spaltung von Aromaten<br />
• α-Ketoaldehyd reagiert im wässrigen Milieu zu Aldehydhydrat<br />
• Dieses wird von RuO4 zu α–Ketosäure oxidiert<br />
1<br />
O O<br />
Os<br />
O O<br />
+VIII<br />
OH<br />
OH<br />
R<br />
RuCl3 3H2O NaIO4 oder NaOCl<br />
Acetonitril/CCl4/H2O O O<br />
H<br />
O<br />
O<br />
H<br />
Os<br />
O<br />
+VI<br />
O<br />
O<br />
O<br />
2 H 2O<br />
I<br />
O<br />
+VII<br />
O<br />
O<br />
H 2O<br />
4<br />
Osmiumsäure<br />
O +VI O<br />
Os<br />
HO OH<br />
HO<br />
R<br />
HO O<br />
+VIII<br />
RuO4 O<br />
NaIO 4<br />
OsO 4<br />
+VI<br />
-RuO3 HO O<br />
R<br />
O<br />
OH<br />
NaIO 4<br />
RuO 2 2H 2O oder<br />
RuCl 3 H 2O<br />
• Ruthenium(VIII)säurediester entsteht: fragmentiert zu Aldehyd, Kohlendioxid <strong>und</strong> RuO3<br />
1<br />
Quellen: R. Brückner, Reaktionsmechanismen, Organische Reaktionen, Stereochemie, moderne Synthesemethoden,<br />
3. Aufl., Spektrum Verlag, Heidelberg, 2004<br />
K. P. C. Vollhardt, Organische Chemie, 3. Auflage Wiley-VCH, Weinheim, 2005<br />
A. Leitzke, Mechanistische <strong>und</strong> kinetische Untersuchungen zur <strong>Ozonolyse</strong> von organischen Verbindungen in<br />
wässriger Lösung, Bergisch-Gladbach, 2003<br />
http://www.chemgapedia.de<br />
O<br />
O<br />
OH<br />
OH<br />
O<br />
I<br />
O<br />
+V<br />
O<br />
O +VIII O<br />
Os<br />
O O<br />
O<br />
R<br />
+VI<br />
Ru<br />
O<br />
O N Me<br />
?<br />
O<br />
O<br />
C<br />
O<br />
O<br />
O<br />
O<br />
O<br />
R<br />
OH<br />
O<br />
O<br />
+VIII<br />
Ru<br />
O<br />
O<br />
O<br />
O<br />
OH