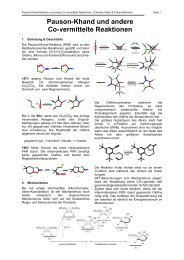
Palladium-katalysierte Alken- und Alkin-Kupplungen
Palladium-katalysierte Alken- und Alkin-Kupplungen
Palladium-katalysierte Alken- und Alkin-Kupplungen
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Vortrag im Rahmen des Seminars zum Organisch-chemischen Fortgeschrittenen-Praktikum<br />
2007/08,Von Edna Ofosua-Nyarko<br />
18.01.2007<br />
<strong>Palladium</strong>-<strong>katalysierte</strong> <strong>Alken</strong>- <strong>und</strong> <strong>Alkin</strong>-<strong>Kupplungen</strong><br />
Inhaltsverzeichnis<br />
1. Einleitung<br />
2. <strong>Palladium</strong>-Katalysatoren<br />
3. Heck-Reaktion<br />
4. Kreuzkupplungen mit <strong>Palladium</strong><br />
5. Ausblick<br />
6. Literatur<br />
1. Einleitung<br />
1.1 Geschichtliches<br />
• Bis 1960 waren ausschließlich <strong>Kupplungen</strong> mit Mg- <strong>und</strong> Li-Organylen bekannt (allerdings nur bei<br />
sterisch ungehinderten Alkylhalogeniden).<br />
• In den 1960ern Entdeckung von Organokupferreagenzien (Csp2-X, Csp-X Bindungen können<br />
seitdem geknüpft werden).<br />
• Seit 1972 Nickelphosphin-Komplex <strong>katalysierte</strong> Reaktionen (Grignardverbindungen mit <strong>Alken</strong>yl-<br />
/Arylhalogeniden).<br />
• Späte 1970er stöchiometrische Bildung von C-C-Bindungen (über reduktive Eliminierung von<br />
Diorganopalladiumphosphin-Komplexen).<br />
• 1976 Entdeckung der <strong>Palladium</strong>-<strong>katalysierte</strong>n Kreuzkupplung mit Grignard- <strong>und</strong><br />
Organolithiumreagenzien (bei Fauvarque/Jutand <strong>und</strong> Sekiya/Ichikawa).<br />
1.2 Eigenschaften des <strong>Palladium</strong>s<br />
• <strong>Palladium</strong> ist das leichteste Metall der Platin-Gruppe <strong>und</strong> besitzt eine mittlere Größe: Zwischen<br />
der von Ni <strong>und</strong> Pt. Dies führt dazu das die <strong>Palladium</strong>verbindungen beständiger sind als die des<br />
Nickels, aber reaktiver als die entsprechenden Platinverbindungen. Außerdem stehen genügend<br />
Koordinationsstellen für katalytische Zwecke zur Verfügung.<br />
• <strong>Palladium</strong> besitzt nach der Paulingskala eine Elektonegativität von 2,2 die dem des Kohlenstoff<br />
(2,5) sehr ähnlich ist. Aus diesem Gr<strong>und</strong> sind die Pd-C-Bindungen realativ unpolar <strong>und</strong> weisen nur<br />
eine geringe Reaktivität gegenüber polaren Gruppen wie Ketonen, Estern usw auf.<br />
• <strong>Palladium</strong> bevorzugt die Oxidationsstufen von 0 <strong>und</strong> +II (selten +IV). Es besitzt außerdem eine<br />
geringe Tendenz, Einelektronen-Reaktionen einzugehen <strong>und</strong> ist dadurch sehr gut geeignet für<br />
Reaktionen bei denen radikalische Zwischenstufen oder radikalische Nebenreaktionen den<br />
Reaktionsablauf stören. Bei den Reaktionen mit <strong>Palladium</strong> werden gleichzeitig zwei Elektronen<br />
übertragen <strong>und</strong> das <strong>Palladium</strong> wird von 0 zu +II oxidiert bzw. von +II zu 0 reduziert.<br />
1 1
1.3 Was sind Kreuzkupplungen?<br />
Eine Kreuzkupplung ist eine Übergangsmetall-<strong>katalysierte</strong> (i.A. Pd, Pt, Ni) C-C-<br />
Bindungsknüpfungreaktion. Dabei reagieren metallorganische Reagenzien als Nukleophile mit<br />
organischen Verbindungen die Abgangsgruppen wie Triflate, Halogene oder ähnliches besitzen. In der<br />
Regel läuft der Mechanismus unter oxidativer Addition des Organyls an den Katalysator <strong>und</strong><br />
anschließender Transmetallierung der organometallischen Verbindung. Das Kupplungsprodukt wird<br />
durch reduktive Eliminierung freigesetzt. Da die eingesetzten metallorganischen Verbindungen relativ<br />
einfach mittels Metallierung oder Halogen-Metall-Austausch darstellbar sind <strong>und</strong> eine vielfältige<br />
Reaktivität aufweisen, eröffnet sich eine Fülle an Möglichkeiten für die Kreuzkupplung, die im weiteren<br />
Verlauf vorgestellt werden.<br />
2 <strong>Palladium</strong> Katalysatoren<br />
Im Allgemeinen wird ein Präkatalysator zu der Reaktionsmischung gegeben <strong>und</strong> es erfolgt eine in situ<br />
–Umwandlung zum initiierenden Pd(0)- bzw. Pd(II)-Komplex mit Stickstoff-, Phosphor- oder Arsen-<br />
Liganden. In der Regel werden <strong>Palladium</strong>salze (z.B. Pd(OAc)2 <strong>und</strong> PdCl2) als Präkatalysatoren<br />
benutzt. Die bekanntesten <strong>Palladium</strong> Komplexe sind das Tris(dibenzyllidenaceton)-dipalladium(0) <strong>und</strong><br />
das Tetrakis(triphenylphosphin)-<strong>Palladium</strong> (0). Häufig wird auch der Chloroform-Komplex<br />
Pd2(dba)3.CHCl3 verwendet. Diese PdL4-Komplexe sind elektronisch abgesättigt (besitzen 18e - ) <strong>und</strong><br />
daher nicht reaktiv. Sie werden unter reduktiven Bedingungen zur reaktiven Stufe umgesetzt, z.B.<br />
durch Reaktion mit Diethylamin oder mit Phosphinen.<br />
Der Vorteil dieser Katalysatoren ist das sie relativ gut lagerbar <strong>und</strong> stabil sind. Außerdem besitzen sie<br />
eine hohe Toleranz gegenüber vielen funktionellen Gruppen.<br />
3. Heck-Reaktion<br />
Erstmals durchgeführt, 1968 von R.F. Heck.<br />
Obwohl bei der Heck-Reation C-C-Bindungen geknüpft werden ist sie keine Kreuzkupplung. Im<br />
Gegensatz zu den anderen Reaktionen enthalten die eingesetzten Nukleophile kein Metall. Es werden<br />
C-C-Bindungen zwischen, Halogen-alkenen, -aromaten oder -heteroaromaten <strong>und</strong> endständigen<br />
<strong>Alken</strong>en unter Erhalt der Doppelbindung geknüpft. Die Heck-Reaktion gehört zu den am besten<br />
untersuchten Organometall-Reaktionen.<br />
Vorteile: 1. Hohe selektivität 2.Funktionelle Carboxy-, Amino-, Cyano- <strong>und</strong> Estergruppen werden<br />
toleriert.<br />
R' X + H2C R''<br />
(Mit -X= -Br, -I, -OSO2CF3, (-Cl))<br />
Pd°L 2<br />
Base R'<br />
R'' + HX-Base<br />
2 2
Mechanismus :<br />
Schritt 1: komplexierung der R‘-X Spezies an den Pd-Katalysator.<br />
Schritt 2: oxidative Addition des Halogenids an den PdL2-Komplex.<br />
Schritt 3: Austausch eines Liganden L gegen das <strong>Alken</strong>.<br />
Schritt 4: Koodinierung des <strong>Alken</strong>s an die R‘PdLX Spezies zum π-Komplex. Anschließende<br />
Übertragung des Substituenten R‘ an das endständige Kohlenstoffatom des <strong>Alken</strong>s<br />
führt zur Ausbildung eines Pd-σ-Zwischenproduktes.<br />
Schritt 5: β-Hydrid-Eliminierung → einer der vorher endständigen an das <strong>Alken</strong> geb<strong>und</strong>enen<br />
Wasserstoffatome wird auf das <strong>Palladium</strong> übertragen. Gleichzeitig wird das Produkt mit der neu<br />
gebildeten Doppelbindung abgespalten.<br />
Schritt 6: Regenerierung des Pd 0 - Katalysators durch reduktive Eliminierung von HX mit einer Base<br />
(z.B. NEt3).<br />
Da sowohl die oxidative Addition als auch die abschließende β-H-Eliminierung cis erfolgen, muss es<br />
zwischenzeitlich eine Rotation um die C-C-Einfachbindung geben damit das H auf der Seite des<br />
<strong>Palladium</strong>s steht. Nur so wird die β-H-Eliminierung überhaupt möglich. Es wird selektiv das trans-<br />
Produkt <strong>und</strong> nicht das cis-Produkt gebildet.<br />
L<br />
X<br />
Pd R'<br />
H<br />
H<br />
R" H<br />
L<br />
X Pd" R'<br />
H<br />
X<br />
Pd H<br />
H<br />
R'<br />
R" H<br />
Die Konstitution des Produkts der Heck-Reaktion ist außerdem abhängig von den Substituenten an<br />
der Doppelbindung des eingesetzten Olefins. Akzeptor (EWG) oder Donor-substituenten (D) ergeben<br />
unterschiedliche Isomere (cis, trans, vic, gem). Olefine mit EWG-Gruppen ergeben eher das trans-<br />
Produkt während Olefine mit D-Substituenten eher Olefine mit terminaler Doppelbindung ergeben.<br />
Als <strong>Alken</strong>e können auch Ringolefine eingesetzt werden. Allerdings wird bei dieser Reaktion das H an<br />
der anderen β-Position zu Pd eliminiert da die erforderliche 180°-Drehung für die oben gezeigte cis-<br />
selektive β-H-Eliminierung nicht möglich ist.<br />
H<br />
R" H<br />
π −<br />
Komplex<br />
L<br />
L<br />
X<br />
Pd R'<br />
H<br />
H<br />
R" H<br />
σ −<br />
L<br />
X Pd<br />
H<br />
Komplex<br />
H<br />
R'<br />
R" H<br />
π − Komplex<br />
3 3
4 Kreuzkupplungen mit <strong>Palladium</strong><br />
4.1 Die wichtigsten Kreuzkupplungen mit <strong>Palladium</strong><br />
Es gibt eine Vielzahl von verschiedenen <strong>Palladium</strong>-<strong>katalysierte</strong>n Kreuzkupplungen. Die wichtigsten<br />
bekannten Namensreaktionen <strong>und</strong> die dabei eingesetzen Edukte sind im folgenden abgebildet.<br />
Suzuki-Miyaura-Kupplung<br />
HO<br />
R<br />
Stille-Kupplung<br />
B OH<br />
Bu<br />
R<br />
Sn<br />
Bu<br />
Bu<br />
4.1.1 Allgemeiner Mechanismus<br />
RNu<br />
Reduktive Elimierung<br />
Sonogashira-Reaktion<br />
Negishi-Kreuzkupplung<br />
Zn X<br />
R<br />
Der oben dargestellte allgemeine Mechanismus verläuft über vier Hauptschritte.<br />
(a) oxidative Addition: Pd(0) wird zu Pd(II) oxidiert.<br />
(b) Transmetallierug: das Nukleophil wird auf das Pd übertragen.<br />
(c) cis-trans Isomerisierung<br />
(d) reduktive Eliminierung: das Produkt wird freigesetzt.<br />
R<br />
CH CuX<br />
Kumada-Tamao-Kupplung<br />
R<br />
Pd° oder Pd"<br />
Pd°L 2<br />
L<br />
R Pd L<br />
Nu<br />
Mg X<br />
Oxidative<br />
Addition<br />
RX<br />
cis-trans-Isomerisierung<br />
Buchwald-Hartwig-Reaktion<br />
L<br />
H<br />
R<br />
N R<br />
R Pd X<br />
L<br />
L<br />
Nu<br />
Transmetallierung<br />
R Pd Nu<br />
L<br />
X<br />
Hiyama-Kupplung<br />
4 4<br />
Me<br />
R<br />
Si<br />
Me<br />
Me
4.1.2 Stille-Kupplung<br />
Bei der Stille Kupplung werden C-C-Bindungen zwischen Stannanen (Organozinnverbindungen) <strong>und</strong><br />
einem sp 2 -hybridisierten organischen Halogenid oder einem Pseudohalogenid (z. B. -OTf) gebildet.<br />
Vorteile: Es wird keine Base benötigt.<br />
Nachteile: Sn ist toxisch.<br />
R'X + R"SnBu 3<br />
Pd(PPh 3 ) 4<br />
R' R" + XSnBu 3<br />
Der Mechanismus ist der einer typischen Kreuzkupplung <strong>und</strong> durchläuft die vier im allgemeinen<br />
Mechanismus angegebenen Schritte. Der Unterschied besteht darin dass, wenn als elektrophile<br />
Triflatverbindungen eingesetzt werden, der Zusatz von LiCl notwendig ist um gute Ausbeuten zu<br />
erzielen.<br />
Nach der oxidativen Addition reagiert der <strong>Palladium</strong>-Triflat-Komplex mit dem LiCl. Dabei wird ein Triflat<br />
gegen einen Chlorliganden ausgetauscht. Der Chlor-Komplex ist in der Lage schneller weiter zu<br />
reagieren als der Triflat-Komplex.<br />
Bei der Stille Kupplung ist zu beachten, dass die eingesetzten Elektrophile keine β-ständigen<br />
Wasserstoffatome besitzen, um zu verhindern das eine β-H Eliminierung stattfindet <strong>und</strong> die Reaktion<br />
unterbrochen wird.<br />
Da Sauerstoff sowohl den <strong>Palladium</strong>-Katalysator oxidiert als auch eine Organozinn-Organozinn<br />
Kupplung begünstigt, muss die Reaktion unter Schutzgas ablaufen.<br />
Die Stille-Kupplung kann eingesetz werden, um selektiv cis oder trans Allylalkohole darzustellen, da<br />
die Konfiguration des eingesetzten Alkohols erhalten bleibt.<br />
OSO 2 CF 3<br />
PdCl2 (PPh3 ) 2<br />
3 Äquiv.LiCl, DMF, 60°C<br />
SnBu 3<br />
SnBu 3<br />
OH<br />
OH<br />
cis-Cinnam ylalkohol<br />
trans-Cinnam ylalkohol<br />
OH<br />
OH<br />
5 5
4.1.3 Sonogashira Kupplung<br />
Das erste Mal wurde diese Reaktion von Kenkichi Sonogashira <strong>und</strong> Nobue Hagihara 1975 erwähnt.<br />
Bei dieser Kupplung handelt es sich um eine C-C-Knüpfung zwischen einem Halogenaromaten <strong>und</strong><br />
einem endstandigen <strong>Alkin</strong>.<br />
X<br />
+ HC R<br />
Pd(PPh 3 ) 2 Cl 2<br />
CuI,NR 3<br />
Die Reaktion verläuft unter <strong>Palladium</strong>-Kupfer-Katalyse im basischen Milieu. Es werden in der Regel<br />
Amine wie Triethylamin oder Diisopropylamin als Lösungsmittel verwendet. Der Mechanismus ist<br />
ähnlich der einer typischen Kreuzkupplung. Als erstes findet die oxidative Addition des<br />
Halogenaromaten an <strong>Palladium</strong> statt. Darauf folgt die Koordinierung des <strong>Alkin</strong>s an den <strong>Palladium</strong>-<br />
Komplex. Das <strong>Alkin</strong> wird nicht als Organometallverbindung eingesetzt, sondern in situ durch Reaktion<br />
mit dem Kupfersalz erzeugt. Die so erhaltene Organokupferverbindung reagiert daraufhin im<br />
Transmetallierungs Schritt weiter.<br />
R<br />
L<br />
Pd X<br />
C<br />
R'<br />
R" 3NH +<br />
L<br />
R Pd X<br />
L<br />
Transmetallierung<br />
Cu R'<br />
Bei der Transmetallierung findet der <strong>Palladium</strong>-Kupfer-Austausch statt. Als nächster Schritt erfolgt die<br />
trans-cis-Isomerisierung <strong>und</strong> zum Schluss wird das Produkt durch reduktive Eliminierung erhalten.<br />
Die Sonogashira Kupplung wird unter Schutzgas-Atmosphäre durchgeführt, nicht nur wegen der<br />
Unbeständigkeit der <strong>Palladium</strong>komplexe gegenüber Luft, sondern auch um die Sauerstoff unterstützte<br />
Dimerisierung des <strong>Alkin</strong>s zu verhindern (Eglinton-/Glaser-Kupplung).<br />
R<br />
H<br />
CH<br />
CuI, O 2<br />
R'<br />
CuX<br />
R"<br />
N +<br />
R"<br />
R"<br />
CH3 + C R'<br />
R R<br />
NR" 3 HX<br />
R<br />
6 6
4.1.4 Negishi-Kupplung<br />
Die Negishi-Kupplung wurde 1977 von ihrem Namensgeber Ei-ichi Negishi entdeckt.<br />
Hier werden Alkyl-, <strong>Alken</strong>yl-, <strong>Alkin</strong>yl- <strong>und</strong> Arylzinkhalogenide alkenyliert oder aryliert (von Triflaten<br />
romiden <strong>und</strong> Iodiden). Die C-C-Bindungs-knüpfung läuft unter <strong>Palladium</strong>- oder Nickel-Katalyse ab.<br />
RX + R'ZnX<br />
Die zur Kupplung benötigten Organozink-Verbindungen sind durch Umsatz von Lithiumorganylen mit<br />
Zinkchlorid erhältlich. Außer den Zinkorganylen können auch Verbindungen mit Metallen mittlerer<br />
Elektronegativität benutzt werden (z.B. Al oder Zr). Die Negishi-Kupplung ermöglicht die Darstellung<br />
von unsymmetrischen Biarylen in guten Ausbeuten .<br />
Die <strong>Alken</strong>ylierung <strong>und</strong> die Arylierung verlaufen nach demselben Mechanismus wie die der Stille-<br />
Kupplung. Der Mechanismus nach dem die <strong>Alkin</strong>-Kupplung verläuft, ist noch nicht geklärt da die<br />
vollständige Aufklärung eine Isolation des <strong>Palladium</strong>-Komplexes notwendig macht, was noch nicht<br />
geglückt ist. Auf gr<strong>und</strong> dessen gibt es 2 verschiedene Vorschläge: der allgemeine Mechanismus <strong>und</strong><br />
der nach Negishi. Bei Negishi findet statt der Transmetallierung eine 1,2- Addition an der<br />
Organometall-Verbindung statt. Darauf folgt eine reduktive β-Eliminierung zum Endprodukt.<br />
Negishis Vorschlag:<br />
X<br />
R'<br />
L 2 Pd"<br />
4.1.5 Suzuki Kupplung<br />
Im Jahre 1979 wurde die Suzuki-Kupplung erstmalig von Akira Suzuki publiziert.<br />
Diese Reaktion ist eine Pd-<strong>katalysierte</strong> alkenylierung von Bororganylen mit <strong>Alken</strong>yltriflaten, -bromiden<br />
oder -iodiden. Als Bororganyle können Akenyl- oder Aryl- boronsäureester <strong>und</strong> –boronsäuren, sowie<br />
9BBN-Derivate mit primärem Alkylrest eingesetzt werden<br />
RX +<br />
(OH) 2 B-R'<br />
oder<br />
R<br />
reduktive<br />
ß-Eliminierung<br />
R' M<br />
9-BBN-R'<br />
Pd(PPh 3 ) 2 Cl 2<br />
R<br />
2(iBu)AlH<br />
R'<br />
PdL 2<br />
Base<br />
Pd°L 2<br />
Carbometallierung<br />
M<br />
R R'<br />
R R'<br />
RX<br />
oxidative<br />
Addition<br />
R Pd X<br />
Ein Vorteil dieser Reaktion ist das Borverbindungen weniger giftig sind als z.B. die Stannane der<br />
Stille-Kupplung.<br />
L<br />
L<br />
7 7
Die Suzuki-Kupplung wird zur Darstellung von cis-Halogenolefinen aus <strong>Alkin</strong>en eingestzt.. Boran <strong>und</strong><br />
seine Mono- <strong>und</strong> Dialkylderivate reagieren nach der Addition an C≡C-Dreifachbindungen zu<br />
<strong>Alken</strong>ylboranen, die erneut mit den eingesetzten Boranen reagieren. Die Folge ist, das <strong>Alken</strong>yl Borane<br />
über diesen Reaktionsweg nicht erhältlich sind. Es gibt aber ein Boran (Catecholboran) das sich in<br />
Gegenwart von Übergangsmetall-Katalysatoren an C≡C-Dreifachbindungen addiert, ohne das die<br />
erhaltene <strong>Alken</strong>ylboronsäureester weiter reagiert. Diese kann mit Brom über einen so gennanten at-<br />
Komplex, zu einem cis-konfiguriertem Bromolefin <strong>und</strong> Borsäureethylester umgesetzt werden.<br />
Außerdem kann die <strong>Alken</strong>ylboronsäureester zur ensprechenden Boronsäure Hydrolisiert werden.<br />
R<br />
5. Ausblick<br />
Durch Optimierung der Liganden <strong>und</strong> erhöhung der Katalysatoreffizienz wird heute versucht, die Pd<strong>katalysierte</strong>n<br />
Kreuzkupplungen zu verbessern. Zum Beispiel wurden, um die oxidative Kupplung von<br />
Alkylhalogeniden zu erleichtern NHC(N-heterocyclische Carbene) Liganden entwickelt, die durch<br />
Erhöhung der Elektronendichte am <strong>Palladium</strong> dieses aktivieren <strong>und</strong> so die Umsetzung von sogar<br />
reaktionsträgen Verbindungen wie Arylchloriden ermöglichen. Ein Beispiel eines Pd-Komplexes mit<br />
NHC–Liganden ist hier dargestellt:<br />
N<br />
CH<br />
Cl<br />
C<br />
H 3<br />
+<br />
6. Literatur<br />
N N CH3<br />
N<br />
H<br />
B<br />
Pd<br />
N<br />
O<br />
O<br />
Catecholboran<br />
N<br />
CH 3<br />
N<br />
R<br />
B<br />
O<br />
O<br />
Br 2, CHCl 2<br />
[1] R Brückner, Reaktionsmechanismen, Spektrum Akademischer Verlag, Heidelberg, 2003.<br />
[2] A. F. Hollemann, E. Wiberg, Lehrbuch der Anorganischen Chemie, 101. Auflage, de Gruyter,<br />
1995.<br />
[3] C.Elschenbroich, Organometallchemie, 4. Auflage, Teubner Verlag, 2003.<br />
[4] M.Louie, J. F. Hartwig, J. Am. Chem. Soc., 1995, 117, 11598.<br />
[5] J. K. Stille, Angew. Chem. Int. Ed. Engl. 1986, 25, 508–524.<br />
[6] R. F. Heck, J. P. Nolley, Jr., J. Org. Chem. 1972, 37, 2320-2322.<br />
[7] L. S. Hegedus, Transition Metals in the Synthesis of Complex Organic Molecules, University<br />
Science Books, 1999.<br />
-78<br />
NaOMe, MeOH<br />
-Br R Br<br />
8 8<br />
+<br />
MeO<br />
B<br />
O<br />
O