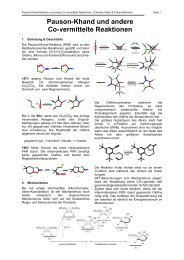
Monocyclische Heteroaromaten
Monocyclische Heteroaromaten
Monocyclische Heteroaromaten
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
1 Malte Sietzen und Steffen Woltering 30.05.08<br />
<strong>Monocyclische</strong> <strong>Heteroaromaten</strong><br />
Einführung<br />
Definition:<br />
Cyclische Systeme mit Heteroatomen im Ringgerüst (in der Regel N,O,S), die Hückelregel muss erfüllt sein<br />
(4n+2 π-Elektronen), planare Moleküle<br />
Nomenklatur:<br />
Trivialnamen üblich, mehrere verschiedene Nomenklatursysteme (nicht eindeutige Benennung)<br />
am einfachsten: Name des entsprechenden Carbocyclus mit beschreibender Präfix.<br />
aza → Stickstoff oxa → Sauerstoff thia → Schwefel<br />
Fünfringe<br />
Aromatizität: Thiophen > Pyrrol > Furan<br />
Furan Thiophen Pyrrol<br />
Elektronenpaar des Heteroatoms über den Ring delokalisiert ->Elektronenreiche, nicht basische Systeme.<br />
Synthese:<br />
Paal-Knorr-Synthese:<br />
Reaktion einer 1,4-Dicarbonylverbindung mit NH3 (Pyrrol), H2S/HCl (Thiophen) oder H3PO4 (Furan).<br />
O<br />
O S<br />
N<br />
H<br />
H +<br />
O<br />
NH 3<br />
Bei Thiophen ist auch P2S5 als Reagenz möglich, hier erfolgt zuerst die Überführung in das Thioketon und<br />
anschließend der Ringschluss unter Abspaltung von Schwefelwasserstoff.<br />
Reaktionen<br />
Sehr reaktiv gegenüber elektrophiler aromatischer Substitution. Reaktivität: Pyrrol > Furan > Thiophen ><br />
Benzol. Grund dafür sind unterschiedliche Elektronenverteilungen im Ring, sowie die Aromatizität.<br />
Substitution erfolgt meist selektiv zugunsten der C2-Stellung.<br />
Bei starken Elektrophilen erfolgt die Substitution wahlloser.<br />
H +<br />
O<br />
C N O/S<br />
Einzelne Reaktionen:<br />
C3<br />
Vilsmeier-Reaktion: C2-selektive Formylierung von Pyrrol, Furan oder Thiophen mit dem<br />
vorher gebildeten Vilsmeier-Komplex:<br />
O<br />
Cl P Cl<br />
Cl<br />
O<br />
+<br />
O<br />
H NMe 2<br />
NH 2<br />
O<br />
HO<br />
Cl P O<br />
Cl<br />
OH<br />
H<br />
Cl<br />
NH 2<br />
N<br />
H<br />
X<br />
NMe 2<br />
-H 2O<br />
C2<br />
-H 2O<br />
-PO 2Cl<br />
O<br />
Cl<br />
N<br />
H<br />
Cl<br />
H NMe2 Vilsmeier-Komplex<br />
NH
2 Malte Sietzen und Steffen Woltering 30.05.08<br />
X = NH, S, O<br />
Außerdem: Mannich-Reaktion, Friedel-Crafts-Acylierungen und -Alkylierungen (nur von Thiophen, Furan und<br />
Pyrrol sind gegenüber Lewis-Säuren nicht stabil, Pyrrol kann aber mit -I-Substituenten stabilisiert werden<br />
und geht dann auch FC-Reaktionen ein)<br />
Vorkommen<br />
Einfache Pyrrol- und Thiophenderivate eher selten, Furanverbindungen recht häufig. Alle in Pflanzen zu<br />
finden.<br />
Diazole<br />
● Enthalten zwei Heteroatome, wovon eines Stickstoff ist. 1,2- und 1,3-Azole möglich<br />
● Allesamt unbasisch auf Grund des -I-Effektes des zweiten Heteroatoms; Imidazol und Pyrazol<br />
deutlich basischer als die anderen Azole durch Resonanzstabilisierung des Kations<br />
● Erhalten ihre Aromatizität durch die Delokalisierung eines freien Elektronenpaares des zweiten<br />
Heteroatoms.<br />
N<br />
N<br />
H<br />
X<br />
Pyrazol Isoxazol Isothiazol Imidazol Oxazol Thiazol<br />
1,2-Azole 1,3-Azole<br />
Synthese<br />
Isoxazol/Pyrazol<br />
Kondensation eines 1,3-Diketons mit Hydroxylamin (Isoxazol) bzw einem Hydrazinderivat (Pyrazol). Bei<br />
unregelmäßig substituierten Ketonen können zwei verschiedene Produkte entstehen, in vielen Fällen ist die<br />
Reaktion aber regiospezifisch.<br />
R 1<br />
Cl<br />
H NMe 2<br />
-H +<br />
(analog für Pyrazol)<br />
N<br />
O O<br />
Isothiazol<br />
Reaktion eines Thioamids mit Chloramid.<br />
NH<br />
R 2<br />
O<br />
Oxazol<br />
Robison-Gabriel-Synthese: Reaktion eines Aminoketons mit einem acylierenden Reagens (hier:<br />
Säurechlorid)<br />
NH 2<br />
O<br />
Cl<br />
Imidazol<br />
Kondensation eines 1,2-Ketons mit einem Aldehyd und einem Ammoniumsalz.<br />
O<br />
O<br />
S<br />
+<br />
+<br />
R 3<br />
NH 2<br />
X NMe 2<br />
Thiazol<br />
Hantzsch-Synthese: Reaktion eines Halogenketons mit Thioamid<br />
O<br />
N<br />
H<br />
S<br />
Cl<br />
+ H2NOH + H +<br />
Cl<br />
-2 H 2 O<br />
ClNH2<br />
-HCl<br />
-H +<br />
H 2O<br />
-HNMe 2<br />
-HCl<br />
Base<br />
-H 2O<br />
O NH 4 + OAc -<br />
-3 H 2O<br />
N<br />
R 1<br />
N<br />
H<br />
R 2<br />
H 2N<br />
N<br />
X O<br />
O<br />
N<br />
H<br />
N<br />
O<br />
H<br />
3 R3<br />
R<br />
R 2<br />
N<br />
N<br />
S<br />
O<br />
N<br />
+<br />
R 1<br />
N<br />
O<br />
S<br />
N
3 Malte Sietzen und Steffen Woltering 30.05.08<br />
Reaktionen<br />
Das Stickstoffatom desaktiviert den Ring hinsichtlich elektrophiler aromatischer Substitution, diese kann<br />
jedoch mit elektronenabgebenden Gruppen im Ring (Ph-, NH2-,...) dennoch durchgeführt werden. Die<br />
Substitution erfolgt dann meist meta zum desaktivierenden Stickstoff.<br />
Nucleophile Substitutionen sind möglich, jedoch sind aktivierende Substituenten (Ph-, Br-,...) am Ring nötig.<br />
Sechsringe<br />
Die heteroaromatischen aromatischen Sechsringe sind elektronische Analoga zum Benzol, es wird ein<br />
Elektron des Heteroatoms zur Ausbildung des aromatischen Zustandes benötigt. Das Elektronenpaar ist in<br />
der Ringebene in einem sp 2 -Orbital lokalisiert.<br />
Pyridin<br />
Azabenzol<br />
Die elektronegativeren Stickstoffatome (-I-Effekt) setzen die Elektronendichte des Ringsystems herab, daher<br />
anderes Verhalten als Benzol in Bezug auf verschiedene Reaktionen (Doppelcharakter Aromat/cyclisches<br />
Imin).<br />
Pyridin<br />
Pyridin ist der einfachste sechsgliedrige Heterocyclus, das freie Elektronenpaar des Stickstoffs ist im sp 2 -<br />
Orbital lokalisiert. Das Reaktionsverhalten unterscheidet sich stark von dem des Benzols:<br />
– elektrophile Substitutionen sind aufgrund verminderter Ladungsdichte erschwert (erfordern Aktivierung);<br />
verlaufen regioselektiv nach meta<br />
N<br />
E +<br />
- elektrophile Addition<br />
N<br />
O<br />
E +<br />
Cl<br />
O<br />
N N<br />
Pyridazin<br />
N<br />
N<br />
+<br />
1,2-Diazabenzol<br />
E<br />
H E<br />
N<br />
O<br />
H<br />
S<br />
NH 2<br />
N<br />
Pyrimidin<br />
- H +<br />
elektrophile Addition am aktivierten Pyridin, das in ein N-Oxid überführt wurde.<br />
N<br />
1,3-Diazabenzol<br />
N<br />
E<br />
H<br />
-HCl N<br />
E<br />
N<br />
O<br />
N<br />
N<br />
Pyrazin<br />
1,4-Diazabenzol<br />
N N N N N<br />
– nucleophile Substitution erleichtert (ebenfalls wegen verminderter Elektronendichte), verläuft ebenfalls<br />
regioselektiv, schneller als Benzol<br />
N<br />
E<br />
H<br />
S<br />
-H +<br />
N<br />
E
4 Malte Sietzen und Steffen Woltering 30.05.08<br />
N<br />
NH 2 -<br />
Tschitschibabin-Reaktion, bessere Abgangsgruppen als Wasserstoff erleichtern die Substitution<br />
– Basenreaktionen aufgrund des freien Elektronenpaares möglich (BrØnstedt-Reaktionen,<br />
Komplexbildung)<br />
Synthese nach Hantzsch:<br />
Aldolreaktion<br />
N<br />
Michael-Addition<br />
Oxidation<br />
Derivate der Diazabenzole<br />
Drei mögliche: Pyridazin (N-Atome ortho), Pyrimidin (N-Atome meta), Pyrazin (N-Atome para)<br />
Pyrimidin am wichtigsten (Derivate sind Bestandteil von RNA/DNA)<br />
H 3C<br />
EtO<br />
EtO<br />
N<br />
N<br />
O<br />
O<br />
N<br />
H<br />
O<br />
O<br />
NH<br />
NH 2 -<br />
NH 2 -<br />
O<br />
CH 2O<br />
- H2O<br />
HN<br />
H<br />
H 2N<br />
CO 2Et<br />
O<br />
N<br />
N<br />
EtO<br />
H<br />
NH<br />
O<br />
H<br />
NH 2<br />
NH 2 N<br />
H<br />
O<br />
H 2N<br />
EtO<br />
NH 2<br />
O N O<br />
N<br />
H<br />
H<br />
O<br />
Thymin<br />
Uracil<br />
Cytosin<br />
Literatur<br />
D.T. Davis, Aromatische Heterocyclen, VCH Verlag, Weinheim, 1995<br />
Brückner, Reaktionsmechanismen, 3. Auflage, Springer Verlag, Berlin, 2004<br />
Vollhardt, Schore, Organische Chemie, 4. Auflage, Wiley-VCH, 2005<br />
Kaufmann, Grundlagen der Organischen Chemie, 11. Auflage, Birkhäuser Verlag, Berlin, 2006<br />
N<br />
N<br />
H<br />
CO 2Et<br />
NH 2<br />
O<br />
H<br />
NH 2<br />
NH 2<br />
H<br />
- H 2O<br />
H<br />
H 2N<br />
H 2N<br />
EtO 2C CO 2Et<br />
N<br />
O<br />
N<br />
H<br />
N<br />
N<br />
N<br />
NH 2<br />
CO 2Et<br />
H<br />
O<br />
OH<br />
HNO 3<br />
H<br />
NH 2<br />
NH 2<br />
H<br />
OEt<br />
H +<br />
H +<br />
-H -<br />
-H -<br />
H +<br />
O<br />
N NH 2<br />
NH 2<br />
N<br />
O<br />
OEt<br />
H3N<br />
EtO 2C CO 2Et<br />
H<br />
HO<br />
EtO 2C CO 2Et<br />
N<br />
H