Quantitative Analyse von Protein-Massenspektren
Quantitative Analyse von Protein-Massenspektren Quantitative Analyse von Protein-Massenspektren
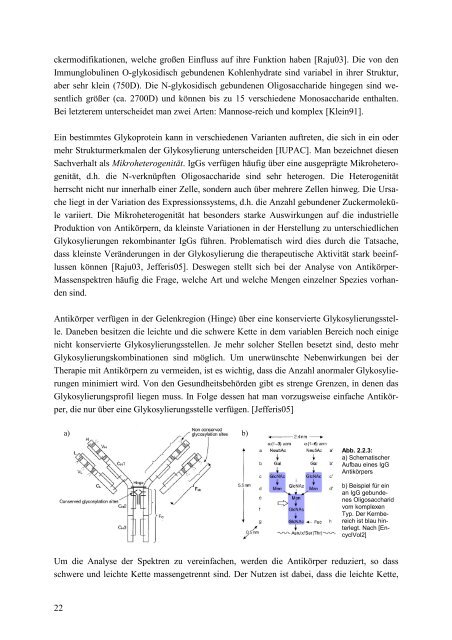
ckermodifikationen, welche großen Einfluss auf ihre Funktion haben [Raju03]. Die von den Immunglobulinen O-glykosidisch gebundenen Kohlenhydrate sind variabel in ihrer Struktur, aber sehr klein (750D). Die N-glykosidisch gebundenen Oligosaccharide hingegen sind wesentlich größer (ca. 2700D) und können bis zu 15 verschiedene Monosaccharide enthalten. Bei letzterem unterscheidet man zwei Arten: Mannose-reich und komplex [Klein91]. Ein bestimmtes Glykoprotein kann in verschiedenen Varianten auftreten, die sich in ein oder mehr Strukturmerkmalen der Glykosylierung unterscheiden [IUPAC]. Man bezeichnet diesen Sachverhalt als Mikroheterogenität. IgGs verfügen häufig über eine ausgeprägte Mikroheterogenität, d.h. die N-verknüpften Oligosaccharide sind sehr heterogen. Die Heterogenität herrscht nicht nur innerhalb einer Zelle, sondern auch über mehrere Zellen hinweg. Die Ursache liegt in der Variation des Expressionssystems, d.h. die Anzahl gebundener Zuckermoleküle variiert. Die Mikroheterogenität hat besonders starke Auswirkungen auf die industrielle Produktion von Antikörpern, da kleinste Variationen in der Herstellung zu unterschiedlichen Glykosylierungen rekombinanter IgGs führen. Problematisch wird dies durch die Tatsache, dass kleinste Veränderungen in der Glykosylierung die therapeutische Aktivität stark beeinflussen können [Raju03, Jefferis05]. Deswegen stellt sich bei der Analyse von Antikörper- Massenspektren häufig die Frage, welche Art und welche Mengen einzelner Spezies vorhanden sind. Antikörper verfügen in der Gelenkregion (Hinge) über eine konservierte Glykosylierungsstelle. Daneben besitzen die leichte und die schwere Kette in dem variablen Bereich noch einige nicht konservierte Glykosylierungsstellen. Je mehr solcher Stellen besetzt sind, desto mehr Glykosylierungskombinationen sind möglich. Um unerwünschte Nebenwirkungen bei der Therapie mit Antikörpern zu vermeiden, ist es wichtig, dass die Anzahl anormaler Glykosylierungen minimiert wird. Von den Gesundheitsbehörden gibt es strenge Grenzen, in denen das Glykosylierungsprofil liegen muss. In Folge dessen hat man vorzugsweise einfache Antikörper, die nur über eine Glykosylierungsstelle verfügen. [Jefferis05] Um die Analyse der Spektren zu vereinfachen, werden die Antikörper reduziert, so dass schwere und leichte Kette massengetrennt sind. Der Nutzen ist dabei, dass die leichte Kette, 22 a) b) Abb. 2.2.3: a) Schematischer Aufbau eines IgG Antikörpers b) Beispiel für ein an IgG gebundenes Oligosaccharid vom komplexen Typ. Der Kernbereich ist blau hinterlegt. Nach [EncyclVol2]
welche meistens über keine Glykosylierungen verfügt, als Referenzmasse verwendet werden kann. Überdies lassen sich die Glykosylierungsvarianten der schweren bzw. leichten Kette leichter bestimmen, da Variationen der jeweils anderen Kette nicht berücksichtigt werden müssen. Im Folgenden wird kurz erläutert, wie Antikörper für die medizinische Therapeutik hergestellt werden können. Bei der aktiven Immunisierung gegen ein Antigen werden eine Vielzahl an Antikörpern gebildet – so genannte polyklonale Antikörper –, welche das Antigen binden. Polyklonal heißt, dass die Antikörper sich nicht nur in den Glykosylierungen unterscheiden, sondern auch in der Aminosäuresequenz. Folglich sezerniert jeder B-Lymphozyt einen anderen Antikörper, es herrscht also eine große Heterogenität. Für die Medizin ist es jedoch von besonderem Interesse, monoklonale Antikörper in großen Mengen herzustellen, die ein bestimmtes Antigen binden. Monoklonale Antikörper besitzen die gleiche Aminosäuresequenz, unterscheiden sich jedoch an den Glykosylierungsstellen (Mikroheterogenität). Die Herstellung monoklonaler Antikörper ist nicht unproblematisch. Zum einen muss ein Lymphozyt gefunden werden, welcher Antikörper gegen das zu bindende Antigen produziert und zum anderen muss der Lymphozyt auch in vitro lebensfähig sein. Ein möglicher Lösungsweg ist folgender: Um Antikörper gegen ein Antigen X zu erhalten, injiziert man in die Milz einer Maus eine bestimmte Dosis des Antigen X. Nach erfolgreicher aktiver Immunisierung haben sich spezifische B-Lymphozyten gegen das injizierte Antigen gebildet. Im nächsten Schritt werden die Milzzellen und somit auch die aktivierten Lymphozyten der Maus entnommen. Es bleibt noch das Problem bestehen, dass normale B- Lymphozyten in vitro nicht lebensfähig sind. Krebsartige Zellen hingegen lassen sich in vitro vermehren, weil sie mit nur sehr wenigen Wachstumsfaktoren auskommen. Deswegen hybridisiert man die entnommenen B-Zellen mit krebsartigen Lymphozyten, den Myelomzellen, welche nur monoklonale Antikörper sezernieren. Die so entstehenden Klone (Hybridome) sind in vitro lebensfähig und können nun auf einem geeigneten Medium gezüchtet werden. Die von den Hybridomen sezernierten Antikörper werden anschließend in einem Screening- Verfahren auf ihre Funktionalität hin überprüft. Es findet also eine Klonauswahl bzw. Antikörperauswahl statt. In der Therapeutik hat man hierbei Interesse, möglichst effektive Antikörper zu finden, d.h. hohe Affinität für das zu bindende Antigen, geringe Mikroheterogenität und keine Wechselwirkung mit anderen Stoffen. Nach Auswahl geeigneter Antikörper müssen diese noch „humanisiert“ werden, da sonst im Menschen eine Immunantwort gegen die Mausantikörper stattfinden würde. Die Humanisierung eines Antikörpers beinhaltet den Austausch der konstanten Bereiche gegen humane Sequenzen. [Voet&Voet92] Ursprünglich wurden Antikörper in der Medizin v. a. zur passiven Impfung gegen Pathogene eingesetzt. Mittlerweile hat auch die Tumortherapie mit Antikörpern eine immer größer wer- 23
- Seite 1: LUDWIG - MAXIMILIANS - UNIVERSITÄT
- Seite 5: Danksagung Ich danke Prof. Dr. Volk
- Seite 8 und 9: Inhalt Seite Liste der Abkürzungen
- Seite 11: Liste der Abkürzungen Ara L-Arabin
- Seite 14 und 15: somit viele Kombinationen, die auf
- Seite 17 und 18: 2. Ausgangssituation Antikörper si
- Seite 19 und 20: Die Frequenz, mit der sich bestimmt
- Seite 21: Die Immunglobuline lassen sich in f
- Seite 25 und 26: Analog lässt sich auf diese Weise
- Seite 27 und 28: m R = (2.3.2) ∆m Dabei ist m die
- Seite 29 und 30: Die Hüllkurve repräsentiert die L
- Seite 31 und 32: werden, welche Massen im Spektrum v
- Seite 33: Peak-Überlappungen und für die Be
- Seite 36 und 37: Ein starkes Rauschen hat man z.B. d
- Seite 38 und 39: Nach optionaler Bestimmung der Hül
- Seite 40 und 41: 40 ∂ 0 = ∂a = 2 ⇒ ⇒ R ∑
- Seite 42 und 43: 3.3. Basislinie Die Basislinie enth
- Seite 44 und 45: Liste werden durch eine kubische Sp
- Seite 46 und 47: Dieser Mechanismus funktioniert nur
- Seite 48 und 49: tionen zu berechnen, multipliziert
- Seite 50 und 51: Der Algorithmus für die Berechnung
- Seite 52 und 53: 3.5. Simulation der Peakverbreiteru
- Seite 54 und 55: die Peakbreite nicht konstant ist.
- Seite 56 und 57: Um die Parameter der Basisfunktione
- Seite 58 und 59: 58 ⎛ df1 ⎜ ⎜ dx1 J ( x) = ⎜
- Seite 60 und 61: 60 2 R =1 − SSE SSM (3.6.2.1) SSE
- Seite 62 und 63: Um diese Probleme zu umgehen, werde
- Seite 64 und 65: Möglichkeit a) konnte nach einem B
- Seite 66 und 67: Ionisierungen beschränkt. Dies kan
- Seite 68 und 69: DLL ist die Methode DLLEXPORT int M
- Seite 70 und 71: statten gehen und zweitens nicht in
ckermodifikationen, welche großen Einfluss auf ihre Funktion haben [Raju03]. Die <strong>von</strong> den<br />
Immunglobulinen O-glykosidisch gebundenen Kohlenhydrate sind variabel in ihrer Struktur,<br />
aber sehr klein (750D). Die N-glykosidisch gebundenen Oligosaccharide hingegen sind wesentlich<br />
größer (ca. 2700D) und können bis zu 15 verschiedene Monosaccharide enthalten.<br />
Bei letzterem unterscheidet man zwei Arten: Mannose-reich und komplex [Klein91].<br />
Ein bestimmtes Glykoprotein kann in verschiedenen Varianten auftreten, die sich in ein oder<br />
mehr Strukturmerkmalen der Glykosylierung unterscheiden [IUPAC]. Man bezeichnet diesen<br />
Sachverhalt als Mikroheterogenität. IgGs verfügen häufig über eine ausgeprägte Mikroheterogenität,<br />
d.h. die N-verknüpften Oligosaccharide sind sehr heterogen. Die Heterogenität<br />
herrscht nicht nur innerhalb einer Zelle, sondern auch über mehrere Zellen hinweg. Die Ursache<br />
liegt in der Variation des Expressionssystems, d.h. die Anzahl gebundener Zuckermoleküle<br />
variiert. Die Mikroheterogenität hat besonders starke Auswirkungen auf die industrielle<br />
Produktion <strong>von</strong> Antikörpern, da kleinste Variationen in der Herstellung zu unterschiedlichen<br />
Glykosylierungen rekombinanter IgGs führen. Problematisch wird dies durch die Tatsache,<br />
dass kleinste Veränderungen in der Glykosylierung die therapeutische Aktivität stark beeinflussen<br />
können [Raju03, Jefferis05]. Deswegen stellt sich bei der <strong>Analyse</strong> <strong>von</strong> Antikörper-<br />
<strong>Massenspektren</strong> häufig die Frage, welche Art und welche Mengen einzelner Spezies vorhanden<br />
sind.<br />
Antikörper verfügen in der Gelenkregion (Hinge) über eine konservierte Glykosylierungsstelle.<br />
Daneben besitzen die leichte und die schwere Kette in dem variablen Bereich noch einige<br />
nicht konservierte Glykosylierungsstellen. Je mehr solcher Stellen besetzt sind, desto mehr<br />
Glykosylierungskombinationen sind möglich. Um unerwünschte Nebenwirkungen bei der<br />
Therapie mit Antikörpern zu vermeiden, ist es wichtig, dass die Anzahl anormaler Glykosylierungen<br />
minimiert wird. Von den Gesundheitsbehörden gibt es strenge Grenzen, in denen das<br />
Glykosylierungsprofil liegen muss. In Folge dessen hat man vorzugsweise einfache Antikörper,<br />
die nur über eine Glykosylierungsstelle verfügen. [Jefferis05]<br />
Um die <strong>Analyse</strong> der Spektren zu vereinfachen, werden die Antikörper reduziert, so dass<br />
schwere und leichte Kette massengetrennt sind. Der Nutzen ist dabei, dass die leichte Kette,<br />
22<br />
a) b)<br />
Abb. 2.2.3:<br />
a) Schematischer<br />
Aufbau eines IgG<br />
Antikörpers<br />
b) Beispiel für ein<br />
an IgG gebundenes<br />
Oligosaccharid<br />
vom komplexen<br />
Typ. Der Kernbereich<br />
ist blau hinterlegt.<br />
Nach [EncyclVol2]