Nukleation: Theorien und Realität
Nukleation: Theorien und Realität
Nukleation: Theorien und Realität
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Nukleation</strong>: <strong>Theorien</strong> <strong>und</strong> <strong>Realität</strong><br />
5. Homogene <strong>Nukleation</strong><br />
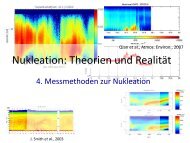
Qian et al., Atmos. Environ., 2007<br />
- Bildung neuer Teilchen aus einer Substanz(mischung) -<br />
J. Smith et al., 2003
A B
Abschnitte<br />
MetAN - Vorlesungsstruktur<br />
1. <strong>Nukleation</strong>, was ist das? Gr<strong>und</strong>begriffe, Definition <strong>und</strong> Zielsetzung der<br />
Vorlesung (11.4.)<br />
2. Aerosoldynamische Prozesse: Gr<strong>und</strong>lagen <strong>und</strong> theoretische Beschreibung<br />
(18.4.)<br />
3. Sättigungsdampfdruck, Kelvin-, Raoult- <strong>und</strong> Thomsoneffekt: Nötige<br />
Übersättigung zur <strong>Nukleation</strong> bzw. Kondensation (2.5.)<br />
4. Messmethoden zur <strong>Nukleation</strong> (9.5.)<br />
5. Homogene <strong>Nukleation</strong>: Bildung neuer Partikel aus einer Mischung (16.5.)<br />
6. Binäre <strong>und</strong> ternäre <strong>Nukleation</strong>: Rolle der Schwefelsäure (23.5.)<br />
7. Heterogene <strong>Nukleation</strong>: Mehrstufenprozess <strong>und</strong> Ioneneffekte (30.5.)<br />
8. Reaktionskontrollierte <strong>Nukleation</strong>: Zwei- bis Dreistufenprozess (6.6.)<br />
9. <strong>Nukleation</strong> in der oberen Troposphäre <strong>und</strong> an Küsten (13.6.)<br />
10. <strong>Nukleation</strong> in <strong>und</strong> über bewaldeten Gebieten (20.6.)
MetAN – Vorlesungsstruktur (Forts.)<br />
11. <strong>Nukleation</strong> über anthropogen beeinflussten Gebieten: Städte, Transportwege<br />
<strong>und</strong> Landwirtschaft; Rauch, Gastronomie, Ampel <strong>und</strong> Autoabgase (27.6.)<br />
Weiteres Wachstum <strong>und</strong> Effekte auf Ges<strong>und</strong>heit, Wolken <strong>und</strong><br />
Strahlungsbudgets das terrestrische Klima<br />
12. Klimaeffekte auf die einzeln vorgestellten <strong>Nukleation</strong>stheorien (4.7.)<br />
13. Auswirkung eines angedachten Geoengineerings auf die <strong>Nukleation</strong> <strong>und</strong> das<br />
Klima. (11.7.)<br />
Klausurtermin: 2.8.2012 um 10:00 Uhr. Ort GW 3.101.<br />
Vorlesung: Mittwochs, 12-13:30 Uhr in Raum GW 2.103<br />
Übung: Mittwochs, 13:30-14:15 Uhr in Raum GW 3.102
Homogene <strong>Nukleation</strong><br />
<strong>Nukleation</strong> einer bzw. mehrerer Komponenten<br />
www.aerosols.wustl.edu/AerosolBasics/Aerosol dynamics.htm
Molekulare Cluster: Gleichgewichtszustand<br />
Im Gleichgewicht (S < 1) gilt:<br />
Daraus folgt: Kondensation = Evaporation<br />
Umgestellt nach b‘:<br />
Cluster �Cluster<br />
� Cluster<br />
g�1<br />
1<br />
Die früher diskutierte Kollisionsrate b folgt hier aus:<br />
b �<br />
b '�s<br />
N<br />
1<br />
�<br />
sv<br />
b '�s<br />
12<br />
g �1<br />
� N<br />
�1<br />
� �<br />
m<br />
1<br />
g �1<br />
b '�<br />
� �<br />
kBT<br />
2�<br />
� m<br />
� N<br />
kBT<br />
2�<br />
� m<br />
Detaillierte Ableitung der mittleren Molekülgeschwindigkeit <strong>und</strong> der<br />
Kollisionsrate pro Fläche <strong>und</strong> Zeit in der ersten Gleichung unter:<br />
http://en.wikipedia.org/wiki/Kinetic_theory#cite_note-1<br />
s<br />
g<br />
s<br />
g �1<br />
1<br />
� s<br />
g<br />
g<br />
� N<br />
� N<br />
g<br />
g �1<br />
g<br />
1<br />
� s �<br />
V<br />
1<br />
��<br />
�<br />
g<br />
g<br />
1<br />
� s<br />
LEGENDE:<br />
�: Ablösekoeffizient<br />
b: Kollisionsrate (in cm 3<br />
Molekül -1 s -1 )<br />
b‘: Kondensationsfluss<br />
ohne eff. Kollisionsfläche<br />
mit Stoßpartnerkonzentration<br />
(Moleküle m -2 s -1 )<br />
s i: effekt. Kollisionsoberfläche<br />
N i: Clusterkonzentration<br />
mit i Molekülen<br />
m 1: Monomermasse<br />
p sat: Sättigungsdampfdruck<br />
v 12: mittlere Molekülgeschwindigkeit<br />
(m/s)<br />
V 1.: Molekulares<br />
Volumen<br />
k B: Boltzmannkon-stante<br />
T: Temperatur<br />
S: Sättigungsverhältnis
Die Molekülkonzentration N 1 ist:<br />
Molekulare Cluster<br />
Das Einsetzen von N 1 (Molekülkonzentration der Monomere) in<br />
die Formel für b‘ <strong>und</strong> das Ausmultiplizieren ergibt:<br />
Es folgt für das<br />
1<br />
b '�<br />
V<br />
�<br />
Clusterverhältnis:<br />
g<br />
1<br />
�<br />
�<br />
N<br />
N<br />
g�1<br />
g<br />
kBT<br />
2�<br />
�m<br />
p<br />
N<br />
1<br />
sat,<br />
eben<br />
2�<br />
�m<br />
k<br />
�<br />
g<br />
�<br />
b'<br />
1<br />
1<br />
�<br />
�<br />
B<br />
T<br />
p1V<br />
k T<br />
B<br />
N<br />
� s �<br />
s<br />
1<br />
1<br />
�<br />
p<br />
1<br />
2�<br />
�m<br />
k<br />
�<br />
�<br />
4�v<br />
exp<br />
�<br />
� kBT<br />
� D<br />
1 � 2 v<br />
exp �<br />
�<br />
S �<br />
� Dpk<br />
Molek.<br />
B<br />
Molek.<br />
T<br />
�<br />
�<br />
�<br />
�<br />
p<br />
1<br />
�<br />
�<br />
�<br />
�<br />
B<br />
mit<br />
T<br />
S<br />
�<br />
p<br />
p<br />
1<br />
s<br />
�<br />
p<br />
p<br />
1<br />
sat,<br />
eben
Molekulare Cluster<br />
• Das Clustervolumen für ein kugelförmig angenommenes<br />
Teilchen ergibt den Durchmesser<br />
� 6g<br />
�vMolek.<br />
�<br />
Dp<br />
� � �<br />
� � �<br />
�<br />
1<br />
Dp<br />
�<br />
• eingesetzt in die Clusterverteilung<br />
N<br />
N<br />
ergibt sich folgende Gleichung<br />
�<br />
� 1 � 8�<br />
�<br />
4�v<br />
� �<br />
�<br />
�<br />
�<br />
Molek.<br />
N g�1<br />
1<br />
2<br />
�<br />
� 6vMolek.<br />
exp<br />
�<br />
�<br />
1/<br />
3<br />
N g S � g kBT<br />
�<br />
�<br />
1<br />
3<br />
�<br />
g<br />
�<br />
b '<br />
�<br />
1<br />
/ 3<br />
�<br />
�<br />
�<br />
�<br />
�<br />
�<br />
�<br />
�<br />
1<br />
2<br />
g �1<br />
Molek.<br />
g<br />
1 �<br />
�<br />
2�v<br />
exp<br />
S �<br />
� Dpk<br />
B<br />
T<br />
� 8�<br />
�<br />
�<br />
� 6�<br />
v<br />
g<br />
�<br />
�<br />
�<br />
�<br />
Molek.<br />
1/<br />
3<br />
�<br />
� 2�v<br />
1 �<br />
exp �<br />
S �<br />
�<br />
�<br />
�<br />
�<br />
�<br />
�<br />
Molek<br />
1/<br />
3<br />
� 4�<br />
�<br />
� .<br />
� 3v<br />
1/<br />
3<br />
g k T<br />
B<br />
Molek.<br />
�<br />
�<br />
�<br />
�<br />
1<br />
/ 3<br />
�<br />
�<br />
�<br />
�<br />
�<br />
�<br />
�
Molekulare Cluster<br />
Multipliziert man dieses Verhältnis mit sukzessive kleineren<br />
Werten von g bis hinab zu g = 2 erhält man das Verhältnis von<br />
Molekülen zu Clustern mit g Molekülen:<br />
N<br />
N<br />
Für eine hinreichend große Molekülzahl g erhält man<br />
g<br />
�<br />
g '�2<br />
Daraus folgt für die Clusterverteilung<br />
N<br />
1<br />
2<br />
g<br />
N<br />
N<br />
g'<br />
�<br />
�1/<br />
3<br />
N<br />
�<br />
S<br />
N<br />
N<br />
�<br />
mit N s = p s/(k B*T)<br />
2<br />
3<br />
...<br />
s<br />
g<br />
g�2<br />
g�1<br />
0<br />
g<br />
N<br />
N<br />
dg'<br />
1<br />
g'<br />
/ 3<br />
g�1<br />
g<br />
�<br />
�<br />
3<br />
2<br />
�<br />
� � 3�v<br />
�<br />
exp �<br />
�<br />
�<br />
�<br />
1<br />
S<br />
g<br />
g�1<br />
2/<br />
3<br />
Molek.<br />
�<br />
� 2�v<br />
�<br />
exp �<br />
�<br />
�<br />
�<br />
� 4�<br />
�<br />
�<br />
� 3v<br />
k T<br />
B<br />
Molek.<br />
�<br />
�<br />
�<br />
�<br />
Molek.<br />
1/<br />
3<br />
g<br />
� 4�<br />
�<br />
�<br />
� 3v<br />
k T<br />
2/<br />
3<br />
B<br />
�<br />
�<br />
�<br />
�<br />
�<br />
�<br />
�<br />
Molek.<br />
�<br />
�<br />
�<br />
�<br />
1/<br />
3<br />
g<br />
�<br />
g '�2<br />
g'<br />
�1/<br />
3<br />
�<br />
�<br />
�<br />
�<br />
�<br />
�<br />
�
Verteilung der Multimere<br />
Kritische Größe mit der<br />
höchsten nötigen Übersättigung.<br />
Hier homogene<br />
Bildung neuer Partikel.
V·G v<br />
Molekulare Cluster: Energiebetrachtung<br />
G s<br />
Freie Energie DG gibt an, ob genug Energie zur Bildung eines neuen<br />
Teilchens zur Verfügung steht. Sie ist die Summe aus den benötigten<br />
Energien zur Volumen- <strong>und</strong> Oberflächenbildung, V·Gv <strong>und</strong> Gs. � 3<br />
DG �V<br />
�Gv<br />
� Gs<br />
� Dp<br />
�Gv<br />
���<br />
� D<br />
6<br />
http://en.wikipedia.org/wiki/Nuclea<br />
tion#Homogeneous_nucleation<br />
Bildung neuer Cluster oder Teilchen: Überwindung des Maximums DG*.<br />
Daraus folgt: kritischen Molekülanzahl g* <strong>und</strong> kritischer Durchmesser<br />
D p*<br />
2<br />
p
Molekulare Cluster: Energiebetrachtung <strong>und</strong><br />
kritische Cluster<br />
• Zur Bestimmung der kritischen Clustergröße (Größe maximal<br />
nötiger Übersättigung) <strong>und</strong> der kritischen freien Energie DG*<br />
wird die Gibb‘sche Energie nach dem Durchmesser abgeleitet.<br />
Das Ergebnis wird gleich 0 gesetzt. Es folgt der kritische<br />
Clusterdurchmesser D p* <strong>und</strong> die kritische Molekülzahl g* :<br />
D<br />
*<br />
p<br />
4�<br />
�<br />
�<br />
G<br />
32��<br />
g*<br />
�<br />
3G<br />
�v<br />
molek<br />
3<br />
16��<br />
DG*<br />
�<br />
3G<br />
v<br />
v<br />
v<br />
3<br />
G<br />
v<br />
ist<br />
negativ
Molekulare Cluster<br />
Für S < 1 nimmt die Verteilung ab g = 1 stetig ab.<br />
Für S > 1 <strong>und</strong> G v = -RT/v Molek.·ln(S) durchläuft die Verteilung ein Minimum bei<br />
D<br />
*<br />
p<br />
3 2<br />
4�v<br />
� Molek.<br />
* �16��<br />
v<br />
� � �<br />
Molek.<br />
<strong>und</strong> N g N1<br />
exp<br />
�<br />
2<br />
kBT<br />
ln S<br />
� 3 B<br />
� � � � ��<br />
3<br />
k T ln S<br />
Kleinere verdampfen, größere wachsen bei hinreichender<br />
Molekülkonzentration an.<br />
N g<br />
�<br />
�
D<br />
*<br />
p<br />
Minimum<br />
3 2<br />
4�v<br />
� Molek.<br />
* �16��<br />
v<br />
� � �<br />
Molek.<br />
<strong>und</strong> N g N1<br />
exp<br />
�<br />
2<br />
kBT<br />
ln S<br />
� 3 B<br />
�<br />
� � � � ��<br />
3<br />
k T ln S<br />
WCPC Achtung: Gleichgewichtsansatz bei<br />
Möglicher <strong>und</strong> realer cut-off von<br />
WCPCs.<br />
N g *<br />
(merklichen) Übersättigungen für N g *<br />
unzutreffend!<br />
�
Homogene <strong>Nukleation</strong><br />
• Lord Kelvin: „Je höher S, desto kleiner der Durchmesser eines<br />
Partikels oder Cluster, der als <strong>Nukleation</strong>skeim dienen kann.“<br />
S<br />
D<br />
Kelvin<br />
p,<br />
Aktivier .<br />
� 4�v<br />
� exp �<br />
�<br />
� RT � D<br />
4�v<br />
�<br />
RT �ln<br />
mol.,<br />
Gas<br />
p,<br />
Aktivier .<br />
mol,<br />
Gas<br />
Identisch mit dem<br />
Clusterverteilungsminimum!<br />
�S �<br />
Kelvin<br />
�<br />
�<br />
�<br />
�
Homogene <strong>Nukleation</strong><br />
• Zwar sind molekulare Cluster auch bei Untersättigung stets<br />
präsent, sie wachsen aber nur bei Übersättigung durch<br />
Aufnahme einzelner Moleküle.<br />
• Wegen der Aktivierung durch Moleküle der gleichen Substanz<br />
wie der Kern heißt dies „homogene“ oder „Selbstnukleation“.<br />
• Bei Übersättigung kein Gleichgewicht mehr!<br />
• Die Bildungsrate J g bei einem Cluster mit g Molekülen ist<br />
J<br />
J<br />
g<br />
g<br />
� b<br />
'�N<br />
�<br />
N<br />
e<br />
g�1<br />
g�1<br />
s<br />
s<br />
g�1<br />
g�1<br />
��<br />
� N<br />
b '��<br />
��<br />
N<br />
g<br />
�<br />
g�1<br />
e<br />
g�1<br />
N<br />
�<br />
g<br />
s<br />
N<br />
N<br />
g<br />
g<br />
e<br />
g<br />
�<br />
�<br />
��<br />
Einheit: cm -3 s -1<br />
N g e : Gleichgewichts-<br />
vert.
Herleitung der <strong>Nukleation</strong>srate<br />
In einer Größenklasse N g verändert sich die Anzahl wie<br />
�N<br />
�t<br />
g<br />
�<br />
in<br />
from<br />
g �1<br />
�<br />
in<br />
from<br />
g �1<br />
�<br />
out<br />
from<br />
Kondensation Evaporation Kondensation Evaporation<br />
Für genügend große Werte von g (g > 10) können wir Jg als kontinuierliche<br />
Funktion von g annehmen. � N �<br />
��<br />
e � e<br />
e N �N<br />
�N<br />
J g � �b<br />
'�N<br />
� s �<br />
� �<br />
� �b<br />
'�s<br />
� � b '�N<br />
� s � e<br />
�g<br />
�g<br />
N ��g<br />
J<br />
�g� g�1<br />
„Diffusion“ von Clustern durch g Transport von Partikeln durch externe Einflüsse<br />
1/<br />
3<br />
(z.B. Ladung)<br />
mit<br />
D�<br />
k T<br />
B<br />
�<br />
�36� �<br />
2<br />
�v<br />
k T<br />
B<br />
B<br />
/ 3<br />
Molek.<br />
g<br />
g<br />
2/<br />
3<br />
�<br />
�N<br />
b '�N<br />
� s �D�<br />
� �b<br />
'�s<br />
� � �<br />
�g<br />
k T �g<br />
out<br />
from<br />
� g �ln<br />
S<br />
g<br />
�<br />
J<br />
g<br />
�<br />
J
Herleitung der <strong>Nukleation</strong>srate<br />
• Die kinetische Gleichung wird zu<br />
• Lösungsabschätzung unter folgenden Annahmen:<br />
1. Für kleine g geht erreicht die Clusterverteilung ihr Gleichgewicht.<br />
2. Für große g wird das Verhältnis n/n e = 0, da im Gleichgewicht<br />
deutlich mehr Cluster präsent sind (kein Wachstum).<br />
3. Es gibt ein quasi-Gleichgewicht mit<br />
Hier wird<br />
J<br />
N e<br />
N<br />
�J<br />
�g<br />
�1 mit g �<br />
�N<br />
� �<br />
�t<br />
� 0<br />
�g� � konst.<br />
�J<br />
0<br />
�N<br />
�t<br />
�J<br />
� �<br />
�g
1<br />
N<br />
�<br />
e<br />
�<br />
Herleitung der <strong>Nukleation</strong>srate<br />
• Integration liefert: N<br />
e<br />
e N<br />
N N s<br />
J � J gdg � N s dg s<br />
dg<br />
g � g kBT<br />
g � �<br />
� �<br />
��<br />
�<br />
� � � � b'�<br />
� �D�<br />
�<br />
� � � b<br />
'�<br />
� � � �<br />
��<br />
b '�<br />
� � �<br />
� � �<br />
� �<br />
• Wichtig: Integral im Nenner:<br />
mit der Reihenentwicklung<br />
wegen des Maximums bei g*.<br />
Damit folgt für das Integral:<br />
1<br />
N<br />
1<br />
� D�<br />
exp �<br />
��<br />
� kBT<br />
max<br />
dg<br />
1<br />
� � e<br />
N s<br />
�<br />
* * � �<br />
0 s N � exp ��<br />
0 � 2<br />
*<br />
� � ��D<br />
p<br />
�<br />
�exp<br />
��<br />
� ��<br />
9kBTg<br />
* �g � g �<br />
2<br />
�<br />
�dg<br />
�<br />
2<br />
* 2<br />
1 1 � D� �<br />
� exp �<br />
e<br />
N N ��<br />
�<br />
1 kBT<br />
�<br />
� �<br />
�<br />
D� � D� max � �D<br />
* 2<br />
9g<br />
* �g � g �<br />
2<br />
�<br />
�<br />
��<br />
2��D<br />
mit � �<br />
9k<br />
Tg<br />
B<br />
* 2<br />
p<br />
* 2<br />
<strong>und</strong><br />
* 2<br />
p<br />
N<br />
� � 2 *<br />
g � g<br />
*<br />
�<br />
N<br />
1<br />
� D�<br />
exp �<br />
��<br />
� kBT<br />
max<br />
�<br />
�<br />
�<br />
�
Herleitung der <strong>Nukleation</strong>srate<br />
• Integration von -� bis +� (kein nennenswerter Beitrag der<br />
negativen Integration):<br />
• Somit wird die <strong>Nukleation</strong>srate J im homogenen Fall<br />
J<br />
J<br />
�<br />
�<br />
�<br />
��<br />
�<br />
�<br />
0<br />
b '<br />
�<br />
� 2�<br />
��<br />
dg<br />
Ns<br />
�<br />
p<br />
1<br />
1<br />
1<br />
2�m<br />
k<br />
* �g � g �<br />
� � 2 � � � � 2 � 2�<br />
exp �� �dg � exp �� � �<br />
2 � z dz<br />
��<br />
�<br />
� � 2 � �<br />
p �D<br />
B<br />
2<br />
p<br />
N<br />
1<br />
exp<br />
2�m<br />
k<br />
1<br />
�<br />
� � N1v<br />
T ��<br />
�� D� / k T �<br />
B<br />
T<br />
2/<br />
3<br />
Molek.<br />
�<br />
�<br />
max<br />
2�<br />
�<br />
�v<br />
k<br />
2/<br />
3<br />
Molek.<br />
B<br />
T<br />
B<br />
3 � 16��<br />
v<br />
exp �<br />
�<br />
�<br />
� 3 B<br />
2<br />
Molek.<br />
�<br />
� � � � ��<br />
3 2<br />
k T ln S<br />
�
<strong>Nukleation</strong>srate: Abhängigkeit von einzelnen<br />
Parametern<br />
J<br />
� �<br />
2/<br />
3<br />
3 2<br />
p<br />
� 1<br />
2/<br />
3 �vMolek.<br />
16��<br />
v<br />
� � � � �<br />
�<br />
Molek.<br />
2<br />
N1vMolek.<br />
exp<br />
�<br />
� 3 2<br />
��<br />
2�m1k<br />
T ��<br />
k T<br />
B<br />
B � 3 kBT<br />
ln S<br />
Die <strong>Nukleation</strong>srate hängt ab von<br />
� � � � ��<br />
- der Temperatur T (negativ): Je höher T, desto höher der<br />
Sättigungsdampfdruck <strong>und</strong> desto stärker die Evaporation;<br />
- die Molekularmasse m 1 (negativ): Je größer m 1, desto langsamer die<br />
Diffusion;<br />
- dem Molekularvolumen v Molek.(positiv): Je größer v Molek., desto schneller<br />
das Wachstum bei Molekülaufnahme;<br />
- der Oberflächenspannung � (positiv): Je stärker die Bindung, desto<br />
geringer die Evaporation;<br />
- dem Partialdruck (Konzentration) p 1 (positiv): Je mehr vorhanden, desto<br />
stärker die <strong>Nukleation</strong>;<br />
- dem Sättigungsverhältnis S (positiv): Je höher S, desto höher der<br />
Kondensationsfluss.<br />
�<br />
�
Homogene <strong>Nukleation</strong><br />
Wasserdampf nukleiert homogen ab Sättigungsverhältnissen von > 3.3.<br />
Schwefelsäure
Erzeugung einer homogenen <strong>Nukleation</strong><br />
• <strong>Nukleation</strong> erfordert die Bildung eines ausreichenden<br />
Sättigungsverhältnis S ohne gleichzeitige starke<br />
Senkenprozesse.<br />
– Expansion, das bedeutet zügige Abkühlung<br />
(T�, p�, S�)<br />
– Lokal sehr starke Quelle
S<br />
oE<br />
Expansion: Gedankenexperiment<br />
• Starke Konvektion (vertikal: v = 10 m/s), T Oberfläche = 25°C, S = 1.<br />
• Abkühlung mit dT/dz = -9.8 K/km (keine Kondensation möglich).<br />
• Kein Entrainment (real vielleicht 30%).<br />
• Zunahme des Wasserpartialdrucks mit ca. 6%/K.<br />
• Wo wird ein Sättigungsverhältnis von 4.2?<br />
� � ��Dz ��Dz S �1.<br />
06 � � �1. � �<br />
Oberfläche<br />
� dT �<br />
�<br />
� dz<br />
� 06<br />
� dT �<br />
�<br />
� dz<br />
• S = 4.2 bei DT = 24.6 K, d.b. bei Dz = 2.5 km, Dt = 250 s ≈ 4 min.<br />
• Mit Entrainment von 30%: S mE = 0.7*S oE folgt<br />
DT = 30.75 K, d.b. bei Dz = 3.14 km, Dt = 314 s ≈ 5.25 min
N g<br />
Effekt von Wolkenkondensationskeimen<br />
Normalfall: Wassercluster müssen D p *<br />
von ca. 2 nm überschreiten.<br />
Kondensationskeime senken nötige<br />
Übersättigung bis < 1 <strong>und</strong> führen so<br />
zu einer Aktivierung der Kerne<br />
jenseits des kritischen Durchmessers.<br />
N g<br />
Achtung:<br />
Gleichgewichtsverteilung nur<br />
im Gleichgewicht oder bei<br />
nahendem Gleichgewicht<br />
verwendbar!
Messung der (homogenen) <strong>Nukleation</strong><br />
• Nötig: Messung im Bereich 10 Å < D p < 100 Å<br />
• Wilson Expansionswolkenkammer<br />
Q: http://njsas.org/projects/atoms/cloud_chamber/index.php<br />
Konzept: Übersättigter Alkohol dient als Kondensat, wenn<br />
ein radioaktives/geladenes Teilchen die Zelle passiert.<br />
Charles Th. R. Wilson<br />
Nobelpreis: 1927<br />
Q: Nobelakademie
J<br />
Homogene <strong>Nukleation</strong>srate<br />
� �<br />
2/<br />
3<br />
3 2<br />
p<br />
� 1<br />
2/<br />
3 �vMolek.<br />
16��<br />
v<br />
� � � � �<br />
�<br />
Molek.<br />
2<br />
N1vMolek.<br />
exp<br />
�<br />
� 3 2<br />
��<br />
2�m1k<br />
T ��<br />
k T<br />
B<br />
B � 3 kBT<br />
ln S<br />
Die <strong>Nukleation</strong>srate hängt ab von<br />
� � � � ��<br />
- der Temperatur T (negativ): Je höher T, desto höher der<br />
Sättigungsdampfdruck <strong>und</strong> desto stärker die Evaporation;<br />
- die Molekularmasse m 1 (negativ): Je größer m 1, desto langsamer die<br />
Diffusion;<br />
- dem Molekularvolumen v Molek.(positiv): Je größer v Molek., desto schneller<br />
das Wachstum bei Molekülaufnahme;<br />
- der Oberflächenspannung � (positiv): Je stärker die Bindung, desto<br />
geringer die Evaporation;<br />
- dem Partialdruck (Konzentration) p 1 (positiv): Je mehr vorhanden, desto<br />
stärker die <strong>Nukleation</strong>;<br />
- dem Sättigungsverhältnis S (positiv): Je höher S, desto höher der<br />
Kondensationsfluss.<br />
�<br />
�
Homogene <strong>Nukleation</strong><br />
Wasserdampf nukleiert homogen ab kritischen Sättigungsverhältnissen von > 3.3.<br />
Schwefelsäure
J<br />
J<br />
Kinetischer <strong>und</strong> thermodynamischer Ansatz<br />
Für eine kinetische 1-Komponenten-Stoßtheorie allein wird die klassische<br />
<strong>Nukleation</strong>srate zur (Seinfeld <strong>und</strong> Pandis, 2007):<br />
klass.,<br />
kinet.<br />
�<br />
3 �k T � �ln S�<br />
Thermodynamisch ergab sich nach Friedlander (2000) (währendes Gleichgewicht):<br />
klass.,<br />
thermod.<br />
2�<br />
� m<br />
�<br />
� 2�<br />
��<br />
N<br />
2<br />
1<br />
v<br />
S<br />
p<br />
1<br />
2�<br />
mk<br />
Molekül<br />
B<br />
3 � 16��<br />
v<br />
exp �<br />
�<br />
�<br />
� 3 B<br />
�<br />
�N1v<br />
T ��<br />
2/<br />
3<br />
Molekül<br />
�v<br />
k<br />
2<br />
Molekül<br />
2<br />
2/<br />
3<br />
Molekül<br />
B<br />
T<br />
�<br />
�<br />
�<br />
�<br />
3 � 16��<br />
v<br />
exp �<br />
�<br />
�<br />
� 3 B<br />
2<br />
Molekül<br />
�<br />
� � � � ��<br />
3 2<br />
k T ln S<br />
�
Homogene <strong>Nukleation</strong> von Wasserdampf<br />
bei T = 298.15 K (25 °C)<br />
Beide Beschreibungen weichen um ca. 1.4% voneinander ab. De facto vernachlässigbar.
Literatur<br />
• J. Aitken (1923): Collected Scientific Papers 1880-1916. Cambridge University<br />
Press, Cambridge, England.<br />
• Friedlander, S.K. (2000): Smoke, dust and haze: F<strong>und</strong>amentals of aerosol<br />
dynamics. Oxford Univ. Press, Oxford.<br />
• Seinfeld, J.H. <strong>und</strong> S.N. Pandis (2007): Atmospheric chemistry and physics:<br />
From Air pollution to climate change. Wiley Intercience, New York.<br />
• J. G. Wilson (1938): Production of secondary electrons by cosmic ray particles.<br />
Nature, 142, 73ff.