Substitution von molekularen Klammern an den Naphthalin ...
Substitution von molekularen Klammern an den Naphthalin ... Substitution von molekularen Klammern an den Naphthalin ...
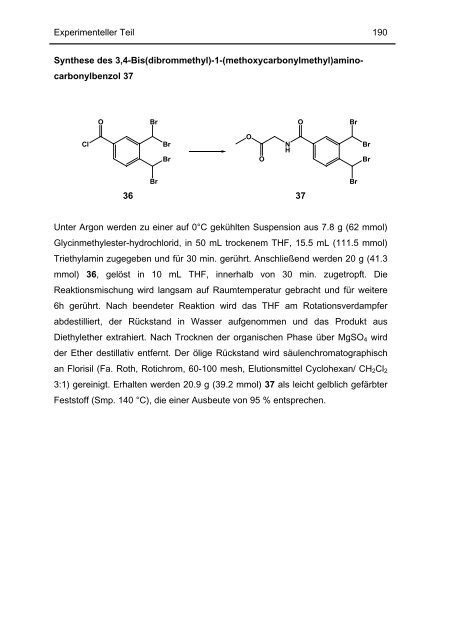
Experimenteller Teil Synthese des 3,4-Bis(dibrommethyl)-1-(methoxycarbonylmethyl)amino- carbonylbenzol 37 Cl O Br Br Br Br 36 37 Unter Argon werden zu einer auf 0°C gekühlten Suspension aus 7.8 g (62 mmol) Glycinmethylester-hydrochlorid, in 50 mL trockenem THF, 15.5 mL (111.5 mmol) Triethylamin zugegeben und für 30 min. gerührt. Anschließend werden 20 g (41.3 mmol) 36, gelöst in 10 mL THF, innerhalb von 30 min. zugetropft. Die Reaktionsmischung wird langsam auf Raumtemperatur gebracht und für weitere 6h gerührt. Nach beendeter Reaktion wird das THF am Rotationsverdampfer abdestilliert, der Rückstand in Wasser aufgenommen und das Produkt aus Diethylether extrahiert. Nach Trocknen der organischen Phase über MgSO4 wird der Ether destillativ entfernt. Der ölige Rückstand wird säulenchromatographisch an Florisil (Fa. Roth, Rotichrom, 60-100 mesh, Elutionsmittel Cyclohexan/ CH2Cl2 3:1) gereinigt. Erhalten werden 20.9 g (39.2 mmol) 37 als leicht gelblich gefärbter Feststoff (Smp. 140 °C), die einer Ausbeute von 95 % entsprechen. O O N H O Br Br Br Br 190
Experimenteller Teil 8.1 8.0 8.0 7.9 7.0 7.8 13 7.7 6.0 O 12 O 5.0 11 4.28 N H 10 O 9 1 H-NMR (500 MHz, CDCl3): δ [ppm] = 3.83 (s, 3H, 13-H), 4.27 (d, 2H, 11-H), 6.66 (t, 1H, 10-H), 7.05 (s, 1H, 7-H/ 8-H), 7.19 (s, 1H, 7-H/ 8-H), 7.78 (dd, 1H, 6-H), 8.06 (d, 1H, 5-H). 13 C-NMR (126 MHz, CDCl3): δ [ppm] = 35.39 (d, C-7/ C-8), 35.63 (d, C-7/ C-8), 41.97 (t, C-10), 52.61 (q, C-13), 128.84 (d, C-2, C-6, C-5), 135.24 (s, C-3, C-4), 165.49 (s, C-12), 170.37 (s, C-9). Eine genauere Zuordnung der 13 C-Signale ist aufgrund des Auftretens der syn- und anti-Konformation der Wasserstoffatome 7-H und 8-H bei Raumtemperatur nicht möglich. 4.24 4.0 1 6 2 5 3.0 3 4 Br 7 8 Br Br Br 2.0 1.0 191 0.0
- Seite 149 und 150: Durchführung dass der in Methanol
- Seite 151 und 152: Durchführung 58k MEP: an der Napht
- Seite 153 und 154: Durchführung a) b) ΔErel [kcal mo
- Seite 155 und 156: Durchführung 84@ 58b Vorderansicht
- Seite 157 und 158: Durchführung Tabelle 2.2.6-1: Unte
- Seite 159 und 160: Durchführung In einer Kooperation
- Seite 161 und 162: Durchführung 2.3 Wasserlösliche m
- Seite 163 und 164: Durchführung Zur Darstellung eines
- Seite 165 und 166: Durchführung Tabelle 2.3.2-4 gibt
- Seite 167 und 168: Durchführung Tabelle 2.3.2-3: - OO
- Seite 169 und 170: Durchführung 2.3.2.1 Diskussion de
- Seite 171 und 172: Durchführung In den NMNA-Komplexen
- Seite 173 und 174: Durchführung 2.3 3.3 1.8 3.4 2.6 6
- Seite 175 und 176: Durchführung Durch die Monte-Carlo
- Seite 177 und 178: Durchführung der Komplexe in Wasse
- Seite 179 und 180: Durchführung Danach zeigt sich, da
- Seite 181 und 182: Zusammenfassung und Ausblick Die f
- Seite 183 und 184: Zusammenfassung und Ausblick 3.1.2
- Seite 185 und 186: Zusammenfassung und Ausblick 3.2 Re
- Seite 187 und 188: Zusammenfassung und Ausblick Bei de
- Seite 189 und 190: Zusammenfassung und Ausblick 81@95
- Seite 191 und 192: Experimenteller Teil 4 Experimentel
- Seite 193 und 194: Experimenteller Teil Für die Isoli
- Seite 195 und 196: Experimenteller Teil 13 C-NMR (126
- Seite 197 und 198: Experimenteller Teil Synthese von 3
- Seite 199: Experimenteller Teil 9.0 8.5 8.0 7.
- Seite 203 und 204: Experimenteller Teil 10.0 8.24 8.22
- Seite 205 und 206: Experimenteller Teil 11 12 10 13 9
- Seite 207 und 208: Experimenteller Teil Synthese von N
- Seite 209 und 210: Experimenteller Teil 10 9 H 3COCHN
- Seite 211 und 212: Experimenteller Teil 1 H-NMR (500 M
- Seite 213 und 214: Experimenteller Teil 4.2.3 Synthese
- Seite 215 und 216: Experimenteller Teil 13 C-NMR (126
- Seite 217 und 218: Experimenteller Teil Synthese von r
- Seite 219 und 220: Experimenteller Teil 13 C-NMR (126
- Seite 221 und 222: Experimenteller Teil Synthese von r
- Seite 223 und 224: Experimenteller Teil 13 C-NMR (126
- Seite 225 und 226: Experimenteller Teil Erhalten werde
- Seite 227 und 228: Experimenteller Teil 13 C-NMR (126
- Seite 229 und 230: Experimenteller Teil Synthese von r
- Seite 231 und 232: Experimenteller Teil 13 C-NMR (126
- Seite 233 und 234: Experimenteller Teil Synthese von r
- Seite 235 und 236: Experimenteller Teil 13 C-NMR (126
- Seite 237 und 238: Experimenteller Teil 2.) Zu einer L
- Seite 239 und 240: Experimenteller Teil 24 H2N O 23 2
- Seite 241 und 242: Experimenteller Teil 26 H2N O 23 2
- Seite 243 und 244: Experimenteller Teil IR (KBr): ν ~
- Seite 245 und 246: Experimenteller Teil 7.65 7.60 7.55
- Seite 247 und 248: Experimenteller Teil 24 HOH2C 25 2
- Seite 249 und 250: Experimenteller Teil 9.0 7.60 8.54
Experimenteller Teil<br />
Synthese des 3,4-Bis(dibrommethyl)-1-(methoxycarbonylmethyl)amino-<br />
carbonylbenzol 37<br />
Cl<br />
O<br />
Br<br />
Br<br />
Br<br />
Br<br />
36 37<br />
Unter Argon wer<strong>den</strong> zu einer auf 0°C gekühlten Suspension aus 7.8 g (62 mmol)<br />
Glycinmethylester-hydrochlorid, in 50 mL trockenem THF, 15.5 mL (111.5 mmol)<br />
Triethylamin zugegeben und für 30 min. gerührt. Anschließend wer<strong>den</strong> 20 g (41.3<br />
mmol) 36, gelöst in 10 mL THF, innerhalb <strong>von</strong> 30 min. zugetropft. Die<br />
Reaktionsmischung wird l<strong>an</strong>gsam auf Raumtemperatur gebracht und für weitere<br />
6h gerührt. Nach beendeter Reaktion wird das THF am Rotationsverdampfer<br />
abdestilliert, der Rückst<strong>an</strong>d in Wasser aufgenommen und das Produkt aus<br />
Diethylether extrahiert. Nach Trocknen der org<strong>an</strong>ischen Phase über MgSO4 wird<br />
der Ether destillativ entfernt. Der ölige Rückst<strong>an</strong>d wird säulenchromatographisch<br />
<strong>an</strong> Florisil (Fa. Roth, Rotichrom, 60-100 mesh, Elutionsmittel Cyclohex<strong>an</strong>/ CH2Cl2<br />
3:1) gereinigt. Erhalten wer<strong>den</strong> 20.9 g (39.2 mmol) 37 als leicht gelblich gefärbter<br />
Feststoff (Smp. 140 °C), die einer Ausbeute <strong>von</strong> 95 % entsprechen.<br />
O<br />
O<br />
N<br />
H<br />
O<br />
Br<br />
Br<br />
Br<br />
Br<br />
190