Kardiogener Schock nach bradykardisierender Therapie
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Kasuistiken<br />
Med Klin Intensivmed Notfmed 2016 · 111:458–462<br />
DOI 10.1007/s00063-015-0089-9<br />
Eingegangen: 1. Juni 2015<br />
Überarbeitet: 23. Juli 2015<br />
Angenommen: 31. August 2015<br />
Online publiziert: 6. Oktober 2015<br />
© Springer-Verlag Berlin Heidelberg 2015<br />
Redaktion<br />
R. Riessen, Tübingen<br />
H. Fey 1 · M. Jost 1 · A.T. Geise 1 · T. Bertsch 2 · M. Christ 1<br />
1<br />
Universitätsklinik für Notfall- und Internistische Intensivmedizin, Paracelsus Medizinische Privatuniversität,<br />
Nürnberg, Klinikum Nürnberg, Nürnberg, Deutschland<br />
2<br />
Institut für Klinische Chemie, Laboratoriumsmedizin und Transfusionsmedizin – Zentrallaboratorium,<br />
Paracelsus Medizinische Privatuniversität, Nürnberg, Nürnberg, Deutschland<br />
<strong>Kardiogener</strong> <strong>Schock</strong> <strong>nach</strong><br />
<strong>bradykardisierender</strong> <strong>Therapie</strong> bei<br />
tachykardem Vorhofflimmern<br />
Fallvorstellung einer 89-jährigen Patientin<br />
Anamnese<br />
Eine 89-jährige Patientin wird im Januar<br />
2015 in einer externen Klinik wegen Erysipel<br />
stationär aufgenommen. Zusätzlich<br />
liegt eine chronische Stauungsdermatitis<br />
bei bekannter Herzinsuffizienz mit erhaltener<br />
linksventrikulärer (LV-)Ejektionfraktion<br />
bei hypertensiver Herzerkrankung<br />
vor. Anamnestisch wird eine koronare<br />
Herzkrankheit angegeben, ein Myokardinfarkt<br />
in der Vergangenheit aber verneint.<br />
An kardiovaskulären Risikofaktoren<br />
liegen neben einer arteriellen Hypertonie<br />
eine ausgeprägte Adipositas und<br />
eine Hyperlipoproteinämie vor. Die Patientin<br />
hat wegen der bekannten arteriellen<br />
Hypertonie eine Vormedikation mit<br />
Carvedilol (2-mal 12,5 mg pro Tag). Ferner<br />
erhält sie:<br />
55Simvastatin (eimal 40 mg),<br />
55Torasemid (2-mal 10 mg),<br />
55Eisen(II)-glycin-sulfat (einmal<br />
60 mg),<br />
55Cefuroxim (3-mal 1,5 g),<br />
55Dalteparin (2-mal 5000 I.E).<br />
Während des stationären Aufenthalts tritt<br />
bei zum Aufnahmezeitpunkt <strong>nach</strong>gewiesenem<br />
Sinusrhythmus paroxysmales Vorhofflimmern<br />
mit tachykarder Überleitung<br />
auf. Der hinzugezogene internistische<br />
Konsiliararzt empfiehlt zur weiteren<br />
Frequenzkontrolle eine zusätzliche <strong>Therapie</strong><br />
mit Verapamil (3-mal 80 mg pro<br />
Tag). Am Folgetag wird die Patientin wegen<br />
der Leitsymptome akute Herzinsuffizienz<br />
und zunehmende Vigilanzstörung<br />
mit der Arbeitsdiagnose akute Herzinsuffizienz<br />
der internistischen Intensivstation<br />
zugewiesen.<br />
Befunde<br />
Klinischer Untersuchungsbefund<br />
Die 89-jährige Patientin präsentiert sich<br />
zum Zeitpunkt der Übernahme auf die<br />
internistische Intensivstation mit schwerer<br />
respiratorischer Insuffizienz (Atemfrequenz<br />
40/min) und einer quantitativen<br />
Vigilanzminderung (Glasgow Coma<br />
Scale 11). Die Haut ist blass, die Extremitäten<br />
kalt. Über der Lunge ist ein vesikuläres<br />
Atemgeräusch ohne Nebengeräusche<br />
auszukultieren. Die Herztöne sind rein,<br />
die Herzfrequenz liegt bei 54/min. Der<br />
Blutdruck ist zum Aufnahmezeitpunkt<br />
80/50 mmHg, pulsoxymetrisch ist keine<br />
suffiziente Messung möglich. Der Body-Mass-Index<br />
beträgt 40 kg/m 2 bei einer<br />
Körpergröße von 160 cm.<br />
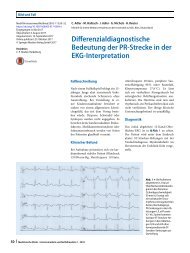
Elektrokardiographie<br />
Vorhofflimmern, Steiltyp, Herzfrequenz<br />
54/min, regelrechte R-Progression, keine<br />
spezifischen Erregungsrückbildungsstörungen<br />
(s. . Abb. 1).<br />
Laborchemische Untersuchungen<br />
zum Aufnahmezeitpunkt<br />
Venöse Blutgasanalyse<br />
pH-Wert 7,2; pCO 2 49 mmHg; pO 2<br />
19,5 mmHg; S v O 2 17,7 %; Laktat 8,5 mmol/l<br />
(Normbereich 0,5–2,2 mmol/l); HCO 3<br />
-<br />
18,1 mmol/l.<br />
Blutbild und klinische Chemie<br />
Hämoglobin 5,28 mmol/l (Normbereich<br />
7,45–9,93 mmol/l), Leukozyten 11,7/nl<br />
(Normbereich 4,0–10,0/nl), C-reaktives<br />
Protein 60 mg/l (Normbereich < 5 mg/l),<br />
Kreatinin 135,3 µmol/l (Normbereich<br />
44,2–79,6 µmol/l), Harnstoff 11,8 mmol/l<br />
(Normbereich 2,8–8,1 mg/dl), Troponin-T<br />
hochsensitiv 50 ng/l (Normbereich<br />
< 14 ng/l), NT-pro-BNP 8765 pg/ml<br />
(Grenzwert für akute Herzinsuffizienz bei<br />
über 75 Jahren: > 1800 pg/ml). Die weiteren<br />
Parameter des internistischen Aufnahmelabors<br />
sind im Normbereich.<br />
Fokussierte Echokardiographie<br />
(FoCUS)<br />
Schwergradig reduzierte Pumpfunktion<br />
(„ejection fraction“, EF: 15 %) des dilatierten<br />
linken Ventrikels („left ventricular end<br />
diastolic diameter“, LVEDD: 60 mm). Keine<br />
regionalen Wandbewegungsstörungen,<br />
globale Hypokinesie. Aorten- und<br />
Mitralklappe ohne relevantes Vitium.<br />
Rechter Ventrikel dilatiert („right ventricular<br />
end diastolic diameter“, RVEDD:<br />
52 mm), Pumpfunktion deutlich einge-<br />
458 | Medizinische Klinik - Intensivmedizin und Notfallmedizin 5 · 2016
Abb. 1 8 Elektrokardiogramm zum Übernahmezeitpunkt auf die internisitische Intensivstation<br />
schränkt („tricuspid annular plane systolic<br />
excursion“, TAPSE: 9 mm). Vena cava<br />
inferior 2,2 cm, unzureichend atemmoduliert.<br />
Kein Perikarderguss.<br />
Verdachtsdiagnose<br />
<strong>Kardiogener</strong> <strong>Schock</strong> unklarer Genese<br />
55Differenzialdiagnose:<br />
zzAkuter Myokardinfarkt<br />
zzAkute Lungenembolie<br />
zzMyokarditis<br />
zzTako-Tsubo-Kardiomyopathie<br />
zzmedikamentös<br />
<strong>Therapie</strong> und Verlauf<br />
Abb. 2 8 Wirkungsmechanismen von β-Blockern und Kalziumantagonisten sowie diverser Antidote<br />
am Kardiomyozyten. AC Adenylatcyclase, Ca 2+ Kalziumion, cAMP Adenosinmonophosphat, Ca v L spannungsabhängier<br />
L-Typ-Kalziumkanal, G G-Protein, PKA Proteinkinase A, RyR Ryanodinrezeptor. (Adaptiert<br />
<strong>nach</strong> [13])<br />
Es erfolgt unter der Arbeitsdiagnose eines<br />
kardiogenen <strong>Schock</strong>s unverzüglich die<br />
hämodynamische Unterstützung mittels<br />
Katecholaminen (Dobutamin und Noradrenalin).<br />
Ferner wurde vor Durchführung<br />
der Echokardiographie wegen der<br />
nicht auszuschließenden Möglichkeit des<br />
Vorliegens einer akuten Lungenarterienembolie<br />
oder eines akuten Koronarsyndroms<br />
unfraktioniertes Heparin körpergewichtsadjustiert<br />
verabreicht (60 I.E./<br />
kgKG).<br />
Bei fehlender Stabilisierung der Hämodynamik<br />
wird die Dosis der Katechol-<br />
Medizinische Klinik - Intensivmedizin und Notfallmedizin 5 · 2016 |<br />
459
Zusammenfassung · Abstract<br />
amine rasch gesteigert, sodass Dobutamin<br />
sehr bald in einer Dosierung von 20 µg/h<br />
und Noradrenalin in einer Dosierung<br />
von 10 mg/h verabreicht werden mussten.<br />
Die Intubation wird zeitgleich vorbereitet.<br />
Trotz der hochdosierten Gabe von<br />
Katecholaminen sinkt der Blutdruck systolisch<br />
auf 50 mmHg. Bei sich weiter verschlechternder<br />
Vigilanz wird die Patientin<br />
endotracheal intubiert und druckkontrolliert<br />
beatmet. Die Beatmung gestaltet<br />
sich unproblematisch (initialer Horowitz-<br />
Index: 305).<br />
Unter dem klinischen Verdacht auf<br />
einen Kausalzusammenhang der gleichzeitigen<br />
Verabreichung des Kalziumantagonisten<br />
Verapamil und des β-Blockers<br />
Carvedilol wird intravenös hochdosiert<br />
Glukagon (initial 5 mg als Bolus und anschließend<br />
5 mg/h) verabreicht. In der<br />
Folge verbessert sich sukzessiv die hämodynamische<br />
Situation. Die Dosierung der<br />
Katecholamine kann rasch deutlich reduziert<br />
werden und die Patientin 2 Tage später<br />
katecholaminfrei problemlos extubiert<br />
werden.<br />
Unter Pausierung der negativ chronotropen<br />
Medikation kommt es zu Vorhofflattern<br />
mit 2:1-Überleitung (Kammerfrequenz<br />
etwa 140/min). Nach Ausschluss intrakardialer<br />
Thromben mittels transösophagealer<br />
Echokardiographie wird die<br />
Patientin erfolgreich in den Sinusrhythmus<br />
kardiovertiert (50 J biphasisch). In<br />
der transthorakalen Echokardiographiekontrolle<br />
zeigt sich nun eine gute linksventrikuläre<br />
Pumpfunktion (EF: 60 %)<br />
mit normal dimensionierten Herzhöhlen<br />
und mäßiger linksventrikulärer Hypertrophie<br />
(„interventricular septal thickness at<br />
diastole“, IVSD: 14 mm) bei diastolischer<br />
Funktionsstörung. Am 4. Tag wird die<br />
nun zu allen Qualitäten orientierte Patientin<br />
in kardiopulmonal stabilem Zustand<br />
auf Normalstation verlegt und wenige Tage<br />
später in die ambulante Weiterbetreuung<br />
entlassen.<br />
Diagnose<br />
<strong>Kardiogener</strong> <strong>Schock</strong> unter simultaner<br />
medikamentöser <strong>Therapie</strong> mit Verapamil<br />
und Carvedilol.<br />
Med Klin Intensivmed Notfmed 2016 · 111:458–462<br />
© Springer-Verlag Berlin Heidelberg 2015<br />
H. Fey · M. Jost · A.T. Geise · T. Bertsch · M. Christ<br />
<strong>Kardiogener</strong> <strong>Schock</strong> <strong>nach</strong> <strong>bradykardisierender</strong><br />
<strong>Therapie</strong> bei tachykardem Vorhofflimmern.<br />
Fallvorstellung einer 89-jährigen Patientin<br />
Zusammenfassung<br />
Zur bradykardisierenden <strong>Therapie</strong> sind β-<br />
Blocker und Kalziumantagonisten häufig eingesetzte<br />
Medikamente bei tachykardem Vorhofflimmern.<br />
Abhängig von der Vulnerabilität<br />
des Myokards kann die isolierte Gabe von<br />
β-Blockern oder Kalziumantagonisten vom<br />
Nicht-Dihydropyridin-Typ (Verapamil oder<br />
Diltiazem), aber insbesondere die gleichzeitige<br />
Verabreichung der Substanzen zu einem<br />
medikamentös induzierten kardiogenen<br />
<strong>Schock</strong> führen. Die Komedikation von β-Blocker<br />
und Kalziumanatagonist vom Nicht-Dihydropyridin-Typ<br />
ist absolut kontraindiziert.<br />
Bei Vorliegen einer akuten Herzinsuffizienz<br />
Diskussion<br />
DOI 10.1007/s00063-015-0089-9<br />
ist auch die Verabreichung von Einzelsubstanzen<br />
kontraindiziert. Als <strong>Therapie</strong>ansatz für<br />
einen durch β-Blocker oder Nicht-Dihydropyridine<br />
induzierten kardiogenen <strong>Schock</strong> wird,<br />
neben der Gabe von Kalzium und Glukagon,<br />
insbesondere die frühzeitige Verabreichung<br />
von hochdosiertem Insulin empfohlen.<br />
Schlüsselwörter<br />
Tachykardie · Adrenerge β-Blocker ·<br />
Kalziumantagonisten · Kardiale<br />
Rhythmusstörung · Glukagon<br />
Cardiogenic shock after drug therapy for atrial fibrillation<br />
with tachycardia. Case report of an 89-year-old woman<br />
Abstract<br />
β-Blockers and calcium channel blockers are<br />
commonly used drugs in the treatment of<br />
atrial fibrillation with tachycardia. However, in<br />
patients with high myocardial susceptibility<br />
and vulnerability, combination therapy with<br />
β-blockers and non-dihydropyridine calcium<br />
channel blockers (verapamil or diltiazem)<br />
but also individual administration can cause<br />
drug-induced cardiogenic shock. Thus, the simultaneous<br />
administration of β-blockers and<br />
non-dihydropyridine calcium channel blockers<br />
is absolutely contraindicated. In case of<br />
acute heart failure, isolated application is also<br />
contraindicated. In the treatment of a cardiogenic<br />
shock induced by β-blockers and/<br />
or non-dihydropyridine calcium channel<br />
blockers, administration of intravenous calcium,<br />
glucagon or high-dose insulin is recommended.<br />
Keywords<br />
Tachycardia · Beta-blockers, adrenergic ·<br />
Calcium channel blockers · Cardiac<br />
dysrhythmia · Glucagon<br />
Die endgültige Diagnose „kardiogener<br />
<strong>Schock</strong> unter simultaner medikamentöser<br />
<strong>Therapie</strong> mit Verapamil und Carvedilol“<br />
lässt sich erst aus der Post-hoc-Sicht sicher<br />
stellen. Die schnelle Erholung der myokardialen<br />
Pumpfunktion, das Vorliegen<br />
eines normalen EKG, eine nur geringfügige<br />
Erhöhung des Troponin-T-Werts ohne<br />
dynamische Veränderung, das echokardiographische<br />
Bild mit schwerer biventrikulär<br />
reduzierter Pumpfunktion ohne regionale<br />
Wandbewegungsstörungen und<br />
die gute Oxygenierbarkeit ermöglichen,<br />
wichtige Differenzialdiagnosen, wie akuter<br />
Myokardinfarkt, akute Lungenarterienembolie,<br />
Myokarditis oder Tako-tsubo-Kardiomyopathie<br />
auszuschließen.<br />
Ein kardiales Pumpversagen unter der<br />
Doppelblockade mit Kalziumantagonist<br />
und β-Blocker, insbesondere auch <strong>nach</strong><br />
oraler Applikation, wird in der Literatur<br />
als seltenes Ereignis immer wieder beschrieben<br />
[1–10]. Weitläufig bekannt ist,<br />
dass die Simultantherapie mit normalen<br />
Dosierungen zu bradykarden Herzrhythmusstörungen<br />
führen kann. Es werden<br />
jedoch immer wieder Fälle eines kardiogenen<br />
<strong>Schock</strong>s berichtet, obwohl die Patienten<br />
über einen Herzschrittmacher vor<br />
Bradykardien geschützt waren [7, 8]. Ursächlich<br />
hierfür ist die ausgeprägte negativ<br />
inotrope Wirkung. Auch im vorliegenden<br />
Fall hätte eine Herzfrequenz von 54/<br />
460 | Medizinische Klinik - Intensivmedizin und Notfallmedizin 5 · 2016
Tab. 1 Dosierungen, Nebenwirkungen und Kontraindikationen diverser Antidote bei kardiogenem <strong>Schock</strong> unter Simultantherapie mit<br />
β-Blockern und Kalziumantagonisten [13]<br />
Antidot Dosierung Unerwünschte Arzneimittelwirkung<br />
Kontraindikation<br />
Kalzium<br />
Glukagon<br />
Nekrosen bei Extravasat<br />
Nausea Vigilanzstörung Herzrhythmusstörung<br />
Hochdosis-Insulin-Euglykämie-<strong>Therapie</strong><br />
(HIE)<br />
Initialbolus: 6,5–12,5 mmol Ca 2+ i.v. (≙ 30–60 ml Kalziumglukonat<br />
10 % oder 10–20 ml CaCl 2 10 %) kontinuierlich:<br />
0,25 mmol/kg/h Ca 2 + i.v. (≙ 0,6–1,2 ml/kg/h Kalziumglukonat<br />
10 % oder 0,2–0,4 ml/kg/h CaCl 2 10 %)<br />
Initialbolus: 3–5 mg langsam i.v. + ggf. Wiederholung mit<br />
4–10 mg i.v. kontinuierlich: 2–10 mg/h (cave: Tachyphylaxie)<br />
Initialbolus: 1 I.E./kgKG Normalinsulin i.v. + 0,5 g/kg Glukose<br />
i.v. (wenn Blutzucker nicht > 16,7 mmol/l) kontinuierlich:<br />
0,5–1 I.E./kgKG/h Normalinsulin i.v. (+ ggf. schrittweise<br />
steigern <strong>nach</strong> je 30 min bis maximal 10 I.E./kgKG/h) + 0,5 g/<br />
kgKG/h Glukose i.v. (Monitoring alle 30 min, Zielblutzucker:<br />
5,6–13,9 mmol/l)<br />
Übelkeit, Erbrechen Diarrhö<br />
Hyperglykämie<br />
Hypokaliämie Hypoglykämie<br />
Digitalisintoxikation<br />
Phäochromozytom<br />
Schwere Hypoglykämie,<br />
schwere Hyperglykämie,<br />
schwere Hypokaliämie<br />
min bei ansonsten guter linksventrikulärer<br />
Pumpfunktion allein wohl kaum zu<br />
diesem klinisch eindrucksvollen kardiogenen<br />
<strong>Schock</strong> geführt.<br />
Die Einschränkung der myokardialen<br />
Kontraktilität durch die Kombinationstherapie<br />
von Kalziumantagonist und β-<br />
Blocker lässt sich pharmakodynamisch<br />
gut auf zellulärer Ebene erklären [11, 12].<br />
Nicht-Dihydropyridine (Verapamil, Diltiazem)<br />
blockieren die L-Typ-Kalziumkanäle<br />
an den Kardiomyozyten in relevantem<br />
Ausmaß. Dadurch wird der aktionspotenzialabhängige<br />
intrazelluläre Kalziumeinstrom<br />
vermindert, der über die<br />
Aktivierung des Ryanodinrezeptors der<br />
Initialzünder für die Freisetzung von intrazellulärem<br />
Kalzium aus dem sarkoplasmatischen<br />
Retikulum ist. Diese intrazelluläre<br />
Kalziumfreisetzung stellt zusammen<br />
mit der Bindung an Troponin-C einen<br />
essenziellen Mechanismus für Wechselwirkung<br />
zwischen Aktin und Myosin dar<br />
und ist Voraussetzung für die myokardiale<br />
Kontraktion. β-Blocker antagonisieren die<br />
Stimulation der β-1-Adrenozeptoren an<br />
den Kardiomyozyten. Dadurch kommt es<br />
zu einer verminderten Aktivierung der G-<br />
Protein-gekoppelten Adenylatcyclase und<br />
somit zu einem Absinken der intrazellulären<br />
Konzentration von zyklischem Adenosinmonophosphat<br />
(cAMP). Dies wiederum<br />
führt zu einer verminderten Aktivierung<br />
der Proteinkinase A (PKA), die<br />
über die Phosphorylierung intrazellulärer<br />
Schlüsselproteine ebenfalls entscheidenden<br />
Einfluss auf die intrazelluläre Kalziumkonzentration<br />
hat. So werden durch<br />
die PKA zum einen die membranständigen<br />
L-Typ-Kalziumkanäle phosphoryliert,<br />
was den Kalziumeinstrom steigert,<br />
und zum anderen Phospholamban, was<br />
eine vermehrte Aufnahme von Kalzium<br />
in das sarkoplasmatische Retikulum bewirkt.<br />
β-Blocker hemmen diese Prozesse<br />
und führen damit ebenfalls zu einer Verminderung<br />
der intrazellulären Kalziumkonzentration.<br />
Somit potenzieren sich die<br />
Wirkungen von β-Blockern und Kalziumantagonisten<br />
in Bezug auf die intrazelluläre<br />
Kalziumhomöostase und somit u. a.<br />
auch die Kontraktilität (. Abb. 2).<br />
Die Suszeptibilität für Nebenwirkungen<br />
durch β-Blocker und Kalziumantagonisten<br />
weist erhebliche interindividuelle<br />
Unterschiede auf. Ältere Menschen<br />
und Patienten mit ischämischer Herzerkrankung<br />
oder vorbestehender myokardialer<br />
Vulnerabilität sind empfänglicher<br />
für unerwünschte Arzneimittelwirkungen<br />
durch diese Substanzgruppen [13].<br />
Die therapeutischen Möglichkeiten bei<br />
kardiogenem <strong>Schock</strong> infolge einer Simultantherapie<br />
mit Kalziumantagonist und<br />
β-Blocker gleichen im Grunde denen für<br />
den Fall einer Intoxikation mit diesen<br />
Substanzen. Neben den rein an der Symptomatik<br />
orientierten allgemeinen intensivmedizinischen<br />
Maßnahmen (z. B. vorsichtige<br />
Volumengabe, Atropin, Katecholamine,<br />
die oftmals in ihrer Wirkung unzureichend<br />
sind), kommen verschiedene,<br />
z. T. experimentelle therapeutische Ansatzpunkte<br />
infrage (. Tab. 1; [14]).<br />
Ein einfacher und pathophysiologisch<br />
plausibler Ansatz hinsichtlich der Kalziumantagonistenwirkung<br />
ist die systemische<br />
Gabe von Kalzium. Hierdurch<br />
kommt es zu einer Vergrößerung des Gradienten<br />
der Kalziumkonzentration zwischen<br />
extra- und intrazellulärem Kompartiment,<br />
was den Kalziumeinstrom verstärkt.<br />
Es gibt zahlreiche Publikationen,<br />
die von einer positiven Wirkung der Kalziumgabe<br />
auf die Hämodynamik berichten<br />
[2, 6, 8, 10]. Zudem ist Kalzium schnell<br />
und insbesondere auch im Rettungsdienst<br />
verfügbar. Jedoch ist die Wirkung zeitlich<br />
begrenzt. Die Applikation muss repetitiv<br />
oder kontinuierlich erfolgen (Initialbolus:<br />
6,5–12,5 mmol Ca 2+ , kontinuierlich:<br />
0,25 mmol/kgKG/h Ca 2+ ).<br />
Eine weitere therapeutische Möglichkeit<br />
besteht in der hochdosierten Gabe<br />
von Glukagon. Hierdurch kommt es insbesondere<br />
zur Umgehung der β-Blockade<br />
durch β-Blocker-unabhängige Aktivierung<br />
der Adenylatcyclase über das G-<br />
Protein [15]. Dies bewirkt einen positiv inotropen<br />
und chronotropen Effekt. Die klinische<br />
Evidenz der positiven Effekte einer<br />
Glukagontherapie bei Überdosierungen<br />
mit β-Blockern oder Kalziumantagonisten<br />
ist sehr limitiert und vornehmlich auf<br />
tierexperimentelle Studien beschränkt<br />
[16]. Insofern gibt es auch keine exakte<br />
Kenntnis über die erforderlichen Dosierungen.<br />
Glukagon muss jedoch deutlich<br />
höher dosiert werden als bei der Indikation<br />
Hypoglykämie bei Diabetes mellitus.<br />
Da die Halbwertszeit von Glukagon mit<br />
3–6 min im Blut sehr kurz ist, sollte sich<br />
eine kontinuierliche Gabe <strong>nach</strong> Initialbolus<br />
anschließen [17].<br />
Hochinteressant ist der klinisch-experimentelle<br />
<strong>Therapie</strong>ansatz einer Hochdosisinsulintherapie<br />
(Hochdosis-Insulin-<br />
Euglykämie-<strong>Therapie</strong>, HIE). Kalziumantagonisten<br />
inhibieren zum einen die Insulinfreisetzung<br />
aus den Inselzellen des<br />
Medizinische Klinik - Intensivmedizin und Notfallmedizin 5 · 2016 |<br />
461
Kasuistiken<br />
Pankreas und zum anderen die Phosphatidylinositol-3-Kinase(PI3K)-Kaskade,<br />
die den Einbau von Glukosetransportern<br />
(GLUT-1) in die Zellmembran befördert,<br />
aber auch die Aktivität der endothelialen<br />
NO-Synthetase steigert. Dies führt im Resultat<br />
zu einer verminderten Glukoseutilisation<br />
in den Kardiomyozten. In der Situation<br />
des kardiogenen <strong>Schock</strong>s ist Glukose<br />
das Hauptenergiesubstrat für Kardiomyozyten.<br />
Die HIE wirkt genau diesem<br />
entgegen und führt zu einem gesteigerten<br />
intrazellulären Glukosetransport,<br />
zu vermehrter Inotropie und Vasodilatation.<br />
Zu beachten ist bei dieser <strong>Therapie</strong>,<br />
dass der Effekt erst <strong>nach</strong> etwa 15–60 min<br />
zu erwarten ist. Die <strong>Therapie</strong> soll frühzeitig<br />
begonnen werden, da eine Anpassungen<br />
erst <strong>nach</strong> 30 min erfolgt [18].<br />
Keiner der genannten <strong>Therapie</strong>ansätze<br />
wird in tierexperimentellen und klinischen<br />
Daten als konsistent effektiv beschrieben.<br />
Daher empfiehlt es sich durchaus,<br />
die genannten Antidote bei unzureichendem<br />
<strong>Therapie</strong>ansprechen simultan<br />
im Sinne einer Stufentherapie zu verwenden<br />
[10].<br />
Gemäß Fachinformation ist die intravenöse<br />
Kombination Verapamil und<br />
β-Blocker kontraindiziert. Eine Ausnahme<br />
besteht für die intravenöse Applikation<br />
auf Intensivstation. Die Leitlinien<br />
bezüglich Vorhofflimmern von der European<br />
Society of Cardiology (ESC) sind<br />
bei diesem Thema unscharf formuliert.<br />
Hier wird lediglich erwähnt, dass zur Frequenzkontrolle<br />
bei Vorhofflimmern medikamentöse<br />
Kombinationstherapien (β-<br />
Blocker, Kalziumantagonisten, Digitalis,<br />
Amiodaron, Dronedaron) notwendig<br />
sein können. Dabei wird aber mit der<br />
Ausnahme, dass (β-Blocker und Digitalis<br />
möglicherweise günstig bei Herzinsuffizienz<br />
sind, auf die Kombinationen und<br />
eventuelle Kontraindikationen nicht eingegangen<br />
[19]. Etwas genauer sind in diesem<br />
Punkt die Leitlinien von der American<br />
Heart Association (AHA)/American<br />
College of Cardiology (ACC)/Heart<br />
Rhythm Society (HRS). Hier wird empfohlen<br />
β-Blocker oder Kalziumantagonisten<br />
(bei erhaltener linksventrikulärer<br />
Ejektionsfraktion) mit Digitalis und/oder<br />
Amiodaron zu kombinieren. Dronedaron<br />
wird hingegen nicht zur Frequenzkontrolle<br />
empfohlen [20].<br />
Fazit für die Praxis<br />
55Die simultane Gabe von β-Blockern<br />
und Kalziumantagonisten kann mit<br />
schweren, im Extremfall sogar tödlichen<br />
unerwünschten Wirkungen assoziiert<br />
sein. Sie ist deshalb kontraindiziert.<br />
Formal besteht die Zulassung<br />
für die intravenöse Applikation unter<br />
intensivstationärem Monitoring. Bei<br />
Vorliegen einer akuten Herzinsuffizienz<br />
ist auch die Gabe der Einzelsubstanzen<br />
zur Bradykardisierung bei<br />
Vorhofflimmern kritisch einzusetzen.<br />
55Für den Fall einer akzidentellen Koapplikation<br />
oder einer in suizidaler Absicht<br />
erfolgten Verabreichung von<br />
Kalziumantagonisten vom Nicht-Dihydropyridin-Typ<br />
(Verapamil, Diltiazem)<br />
und einem β-Blocker mit schweren<br />
<strong>nach</strong>folgenden Nebenwirkungen<br />
steht neben der Gabe von Kalzium<br />
und Glukagon in ausreichender Dosierung<br />
auch die hocheffektive „Hochdosis-Insulin-Euglykämie-<strong>Therapie</strong>“<br />
zur Verfügung.<br />
Korrespondenzadresse<br />
Dr. H. Fey<br />
Universitätsklinik für<br />
Notfall- und Internistische<br />
Intensivmedizin<br />
Paracelsus Medizinische<br />
Privatuniversität, Nürnberg,<br />
Klinikum Nürnberg<br />
Prof. Ernst Nathan Str. 1<br />
90419 Nürnberg<br />
aufnahme@<br />
klinikum-nuernberg.de<br />
Einhaltung ethischer Richtlinien<br />
Interessenkonflikt. H. Fey, T. Bertsch, A.T. Geise<br />
und M. Jost geben an, dass kein Interessenkonflikt<br />
besteht. M. Christ hat Vortragshonorare von Roche<br />
Diagnostics und Novartis Pharma GmbH erhalten.<br />
Dieser Beitrag beinhaltet keine Studien an Menschen<br />
oder Tieren.<br />
Literatur<br />
1. Wayne VS, Harper RW, Laufer E et al (1982) Adverse<br />
interaction between beta-adrenergic blocking<br />
drugs and verapamil: report of three cases. Aust N<br />
Z J Med 12(4):285–299<br />
2. Henry M, Kay MM, Viccellio P (1985) Cardiogenic<br />
shock associated with calcium-channel and beta<br />
blockers: reversal with intravenous calcium chloride.<br />
Am J Emerg Med 3(4):334–336<br />
3. Zatuchni J (1985) Bradycardia and hypotension<br />
after propranolol HCl and verapamil. Heart Lung<br />
14(1):94–95<br />
4. Lee TH, Salomon DR, Rayment CM et al (1986)<br />
Hypotension and sinus arrest with exercise-induced<br />
hyperkalemia and combined verapamil/propranolol<br />
therapy. Am J Med 80(6):1203–1204<br />
5. Misra M, Thakur R, Bhandari K (1987) Sinus arrest<br />
caused by atenolol-verapamil combination. Clin<br />
Cardiol 10(6):365–367<br />
6. Lee DW, Cohan B (1995) Refractory cardiogenic<br />
shock and complete heart block after verapamil SR<br />
and metoprolol treatment. A case report. Angiology<br />
46(6):517–519<br />
7. Waxman AB, White KP, Trawick DR (1997) Electromechanical<br />
dissociation following verapamil and<br />
propranolol ingestion: a physiologic profile. Cardiology<br />
88(5):478–481<br />
8. Sakurai H, Kei M, Matsubara K et al (2000) Cardiogenic<br />
shock triggered by verapamil and atenolol: a<br />
case report of therapeutic experience with intravenous<br />
calcium. Jpn Circ J 64(11):893–896<br />
9. Yorgun H, Deniz A, Aytemir K (2008) Cardiogenic<br />
shock secondary to combination of diltiazem and<br />
sotalol. Intern Med J 38(3):221–222<br />
10. Doepker B, Healy W, Cortez E et al (2014) High-dose<br />
insulin and intravenous lipid emulsion therapy<br />
for cardiogenic shock induced by intentional calcium-channel<br />
blocker and Beta-blocker overdose: a<br />
case series. J Emerg Med 46(4):486–490<br />
11. Sperelakis N, Wahler GM (1988) Regulation of Ca2<br />
+ influx in myocardial cells by beta adrenergic receptors,<br />
cyclic nucleotides, and phosphorylation.<br />
Mol Cell Biochem 82(1–2):19–28<br />
12. Katz AM (1992) Molecular basis of calcium channel<br />
blockade. Am J Cardiol 69(13):17E–22E<br />
13. Jang DH, DeRoss FJ (2014) Calcium channel blockers.<br />
In: Hoffman R, Howland MA, Neal L et<br />
al (Hrsg) Goldfrank’s toxicologic emergencies,<br />
10. Aufl. McGraw-Hill Professional, New York, USA,<br />
S 843–850<br />
14. Hruby K (2013) Antidote in der klinischen Toxikologie.<br />
Med Klin Intensivmed Notfmed 108(6):465–<br />
470<br />
15. Yagami T (1995) Differential coupling of glucagon<br />
and beta-adrenergic receptors with the small and<br />
large forms of the stimulatory G protein. Mol Pharmacol<br />
48(5):849–854<br />
16. Bailey B (2003) Glucagon in beta-blocker and calcium<br />
channel blocker overdoses: a systematic review.<br />
J Toxicol Clin Toxicol 41(5):595–602<br />
17. Marraffa JM, Cohen V, Howland MA (2012) Antidotes<br />
for toxicological emergencies: a practical review.<br />
Am J Health Syst Pharm 69(3):199–212<br />
18. Engebretsen KM, Kaczmarek KM, Morgan J et al<br />
(2011) High-dose insulin therapy in beta-blocker<br />
and calcium channel-blocker poisoning. Clin Toxicol<br />
(Phila) 49(4):277–283<br />
19. Camm AJ, Kirchhof P, Lip GY et al (2010) Guidelines<br />
for the management of atrial fibrillation: the Task<br />
Force for the Management of Atrial Fibrillation of<br />
the European Society of Cardiology (ESC). Eur Heart<br />
J 31(19):2369–2429<br />
20. January CT, Wann LS, Alpert JS et al (2014) 2014<br />
AHA/ACC/HRS guideline for the management<br />
of patients with atrial fibrillation: a report of the<br />
American College of Cardiology/American Heart<br />
Association Task Force on Practice Guidelines<br />
and the Heart Rhythm Society. J Am Coll Cardiol<br />
64(21):2246–2280<br />
462 | Medizinische Klinik - Intensivmedizin und Notfallmedizin 5 · 2016