Dissertation Klaus Heitkamp 1999
Dissertation Klaus Heitkamp 1999 Dissertation Klaus Heitkamp 1999
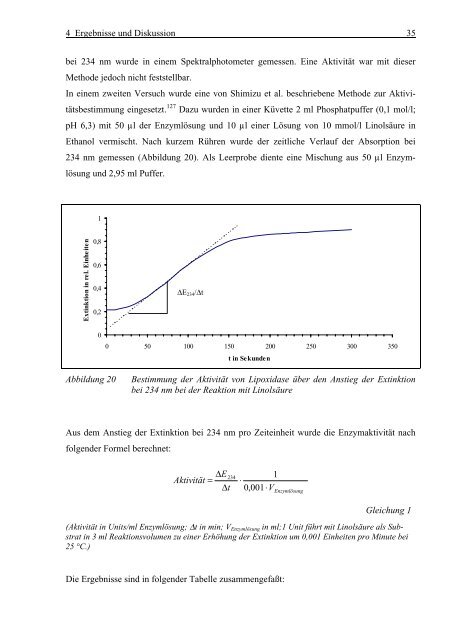
4 Ergebnisse und Diskussion 35bei 234 nm wurde in einem Spektralphotometer gemessen. Eine Aktivität war mit dieserMethode jedoch nicht feststellbar.In einem zweiten Versuch wurde eine von Shimizu et al. beschriebene Methode zur Aktivitätsbestimmungeingesetzt. 127 Dazu wurden in einer Küvette 2 ml Phosphatpuffer (0,1 mol/l;pH 6,3) mit 50 µl der Enzymlösung und 10 µl einer Lösung von 10 mmol/l Linolsäure inEthanol vermischt. Nach kurzem Rühren wurde der zeitliche Verlauf der Absorption bei234 nm gemessen (Abbildung 20). Als Leerprobe diente eine Mischung aus 50 µl Enzymlösungund 2,95 ml Puffer.1Extinktion in rel. Einheiten ...0,80,60,40,2∆E ∆A 234/∆t00 50 100 150 200 250 300 350t in SekundenAbbildung 20Bestimmung der Aktivität von Lipoxidase über den Anstieg der Extinktionbei 234 nm bei der Reaktion mit LinolsäureAus dem Anstieg der Extinktion bei 234 nm pro Zeiteinheit wurde die Enzymaktivität nachfolgender Formel berechnet:∆EAktivität =∆t2341⋅0,001⋅VEnzymlösungGleichung 1(Aktivität in Units/ml Enzymlösung; ∆t in min; V Enzymlösung in ml;1 Unit führt mit Linolsäure als Substratin 3 ml Reaktionsvolumen zu einer Erhöhung der Extinktion um 0,001 Einheiten pro Minute bei25 °C.)Die Ergebnisse sind in folgender Tabelle zusammengefaßt:
36 4 Ergebnisse und DiskussionProbe-Nr. ∆E 234 in rel.Einheiten∆t in min ∆E 234 /∆t Vol. Enzymlösungin mlAktivität der Enzymlösungin Units/ml1 0,68 1,57 0,43 0,02 217022 0,51 1,52 0,34 0,02 168133 0,67 1,27 0,53 0,02 262504 0,74 2,33 0,32 0,02 158575 0,78 1,43 0,54 0,02 272096 0,88 1,73 0,51 0,02 253847 0,76 1,30 0,58 0,02 29230Mittelwert 23207 ± 5220Tabelle 5Bestimmung der Aktivität von Lipoxidase aus KartoffelnDamit ergab sich mit dem zuvor bestimmten Proteingehalt pro ml Lösung eine Aktivität von(23207 ± 5220)/(14,56 ± 0,35) = 1594 ± 361 Units/mg Protein.4.1.1.3 Synthese von 9S-Hydroperoxyoctadeca-10(E),12(Z)-diensäure mit dem isoliertenEnzymextrakt100 mg (0,36 mmol) Linolsäure wurden in 5 ml einer wäßrigen 0,01 %-igen Tween 20-Lösung durch Zugabe von 2 ml 1 N NaOH gelöst. Nach Verdünnen mit Boratpuffer(20 mmol/l; pH 9,5) auf 250 ml wurde mit verdünnter Salzsäure auf pH 9,5 angesäuert. DieLösung wurde daraufhin gekühlt und während dieser Zeit durch Einleiten von Sauerstoff mitSauerstoff gesättigt. Nach Zugabe von 10 ml des isolierten Enzymextraktes zu der Substratlösungwurde bei 0 °C weiterhin Sauerstoff durch den Reaktionsansatz geleitet. DerVersuchsverlauf wurde mit Hilfe der Dünnschichtchromatographie kontrolliert [Hexan/Ethylacetat80/20; R f (Produkt) = 0,17-0,2].Der Versuch wurde nach acht Stunden durch Ansäuern der Reaktionslösung mit 2 N HCl aufpH 3 abgebrochen, obwohl zu diesem Zeitpunkt noch keine vollständige Umsetzung erfolgtwar, wie die spätere NMR-Untersuchung ergab. Die angesäuerte Lösung wurde dreimal mit100 ml Diethylether extrahiert. Die etherischen Phasen wurden vereinigt, zweimal mit je75 ml Wasser gewaschen und anschließend über Natriumsulfat getrocknet. Das Lösungsmittelwurde am Rotationsverdampfer entfernt.Es wurden etwa 90 mg eines Gemisches von Linolsäure und 9S-Hydroperoxy-10(E),12(Z)-octadecadiensäure erhalten. Der Peroxidgehalt betrug ca. 60 % (NMR-Auswertung).
- Seite 1 und 2: Entwicklung von Detektionssystemen
- Seite 3 und 4: DanksagungMein großer Dank gilt He
- Seite 5 und 6: IInhaltsverzeichnis0 Abstract .....
- Seite 7 und 8: III6.5.4 Hydroperoxide des Linolens
- Seite 9 und 10: VAbbildung 25 Änderung der Extinkt
- Seite 11 und 12: VIIAbbildung 64Abbildung 65Abbildun
- Seite 13 und 14: IXTabelle 25 Konzepte zur Enzymimmo
- Seite 15 und 16: 2 1 Einleitung - Vorkommen und Bede
- Seite 17 und 18: 4 1 Einleitung - Vorkommen und Bede
- Seite 19 und 20: 6 3 Theoretischer Teil3 Theoretisch
- Seite 21 und 22: 8 3 Theoretischer TeilDer Radikalke
- Seite 23 und 24: 10 3 Theoretischer TeilDie Bildung
- Seite 25 und 26: 12 3 Theoretischer TeilHHR1R2R1R2(I
- Seite 27 und 28: 14 3 Theoretischer Teil3.2 Eigensch
- Seite 29 und 30: 16 3 Theoretischer TeilR1R2OOH R1 O
- Seite 31 und 32: 18 3 Theoretischer TeilDiese Method
- Seite 33 und 34: 20 3 Theoretischer TeilDamit ließ
- Seite 35 und 36: 22 3 Theoretischer TeilH 3CCNNR1H 3
- Seite 37 und 38: 24 3 Theoretischer TeilUeberreiter
- Seite 39 und 40: 26 3 Theoretischer TeilIn der Liter
- Seite 41 und 42: 28 3 Theoretischer TeilDie Methode
- Seite 43 und 44: 30 3 Theoretischer Teil3.3.3 GC-(MS
- Seite 45 und 46: 32 4 Ergebnisse und Diskussion4 Erg
- Seite 47: 34 4 Ergebnisse und DiskussionBezei
- Seite 51 und 52: 38 4 Ergebnisse und Diskussionwurde
- Seite 53 und 54: 40 4 Ergebnisse und Diskussionwurde
- Seite 55 und 56: 42 4 Ergebnisse und Diskussion4.1.5
- Seite 57 und 58: 44 4 Ergebnisse und Diskussion4.1.5
- Seite 59 und 60: 46 4 Ergebnisse und DiskussionIm Ge
- Seite 61 und 62: 48 4 Ergebnisse und DiskussionIδ [
- Seite 63 und 64: 50 4 Ergebnisse und DiskussionSubst
- Seite 65 und 66: 52 4 Ergebnisse und Diskussion4.2 V
- Seite 67 und 68: 54 4 Ergebnisse und Diskussionentsp
- Seite 69 und 70: 56 4 Ergebnisse und Diskussion4.2.2
- Seite 71 und 72: 58 4 Ergebnisse und Diskussiondient
- Seite 73 und 74: 60 4 Ergebnisse und DiskussionExtin
- Seite 75 und 76: 62 4 Ergebnisse und DiskussionMetho
- Seite 77 und 78: 64 4 Ergebnisse und Diskussion80706
- Seite 79 und 80: 66 4 Ergebnisse und DiskussionEine
- Seite 81 und 82: 68 4 Ergebnisse und Diskussion4.4 E
- Seite 83 und 84: 70 4 Ergebnisse und Diskussion501,1
- Seite 85 und 86: 72 4 Ergebnisse und DiskussionEinfl
- Seite 87 und 88: 74 4 Ergebnisse und DiskussionDie v
- Seite 89 und 90: 76 4 Ergebnisse und DiskussionLäng
- Seite 91 und 92: 78 4 Ergebnisse und DiskussionFür
- Seite 93 und 94: 80 4 Ergebnisse und DiskussionHydro
- Seite 95 und 96: 82 4 Ergebnisse und Diskussion4.5.1
- Seite 97 und 98: 84 4 Ergebnisse und DiskussionIm Fa
4 Ergebnisse und Diskussion 35bei 234 nm wurde in einem Spektralphotometer gemessen. Eine Aktivität war mit dieserMethode jedoch nicht feststellbar.In einem zweiten Versuch wurde eine von Shimizu et al. beschriebene Methode zur Aktivitätsbestimmungeingesetzt. 127 Dazu wurden in einer Küvette 2 ml Phosphatpuffer (0,1 mol/l;pH 6,3) mit 50 µl der Enzymlösung und 10 µl einer Lösung von 10 mmol/l Linolsäure inEthanol vermischt. Nach kurzem Rühren wurde der zeitliche Verlauf der Absorption bei234 nm gemessen (Abbildung 20). Als Leerprobe diente eine Mischung aus 50 µl Enzymlösungund 2,95 ml Puffer.1Extinktion in rel. Einheiten ...0,80,60,40,2∆E ∆A 234/∆t00 50 100 150 200 250 300 350t in SekundenAbbildung 20Bestimmung der Aktivität von Lipoxidase über den Anstieg der Extinktionbei 234 nm bei der Reaktion mit LinolsäureAus dem Anstieg der Extinktion bei 234 nm pro Zeiteinheit wurde die Enzymaktivität nachfolgender Formel berechnet:∆EAktivität =∆t2341⋅0,001⋅VEnzymlösungGleichung 1(Aktivität in Units/ml Enzymlösung; ∆t in min; V Enzymlösung in ml;1 Unit führt mit Linolsäure als Substratin 3 ml Reaktionsvolumen zu einer Erhöhung der Extinktion um 0,001 Einheiten pro Minute bei25 °C.)Die Ergebnisse sind in folgender Tabelle zusammengefaßt: