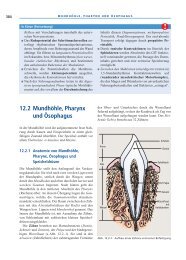
Probekapitel - Deutscher Apotheker Verlag
Probekapitel - Deutscher Apotheker Verlag
Probekapitel - Deutscher Apotheker Verlag
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Tabelle 2: WirkstoffeDie folgende Tabelle listet die charakteristischen Eigenschaftenzahlreicher Wirkstoffe auf, insoweit siefür die Herstellung der Rezeptur sowie für die Prüfungvon deren Plausibilität und Kompatibilität relevantsind. Im Gegensatz zu den meisten anderen Übersichtenumfasst die nachfolgende Zusammenschau nichtnur Wirkstoffe, die im Bereich der Dermatika eingesetztwerden, sondern auch eine ganze Reihe von Substanzen,die für die Herstellung ophthaler, auricularer,oraler, rektaler, inhalativer und auch parenteralerArzneiformen verwendet werden. Grundlage fürdie Wirkstoffauswahl waren gängige Rezeptursammlungensowie allgemein anerkannte pharmazeutischeRegeln zur Herstellung von Rezepturarzneimitteln.Um zu beurteilen, inwieweit die eingesetzten Wirkstoffezu den ggf. vom Patienten geschilderten Symptomenbzw. dem voraussichtlichen Verwendungszweckpassen, werden die einzelnen Arzneistoffe bestimmtenWirkstoffgruppen zugeordnet, aus denensich die üblichen Einsatzgebiete der entsprechendenSubstanzen ableiten.Die chemische Verbindungsklasse gibt Auskunft überden Ladungszustand der Wirkstoffmoleküle (+ kationisch,− anionisch, ◦ nichtionisch). Dies ist insofern vonBedeutung, als ionische Wechselwirkungen zwischenWirk- und Hilfsstoffen eine der häufigsten Ursachenfür Inkompatibilitäten darstellen (vgl. Tab. 5). Da phenolischeWirkstoffe in Kombination mit bestimmtenEmulgatoren bzw. Hydrogelbildnern zum Brechen derEmulsion bzw. zum Ausflocken des Hydrogels führenkönnen (vgl. Tab. 6), sind diese als besondere chemischeVerbindungsklasse separat ausgewiesen. Fernerwerden Ester explizit gekennzeichnet, um zu verdeutlichen,dass es sich einerseits nicht um die Salze organischerSäuren und andererseits in der Regel um hydrolytischleicht angreifbare Strukturen handelt. Auf dieseWeise lassen bereits einige wenige Angaben zurchemischen Verbindungsklasse profunde Rückschlüsseauf Inkompatibilitäten, Stabilitätsbeeinträchtigungenund/oder Wirkminderung zu.Bei der Angabe der therapeutischen Konzentrationwerden verschiedene Applikationsarten unterschieden,die für den jeweiligen Wirkstoff gebräuchlichsind. Die entsprechenden Angaben erlauben demnachnicht nur eine Überprüfung der Dosierung, sondernauch der Applikationsart. Für halbfeste und flüssigeZubereitungen ist der übliche Konzentrationsbereichangegeben, für feste Darreichungsformen diegebräuchliche Einzeldosis. Beim Versuch die Normdosenrezepturrelevanter Wirkstoffe zusammenzustellenergibt sich das Problem, dass sich die diesbezüglichenAngaben unterschiedlicher Quellen mituntersignifikant unterscheiden. Unter Abwägung allerUmstände (üblicherweise intendierte Arzneimittelanwendung,Zuverlässigkeit und Aktualität der Datenquelle,Berücksichtigung seltener Spezialindikationenetc.) wurde ein konsolidierter Datenbestand geschaffen,der nicht nur eine breite Literaturbasis, sondernauch die Konzentrationen und Einzeldosen der gegenwärtigauf dem deutschen Markt verfügbaren Handelspräparateberücksichtigt.Für die oberen Richtkonzentrationen bzw. -einzeldosender Wirkstoffe ergeben sich dieselben Problemehinsichtlich etwaiger Inkonsistenzen der publiziertenDaten. Da versehentlich zu hoch konzentrierte/dosierte Wirkstoffe ein erhebliches Risiko für den Patientendarstellen können, wurden die angegebenoberen Richtwerte bei widersprüchlicher Datenlageaus Gründen des Verbraucherschutzes in der Regelpräventiv zurückhaltend gewählt. Auch hier dientenverfügbare Handelspräparate als Orientierungshilfe.Eine Überschreitung der genannten oberen Richtkonzentrationenbzw. -einzeldosen kann im Einzelfalldurchaus therapeutisch begründet sein und führtnicht zwangsläufig dazu, dass die entsprechende Rezepturnicht angefertigt werden darf. In diesen Fällensollte der Arzt die Überschreitung der oberen Richtkonzentrationenbzw. -einzeldosen jedoch auf demRezept durch einen gesonderten Vermerk kenntlichmachen. Fehlt ein solcher Vermerk, ist die Konzentrationsüberschreitungals Unklarheit zu werten und vorder Herstellung mit dem Arzt Rücksprache zu halten.Der rezeptierbare pH-Bereich gibt an, welches Milieu– zumindest über einen begrenzten Zeitraum – eineausreichende Stabilität des Wirkstoffs in wasserhaltigenZubereitungen erwarten lässt. In die Betrachtungengeht dabei nicht nur die chemische Stabilität derWirkstoffmoleküle ein, sondern auch mögliche Veränderungendes Ladungszustands, die sich bei pH-Wert-Verschiebungen aus den spezifischen pK S -Werten derWirkstoff-Säuren und -Basen ergeben können. Unabhängigvon der Beurteilung der chemischen Stabilitätmuss der jeweilige Arzneistoff natürlich im gesamtenrezeptierbaren pH-Bereich auch eine adäquateWirksamkeit aufweisen. Aus einer fehlenden Angabezum rezeptierbaren pH-Bereich darf nicht geschlossenwerden, dass die betreffende WirksubstanzpH-unabhängig verarbeitet werden kann. Mitunterkonnten der wissenschaftlichen Fachliteratur diesbezüglichkeine adäquaten Daten entnommen werden,was häufig daran liegt, dass der betreffende Wirkstoffin erster Linie in wasserfreien Zubereitungen oder alsFeststoff verarbeitet wird. Aus Sicherheitsgründen istbei einer rein theoretischen Überprüfung des rezeptierbarenpH-Bereichs grundsätzlich eine präventiv zurückhaltendeBewertung der Rezeptur geboten. Dieshat zur Folge, dass sich im Einzelfall Diskrepanzenzwischen den in Tabelle 3 gelisteten laboranalytischnachgewissenermaßen stabilen und kompatiblen Rezepturenund dem Abgleich der pH-Werte aus denTabellen 2 und 4 ergeben können. In diesen Fällenist der laboranalytische Nachweis gegenüber der rein192
220 Tabelle 2: Wirkstoffetheoretischen Abwägung stets als höherwertig anzusehen.Sollte ein Wirkstoff antimikrobielle Eigenschaften aufweisen,die in wässrigen Zubereitungen bei therapeutischverwendeten Konzentrationen konservierendwirken, so ist dies durch einen Vermerk (×) in derentsprechenden Spalte gekennzeichnet. Dies dient alsHilfestellung für die Entscheidung, ob ggf. ein Konservierungsmittelergänzt werden muss oder nicht. Danicht für alle Wirkstoffe Daten zu ihrer antimikrobiellenWirksamkeit vorliegen, ist es denkbar, dass auchnicht explizit gekennzeichnete Stoffe in therapeutischeingesetzten Konzentrationen einen ausreichendenantimikrobiellen Schutz gewährleisten. Aufgrund derfehlenden Datenbasis können in diesen Fällen jedochkeine verlässlichen Aussagen getroffen werden.Die Spalte Besonderheiten/CAVE enthält zusätzlicheAngaben zu speziellen physiko-chemischen Eigenschaftender Wirkstoffe, zur korrekten Applikationoder zu Anwendungsbeschränkungen, insoweit sieüber allgemeine Unverträglichkeitsreaktionen deutlichhinaus gehen. Die Aussagen sollen und könnenkeinen Anspruch auf Vollständigkeit erheben, sie dienenlediglich dazu, wirkstoffspezifisch für bestimmteAspekte der Rezepturherstellung und -anwendung zusensibilisieren.Einige der gelisteten Wirkstoffe sind photoinstabil,d. h. unter der Einwirkung von Licht treten Oxidationen,Reduktionen, Racemisierungen, Isomerisierungenoder weitere chemische Veränderungen auf, diezu einer Inaktivierung der Substanz führen können.Die wichtigste Maßnahme zur Verhinderung einer solchenPhotoreaktion besteht im Lichtausschluss, der inder Regel durch lichtundurchlässige Verpackungen gewährleistetwerden kann.Wirkstoffe, die bestimmte funktionelle Gruppen wieetwa Ester-, Amid-, Lacton-, Lactam- oder Glykosid-Strukturen enthalten, sind in wässrigen Medien besondershydrolyseempfindlich. Die Anfälligkeit gegenüberhydrolytischen Spaltungen ist dabei häufigpH-abhängig. Die tabellierte Angabe zur Hydrolyseempfindlichkeitist das Resultat ganz grundsätzlicherErwägungen, ohne den pH-Bereich im Einzelnen zuberücksichtigen. In vielen Fällen ist es möglich, die Hydrolyseauf ein tolerierbares Minimum zu reduzieren,indem man sich in wässrigen Medien dem jeweiligenpH-Stabilitätsoptimum und dem pH-Wirkoptimum hydrolysegefährdeterWirkstoffe so weit wie möglich annähert.Der Hinweis auf eine hydrolytische Gefährdungdes Wirkstoffs ist daher lediglich als Warnsignalund nicht als Ausschlusskriterium für die Verarbeitungin wässrigen Zubereitungen zu verstehen, insbesonderewenn der angegebene rezeptierbare pH-Bereicheingehalten wird.Oxidationsempfindliche Wirkstoffe können durch oxidativeVorgänge derart verändert werden, dass sieeinen wesentlichen Teil ihrer Wirkung einbüßen oderdiese gar vollkommen verlieren. Besonders gefährdetsind Verbindungen mit einer oder mehreren Doppelbindungenoder Bindungen, die unter sterischerSpannung stehen. Steigende pH-Werte erhöhen dieGeschwindigkeit der Oxidation. Deshalb sollte manZubereitungen mit oxidationsempfindlichen Stoffenmöglichst auf saure pH-Werte einstellen, wobei natürlichdie physiologische Verträglichkeit gewährleistetbleiben muss. Durch Luftsauerstoff verursachte Oxidationenkönnen mithilfe von luftdichten Verpackungenund Packungen mit geringem Restleervolumenweitgehend ausgeschlossen werden. Allerdings könnenOxidationen nicht nur durch Luftsauerstoff erfolgen,sondern auch durch Oxidanzien, die in der Zubereitungselbst enthalten sind. Letzteres macht ggf. denZusatz von Antioxidanzien erforderlich.Hierfür stehen beispielsweise folgende Substanzenzur Verfügung:AntioxidanzienFür lipophile Systeme1. natürliche Verbindungen• Tocopherole (0,05–0,075 %)2. synthetische Verbindungen• Butylhydroxyanisol (0,005–0,02 %)• Butylhydroxytoluol (0,01–0,02 %)• Gallussäureester (0,05–0,1 %)• Ascorbinsäureester (0,01–0,015 %)Für hydrophile Systeme1. Ascorbinsäure (0,01–0,1 %)2. anorganische Schwefelverbindungen• Natriumhydrogensulfit (0,05–0,15 %)• Natriumsulfit (0,05–0,15 %)• Natriumpyrosulfit (0,05–0,15 %)3. organische Schwefelverbindungen• Cysteamin (0,05–0,15 %)• Thiomilchsäure (0,05–0,15 %)• Glutathion (0,05–0,15 %)• Cystein (0,05–0,15 %)Ferner gilt es zu berücksichtigen, dass Redox-Reaktionenhäufig durch Spuren von Schwermetallionenkatalysiert werden. Solche Verunreinigungen (z. B.Kupfer-, Eisen-, Mangan- oder Nickelionen) solltendaher bei oxidationsempfindlichen Wirkstoffen soweitwie möglich ausgeschlossen werden, ggf. könnenauch Komplexierungsmittel, wie z. B. Na-EDTA zur Stabilitätsverbesserungeingesetzt werden.Grenzflächenaktive Wirkstoffe treten in Emulsionenin Konkurrenz mit an der Grenzfläche fixierten Emulgatorenund bewirken so eine Schwächung des Emulgatorfilms,wodurch das Emulsionssystem als Ganzesdestabilisiert wird. Prinzipiell können alle tensidartigwirkenden Stoffe mit Emulgatoren Wechselwirkungeneingehen, allerdings muss das nicht immer einProblem sein; der Effekt kann sogar gezielt eingesetztwerden, um eine Stabilisierung zu bewirken (z. B. bei
Komplexemulgatoren wie dem emulgierenden Cetylstearylalkohol).Werden grenzflächenaktive Substanzenallerdings unkontrolliert kombiniert, führt dasmeist zu Unverträglichkeiten und in letzter Konsequenzzum Brechen der Emulsionssysteme. GrenzflächenaktiveWirkstoffe sollten daher in solchen Systemenmöglichst nicht verarbeitet werden, sofern keinegeprüfte Rezeptur vorliegt.Insbesondere bei der Verarbeitung von Pulvern kannsich hygroskopisches Verhalten als problematisch erweisen.Hygroskopische Stoffe nehmen nicht nur vermehrtFeuchtigkeit aus der Atmosphäre auf, im Gegensatzzu nicht hygroskopischen Stoffen, binden sieneben dem oberflächlichen Haftwasser auch Wasser inkleineren Kapillaren. Einerseits steigt dadurch die Gefahreiner Hydrolyse, andererseits hat der Sorptionszustandvon Pulvern oder Haufwerken auch entscheidendenEinfluss auf deren Kohäsivität und damit auchauf deren Fließeigenschaften. Dies spielt unter anderemfür die Verarbeitung, z. B. beim Abfüllen inKapseln, eine wichtige Rolle. Beginnen die Pulver zukleben oder zu verklumpen, ändert sich dadurch möglicherweisesogar die systemische Bioverfügbarkeitoraler Darreichungsformen. Bei der Abgabe von Zubereitungenmit hygroskopischen Inhaltsstoffen solltedaher präventiv ein geeignetes Packmittel (wasserdampfundurchlässig,Trockenmittel in der Verschlusskappeo. ä.) ausgewählt werden.Tabelle 2: Wirkstoffe 21PrüfungÜberprüfen Sie anhand der nachfolgenden Tabelle,ob alle Wirkstoffkonzentrationen bzw. Einzeldosen innerhalbdes jeweils üblichen Dosierungsbereichs liegenund ob die Applikationsart für alle Wirkstoffe bekanntbzw. plausibel ist!Überprüfen Sie ferner, ob alle Wirkstoffe im pH-Bereichder Grundlage / des Lösungsmittels stabil bzw.wirksam rezeptierbar sind und ob die enthaltenenSubstanzen gegenüber sonstigen Einflüssen (z. B.Licht, Hydrolyse, Oxidation) stabil sind!Überprüfen Sie bei Emulsionen zudem, ob grenzflächenaktiveWirkstoffe enthalten sind, die das Emulsionssystemdestabilisieren können und wählen Sie ggf.eine andere Grundlage deren Stabilität nicht beeinträchtigtwird!Überprüfen Sie ferner bei festen Darreichungsformen,ob hygroskopische Wirkstoffe enthalten sind und ergreifenSie ggf. Maßnahmen, die eine Änderung desSorptionszustands weitgehend verhindern!Falls Sie Anpassungen vornehmen, denken Sie daranggf. die Plausibilität der veränderten Gesamtrezepturerneut zu prüfen!Beachten Sie:• Die Zuordnung der Verbindungsklassen erfolgtein erster Linie unter dem Aspekt der praktischenRelevanz für mögliche Inkompatibilitätenbei der Rezepturherstellung und ist daher unterrein chemischer Betrachtung nicht immer konsistent.Beispielsweise wurden bei geladenen Wirkstoffenentgegengesetzt geladene Begleitionenin der Regel nicht berücksichtigt, es sei denn diesenkommt ein eigenes Inkompatibilitätspotentialzu (z. B. Povidon-Iod). In diesen Fällen wurdedann auch die Ladung des Begleitions angegeben!• Die in der folgenden Tabelle aufgeführten Empfindlichkeitengegenüber äußeren Einflüssen(Licht, Feuchtigkeit, Luftsauerstoff etc.) stellennicht automatisch ein Ausschlusskriterium fürdie Verarbeitung unter bestimmten Umgebungsbedingungendar. Sie sollen lediglich für möglicherweisein Betracht zu ziehende Probleme sensibilisieren.2
22 Tabelle 2: WirkstoffeWirkstoff Wirkstoffgruppe Verbindungsklasseeingesetzte Konzentration bzw.Übliche Applikationsarten und therapeutischEinzeldosisObere Richtkonzentrationbzw. -einzeldosisRezeptierbarerpH-BereichAcetylcysteinMukolytikum; Antidot bei ParacetamolvergiftungSäureparenteral: 300 mg; oral: 200–600 mg;pulmonal: 10 %–2AcetylsalicylsäureAnalgetikum; Antipyretikum; Antiphlogistikum;Säure oral: 500–1000 mg –ThrombozytenaggregationshemmerAciclovir Virustatikum ◦amphoterdermal: 5 %; ophthal: 3 %; oral: 200 mg 5% > 2Alfatradiol (17α-Estradiol) 5α-Reduktase-Hemmer bei Alopezie ◦Phenoldermal: 0,015–0,025 % (auf der Kopfhaut) – –Allantoin Wundbehandlungsmittel ◦ dermal: 0,2–3 % – pH-Optimum 6,5Aluminiumacetat-tartrat-Lösung Adstringens; Antiseptikum + dermal: Umschlag/Spülung 1,5 %, Salbe 10 % –Aluminiumkaliumsulfat Adstringens; Antiseptikum + dermal: Salbe 2 %, Puder 20 %; ophthal: 2 %;oral:0,3mg;buccal:2%–Aluminiumtrichlorid-Hexahydrat Adstringens; Aknemittel; Antihidrotikum + dermal: 10–30 %; buccal: 10 % – ≤ 45-AminolävulinsäurehydrochloridKontrastmittel zur Visualisierung vonmalignem Gewebe; Photosensitizer+ dermal: 20 %; oral: 20–30 mg/kg KG – < 3Ammoniumbituminosulfonat(Ichthyol ® )AmphetaminsulfatAntiphlogistikum; nichtsteroidales Antirheumatikum;DermatikumPsychostimulanz; zentral wirkendes Sympathomimetikum− dermal: 5–50 %; rektal: 200 mg – 4–8+ parenteral: 15 mg; oral: 2–5 mg 20 mgAmphotericin B Peptid-Antibiotikum ◦(Zwitterion)parenteral: 0,1 mg/kg KG/d; vaginal: 2,5 %;oral: 100 mg; buccal: Lutschtableten 10 mg,Mundtropfen 10 %– pH-Optimum 5,5–7AtropinAnticholinergikum; Mydriatikum; Spasmolytikum;Antidot (Organophosphat-Insektizide)Base ophthal: 0,5–2 %; parenteral: 0,025–1 %;oral: 0,5 mg3mgAtropinsulfatAnticholinergikum; Mydriatikum; Spasmolytikum;Antidot (Organophosphat-Insektizide)+ ophthal: 0,5–2 %; parenteral: 0,025–1 %;oral: 0,5 mg3mg 4–5,5Azelainsäure Akne-Therapeutikum Säure dermal: 15–20 %Bacitracin Lokalantibiotikum ◦ dermal: 50.000 I.E./100 g (etwa 0,8 %) – 4–7Basisches Bismutgallat Ulkustherapeutikum; Antiseptikum ◦Phenoldermal: Salbe 10–20 %, als Puder unverdünnt;oral:k.A.1gBeclometasondipropionat halogeniertes Glucocorticoid Ester pulmonal: 0,05–0,1 mgBenzalkoniumchlorid Antiseptikum; Desinfiziens + dermal: 0,05–0,1 % 0,5 % 4–8Benzocain Lokalanästhetikum; Natriumkanal-Blocker BaseEsterdermal: 5–10 %; rektal: 100 mg; buccal: 10 mg 10 % 4–7Benzoylperoxid Akne-Therapeutikum ◦ dermal: 2–10 % – 4–6Benzylalkohol Antiseptikum ◦ dermal: bis 10 % –Benzylbenzoat Antiskabiosum Ester dermal: 10–25 % dermal: 25 %Betamethasondipropionat Halogeniertes Glucocorticoid Ester dermal: 0,05–0,1 %; oral: 0,5 mg 0,1 % 4–8Betamethasonvalerat Halogeniertes Glucocorticoid Ester dermal: 0,025–0,15 % 0,15 % 2–5Bifonazol Antimykotikum ◦ dermal: 1 % 1–12Budesonid Nichthalogeniertes Glucocorticoid ◦ nasal: 0,05 mg; pulmonal: 0,2 mg < 5,5Butylscopolaminiumbromid Anticholinergikum; Spasmolytikum + parenteral: 20 mg; rektal: 20 mg; oral: 20 mg 1,5 mg/kg KG/d+ kationisch; − anionisch; ◦ nichtionisch
Tabelle 2: Wirkstoffe 23In therapeutischerKonzentrationkonservierendBesonderheiten/CavephotoinstabilhydrolyseempfindlichoxidationsempfindlichgrenzflächenaktivhygroskopischWirkstoff× Acetylcystein× AcetylsalicylsäureAlfatradiol soll während Schwangerschaft und Stillzeit sowie bei Patienten unter 18Jahren nicht angewendet werden, da hierzu bisher keine Erkenntnisse vorliegen.× × Aciclovir× Alfatradiol (17α-Estradiol)AllantoinAluminiumacetat-tartrat-LösungAluminiumkaliumsulfat2× Lösungsvorgang in wasserfreiem Ethanol dauert ca. 3 Wochen × Aluminiumtrichlorid-Hexahydrat14 bis 18 Stunden vor UV-A-Lichtbestrahlung auf die betroffenen Haustellen auftragen;Therapiewiederhohlung frühstens nach 8 Wochen; 5-Aminolävulinsäure darfnicht angewandt werden bei Patienten mit Photosensibilität gegenüber UV-Lichtvon 380 bis 400 nm, Porphyrien oder Überempfindlichkeit auf Porphyrine. Die peroraleAnwendung soll bei Patienten mit kardiovaskulären Krankheiten mit Vorsichterfolgen, da Blutdruckabfälle auftreten können.5-Aminolävulinsäurehydrochlorid× × Ammoniumbituminosulfonat(Ichthyol ® )Nicht abends einnehmen; Cave: Kardiovaskuläre Krankheiten, Hypertonie, Hyperthyreoidismusund Glaukom. Ferner sollen Patienten mit Depressionen, Psychosen undAngsterkrankungen nicht mit Dexamfetamin behandelt.AmphetaminsulfatCave: Schwere Leber- und Nierenfunktionsstörungen × × Amphotericin BCave: Glaukom × AtropinCave: Glaukom × AtropinsulfatCave: Die Substanz zeigt Polymorphie.Azelainsäure× × BacitracinDie innerliche Wirksamkeit nach oraler Verabreichung ist als nicht ausreichendanzusehen. Die Bismutresorption aus dermal verabreichten basischen Bismutverbindungenist so gering, dass Konzentration oder Anwendungsdauer nicht limitiertzu werden brauchen. Die dermatologische Anwendung von basischen Bismutverbindungenist weniger aus pharmakologisch-toxikologischen als aus ökologischenGründen kritisch diskutiert worden.× Basisches Bismutgallat× Beclometasondipropionat× × Benzalkoniumchlorid× × Benzocain× Explosionsartige Zersetzung möglich, daher üblicherweise in wasserhaltiger Form(Wasseranteil 25 %) vorrätig zu halten.Benzoylperoxid× × Benzylalkohol× × Benzylbenzoat× × × BetamethasondipropionatMax. 3–4 Wochen anwenden × × × BetamethasonvaleratCave: Die Substanz zeigt Polymorphie.BifonazolCave: nicht länger als 2 bis 4 Wochen × BudesonidButylscopolaminiumbromid
Tabelle 3: Bekannte Kompatibilitäten von Wirkstoffenund Grundlagen41Für die dermatologische Rezeptur gibt es eine Reihevon erprobten Vorschriften, die in nationalenund internationalen Vorschriftensammlungen, sowiein Industrierezepturen und wissenschaftlichen Veröffentlichungenzusammengestellt sind. WesentlicherVorteil dieser Rezeptursammlungen ist, dass es sichum erprobte, therapeutisch sinnvolle und über denAnwendungszeitraum galenisch stabile Rezepturenhandelt, für die die Kompatibilität ihrer Einzelbestandteilenachgewiesen ist. In der folgenden Tabellesind solche bekanntermaßen stabilen Zubereitungenzusammengestellt. Die systematische Sortierungnach Wirkstoffen einerseits und Grundlagen andererseitsermöglicht die schnelle und zuverlässige Auffindungkompatibler Wirkstoff-Grundlagen-Kombinationen.Die Wirkstoffkonzentration (soweit nicht andersangegeben in Massenprozent), bis zu der die Kompatibilitätnachgewiesen wurde, kann den tabellarischenKreuzungspunkten der jeweiligen Wirkstoff-Grundlagen-Kombination entnommen werden. Befindetsich im entsprechenden Feld ein „n. k.“, so istdie Wirkstoff-Grundlagen-Kombination nicht kompatibel,nicht stabil, nicht geeignet oder nicht empfohlen.Leere Felder bedeuten, dass für die entsprechendeWirkstoff-Grundlagen-Kombination keine Datenvorliegen und daher keine sichere Aussage überderen Kompatibilität getroffen werden kann. Die tabelliertenAngaben beruhen auf Rezepturen aus anerkanntenVorschriftensammlungen, Herstellerangabenoder wissenschaftlichen Publikationen, die die Qualitätder genannten Zubereitungen systematisch untersuchthaben. Bitte beachten Sie, dass es im Einzelfallmöglich ist, dass für einzelne Rezepturen in der laboranalytischenUntersuchung eine ausreichende Stabilitätund Kompatibilität nachgewiesen wurde, obwohleine rein theoretische Beurteilung, die aus Sicherheitsgründennotwendigerweise präventiv zurückhaltenderfolgen muss, Zweifel daran ergäbe. In diesen Fällenist der laboranalytische Nachweis gegenüber der reintheoretischen Abwägung stets als höherwertig anzusehen.PrüfungÜberprüfen Sie anhand der nachfolgenden Tabelle,ob für den rezeptierten Wirkstoff die Kompatibilitätmit einer gängigen Rezepturgrundlage bereits nachgewiesenist!Falls ja, kann auf die übrigen Kompatibilitätsprüfungenverzichtet werden, sofern keine weiteren Bestandteilein der Rezeptur enthalten sind. Ferner hilftdie Tabelle beim Auffinden alternativer Grundlagen,sofern im Rahmen der Plausibilitätsprüfung eine Inkompatibilitätvon einem der Rezepturbestandteilemit der zunächst rezeptierten Grundlage festgestelltwurde.Falls Sie Anpassungen vornehmen, denken Sie daranggf. die Plausibilität der veränderten Gesamtrezepturerneut zu prüfen!Beachten Sie:• Felder ohne Eintrag treffen keinerlei Aussageüber die Kompatibilität. Sie besagen lediglich,dass hierzu keine Daten vorliegen.• Der Kompatibilitätsnachweis gilt nur für Wirkstoffkonzentrationenbis zur tabellierten Maximalkonzentration.Extrapolationen sind nichtstatthaft und Aussagen für höhere Wirkstoffkonzentrationendemnach unzulässig.• Der Zusatz weiterer Wirk- und Hilfsstoffe kanndie Stabilität der Zubereitung nachhaltig beeinflussenund ist daher nicht durch den vorliegendenKompatibilitätsnachweis gedeckt.3
42 Tabelle 3: Bekannte Kompatibilitäten von Wirkstoffen und GrundlagenMonographierte Grundlagen und Handelspräparate A–GWirkstoffAlfason ® Basis CresaAlfason ® CreloAlfason ® CresaAlfason ® RepairAlfason ® SalbeAnefug ® simplexAnionische hydrophileCreme SR DACAsche Basis ® CremeAsche Basis ® SalbeAsche Basis ® FettsalbeAsche Basis ® LotioBasiscreme DACCarmellose-Natrium-GelDABCordes ® Basis RKBasis Cordes ® RKCordes ® GelGel Cordes ®Cordes ® LotioLotio Cordes ®Cordes ® MilchMilch Cordes ®Allantoin 0,5 5,0 0,5Aluminiumacetattartrat-Lösung(Essig-weinsaureTonerde)10,03Aluminiumchlorid n. k. n. k. 20,0Ammoniumbituminosulfonat(Ichthyol ® )n. k. n. k. n. k. 5,0 n. k. 1,0–5,0 1,0–5,0 1,0–5,0Amphotericin B 3,0 n. k.Bacitracin 500,0I.E./g500,0I.E./gBamipinhydrochlorid n. k.BasischesBismutgallat10,0 n. k.Benzalkoniumchlorid n. k. n. k.Benzocain 10,0 n. k. 10,0 n. k. 10,0Benzoylperoxid 5,0 5,0Benzylalkohol n. k. 10,0Benzylnicotinat 3,00,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1Bifonazol 1,0Birkenteer n. k.Calciumchlorid n. k. 5,0Campher 5,0 5,0BetamethasonvaleratCetylpyridiniumchloridChinolinolsulfat-Monohydrat(8-Hydroxychinolinsulfat-Monohydrat)Chloramin T(Tosylchloramid-Natrium)n. k.n. k.n. k. n. k.Chloramphenicol 2,0 n. k. 2,0 n. k. 1,0 2,0 2,0 0,85 1,0ChlorhexidindigluconatChlorhexidinhydrochloridChlorphenoxaminhydrochloridChlortetracyclinhydrochloridn. k. n. k. n. k. 1,0 n. k. 1,01,0n. k.n. k. n. k.1 Die gelisteten Werte wurden mit den Handelspräparaten Eucerinum® anhydricum bzw. Eucerinum® cum aqua erhoben. Weitere Kompatibilitätsdaten liegen für die inhaltsgleichenDAB-Grundlagen Wollwachsalkoholsalbe DAB bzw. Wasserhaltige Wollwachsalkoholsalbe DAB vor, diese sind sinngemäß übertragbar.
Tabelle 3: Bekannte Kompatibilitäten von Wirkstoffen und Grundlagen 43Cordes ® PastePasta Cordes ®Cordes ® UnguentumUnguentum Cordes ®Decoderm ® BasiscremeDermatop ® BasiscremeDermatop ®Basis-FettsalbeDermatop ® BasissalbeDermatop ® CremeDermatop ® FettsalbeDermatop ® LösungDermatop ® SalbeEucerinum ®anhydricum 1Eucerinum ® cum aqua 1Eucerinum ® O/WGrundlageEucerinum ® W/OGrundlageExcipial ® Creme(Hydrocreme)Excipial ® Fettcreme(Lipocreme)Excipial ® MandelölsalbeWirkstoff2,0 2,0 5,0 AllantoinAluminiumacetattartrat-Lösung(Essig-weinsaureTonerde)Aluminiumchlorid2,0–10,0 2,0–20,0 5,0 5,0 5,0 5,0 5,0 2,0 5,0 20,0 5,0 Ammoniumbituminosulfonat(Ichthyol ® )3Amphotericin BBacitracinBamipinhydrochloridBasisches BismutgallatBenzalkoniumchlorid20,0 20,0 20,0 BenzocainBenzoylperoxidBenzylalkoholBenzylnicotinatBifonazol10,0 10,0 10,0 10,0 10,0 10,0 BirkenteerCalciumchloridCampher0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 BetamethasonvaleratCetylpyridiniumchlorid10,0 10,0 10,0 10,0 10,0 10,0 Chinolinolsulfat-Monohydrat(8-Hydroxychinolinsulfat-Monohydrat)Chloramin T(Tosylchloramid-Natrium)ChloramphenicolChlorhexidindigluconatChlorhexidinhydrochloridChlorphenoxaminhydrochlorid3,0 ChlortetracyclinhydrochloridKonzentrationsangaben soweit nicht anders angegeben in % (m/m)
Tabelle 4: GrundlagenDie folgende Tabelle enthält eine Übersicht über gängigeDermatika-Grundlagen aus DAB und DAC sowiein der Rezeptur häufig eingesetzte Handelsprodukte.Die Daten zur Zusammensetzung sind den jeweilsaktuellen Monographien entnommen bzw. beruhenauf Herstellerangaben, wobei die bei Handelspräparatengebräuchliche INCI-Deklaration (International Nomenclatureof Cosmetic Ingredients), soweit möglich,in gängige pharmazeutische Substanzbezeichnungenübertragen wurde. Ferner werden zu den einzelnenGrundlagen charakteristische Eigenschaften angegeben,soweit sie für die Plausibilitäts- und insbesonderefür die Inkompatibilitätsprüfung relevant sind.Der Grundlagen-Typ ist insbesondere dann von Bedeutung,wenn eine Grundlage mit anderen Grundlagenverdünnt werden soll. Grundsätzlich muss hierfür einemöglichst passende Verdünnungsgrundlage gewähltwerden (gleiche Phasenlage, ähnliche Zusammensetzung).So sollten Grundlagen vom O/W-Emulsionstypprinzipiell nicht mit einer W/O-Grundlage verdünntwerden, da die Emulsion dann brechen kann. Selbstwenn bei der Kombination verschiedener Formulierungstypenmakroskopisch keine Inkompatibilitätensichtbar werden, so offenbart die mikroskopischeÜberprüfung meist eine Tropfengrößenzunahme, welcheAuswirkungen auf die dermale Verfügbarkeit habenkann.Die Kenntnis des vorliegenden pH-Bereichs von Zubereitungenmit einer wässrigen Phase ist essenziell zurBeurteilung einer Rezeptur. Einige Wirkstoffe sind nurin bestimmten pH-Fenstern ausreichend chemisch stabilund therapeutisch wirksam. Gleiches gilt für dieStabilität und antimikrobielle Wirksamkeit einer Vielzahlvon Konservierungsmitteln. Je geringer der Wasseranteileiner Zubereitung, desto schwieriger ist esden pH-Wert zuverlässig zu messen. Teilweise ist dertatsächliche pH-Wert (insbesondere wenn es sich umdie innere Phase einer Emulsion handelt) einer direktenMessung gar nicht zugänglich und muss anhandvon Verdünnungsreihen durch Extrapolation bestimmtwerden, was seine Relevanz für die Stabilitätund Kompatibilität jedoch nicht schmälert. Für denFall, dass eine Anpassung des pH-Wertes zur Zubereitungerforderlich und möglich ist, finden Sie auf Seite68 eine Auswahl evtl. einsetzbarer Pufferlösungendes Europäischen Arzneibuchs.Ionische Emulgatoren bzw. Gelbilder sind einerseitsfür eine Vielzahl von Inkompatibilitäten verantwortlich,andererseits jedoch für das ungeübte Auge –selbst anhand der Inhaltsstoffdeklaration – häufignicht auf den ersten Blick zu erkennen. Daher gibtdie folgende Tabelle bei allen Zubereitungen auch dieeingesetzten emulgierenden bzw. gelbildenden Hilfsstoffean, sowie ggf. deren Ladung, aus der ebenfallsInkompatibilitäten resultieren könnten.Um in einem weiteren Schritt die Notwendigkeit einesZusatzes von Konservierungsmitteln zu beurteilen,ist es wichtig zu wissen, ob und ggf. mit welchemKonservierungsmittel die verwendete Grundlagebereits konserviert ist. Bei einigen der in DABund DAC monographierten Grundlagen ist der Zusatzeines Konservierungsmittels zwar nicht verpflichtendvorgeschrieben, sondern lediglich empfohlenbzw. optional gestattet, allerdings wird von dieserOption in aller Regel Gebrauch gemacht. Die Angabeder verwendeten Konservierungsmittel dientjedoch nicht nur zur Beurteilung der mikrobiellenStabilität sondern auch dem Erkennen etwaigerInkompatibilitäten mit dem Wirkstoff oder –sofern vorgesehen – weiteren zugesetzten Hilfsstoffen.PrüfungÜberprüfen Sie anhand der nachfolgenden Tabelle, obder Wirkstoff in der Grundlage ausreichend stabil ist.Vergleichen Sie hierzu den rezeptierbaren pH-Bereichdes jeweiligen Wirkstoffs aus Tab. 2 mit dem pH-Wertder Grundlage!Ferner gibt die nachfolgende Tabelle Aufschluss darüber,welche Inhaltsstoffe in den Grundlagen enthaltensind. Diese Informationen bilden die Basis einerggf. erforderlichen weitergehenden Kompatibilitätsbeurteilung.Die Angaben zur Konservierung sind bei der Festlegungder Aufbrauchfrist nach Tab. 10 mit einzubeziehen.Bei Verwendung einer konservierten Grundlageist der Zusatz weiterer Konservierungsmittel ggf.überflüssig.Beachten Sie:• Aufgrund möglicherweise larvierter Inkompatibilitätendürfen nur Grundlagen des gleichen Emulsionstypsmiteinander gemischt werden.• Nach Zugabe von sauer oder basisch reagierendenWirk-/Hilfsstoffen kann sich der pH-Wert derZubereitung signifikant von den tabellierten Wertender reinen Grundlage unterscheiden, gleichesgilt für puffernde Zusätze oder Rezepturbestandteile,die die Verteilung bestimmter Substanzenzwischen hydro- und lipophiler Phase merklichverändern!• Eine Verschiebung des pH-Wertes kann auch dazuführen, dass das Konservierungsmittel nicht mehrwirksam ist. Dies kann einen Wechsel der Grundlageerforderlich machen.• Bei Zusatz größerer Wassermengen reicht dieKonzentration des Konservierungsmittels möglicherweisenicht mehr aus, um die mikrobielleStabilität zu gewährleisten. Überprüfen Siedie Rezeptur in diesem Fall auf ausreichendeKonservierung!594
60 Tabelle 4: GrundlagenMonographierte Grundlage/HandelsproduktGrundlagen-Typ pH-Wert Enthaltene Emulgatoren/GelbildnerAlfason ® Basis Cresa O/W-Emulsion 3,7–4,3 nichtionisch: Cetylstearylalkohol; Macrogol-25-cetylstearyletherAlfason ® Crelo O/W-Emulsion 3,8–4,2 nichtionisch: Cetylstearylalkohol; Macrogol-25-cetylstearyletherAlfason ® Creme O/W-Emulsion 3,5–4,2 nichtionisch: Cetylstearylalkohol; Macrogol-25-cetylstearyletherAlfason ® Cresa O/W-Emulsion 3,7–4,3 nichtionisch: Cetylstearylalkohol; Macrogol-25-cetylstearyletherAlfason ® Repair W/O-Emulsion 5,0–6,0 anionisch: Carbomer (Polyacrylsäure) nichtionisch: SorbitanmonooleatAlfason ® Salbe Lipophiles Gel k. A. –Amciderm ® Basiscreme O/W-Emulsion k. A. nichtionisch: Polyoxyethylen-20-monostearat; CetylstearylalkoholAmciderm ® Basisfettsalbe Wasserfreie Grundlage Nicht messbar nichtionisch: Polyoxyethylen-20-monostearat; Cetylstearylalkohol4Anefug ® Simplex O/W-Emulsion 4,4–5,4 nichtionisch: Glycerolmonostearat 40–55; Macrogol-2-Stearylether; Macrogol-21-StearyletherAnionische hydrophile Creme SRDACO/W-Emulsion 4,0–5,5 anionisch: Natrium-Cetylstearylsulfat im Emulgierenden Cetylstearylalkohol Typ AAsche Basis ® Creme O/W-Emulsion 5,5–6,5 nichtionisch: Polyoxyl-40-stearatanionisch: PolyacrylsäureAsche Basis ® Fettsalbe Wasserfreie Grundlage Nicht messbar –Asche Basis ® Lotio O/W-Emulsion 5,0–6,5 nichtionisch: Polyoxyl-40-stearatanionisch: PolyacrylsäureAsche Basis ® Salbe W/O-Emulsion k. A. nichtionisch: Dehymuls E (Emulgator-Grundlagen-Gemisch)Austrocknende Salbe SR Wasseraufnehmende Paste k. A. nichtionisch: Wollwachsalkohole; Sorbitanmonooleat; GlycerolmonooleatBasiscreme DAC Ambiphile Emulsionsgrundlage 5,0–6,5 nichtionisch: Glycerolmonostearat 60; Cetylalkohol; Macrogol-20-glycerolmonostearatCarmellose-Natrium-Gel DAB Hydrophiles Gel Mit Sorbinsäure/Kaliumsorbat 4,0–5,0;mit PHB–Estern 5,0–7,0anionisch: Carmellose-Natrium 600 (= Carboxymethylcellulose-Natrium 600)Cordes ® Basis RKBasis Cordes ® RKAmbiphile GrundlageCa. 5,0 (mit Wasser imVerhältnis 1:1)nichtionisch: Macrogol-20-glycerolmonostearat; Cetylalkohol; GlycerolmonostearatCordes ® GelHydrogel 5,5–7,0 nichtionisch: Poloxamer 407Gel Cordes ®Cordes ® LotioSchüttelmixtur 5,0–6,5 nichtionisch: Macrogolglycerolricinoleat; Macrogol-5-oleyletherLotio Cordes ® anionisch: Natrium-Cetylstearylsulfat im Emulgierenden Cetylstearylalkohol Typ ACordes ® MilchO/W-Emulsion 3,7–4,7 nichtionisch: Glycerol- und Propylenglycolfettsäureester; Macrogolether; GlycerolmonostearatMilch Cordes ®Cordes ® PasteEmulgatorhaltige Fettpaste Ca. 7,0 (mit Wasser imPasta Cordes ® Verhältnis 1:1)nichtionisch: Wollwachsalkohole; CetylstearylalkoholCordes ® UnguentumUnguentum Cordes ®Ambiphile, emulgierendeSalbengrundlageCa. 6,0 (mit Wasser imVerhältnis 1:1)nichtionisch: Macrogolstearat 400; Glycerolmonostearat; SorbitanmonostearatDecoderm ® Basiscreme Ambiphile Emulsionsgrundlage 4,5 nichtionisch: Glycerolmonostearat; Polysorbat 40; CetylstearylalkoholDermatop ® Basiscreme O/W-Emulsion 5,5–6,5 nichtionisch: Polysorbat 60; Sorbitanmonostearat; Stearylalkohol; CetylalkoholDermatop ® Basis-Fettsalbe Wasserfreie Salbengrundlage Nicht messbar nichtionisch: GlycerolmonooleatDermatop ® Basissalbe W/O-Emulsion 5,5–6,5 nichtionisch: GlycerolmonooleatDermatop ® Creme O/W-Emulsion 5,5–6,5 nichtionisch: Polysorbat 60; Sorbitanmonostearat; Stearylalkohol; Cetylalkohol
Tabelle 4: Grundlagen 61Enthaltenes Konservierungsmittel Zusammensetzung laut Herstellerangaben Monographierte Grundlage/HandelsproduktPropyl-4-hydroxybenzoat; BenzylalkoholButyl-4-hydroxybenzoat; Propyl-4-hydroxybenzoat (Butylhydroxytoluolals Antioxidanz)Butyl-4-hydroxybenzoat; Propyl-4-hydroxybenzoatPropyl-4-hydroxybenzoat; Benzylalkoholkein ZusatzCetylstearylalkohol; Macrogol-25-cetylstearylether; dünnflüssiges Paraffin; wasserfreie Citronensäure; wasserfreiesNatriumcitrat; weißes Vaselin; Propyl-4-hydroxybenzoat; Benzylalkohol; gereinigtes Wasser0,1 % Hydrocortison-17-butyrat; Borretschsamenöl; Butylhydroxytoluol; Cetylstearylalkohol;Macrogol-25-cetylstearylether; wasserfreie Citronensäure; wasserfreies Natriumcitrat; Hartparaffin; Propylenglycol;weißes Vaselin; Butyl-4-hydroxybenzoat; Propyl-4-hydroxybenzoat; gereinigtes Wasser0,1 % Hydrocortison-17-butyrat; Cetylstearylalkohol; Macrogol-25-cetylstearylether; dünnflüssiges Paraffin;wasserfreie Citronensäure; wasserfreies Natriumcitrat; weißes Vaselin; Butyl-4-hydroxybenzoat; Propyl-4-hydroxybenzoat; gereinigtes Wasser0,1 % Hydrocortison-17-butyrat; Cetylstearylalkohol; Macrogol-25-cetylstearylether; dünnflüssiges Paraffin;wasserfreie Citronensäure; wasserfreies Natriumcitrat; weißes Vaselin; Propyl-4-hydroxybenzoat; Benzylalkohol;gereinigtes WasserGelbes Vaselin; dünnflüssiges Paraffin; dickflüssiges Paraffin; Glycerin; Sorbitanmonooleat; Carnaubawachs;Cholesterol; Ceramide 3; Ölsäure; Palmitinsäure; Trometamol; Carbomer (Polyacrylsäure); gereinigtes WasserAlfason ® Basis CresaAlfason ® CreloAlfason ® CremeAlfason ® CresaAlfason ® Repairkein Zusatz 0,1 % Hydrocortison-17-butyrat; Polyethylen-Oleogel (dickflüssiges Paraffin; 5 % Polyethylen) Alfason ® SalbeBenzylalkohol Polyoxyethylen-20-monostearat; Cetylstearylalkohol; Isopropylpalmitat; Glycerol; Sorbitol; Milchsäure; Wasser Amciderm ® BasiscremeKein ZusatzGelbes Vaselin; Polyoxyethylen-20-monostearat; Cetylstearylalkohol; Butylhydroxyanisol; Propylgallat; wasserfreieCitronensäure; PropylenglycolAmciderm ® BasisfettsalbePhenoxyethanolKaliumsorbatgereinigtes Wasser; Decyloleat; Glycerolmonostearat 40–55; Macrogol-2-Stearylether; Macrogol-21-Stearylether; Titandioxid; Stearinpalmitinsäure; Linolsäuren; Eisenoxide (gelb; rot; schwarz); gebleichtesWachs; Triclosan; Phenoxyethanol; Parfüm21 Teile Emulgierender Cetylstearylalkohol Typ A; 10 Teile 2-Ethylhexyllaurat; 5 Teile Glycerol 85 %; 0,14 TeileKaliumsorbat; 0,07 Teile wasserfreie Citronensäure; 63,79 Teile gereinigtes WasserAnefug ® SimplexAnionischehydrophile Creme SR DAC4BenzylalkoholCa. 70 % Wasser; dickflüssiges Paraffin; weißes Vaselin; Stearylalkohol; Polyoxyl-40-stearat; Dinatriumedetat;Polyacrylsäure; GeruchsstoffeAsche Basis ® CremeKein Zusatz Dickflüssiges Paraffin; weißes Vaselin; mikrokristallines Wachs; hydriertes Rizinusöl Asche Basis ® FettsalbeBenzylalkoholKein ZusatzGeeignete Antioxidanzien erlaubt (z.B.α-Tocopherol; 3-Butyl-4-hydroxyanisol)Propylenglycol mit antimikrobiellerWirkungSorbinsäure/KaliumsorbatoderMethyl-4-hydroxybenzoat/Propyl-4-hydroxybenzoatPropylenglycol mit antimikrobiellerWirkungCa. 75 % Wasser; dickflüssiges Paraffin; weißes Vaselin; Stearylalkohol; Polyoxyl-40-stearat; Dinatriumedetat;Polyacrylsäure; GeruchsstoffeCa. 30 % Wasser; dickflüssiges Paraffin; weißes Vaselin; gebleichtes Wachs; Dehymuls E (Emulgator-Grundlagen-Gemisch); Geruchsstoffe10 Teile Basisches Bismutgallat; 20 Teile Leinöl; 50 Teile Zinkoxid; 20 Teile Wollwachsalkoholsalbe SR (bestehendaus: 2,5 Teile Wollwachsalkohole; 2,1 Teile Sorbitanmonooleat; 0,9 Teile Glycerolmonooleat; 94,5 Teileweißes Vaselin)4 Teile Glycerolmonostearat 60; 6 Teile Cetylalkohol; 7,5 Teile Mittelkettige Triglyceride; 25,5 Teile weißesVaselin; 7 Teile Macrogol-20-glycerolmonostearat; 10 Teile Propylenglykol; 40 Teile gereinigtes Wasser5 Teile Carmellose-Natrium 600 (= Carboxymethylcellulose-Natrium 600); 10 Teile Glycerol 85 %; 85 TeileWasserWeißes Vaselin; Propylenglycol; gereinigtes Wasser; mittelkettige Triglyceride; Macrogol-20-glycerolmonostearat;Cetylalkohol; Glycerolmonostearat 40–55Asche Basis ® LotioAsche Basis ® SalbeAustrocknende Salbe SRBasiscreme DACCarmellose-Natrium-Gel DABCordes ® Basis RKBasis Cordes ® RKPropylenglycol mit antimikrobieller Wirkung(Butylhydroxytoluol als Antioxidanz)Gereinigtes Wasser; Poloxamer 407; Propylenglycol; Citronensäure; Di-Natriumhydrogenphosphat; ButylhydroxytoluolCordes ® GelGel Cordes ®Propylenglycol mit antimikrobiellerWirkungGereinigtes Wasser; Propylenglycol; Titandioxid; Maisstärke; Eisenoxide und -hydroxide; Macrogolglycerolricinoleat;Macrogol-5-oleylether; emulgierender Cetylstearylalkohol Typ A; Natriumhydroxid; MilchsäureCordes ® LotioLotio Cordes ®Sorbinsäure (Butylhydroxytoluol alsAntioxidanz)gereinigtes Wasser; Glycerol- und Propylenglycolfettsäureester; Macrogolether; dickflüssiges Paraffin; Sorbinsäure;Propylenglycol; Butylhydroxytoluol; Palmitoylascorbinsäure; Glycerolmonostearat; CitronensäureCordes ® MilchMilch Cordes ®Kein Zusatz (Butylhydroxytoluol alsAntioxidanz)Kein ZusatzSorbinsäureBenzylalkoholWeißes Vaselin; Wollwachs; Talkum; Titandioxid; dickflüssiges Paraffin; Wollwachsalkohol; Cetylstearylalkohol;ButylhydroxytoluolWeißes Vaselin; dickflüssiges Paraffin; Macrogolstearat 400; Glycerolmonostearat 40–55; SorbitanmonostearatWasser; Natriumhydroxid; hochdisperses Siliciumdioxid; mittelkettige Triglyceride; dickflüssiges Paraffin;Glycerolmonostearat; Propylenglycol; Polysorbat 40; Cetylstearylalkohol; weißes VaselinWasser; Octyldodecanol; dünnflüssiges Paraffin; Polysorbat 60; Sorbitanmonostearat; Stearylalkohol; Cetylalkohol;MyristylalkoholCordes ® PastePasta Cordes ®Cordes ® UnguentumUnguentum Cordes ®Decoderm ® BasiscremeDermatop ® BasiscremeKein Zusatz Glycerolmonooleat; Octyldodecanol; weißes Vaselin Dermatop ® Basis-FettsalbeKein Zusatz Wasser; Glycerolmonooleat; Magnesiumsulfat; Octyldodecanol; weißes Vaselin Dermatop ® BasissalbeBenzylalkohol0,25 % Prednicarbat; gereinigtes Wasser; Octyldodecanol; dünnflüssiges Paraffin; Polysorbat 60; Sorbitanmonostearat;Stearylalkohol; Cetylalkohol; Myristylalkohol; NatriumedetatDermatop ® Creme