Feinplanung 1. HJ â 16 Wochen je 3 Stunden = 48 Stunden GK ...
Feinplanung 1. HJ â 16 Wochen je 3 Stunden = 48 Stunden GK ...
Feinplanung 1. HJ â 16 Wochen je 3 Stunden = 48 Stunden GK ...
- Keine Tags gefunden...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
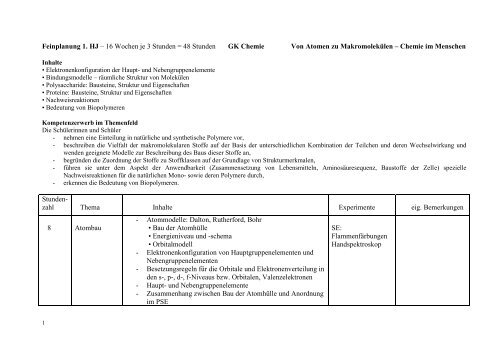
<strong>Feinplanung</strong> <strong>1.</strong> <strong>HJ</strong> – <strong>16</strong> <strong>Wochen</strong> <strong>je</strong> 3 <strong>Stunden</strong> = <strong>48</strong> <strong>Stunden</strong> <strong>GK</strong> Chemie Von Atomen zu Makromolekülen – Chemie im MenschenInhalte• Elektronenkonfiguration der Haupt- und Nebengruppenelemente• Bindungsmodelle – räumliche Struktur von Molekülen• Polysaccharide: Bausteine, Struktur und Eigenschaften• Proteine: Bausteine, Struktur und Eigenschaften• Nachweisreaktionen• Bedeutung von BiopolymerenKompetenzerwerb im ThemenfeldDie Schülerinnen und Schüler- nehmen eine Einteilung in natürliche und synthetische Polymere vor,- beschreiben die Vielfalt der makromolekularen Stoffe auf der Basis der unterschiedlichen Kombination der Teilchen und deren Wechselwirkung undwenden geeignete Modelle zur Beschreibung des Baus dieser Stoffe an,- begründen die Zuordnung der Stoffe zu Stoffklassen auf der Grundlage von Strukturmerkmalen,- führen sie unter dem Aspekt der Anwendbarkeit (Zusammensetzung von Lebensmitteln, Aminosäuresequenz, Baustoffe der Zelle) spezielleNachweisreaktionen für die natürlichen Mono- sowie deren Polymere durch,- erkennen die Bedeutung von Biopolymeren.<strong>Stunden</strong>zahlThema Inhalte Experimente eig. Bemerkungen8 Atombau- Atommodelle: Dalton, Rutherford, Bohr• Bau der Atomhülle• Energieniveau und -schema• Orbitalmodell- Elektronenkonfiguration von Hauptgruppenelementen undNebengruppenelementen- Besetzungsregeln für die Orbitale und Elektronenverteilung inden s-, p-, d-, f-Niveaus bzw. Orbitalen, Valenzelektronen- Haupt- und Nebengruppenelemente- Zusammenhang zwischen Bau der Atomhülle und Anordnungim PSESE:FlammenfärbungenHandspektroskop1
<strong>Feinplanung</strong> 3. <strong>HJ</strong> – <strong>16</strong> <strong>Wochen</strong> <strong>je</strong> 3 <strong>Stunden</strong> = <strong>48</strong> <strong>Stunden</strong> <strong>GK</strong> Chemie Von chemischen Reaktionen zu Wärme und StromInhalte• <strong>1.</strong> Hauptsatz der Thermodynamik• Ermittlung der Reaktionswärme• Redoxreaktionen – Reaktionen mit Elektronenübergängen• elektrochemische Spannungsreihe• Lokalelement, Korrosion, Korrosionsschutz• Galvanisches Element: Batterie, Akkumulator• technische Elektrolysen (ein Beispiel)Kompetenzerwerb im ThemenfeldDie Schülerinnen und Schüler- beschreiben und erläutern Phänomene der Stoff- und Energieumwandlung bei chemischen Reaktionen und erklären diese Phänomene auf der Grundlagevon Teilchen- und Bindungsmodellen,- wenden den <strong>1.</strong> Hauptsatz der Thermodynamik auf chemische Reaktionen an und bestimmen Reaktionswärmen experimentell und mathematisch,- erarbeiten die praktische Bedeutung energetischer Betrachtungen chemischer Reaktionen anhand der Heizwerte von Energieträgern und der Brennwertevon Lebensmitteln,- erkennen Redoxreaktionen als Donator-Akzeptor-Reaktionen und entwickeln für ausgewählte Reaktionen Teil- und Gesamtgleichungen,- lernen chemische und technische Grundlagen der Umwandlung von chemischer in elektrische Energie und umgekehrt kennen,- benutzen die elektrochemische Spannungsreihe als Modell, um Redoxreaktionen vorauszusagen und Zellspannungen unter Standardbedingungen zuermitteln,- erklären die Wirkung elektrochemischer Spannungsquellen und Korrosionsvorgänge und betrachten Vorgänge der Elektrolyse unter Nutzung derFARADAYschen Gesetze quantitativ,- betrachten elektrochemische Prozesse in Technik und Alltag unter dem Aspekt der Nachhaltigkeit,- erkennen die Problematik zukünftiger Energieversorgung und diskutieren verschiedene Energiekonzepte,- erkennen, beschreiben und bewerten die gesellschaftliche Relevanz und Bedeutung der angewandten Chemie für die Sicherung der Energieversorgung<strong>Stunden</strong>zahlThema Inhalte Experimente Bemerkungen- innere Energie und EnergieumwandlungenExp. zur Darstellung2 Energie-- exo- und endotherme Reaktionenvon Energieumwandumwandlungen - offene, geschlossene und abgeschlossene Systemelungen5
6Enthalpie- Reaktionsenergie und Reaktionsenthalpie- <strong>1.</strong> Hauptsatz der Thermodynamik- Satz von HESS- Bestimmung der Reaktionsenthalpie – die KalorimetergleichungexperimentelleBestimmung vonEnthalpien4 Redoxreaktion- Redoxreaktionen als Reaktionen mit Elektronenübergang- Oxidationszahlen und –stufen- korrespondierende Redoxpaare- Aufstellen von Redoxgleichungen auf der Grundlage derTeilgleichungenexp. UntersuchungvonRedoxreaktionen4elektrolytischeLeitfähigkeit- echte und potentielle Elektrolyte- elektrolytische und metallische Leitfähigkeitexp. Darstellung derIonenwanderung6 Oxolyse undRedoxreihen6 ElektrochemischeStromerzeugungGalvanischeElemente- Lösungstension- Potentialdifferenz – Elektrodenpotential- elektrochemische Doppelschicht- Löslichkeitsreihe bzw. Redoxreihe der Metalle- Standard-Wasserstoff-Elektrode als Bezugselektrode- Standardelektrodenpotentiale – elektrochem. Spannungsreiheder Metalle- Zementation – elektrochemische Fällung- Voraussagen des Ablaufs von Redoxreaktionen und exp.Prüfung- Aufbau einer galvanischen Zelle – Zelldiagramm- Funktion der galvanischen Zelle – Elektrodenreaktionen –Energieumwandlung- Standardzellspannungen- Primär- und Sekundärelemente – Aufbau und Funktion- Brennstoffzellen – Solar-Wasserstoff-Technologieexp. Ermittlung einerRedoxreihe ausmind. 4 Metallen- Zementation- Reaktionen unedlerMetalle mit Säurenexp. Bestimmungvon StandardzellspannungenBau des Daniell- unddes Leclanche-Elem.exp. Darstellung desBleiakkus6
6Elektrolyse alserzwungeneRedoxreaktion- Ablauf von Redoxvorgängen in Elektrolysezellen- Abscheidungspotential und Zersetzungsspannung- Überspannung - Einfluss des Elektrodenmaterials- Faraday – Gesetze und Berechnungen auf ihrer GrundlageElektrolyse einerCuCl 2 -Lsg.elektrolytischeWasserzersetzung4großtechnischeElektrolysen- Kupferraffination- Schmelzflusselektrolyse zur Herstellung von Aluminium- vergleichende Betrachtung6 Korrosion undKorrosionsschutz- Lokalelemente- Korrosion• Säurekorrosion• Sauerstoffkorrosion- Korrosionsschutz – aktiv, passivExperimente zurKorrosion4 - Leistungskontrollen und Klausur7
<strong>Feinplanung</strong> 4.<strong>HJ</strong> – 10 <strong>Wochen</strong> <strong>je</strong> 3 <strong>Stunden</strong> = 30 <strong>Stunden</strong> <strong>GK</strong> Chemie Von der Umkehrbarkeit chemischer Reaktionen zumchemischen GleichgewichtInhalte• Reaktionsgeschwindigkeit• Wirkungsweise von Katalysatoren• Merkmale des chemischen Gleichgewichts• Prinzip von LE CHATELIER und BRAUN• Massenwirkungsgesetz• Säure-Base-Theorie von BRÖNSTED• Ionenprodukt des Wassers• pH-Wert• Säure-Base-Indikatoren• Säure-Base-Titrationen• eine ausgewählte technische Synthese• Grundprinzipien der technischen Chemie (Gegenstrom-, Rückführungsprinzip)• ein StoffkreislaufKompetenzerwerb im ThemenfeldDie Schülerinnen und Schüler- erkennen, dass viele chemische Reaktionen zu Gleichgewichtszuständen führen können,- nutzen Kenntnisse über die Merkmale und die Beeinflussbarkeit chemischer Gleichgewichte zur Diskussion von Problemen der Durchführungchemischer Reaktionen in der chemischen Industrie,- formulieren mithilfe des Massenwirkungsgesetzes (MWG) quantitative Aussagen zur Lage von Gleichgewichtsreaktionen,- wenden das MWG auf Gasgleichgewichte und Gleichgewichte in wässrigen Lösungen an,- beurteilen unter Nutzung des MWG bedeutende großtechnische Synthesen, wie z. B. das HABER-BOSCH-Verfahren, hinsichtlich ihrerWirtschaftlichkeit,- stellen den Zusammenhang von Ionenprodukt des Wassers und pH-Wert dar,- berechnen pH-Werte, planen selbstständig Säure-Base-Titrationen und führen diese durch,- untersuchen und diskutieren die Bedeutung des pH-Wertes in Alltag und Technik.<strong>Stunden</strong>zahlThema Inhalte Experimente BemerkungenReaktionsgeschwindigkeit- Definition der ReaktionsgeschwindigkeitPraktikum „6- Einfluss von T, c, pReaktionsge-und Katalyse - RGT – Regelschwindigkeit“8
8 ChemischesGleichgewichtund MWG12 Gleichgewichtein wässrigenLösungen- Einfluss von Katalysatoren- Geschwindigkeitsgesetz- unvollständiger und vollständiger Stoffumsatz- umkehrbare Reaktionen- das chemische Gleichgewicht und das Prinzip von Le Chatelierund Braun- das MWG und seine Anwendung auf einfache organischeGleichgewichte- kinetische Herleitung des MWG- Ammoniaksynthese oder Schwefelsäureherstellung- Löslichkeitsgleichgewichte – Löslichkeitsprodukt- Säure-Base-Theorie von Brönsted• Reaktion mit Protonenübergang• korrespondierende Säure-Base-Paare• Ampholyte- Autoprotolyse von Wasser – Ionenprodukt des Wassers- pH-Wert- Stärke von Säuren und Basen- Puffersysteme – Bedeutung und phänomenologische Betrachtung- Neutralisation und Indikatoren- Maßanalyse, Titration einwertiger Protolyte↗ Schrödel-LB„Chemie heute“SE:EstergleichgewichtSE:Fällungsreaktionenals IonennachweiseEssigsäure/Acetat-PufferTitration4 - Leistungskontrollen und Klausur9