HerzSupplement - Pentalong von Actavis
HerzSupplement - Pentalong von Actavis HerzSupplement - Pentalong von Actavis
Herz Supplement Cardiovascular Diseases A % mRNA in der Aorta von mit EtOH behandelten Tieren 200 180 160 140 120 100 80 60 40 20 0 FeHc ns HO-1 ns EtOH NTG EtOH NTG % mRNA in der Aorta von mit DMSO behandelten Tieren 300 250 200 150 100 50 0 FeHc DMSO PETN DMSO PETN Abb. 3: Die Wirkung von NTG bzw. PETN auf die Expression der Hämoxygenase I (HO-1) und der schweren Kette des Ferritins (FeHc) in Aorten von Ratten. Männliche Wistar-Ratten wurden für vier Tage mithilfe von mikroosmotischen Pumpen (Alznet) mit NTG (6,6 μg/kg/min) oder PETN (10,5 μg/kg/min; bzw. den zugehörigen Lösungsmitteln EtOH oder DMSO) behandelt. Dann wurden die Tiere getötet und Organe (Aorta, Herz etc.) entnommen. Die RNA wurde aus den Organen isoliert und für DNA-Microarray-Analysen oder qRT-PCR-Untersuchungen eingesetzt. Gezeigt sind Ergebnisse der qRT-PCR-Analysen mit RNA aus den Aorten. Dabei wurde die mRNA-Expression der Hämoxygenase I (HO-1) bzw. der schweren Kette des Ferritin (FeHc) auf die Expression des Haushaltsgens GAPDH bezogen (*: p < 0,05, ns: nicht signifikant verschieden vs. mit Lösungsmittel behandelte Tiere). B lation der mRNA-Stabilität bzw. -Translation erfolgt dabei über Modulation der Aktivität/Expression von RNA-BP wie HuR (human antigen R) oder dem IRP-1 (iron responsive element binding protein- 1). Schließlich kann NO auch die Stabilität von Proteinen regulieren, wie am Beispiel des Hypoxie-induzierten Faktors-1 (HIF- 1) beschrieben wird [10]. Wirkungen von organischen Nitraten auf die Genexpression Organische Nitrate werden als indirekte NO-Donatoren angesehen. Daher ist es sehr wahrscheinlich, dass auch organische Nitrate (zumindest bei längerer Anwendung) Effekte auf die Expression multipler Gene haben (Tab. 1). So wurde gezeigt, dass NTG z. B. die c-fos-, COX-2-, Bcl2- und nNOS-Expression im Gehirn und der eNOS in Aorten von Ratten erhöht. Mithilfe von DNA-Microarray-Analysen zeigten Wang et al eine NTG-abhängige Regulation der Expression von 290 Genen in Aorten von NTG-behandelten Ratten [11]. Es gibt auch einige Analysen zu den expressionellen Wirkungen des organischen Nitrats PETN (Tab. 1). PETN, aber nicht NTG, erhöht in humanen Endothelzellen und Aorten von Schweinen die Expression * von antioxidativ wirkenden Proteinen wie HO-1 und FeHc [12]. Auch in den Aorten von Ratten konnte dieser Unterschied der beiden organischen Nitrate auf die FeHc- bzw. HO-1-Expression von den Autoren beobachtet werden (Abb. 3). Diese Unterschiede in der Wirkung von PETN bzw. NTG auf die Expression antioxidativer Proteine könnte die Unterschiede in der Produktion reaktiver Sauerstoffspezies (ROS) durch diese organischen Nitrate zumindest zum Teil erklären. Die molekularen Mechanismen, die hinter diesen unterschiedlichen Effekten stehen, sind noch nicht vollständig klar. Vergleicht man die DNA-Sequenzen der 5’-flankierenden genomischen Bereiche (die Promotoren; 10 kb) des HO-1-Gens in verschiedenen Spezies (Ratte, Maus, Rhesus-Affe, Schimpanse und Mensch), so erkennt man Sequenzbereiche, die zwischen diesen Spezies hoch konserviert sind (Abb. 4). Solche Sequenzbereiche sind mit hoher Wahrscheinlichkeit an der Regulation der HO-1-Promotoraktivität beteiligt. So findet sich in einem solchen Homologiebereich auch die Konsensussequenz für die Bindung des TF NRF2. So konnte z. B. gezeigt werden, dass die Erhöhung der HO-1-Expression in humanen SH-Sy5y- Neuroblastom-Zellen durch Behandlung mit dem NO-Donor DETA-NO von der Anwesenheit des Transkriptionsfaktors NRF2 abhängt [13]. Neben diesen transkriptionellen Wirkungen von NO auf die HO-1-Expression, sind auch posttranskriptionelle Prozesse (mRNA-Stabilität und -Translatierbarkeit) an der NO-abhängigen Regulation der HO- 1-Expression beteiligt. Die posttranskriptionale Regulation der Genexpression ist häufig von DNA- bzw. RNA-Sequenzen abhängig, die sich in der 3’-untranslatierten Region (3’-UTR) der mRNAs befinden [14, 15]. Vergleicht man nun die 3’-UTR-Sequenzen der HO-1-mRNA verschiedener Spezies (Abb. 5a), so findet man auch hier Sequenzbereiche mit hoher Homologie. Bildet man nun aus diesen Sequenzen eine Konsensus-Sequenz, so erkennt man die hohe Konservierung von AU-reichen Elementen (ARE) in der 3’-UTR-Sequenz der HO-1-mRNA (Abb. 5b). An solche ARE können verschiedene RNA-BP (dann ARE- BP genannt) wie HuR binden, die die Stabilität und Translatierbarkeit von mRNAs regulieren. So fanden Kuwano et al. eine 58 Herz 35 · 2010 · Supplement II © Urban & Vogel HO-1 *
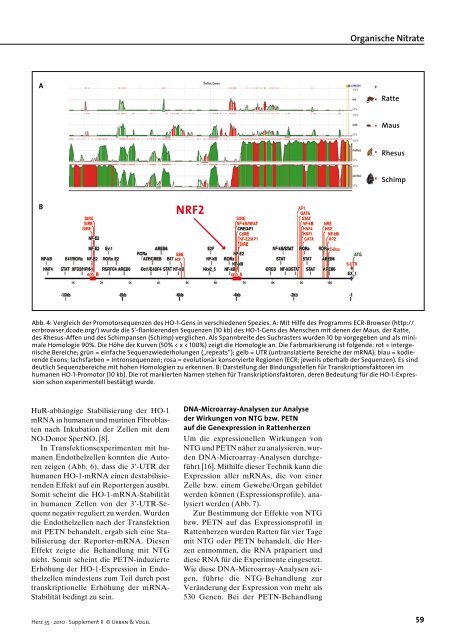
A B NRF2 HuR-abhängige Stabilisierung der HO-1 mRNA in humanen und murinen Fibroblasten nach Inkubation der Zellen mit dem NO-Donor SperNO. [8]. In Transfektionsexperimenten mit humanen Endothelzellen konnten die Autoren zeigen (Abb. 6), dass die 3’-UTR der humanen HO-1-mRNA einen destabilisierenden Effekt auf ein Reportergen ausübt. Somit scheint die HO-1-mRNA-Stabilität in humanen Zellen von der 3’-UTR-Sequenz negativ reguliert zu werden. Wurden die Endothelzellen nach der Transfektion mit PETN behandelt, ergab sich eine Stabilisierung der Reporter-mRNA. Diesen Effekt zeigte die Behandlung mit NTG nicht. Somit scheint die PETN-induzierte Erhöhung der HO-1-Expression in Endothelzellen mindestens zum Teil durch post transkriptionelle Erhöhung der mRNA- Stabilität bedingt zu sein. Herz 35 · 2010 · Supplement II © Urban & Vogel DNA-Microarray-Analysen zur Analyse der Wirkungen von NTG bzw. PETN auf die Genexpression in Rattenherzen Um die expressionellen Wirkungen von NTG und PETN näher zu analysieren, wurden DNA-Microarray-Analysen durchgeführt [16]. Mithilfe dieser Technik kann die Expression aller mRNAs, die von einer Zelle bzw. einem Gewebe/Organ gebildet werden können (Expressionsprofile), analysiert werden (Abb. 7). Zur Bestimmung der Effekte von NTG bzw. PETN auf das Expressionsprofil in Rattenherzen wurden Ratten für vier Tage mit NTG oder PETN behandelt, die Herzen entnommen, die RNA präpariert und diese RNA für die Experimente eingesetzt. Wie diese DNA-Microarray-Analysen zeigen, führte die NTG-Behandlung zur Veränderung der Expression von mehr als 530 Genen. Bei der PETN-Behandlung Organische Nitrate Abb. 4: Vergleich der Promotorsequenzen des HO-1-Gens in verschiedenen Spezies. A: Mit Hilfe des Programms ECR-Browser (http:// ecrbrowser.dcode.org/) wurde die 5’-flankierenden Sequenzen (10 kb) des HO-1-Gens des Menschen mit denen der Maus, der Ratte, des Rhesus-Affen und des Schimpansen (Schimp) verglichen. Als Spannbreite des Suchrasters wurden 10 bp vorgegeben und als minimale Homologie 90%. Die Höhe der Kurven (50% < x < 100%) zeigt die Homologie an. Die Farbmarkierung ist folgende: rot = intergenische Bereiche; grün = einfache Sequenzwiederholungen („repeats“); gelb = UTR (untranslatierte Bereiche der mRNA); blau = kodierende Exons; lachsfarben = Intronsequenzen; rosa = evolutionär konservierte Regionen (ECR; jeweils oberhalb der Sequenzen). Es sind deutlich Sequenzbereiche mit hohen Homologien zu erkennen. B: Darstellung der Bindungsstellen für Transkriptionsfaktoren im humanen HO-1-Promotor (10 kb). Die rot markierten Namen stehen für Transkriptionsfaktoren, deren Bedeutung für die HO-1-Expression schon experimentell bestätigt wurde. Ratte Maus Rhesus Schimp 59
- Seite 7 und 8: Entwicklung einer LC-MS-Methode zur
- Seite 9 und 10: Bildung von FormiatAddukten zu ge
- Seite 11 und 12: Summary Pentaerythritol tetranitrat
- Seite 13 und 14: von Cholesterolsynthesehemmern (Sta
- Seite 15 und 16: Aggregation [%] 120 100 80 60 40 20
- Seite 17 und 18: Der durch Fluoreszenzmessungen erka
- Seite 19 und 20: eigene Klasse von Nitrovasodilatato
- Seite 21 und 22: tenverzweigung führte zu abgeschw
- Seite 23 und 24: nische Nitrate wirken, weil aus ihr
- Seite 25 und 26: mitierung der organischen Nitrate d
- Seite 27 und 28: A 5,5 p = 0,427 B C Durchmesser der
- Seite 29 und 30: fokussiert. Wir konnten in älteren
- Seite 31 und 32: Nach Daiber et al. In Vorbereitung
- Seite 33 und 34: L-012-Chemilumineszenz [min] 1,2 ×
- Seite 35 und 36: chondrial nitrite reduction coupled
- Seite 37 und 38: iosklerose verlangsamt werden könn
- Seite 39 und 40: L-NAME Puffer Nicht bestimmte Einhe
- Seite 41 und 42: Nach Schuhmacher et al. Hypertensio
- Seite 43 und 44: oxidativen Spektrums nicht nur auss
- Seite 45 und 46: Pulmonale Hypertonie - ein weiteres
- Seite 47 und 48: 2. Pulmonale Hypertonie - klinische
- Seite 49 und 50: Literatur 1. Schwemmer M, Bassenge
- Seite 51 und 52: Klinisch von Bedeutung sind vor all
- Seite 53 und 54: a 123-Rhodaminfluoreszenz ∆% zu u
- Seite 55 und 56: we speculate that GTN affects ROS f
- Seite 57: der Zellen exportiert werden. Auch
- Seite 61 und 62: a Relative Luciferaseaktivität [%
- Seite 63 und 64: die nach Literaturangaben (siehe [1
- Seite 65 und 66: Unterschiede in den freigesetzten N
A<br />
B NRF2<br />
HuR-abhängige Stabilisierung der HO-1<br />
mRNA in humanen und murinen Fibroblasten<br />
nach Inkubation der Zellen mit dem<br />
NO-Donor SperNO. [8].<br />
In Transfektionsexperimenten mit humanen<br />
Endothelzellen konnten die Autoren<br />
zeigen (Abb. 6), dass die 3’-UTR der<br />
humanen HO-1-mRNA einen destabilisierenden<br />
Effekt auf ein Reportergen ausübt.<br />
Somit scheint die HO-1-mRNA-Stabilität<br />
in humanen Zellen <strong>von</strong> der 3’-UTR-Sequenz<br />
negativ reguliert zu werden. Wurden<br />
die Endothelzellen nach der Transfektion<br />
mit PETN behandelt, ergab sich eine Stabilisierung<br />
der Reporter-mRNA. Diesen<br />
Effekt zeigte die Behandlung mit NTG<br />
nicht. Somit scheint die PETN-induzierte<br />
Erhöhung der HO-1-Expression in Endothelzellen<br />
mindestens zum Teil durch post<br />
transkriptionelle Erhöhung der mRNA-<br />
Stabilität bedingt zu sein.<br />
Herz 35 · 2010 · Supplement II © Urban & Vogel<br />
DNA-Microarray-Analysen zur Analyse<br />
der Wirkungen <strong>von</strong> NTG bzw. PETN<br />
auf die Genexpression in Rattenherzen<br />
Um die expressionellen Wirkungen <strong>von</strong><br />
NTG und PETN näher zu analysieren, wurden<br />
DNA-Microarray-Analysen durchgeführt<br />
[16]. Mithilfe dieser Technik kann die<br />
Expression aller mRNAs, die <strong>von</strong> einer<br />
Zelle bzw. einem Gewebe/Organ gebildet<br />
werden können (Expressionsprofile), analysiert<br />
werden (Abb. 7).<br />
Zur Bestimmung der Effekte <strong>von</strong> NTG<br />
bzw. PETN auf das Expressionsprofil in<br />
Rattenherzen wurden Ratten für vier Tage<br />
mit NTG oder PETN behandelt, die Herzen<br />
entnommen, die RNA präpariert und<br />
diese RNA für die Experimente eingesetzt.<br />
Wie diese DNA-Microarray-Analysen zeigen,<br />
führte die NTG-Behandlung zur<br />
Veränderung der Expression <strong>von</strong> mehr als<br />
530 Genen. Bei der PETN-Behandlung<br />
Organische Nitrate<br />
Abb. 4: Vergleich der Promotorsequenzen des HO-1-Gens in verschiedenen Spezies. A: Mit Hilfe des Programms ECR-Browser (http://<br />
ecrbrowser.dcode.org/) wurde die 5’-flankierenden Sequenzen (10 kb) des HO-1-Gens des Menschen mit denen der Maus, der Ratte,<br />
des Rhesus-Affen und des Schimpansen (Schimp) verglichen. Als Spannbreite des Suchrasters wurden 10 bp vorgegeben und als minimale<br />
Homologie 90%. Die Höhe der Kurven (50% < x < 100%) zeigt die Homologie an. Die Farbmarkierung ist folgende: rot = intergenische<br />
Bereiche; grün = einfache Sequenzwiederholungen („repeats“); gelb = UTR (untranslatierte Bereiche der mRNA); blau = kodierende<br />
Exons; lachsfarben = Intronsequenzen; rosa = evolutionär konservierte Regionen (ECR; jeweils oberhalb der Sequenzen). Es sind<br />
deutlich Sequenzbereiche mit hohen Homologien zu erkennen. B: Darstellung der Bindungsstellen für Transkriptionsfaktoren im<br />
humanen HO-1-Promotor (10 kb). Die rot markierten Namen stehen für Transkriptionsfaktoren, deren Bedeutung für die HO-1-Expression<br />
schon experimentell bestätigt wurde.<br />
Ratte<br />
Maus<br />
Rhesus<br />
Schimp<br />
59