HerzSupplement - Pentalong von Actavis
HerzSupplement - Pentalong von Actavis HerzSupplement - Pentalong von Actavis
Herz Supplement Cardiovascular Diseases Abb. 2: Funktioneller Nachweis eines spezifischen Rh123-Transportes mittels Durchflusszytometrie. Die Auswertung der Daten erfolgte über den geometrischen Mittelwert der Histogramme. Dargestellt sind die prozentualen Unterschiede bezogen auf die Kontrolle (*: signifikant gegenüber unstimulierten Zellen; #: signifikant gegenüber Efflux). Abb. 3: Die Determination reaktiver Sauerstoffspezies mittels HPLC. EA.hy.926- Zellen wurde 60 min mit 500 μmol/l GTN ± 2 μmol/l Cyclosporin inkubiert. Rh123 wurde aus dem Zelllysat (A) und dem Inkubationsüberstand (B) extrahiert und die Fluoreszenz nach chromatografischer Trennung quantifiziert (*: signifikant gegenüber unstimulierten Zellen; #: signifikant im Vergleich zu mit GTN-stimulierten Zellen). Abb. 4: EA.hy.926-Zellen wurden 30 min mit 10 μmol/l des jeweiligen Nitrats inkubiert. Nach der Extraktion aus Zelllysat (A) und Inkubationsüberstand (B) wurde Rh123 mittels HPLC quantifiziert (*: signifikant gegenüber unstimulierten Zellen). ∆% zur Kontrolle 0 –10 –20 –30 –40 –50 –60 * *# Efflux CycloA den konnte. Der Unterschied war nach fünf Minuten am stärksten ausgeprägt. Nach zehn und 20 Minuten war zwar ebenfalls ein Anstieg der Fluoreszenz nachweisbar, jedoch nahm das detektierte Signal überraschenderweise mit steigender Inkubationszeit ab. Da Rh123 als Substrat für pGlycoprotein und andere Transporter der ABCFamilie beschrieben worden ist [15, 16], ka a 123-Rhodaminfluoreszenz ∆% zu unstimulierten Zellen a 123 Rhodaminfluoreszenz ∆% zu unstimulierten Zellen 50 40 30 20 10 0 50 40 30 20 10 0 men Zweifel bezüglich der diffusionskontrollierten Stabilität des Fluoreszenzsignals auf, sodass EA.hy.926Zellen mittels Durchflusszytometrie auf einen RhodaminEfflux untersucht wurden. Die in Abbildung 2 dargestellten Ergebnisse zeigen, dass ein solcher nachgewiesen und dieser wie in der Literatur beschrieben durch Cyclosporin A gehemmt werden konnte [17]. Eine weitere Ursache für die Abnahme der intrazellulären Fluoreszenz könnte der in der Literatur beschriebene Einfluss von GTN auf die Öffnung der mitochondrialen Transitionsporen sein, die ebenfalls zu einer Abnahme der intrazellulären Rhodaminkonzentration beitragen könnte [18, 19]. Die Öffnung der Poren kann ebenfalls durch Cyclosporin A inhibiert werden [20]. Dementsprechend führte die Stimulation der Bildung reaktiver Sauerstoffspezies mit GTN bei gleichzeitiger Inkubation mit Cyclosporin A dazu, dass das intrazelluläre Fluoreszenzsignal auch nach 60minütiger Inkubation mit GTN iden –40 Cyclo A GTN Cyclo A + GTN Cyclo A GTN Cyclo A + GTN 52 Herz 35 · 2010 · Supplement II © Urban & Vogel * # B 123-Rhodaminfluoreszenz ∆% zu unstimulierten Zellen B 123 Rhodaminfluoreszenz ∆% zu unstimulierten Zellen 0 ISDN GTN PETN ISDN GTN PETN 80 60 40 20 0 –20 80 60 40 20 * *
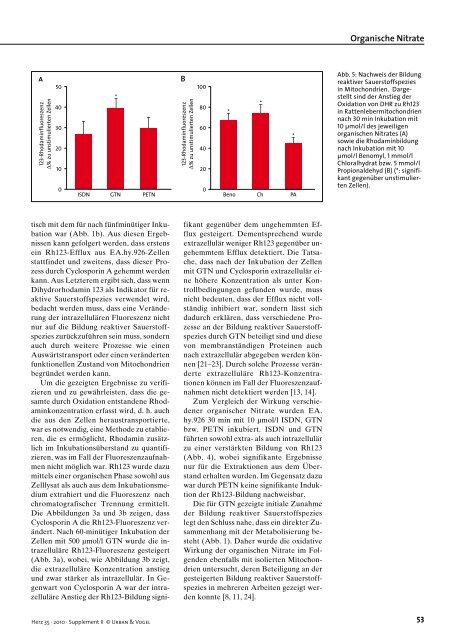
a 123-Rhodaminfluoreszenz ∆% zu unstimulierten Zellen 50 40 30 20 10 0 0 ISDN GTN PETN Beno Ch PA tisch mit dem für nach fünfminütiger Inkubation war (Abb. 1b). Aus diesen Ergebnissen kann gefolgert werden, dass erstens ein Rh123Efflux aus EA.hy.926Zellen stattfindet und zweitens, dass dieser Prozess durch Cyclosporin A gehemmt werden kann. Aus Letzterem ergibt sich, dass wenn Dihydrorhodamin 123 als Indikator für reaktive Sauerstoffspezies verwendet wird, bedacht werden muss, dass eine Veränderung der intrazellulären Fluoreszenz nicht nur auf die Bildung reaktiver Sauerstoffspezies zurückzuführen sein muss, sondern auch durch weitere Prozesse wie einen Auswärtstransport oder einen veränderten funktionellen Zustand von Mitochondrien begründet werden kann. Um die gezeigten Ergebnisse zu verifizieren und zu gewährleisten, dass die gesamte durch Oxidation entstandene Rhodaminkonzentration erfasst wird, d. h. auch die aus den Zellen heraustransportierte, war es notwendig, eine Methode zu etablieren, die es ermöglicht, Rhodamin zusätzlich im Inkubationsüberstand zu quantifizieren, was im Fall der Fluoreszenzaufnahmen nicht möglich war. Rh123 wurde dazu mittels einer organischen Phase sowohl aus Zelllysat als auch aus dem Inkubationsmedium extrahiert und die Fluoreszenz nach chromatografischer Trennung ermittelt. Die Abbildungen 3a und 3b zeigen, dass Cyclosporin A die Rh123Fluoreszenz verändert. Nach 60minütiger Inkubation der Zellen mit 500 µmol/l GTN wurde die intrazelluläre Rh123Fluoreszenz gesteigert (Abb. 3a), wobei, wie Abbildung 3b zeigt, die extrazelluläre Konzentration anstieg und zwar stärker als intrazellulär. In Gegenwart von Cyclosporin A war der intrazelluläre Anstieg der Rh123Bildung signi Herz 35 · 2010 · Supplement II © Urban & Vogel * B 123-Rhodaminfluoreszenz ∆% zu unstimulierten Zellen 100 80 60 40 20 * fikant gegenüber dem ungehemmten Efflux gesteigert. Dementsprechend wurde extrazellulär weniger Rh123 gegenüber ungehemmtem Efflux detektiert. Die Tatsache, dass nach der Inkubation der Zellen mit GTN und Cyclosporin extrazellulär eine höhere Konzentration als unter Kontrollbedingungen gefunden wurde, muss nicht bedeuten, dass der Efflux nicht vollständig inhibiert war, sondern lässt sich dadurch erklären, dass verschiedene Prozesse an der Bildung reaktiver Sauerstoffspezies durch GTN beteiligt sind und diese von membranständigen Proteinen auch nach extrazellulär abgegeben werden können [21–23]. Durch solche Prozesse veränderte extrazelluläre Rh123Konzentrationen können im Fall der Fluoreszenzaufnahmen nicht detektiert werden [13, 14]. Zum Vergleich der Wirkung verschiedener organischer Nitrate wurden EA. hy.926 30 min mit 10 µmol/l ISDN, GTN bzw. PETN inkubiert. ISDN und GTN führten sowohl extra als auch intrazellulär zu einer verstärkten Bildung von Rh123 (Abb. 4), wobei signifikante Ergebnisse nur für die Extraktionen aus dem Überstand erhalten wurden. Im Gegensatz dazu war durch PETN keine signifikante Induktion der Rh123Bildung nachweisbar. Die für GTN gezeigte initiale Zunahme der Bildung reaktiver Sauerstoffspezies legt den Schluss nahe, dass ein direkter Zusammenhang mit der Metabolisierung besteht (Abb. 1). Daher wurde die oxidative Wirkung der organischen Nitrate im Folgenden ebenfalls mit isolierten Mitochondrien untersucht, deren Beteiligung an der gesteigerten Bildung reaktiver Sauerstoffspezies in mehreren Arbeiten gezeigt werden konnte [8, 11, 24]. * * Organische Nitrate Abb. 5: Nachweis der Bildung reaktiver Sauerstoffspezies in Mitochondrien. Dargestellt sind der Anstieg der Oxidation von DHR zu Rh123 in Rattenlebermitochondrien nach 30 min Inkubation mit 10 μmol/l des jeweiligen organischen Nitrates (A) sowie die Rhodaminbildung nach Inkubation mit 10 μmol/l Benomyl, 1 mmol/l Chloralhydrat bzw. 5 mmol/l Propionaldehyd (B) (*: signifikant gegenüber unstimulierten Zellen). 53
- Seite 1 und 2: Herz Supplement Cardiovascular Dise
- Seite 3 und 4: Vorwort PETN- und PETN-Verwandtes I
- Seite 5 und 6: in A gehemmt wurden, dann fand kein
- Seite 7 und 8: Entwicklung einer LC-MS-Methode zur
- Seite 9 und 10: Bildung von FormiatAddukten zu ge
- Seite 11 und 12: Summary Pentaerythritol tetranitrat
- Seite 13 und 14: von Cholesterolsynthesehemmern (Sta
- Seite 15 und 16: Aggregation [%] 120 100 80 60 40 20
- Seite 17 und 18: Der durch Fluoreszenzmessungen erka
- Seite 19 und 20: eigene Klasse von Nitrovasodilatato
- Seite 21 und 22: tenverzweigung führte zu abgeschw
- Seite 23 und 24: nische Nitrate wirken, weil aus ihr
- Seite 25 und 26: mitierung der organischen Nitrate d
- Seite 27 und 28: A 5,5 p = 0,427 B C Durchmesser der
- Seite 29 und 30: fokussiert. Wir konnten in älteren
- Seite 31 und 32: Nach Daiber et al. In Vorbereitung
- Seite 33 und 34: L-012-Chemilumineszenz [min] 1,2 ×
- Seite 35 und 36: chondrial nitrite reduction coupled
- Seite 37 und 38: iosklerose verlangsamt werden könn
- Seite 39 und 40: L-NAME Puffer Nicht bestimmte Einhe
- Seite 41 und 42: Nach Schuhmacher et al. Hypertensio
- Seite 43 und 44: oxidativen Spektrums nicht nur auss
- Seite 45 und 46: Pulmonale Hypertonie - ein weiteres
- Seite 47 und 48: 2. Pulmonale Hypertonie - klinische
- Seite 49 und 50: Literatur 1. Schwemmer M, Bassenge
- Seite 51: Klinisch von Bedeutung sind vor all
- Seite 55 und 56: we speculate that GTN affects ROS f
- Seite 57 und 58: der Zellen exportiert werden. Auch
- Seite 59 und 60: A B NRF2 HuR-abhängige Stabilisier
- Seite 61 und 62: a Relative Luciferaseaktivität [%
- Seite 63 und 64: die nach Literaturangaben (siehe [1
- Seite 65 und 66: Unterschiede in den freigesetzten N
a<br />
123-Rhodaminfluoreszenz<br />
∆% zu unstimulierten Zellen<br />
50<br />
40<br />
30<br />
20<br />
10<br />
0<br />
0<br />
ISDN GTN PETN<br />
Beno Ch<br />
PA<br />
tisch mit dem für nach fünfminütiger Inkubation<br />
war (Abb. 1b). Aus diesen Ergebnissen<br />
kann gefolgert werden, dass erstens<br />
ein Rh123Efflux aus EA.hy.926Zellen<br />
stattfindet und zweitens, dass dieser Prozess<br />
durch Cyclosporin A gehemmt werden<br />
kann. Aus Letzterem ergibt sich, dass wenn<br />
Dihydrorhodamin 123 als Indikator für reaktive<br />
Sauerstoffspezies verwendet wird,<br />
bedacht werden muss, dass eine Veränderung<br />
der intrazellulären Fluoreszenz nicht<br />
nur auf die Bildung reaktiver Sauerstoffspezies<br />
zurückzuführen sein muss, sondern<br />
auch durch weitere Prozesse wie einen<br />
Auswärtstransport oder einen veränderten<br />
funktionellen Zustand <strong>von</strong> Mitochondrien<br />
begründet werden kann.<br />
Um die gezeigten Ergebnisse zu verifizieren<br />
und zu gewährleisten, dass die gesamte<br />
durch Oxidation entstandene Rhodaminkonzentration<br />
erfasst wird, d. h. auch<br />
die aus den Zellen heraustransportierte,<br />
war es notwendig, eine Methode zu etablieren,<br />
die es ermöglicht, Rhodamin zusätzlich<br />
im Inkubationsüberstand zu quantifizieren,<br />
was im Fall der Fluoreszenzaufnahmen<br />
nicht möglich war. Rh123 wurde dazu<br />
mittels einer organischen Phase sowohl aus<br />
Zelllysat als auch aus dem Inkubationsmedium<br />
extrahiert und die Fluoreszenz nach<br />
chromatografischer Trennung ermittelt.<br />
Die Abbildungen 3a und 3b zeigen, dass<br />
Cyclosporin A die Rh123Fluoreszenz verändert.<br />
Nach 60minütiger Inkubation der<br />
Zellen mit 500 µmol/l GTN wurde die intrazelluläre<br />
Rh123Fluoreszenz gesteigert<br />
(Abb. 3a), wobei, wie Abbildung 3b zeigt,<br />
die extrazelluläre Konzentration anstieg<br />
und zwar stärker als intrazellulär. In Gegenwart<br />
<strong>von</strong> Cyclosporin A war der intrazelluläre<br />
Anstieg der Rh123Bildung signi<br />
Herz 35 · 2010 · Supplement II © Urban & Vogel<br />
*<br />
B<br />
123-Rhodaminfluoreszenz<br />
∆% zu unstimulierten Zellen<br />
100<br />
80<br />
60<br />
40<br />
20<br />
*<br />
fikant gegenüber dem ungehemmten Efflux<br />
gesteigert. Dementsprechend wurde<br />
extrazellulär weniger Rh123 gegenüber ungehemmtem<br />
Efflux detektiert. Die Tatsache,<br />
dass nach der Inkubation der Zellen<br />
mit GTN und Cyclosporin extrazellulär eine<br />
höhere Konzentration als unter Kontrollbedingungen<br />
gefunden wurde, muss<br />
nicht bedeuten, dass der Efflux nicht vollständig<br />
inhibiert war, sondern lässt sich<br />
dadurch erklären, dass verschiedene Prozesse<br />
an der Bildung reaktiver Sauerstoffspezies<br />
durch GTN beteiligt sind und diese<br />
<strong>von</strong> membranständigen Proteinen auch<br />
nach extrazellulär abgegeben werden können<br />
[21–23]. Durch solche Prozesse veränderte<br />
extrazelluläre Rh123Konzentrationen<br />
können im Fall der Fluoreszenzaufnahmen<br />
nicht detektiert werden [13, 14].<br />
Zum Vergleich der Wirkung verschiedener<br />
organischer Nitrate wurden EA.<br />
hy.926 30 min mit 10 µmol/l ISDN, GTN<br />
bzw. PETN inkubiert. ISDN und GTN<br />
führten sowohl extra als auch intrazellulär<br />
zu einer verstärkten Bildung <strong>von</strong> Rh123<br />
(Abb. 4), wobei signifikante Ergebnisse<br />
nur für die Extraktionen aus dem Überstand<br />
erhalten wurden. Im Gegensatz dazu<br />
war durch PETN keine signifikante Induktion<br />
der Rh123Bildung nachweisbar.<br />
Die für GTN gezeigte initiale Zunahme<br />
der Bildung reaktiver Sauerstoffspezies<br />
legt den Schluss nahe, dass ein direkter Zusammenhang<br />
mit der Metabolisierung besteht<br />
(Abb. 1). Daher wurde die oxidative<br />
Wirkung der organischen Nitrate im Folgenden<br />
ebenfalls mit isolierten Mitochondrien<br />
untersucht, deren Beteiligung an der<br />
gesteigerten Bildung reaktiver Sauerstoffspezies<br />
in mehreren Arbeiten gezeigt werden<br />
konnte [8, 11, 24].<br />
*<br />
*<br />
Organische Nitrate<br />
Abb. 5: Nachweis der Bildung<br />
reaktiver Sauerstoffspezies<br />
in Mitochondrien. Dargestellt<br />
sind der Anstieg der<br />
Oxidation <strong>von</strong> DHR zu Rh123<br />
in Rattenlebermitochondrien<br />
nach 30 min Inkubation mit<br />
10 μmol/l des jeweiligen<br />
organischen Nitrates (A)<br />
sowie die Rhodaminbildung<br />
nach Inkubation mit 10<br />
μmol/l Benomyl, 1 mmol/l<br />
Chloralhydrat bzw. 5 mmol/l<br />
Propionaldehyd (B) (*: signifikant<br />
gegenüber unstimulierten<br />
Zellen).<br />
53