Skript - Mikrobiologie und Weinforschung - Johannes Gutenberg ...
Skript - Mikrobiologie und Weinforschung - Johannes Gutenberg ...
Skript - Mikrobiologie und Weinforschung - Johannes Gutenberg ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Anfängerübungen in <strong>Mikrobiologie</strong>Teil 2WS 2013/2014<strong>Mikrobiologie</strong> <strong>und</strong> <strong>Weinforschung</strong><strong>Johannes</strong> <strong>Gutenberg</strong>-UniversitätMainzIdentifizierung <strong>und</strong> Charakterisierung von Mikroorganismen:Stoffwechselphysiologische Merkmale1
ProfileAssistant professor:the University of Electro-Communications, Japan(also providing consultancy service to industry on testing and TQM)President:Association of Software Test Engineering, Japan (ASTER)President:Japan Software Testing Qualifications Board (JSTQB)National delegate:ISO/IEC JTC1/SC7/WG26 Software testingfor ISO/IEC/IEEE 29119-1, 2, 3, 4, 5 and ISO/IEC 33063Fo<strong>und</strong>er:Japan Symposium on Software Testing (JaSST)Fo<strong>und</strong>er:Testing Engineers’ Forum (Japanese community on software testing)Fo<strong>und</strong>er and awards committee member:Software Test Design ContestVice chair:SQiP/Software Quality Committee of JUSE (promoting organization of TQM)(SQiP has published the book of “SQuBOK: Software Quality Body of Knowledge”)2© NISHI, Yasuharu
Ergebnis:Blaufärbung (stark, schwach, fehlend):E. coli:……………………………………….. Unbekanntes Bakterium 1: ………………Ps. stutzeri: ……………………………..Unbekanntes Bakterium 2: ………………Lactobacillus lactis:…………………… Unbekanntes Bakterium 3: ………………B) Katalase-TestVerschiedene bakterielle Oxidasen produzieren in Gegenwart von Sauerstoff Wasserstoffperoxid(H 2 O 2 ). Katalase, die in vielen aeroben Bakterien zu finden ist, spaltetWasserstoffperoxid zu weniger toxischen Produkten: 2 H 2 O 2 → 2 H 2 O + O 2Die Freisetzung von O 2 ist an der Bildung von Gasblasen erkennbar.Material 3% H 2 O 2 (v/v) in H 2 O (10 ml in Tropfflasche, 1 x pro Bank) Objektträger (4 pro Gruppe) 8 Zahnstocher pro Gruppe Vereinzelungsausstrich von 3 unbekannten Bakterien Standard I-Agarplatten mit den Referenzorganismen (E. coli, P. stutzeri, Lactobacilluslactis ). Je eine Platte pro Bank, vergl. Oxidasetest.Durchführung :Eine Bakterienkolonie wird mit einem Zahnstocher oder einer Impföse von der Platteabgenommen <strong>und</strong> auf einen Objektträger gegeben. Die Kolonie wird mit einem TropfenH 2 O 2 -Lösung überschichtet. Alle Referenzorganismen testen !Auswertung :Das Ausmaß der Gasbildung wird nach 10-60 Sek<strong>und</strong>en beurteilt.Katalase–positiv : Pseudomonadaceae, Enterobacteriaceae, BacillusKatalase-negativ : Lactobacillaceae, Streptokokken, ClostridiumErgebnis: Bläschenbildung (stark, schwach, fehlend):E. coli:……………………………………….. Unbekanntes Bakterium 1: ………………Ps. stutzeri: ……………………………..Unbekanntes Bakterium 2: ………………Lactobacillus lactis:…………………… Unbekanntes Bakterium 3: ………………4
C) Verwertung von Nitrat <strong>und</strong> NitritbildungViele Bakterien können Nitrat als terminalen Elektronenakzeptor für die Nitratatmung nutzen.Mit einem geeigneten Elektronendonor (z.B. Glucose) wird Nitrat über Nitrit zu NH 4 + (Nitratammonifikation)oder zu N 2 (Denitrifikation) umgesetzt. Rein fermentative Bakterien zeigendagegen keine Nitratatmung. In fakultativ anaeroben Bakterien wird die Nitratreduktion durchSauerstoff, den bevorzugten Elektronenakzeptor, reprimiert. In dem Test wird die Umsetzungvon Nitrat durch anaerob (Standkultur) <strong>und</strong> aerob (‚Rollerkultur’) gezüchtete Bakterienuntersucht.Material (A) 1 Röhrchen Standard I–Medium (10 ml) mit Nitrat (2 mM) für die anaerobe Zucht(pro Gruppe) (B) 1 Röhrchen Standard I–Medium (3 ml) mit Nitrat (2 mM) für die aerobe Zucht (proGruppe) Impföse, (je 1 x pro Gruppe) Standard I-Agarplatte mit E. coli. Je eine Platte pro Bank, vergl. Oxidasetest.DurchführungRöhrchen (A) <strong>und</strong> (B) werden beschriftet (A, E. coli, anaerob) <strong>und</strong> (B, E. coli aerob).Anschließend werden die Röhrchen mit Hilfe der Impföse mit einem Teil einer Kolonie vonE. coli beimpft (auf steriles <strong>und</strong> sauberes Arbeiten achten!). Die Kulturen werden für 3 h aufeinem Rollinkubator bei 190 Umdrehungen ((B) aerobe Zucht) oder über Nacht alsStandkultur ((A), ‚anaerobe’ oder sauerstoffarme Zucht) bei 30 °C inkubiert. Danach werdendie Kulturen bei 4°C bis zur Auswertung gelagert.Auswertung (darauffolgende Woche !)Material: - Bewachsene Kulturen (A) <strong>und</strong> (B) der Vorwoche- Unbewachsene Kulturflüssigkeit mit Nitrat (1 x pro Laborbank)- Unbewachsene Kulturflüssigkeit ohne Nitrat (1 x pro Laborbank)- 2 Nitratteststäbchen pro Gruppe- Zusätzlich 2 Nitratteststäbchen pro Laborbank für unbewachsene KulturenDie Auswertung des Nitratgehalts erfolgt mit einem Schnelltest zur halb-quantitativenNitratbestimmung.In die beiden Röhrchen wird ein Schnellteststäbchen kurz eingetaucht. Ebenso mit derunbewachsenen Kulturflüssigkeit (mit <strong>und</strong> ohne Nitrat) verfahren (1 x pro Laborbank). Nach1 - 2 min wird die Färbung für die Nitratbildung abgelesen. Über die Referenz-Farbskala wirdder Gehalt an Nitrat abgeschätzt <strong>und</strong> in die Auswertetabelle eingetragen.5
Auswertung <strong>und</strong> Ergebnis (4. Praktikumstag)(A) Stand.I Medium + Nitrat(unbewachsenes Medium)(A) Stand.I Medium ohneNitrat (unbewachs. Medium)(B) E. coli (aerobe Zucht)(A) E. coli (anaerobe Zucht)Färbung NitrattestFärbung Nitrit-WarnzoneD) Bunte ReiheZur Identifizierung einer unbekannten Bakterienreinkultur sollen Tests eingesetzt werden,durch die bestimmte Stoffwechsel-Fähigkeiten nachgewiesen werden. Diese Tests werdenhäufig zur Differenzierung von Enterobakterien eingesetzt, eignen sich aber auch für andereBakterien. Bei diesen Tests wird der Abbau verschiedener Substrate oder die Bildung vonGärprodukten nachgewiesen, die für bestimmte Gärungsformen charakteristisch sind.Wegen der Farben der verwendeten Indikatoren spricht man von einer „Bunten Reihe“. ImPraktikum werden exemplarisch einige Tests durchgeführt (‚IMViC-Reaktion’: Indol,Methylrot, Voges-Proskauer, Citrat). Damit kann das unbekannte Bakterium von anderen(bekannten) Bakterien unterschieden werden. Die Bunte Reihe besitzt diagnostischeBedeutung <strong>und</strong> wird zur schnellen Identifizierung unbekannter Keime, vor allem in derTrinkwasseranalyse, eingesetzt. Ähnliche Tests können mit käuflichen Teströhrchendurchgeführt werden (sog. „Enterotubes“).Beschriftung der Röhrchen/Platte: Gruppennr., Nr. des unbekannten Bakteriums, KurstagMaterial: Impföse, Bunsenbrenner (je 1 x pro Gruppe) Automat. Pipetten (1 ml) mit Spitzen eine unbekannte Bakterien-Reinkultur pro Gruppe (5 ml in Standard I-Medium, überNacht bei 37°C im „Roller“ gezogen). Jede Gruppe erhält 5 Röhrchen die mit den 5 verschiedenen Testmedien gefüllt sind <strong>und</strong>eine Platte für den Test auf Citratverwertung.Zur Auswertung der Tests werden benötigt : Methylrot-Indikatorlösung (10 ml in Tropfflasche, 1 x pro Bank); 0,02g Methylrot werdenin 30 ml Ethanol gelöst, der pH wird auf 5,0 eingestellt. Kovàcs-Indolreagenz (10 ml in Tropfflasche, 1 x pro Bank, gebrauchsfertige Lösung:Merk Nr. 1.09293.0100, wird bei 4°C gelagert). Barritt-Reagens (15 ml in Plastikflasche, 1 x pro Bank); 5% (w/v) Naphtol in Ethanollösen. Jeden Tag frisch ansetzen ! 40%ige wässrige KOH-Lösung (10 ml in Flasche, 1 x pro Bank)Die Herstellung der einzelnen Testmedien ist am Ende der Anleitung beschrieben.6
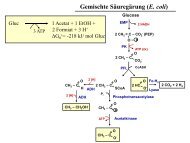
Wirkungsweise der eingesetzten Differenzierungstests:a: Test auf gemischte Säuregärung <strong>und</strong> Gasbildung bei GlucosevergärungEinige Bakterien <strong>und</strong> Enterobakterien verwerten Glucose in Abwesenheit von O 2 unterstarker Säurebildung (z.B. in der gemischten Säuregärung), so dass der pH-Wert des Mediumsunter 4,4 absinkt. Andere bilden weniger Säure <strong>und</strong> der pH-Wert bleibt oberhalb von 5 (z.B.Butandiol-Gärung). Der Unterschied im pH-Wert kann durch Methylrot sichtbar gemachtwerden. Methylrot weist oberhalb von pH 5,1 eine gelbe Farbe auf, unterhalb von pH 4,4eine rote Farbe. Die Bildung von größeren Mengen CO 2 bei der Gärung wird durch dasZerreißen des Weichagars sichtbar. Die Gasbildung (CO 2 ) unterscheidet die beidenGärungstypen ebenfalls.Bilanzgleichung (idealisiert) der gemischten Säuregärung:Glucose → 2 Formiat - + Acetat - + Ethanol + 3 H +Bilanzgleichung (idealisiert) der Butandiol –Gärung:2 Glucose → 2,3-Butandiol + 2 CO 2 + Lactat - + Formiat - + Ethanol + 2 H +b: Test auf IndolbildungCaseinhydrolysat enthält einen hohen Anteil an Tryptophan, das von „Indol- positiven“Mikroorganismen durch das Enzym Tryptophanase unter Bildung von Indol abgebaut wird.Dieses wird mit Kovàcs-Indolreagenz (p-Dimethylaminobenzaldehyd) nachgewiesen.c: Test auf Acetoinbildung (Voges-Prokauer)Einige Enterobakterien bilden aus Glucose Acetoin, 2,3-Butandiol oder Diacetyl. Acetoinkann mit KOH zu Diacetyl umgesetzt werden, welches dann mit dem Kreatin des Peptonmediumseine Kondensationsreaktion eingeht. α-Naphtol (Barritt-Reagens) wirkt dabeikatalytisch.d: Test auf H 2 S-BildungThiosulfat wird von einigen Bakterien zu Schwefelwasserstoff reduziert, der mit Eisenionenzu schwarzem Eisensulfid reagiert.e: Test auf Harnstoffspaltung (Anwesenheit von Urease)Harnstoff wird durch das Enzym Urease zu Kohlendioxid <strong>und</strong> Ammonium hydrolysiert.(NH 2 ) 2 CO + H 2 O + 2 H + → 2 NH 4 + + CO 2Dabei werden Protonen verbraucht <strong>und</strong> der pH-Indikator Phenolrot schlägt von gelblich nachpurpurrot um.f: Test auf CitratverwertungDer Test dient zur Identifizierung von Mikroorganismen, die mit Citrat als alleinigerKohlenstoffquelle wachsen können. Die Verwertung von Citrat bei pH 6,6 in Gegenwart vonO 2 (auf der Agarplatte) führt zur Alkalisierung des Mediums, was durch den Farbumschlagdes pH-Indikators Bromthymolblau von Grün nach Blau angezeigt wird:C 6 H 5 O 7 3- + 4,5 O 2 + 3 H + → 6 CO 2 + 4 H 2 ODurchführung:Die fünf Teströhrchen (a – e) <strong>und</strong> die Platte (Citrat-Verwertung) werden von jeder Gruppe nuraus einer einzigen (bereitgestellten) Flüssigkultur beimpft, die das zu identifizierende Bakteriumenthält. Es ist auf steriles Arbeiten zu achten! Alle Röhrchen <strong>und</strong> Platten sind durchBeschriftung eindeutig zu kennzeichnen (Testmedium, Datum, Name, Nr. des Bakteriums,7
Gruppen-Nummer). Nach dem Beimpfen werden die Röhrchen <strong>und</strong> die Platte mindestens 2Tage im Brutraum bebrütet. Bis zur Auswertung werden die Testansätze bei 4°C gelagert.a: Test auf gemischte Säuregärung <strong>und</strong> Gasbildung bei Glucosevergärung (Weichagarröhrchen)Die sterilisierte Impföse wird in die Flüssigkultur getaucht <strong>und</strong> danach zentral tief in dashalbfeste Medium von Röhrchen (a) gestochen.b: Test auf IndolbildungDie sterile Impföse wird durch Eintauchen mit der Kulturflüssigkeit beladen <strong>und</strong> danach inRöhrchen (b) getaucht.c: Test auf Acetoinbildung (Voges-Proskauer)Die sterile Impföse wird durch Eintauchen mit der Kulturflüssigkeit beladen <strong>und</strong> danach inRöhrchen (c) getaucht.d: Test auf H 2 S-BildungDie sterile Impföse wird durch Eintauchen beladen. Danach wird die Oberfläche des Schrägagar-Mediumsbestrichen. Dieser Vorgang wird 2 – 3 mal wiederholt. Danach wird diesterilisierte Impföse mit Kulturflüssigkeit beladen <strong>und</strong> zentral in das Schrägagar-Mediumgestochen.e: Test auf Harnstoffspaltung (Anwesenheit von Urease)Das Schrägagar-Medium wird 2 – 3 mal mit der durch Eintauchen beladenen Impfösebestrichen.f: Test auf CitratverwertungDie an der Impföse haftende Kulturflüssigkeit wird mit der Öse großflächig auf der Platteverteilt. Es soll hier kein Vereinzelungsausstrich vorgenommen werden.Auswertung:Es ist sicherzustellen, dass sich die Bakterien vermehrt haben (Ausnahme: Citrat-Test).zu a: Test auf gemischte Säuregärung <strong>und</strong> Gasbildung bei GlucosevergärungDas Teströhrchen zuerst auf Gasbildung untersuchen !Zu dem Teströhrchen wird ein Tropfen Methylrot-Indikatorlösung pipettiert (leicht schütteln)<strong>und</strong> nach 10 bis 20 Minuten wird der Farbumschlag beurteilt (rot: positiv; gelb: negativ).zu b: Test auf IndolbildungDie Kultur wird mit 4-5 Tropfen Kovàcs-Indolreagens überschichtet (Tropfflasche). Kurzschütteln <strong>und</strong> stehen lassen. Bei Indol-positiven Kulturen nimmt die Reagenzschicht nachwenigen Minuten eine kirschrote Farbe an.zu c: Test auf Acetoinbildung (Voges-Proskauer)Zu dem Röhrchen werden nacheinander 1,5 ml Barritt-Reagens <strong>und</strong> 0,5 ml 40% KOHpipettiert. Schütteln. Im positiven Fall färbt sich die Kulturflüssigkeit nach 5 – 15 min rötlich.zu d: Test auf H 2 S-BildungIm positiven Fall kommt es zur Schwarzfärbung des Agars.zu e: Test auf Harnstoffspaltung (Anwesenheit von Urease)Die positive Reaktion wird durch einem Farbumschlag des pH-Indikators Phenolrot vongelblich nach purpurrot nachgewiesen.zu f: Test auf Citratverwertung8
Im positiven Fall tritt ein Farbumschlag des pH-Indikators Bromthymolblau von grün nachblau ein.Die Testergebnisse werden in die folgende Tabelle eingetragen. Um welches Bakteriumhandelt es sich ?Antwort: ………………………………Nr. des unbekannten Bakteriums: ……UnbekanntesBakteriumMethylrotGasbildungIndolbildungAcetoin Citrat H 2 S-bildungUreaseEscherichia coli + + + - - - -Klebsiella planticola v + v + + - +Citrobacter fre<strong>und</strong>ii + + - - + + +Proteus vulgaris + - + - - + +Pseudomonas stutzeri + - - - + - -Enterobacteraerogenes - + - + + - -Bacillus subtilis (+) - - + + -+, positiv; -, negativ; v, variabel; (+), Reaktion schwach positivDie Tabelle gibt an, wie die Stämme nach einer 36-stündigen Inkubation bei 35 bis 37°Creagieren.9
e: Test auf Harnstoffspaltung (Anwesenheit von Urease)Harnstoff-Schrägagarröhrchen nach Christensen:Fleischpepton 1 g/lGlucose 1 g/lNaCl 5 g/lKH 2 PO 4 2 g/lPhenolrot0,012 g/lAgar 15 g/l pH 6,8 Substanzen lösen <strong>und</strong> pH einstellen <strong>und</strong> 15 min bei 121°C autoklavieren. Auf50°Cabkühlen lassen. Pro Liter 50 ml einer 40 %igen (w/v) Harnstofflösung (in H 2 O) durch einen Sterilfilterzusetzen. Medium in Röhrchen zu 10 ml verteilen <strong>und</strong> schrägliegend erstarren lassen.Oder: Fertigmedium Harnstoffagar nach Christensen (Basis), Merck Nr. 108 492f: Test auf CitratverwertungPlatten mit Simmons-Citrat Agar:NH 4 H 2 PO 4 1 g/lK 2 HPO 4 1 g/lNaCl 5 g/lNaCitrat 2 g/lMgSo 4 0,2 g/lAgar 13 g/l pH 6,6 Substanzen lösen. Pro 1 Liter Medium 80 mg Bromthymolblau in 3 ml Ethanol lösen <strong>und</strong> dem Mediumzusetzen. pH einstellen <strong>und</strong> autoklavieren (15 min 121°C) Medium bei 50°C temperieren <strong>und</strong> Platten zu je 20 ml gießen.Oder: Fertigmedium Simmons Citratagar, Merck Nr 2501Vorkulturen <strong>und</strong> AgarplattenStandard I nach Miller, Merck Nr. 110 28511