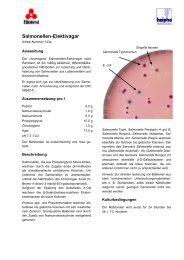
Nährboden-Beschreibung aus dem Oxoid Nährmedien ... - mibius
Nährboden-Beschreibung aus dem Oxoid Nährmedien ... - mibius
Nährboden-Beschreibung aus dem Oxoid Nährmedien ... - mibius
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
CASEINPEPTON-SOJAMEHLPEPTON-LÖSUNGUSP, BESTRAHLT (KALTFILTRATION)Art.-Nr. CM1065Kaltfiltrierbare, γ-bestrahlte Caseinpepton-Sojamehlpepton-Lösung, diefür mikrobiologische Media Fill-Tests in der pharmazeutischen Industriegeeignet ist.· Nährstoffreiche LösungCaseinpepton-Sojamehlpeton-Lösung USP (CASO-Lösung, TSB) ist ein universellerNährboden mit hochwertigen Nähreigenschaften, der die Anzucht von Bakterien, Hefenund Pilzen bei Inkubation unter den für die Zielorganismen geeigneten Bedingungenermöglicht 1 .· Standardisiertes MediumDie Zusammensetzung entspricht <strong>dem</strong> Caseinpepton-Sojamehlpepton-Medium gemäßder Europäischen Pharmacopeia 4. Ausgabe 2002 2 , der Britischen Pharmacopeia2003 3 , der US Pharmacopeia 27 NF22 2004 4 und der Japanischen Pharmacopeia XIV2001 5 .· Einfache AnwendungJeder Bestandteil der CASO-Lösung wird hinsichtlich seiner Eignung für die Filtrationspeziell geprüft und <strong>aus</strong>gewählt. Der V cap -Wert jeder Charge wird mit dreiverschiedenen Filtertypen ermittelt.· ÜberzeugendDie Abpackungen der CASO-Lösung werden mit einer sterilisierenden Dosis γ-Strahlenbehandelt (Minimum 25 KGy), die letal für alle Hefen, Schimmelpilze und Bakterieneinschließlich bakterieller Sporen und Mycoplasmen ist.· GrundlagenFlüssige Arzneiformen, die steril sein müssen, jedoch aufgrund der Hitzeempfindlichkeit eineroder mehrerer Komponenten nicht endsterilisiert werden dürfen, können durch Filtrationsterilisiert und anschließend unter aseptischen Bedingungen abgefüllt werden.Media Fill-Tests dienen der Simulation von möglichen mikrobiologischen Kontaminationen beider aseptischen Abfüllung. Mit Hilfe von kaltfiltrierbarer CASO-Lösung kann derHerstellungsprozeß, d.h. die Filtration, die Abfüllung und das Verschließen der mittels Filtrationsterilisierten flüssigen Arzneiform simuliert werden. Das Medium wird anschließend bebrütetund die Anzahl der kontaminierten Einheiten ins Verhältnis zu den nichtkontaminiertenEinheiten gesetzt. Anhand der Zahl der kontaminierten Einheiten und der Identität derMikroorganismen kann eine Bewertung getroffen werden 6 .Für sterile feste Arzneiformen kann der aseptische Produktionsprozeß durch Zugabe einesMediums zu einem geeigneten Placebo simuliert werden. Diese Substanzen sollten geeignetsein, den aseptischen Produktionsprozeß exakt zu simulieren, wobei die sterile CASO-Lösungam Ende des Produktionsprozesses zugegeben wird 6 .
Caseinpepton-Sojamehlpepton-Lösung USP, bestrahlt (Kaltfiltration)Art.-Nr. CM1065VerwendungzweckDas Medium ist besonders für Media Fill-Tests in derpharmazeutischen Industrie geeignet. Der Trockennährbodenkann gepulverte Komponenten ersetzen, die fürdie Herstellung flüssiger Arzneiformen verwendet werden.Als sterile Lösung kann diese alternativ am Ende desProduktionsprozesses einem Placebo für die Simulationeiner festen Arzneiform zugesetzt werden. Nach <strong>dem</strong>Media Fill-Lauf wird die Lösung unter geeignetenBedingungen für die Anzucht von Bakterien, Hefen undSchimmelpilzen bebrütet.ZusammenfassungCASO-Lösung ist ein universeller Nährboden mithochwertigen Nähreigenschaften zur Anzucht vonBakterien, Hefen und Pilzen unter den für dieZielorganismen geeigneten Bedingungen. DieZusammensetzung entspricht der CASO-Lösungverschiedener Arzneibücher 2,3,4,5 .Jeder Bestandteil wird hinsichtlich seiner Eignung für dieFiltration speziell geprüft und <strong>aus</strong>gewählt.Die Abpackungen der CASO-Lösung werden mit einersterilisierenden Dosis γ-Strahlen (Minimum 25 KGy)behandelt, die letal für alle Hefen, Schimmelpilze undBakterien, einschließlich bakterieller Sporen undMycoplasmen ist.TestprinzipFlüssige, steril zu verabreichende Arzneiformen, könnenaufgrund hitzesensitiver Komponenten oft nicht imAutoklaven endsterilisiert werden. Sie werden durchFiltration sterilisiert und anschließend aseptisch abgefüllt.Media Fill-Tests dienen der Simulation von möglichenmikrobiologischen Kontaminationen bei der aseptischenAbfüllung.In der Regel ermöglicht die Zusammensetzung derflüssigen Arzneiform eine Filtration großer Volumina, sodaß ein Zusetzen der Filter nicht vorkommt. Aufgrund derbiologischen Eigenschaften der CASO-Lösung werden dieFilter schneller blockiert, so daß das Nährmedium erhitztoder die Filter während des Media Fill-Laufes gewechseltwerden müßten. OXOID testet die Rohstoffe, die für dieProduktion der kaltfiltrierbaren CASO-Lösung verwendetwerden, so daß jede Charge einen hohen V cap -Werterreicht. Der V cap -Wert ist der theoretische maximalevolumetrische Durchfluß des Filters unter denTestbedingungen. Damit kann das maximal filtrierbareVolumen der CASO-Lösung vor Durchführung des MediaFill-Tests ermittelt werden.OXOID testet jede Charge kaltfiltrierbarer CASO-Lösungmit verschiedenen Filtern zur Bestimmung der jeweiligenV cap -Werte. Das filtrierbare Volumen der CASO-Lösunghängt vom Membrantyp, der Porengröße und der zurFiltration zur Verfügung stehenden Fläche ab. Jede Chargehat einen Minimum V cap -Wert von 2800 l/m 2 bei den dreigetesteten Filtertypen (0,2 µm).Typische V cap -Werte für kaltfiltrierbare CASO-Lösung:MembranfilterV cap -Wert (ml)(47 mm) (Fläche 14 cm 2 )V cap -Wert(l/m 2 )Polyvinylidenfluorid (PVDF) 4909 3506Polyethersulfon (PES) 6700 4786Nylon (NR) 4561 3258Der V cap -Wert ist die Extrapolation des „Fluß = Null“ Punktes;die Zeit bis zu diesem Punkt kann sehr lang sein. Daher ist derV cap -Wert gut für vergleichende Analysen geeignet, jedochnicht für Media Fill-Tests, bei denen die Dauer des Prozessesbegrenzt ist. Besser geeignet ist der V 90 -Wert, der mit 68% desV cap -Wertes kalkuliert wird, wobei die Flußrate nur noch 10 %der ursprünglichen Flußrate beträgt. Nähere Informationenerteilt der Hersteller der Filter.Anmerkung:Kaltfiltrierbare CASO-Lösung sollte nicht für die Validierungder Eignung der für die Herstellung der Arzneimittel<strong>aus</strong>gewählten Filtersysteme verwendet werden. DieBestandteile der CASO-Lösung weichen sehr stark vondenen flüssiger Arzneiformen ab. Die Validierung solltedaher mit <strong>dem</strong> flüssigen Arzneimittel selbst durchgeführtwerden.Typische Zusammensetzung(g/l)Caseinpepton 17,0Sojamehlpepton 3,0Natriumchlorid 5,0Dikaliumhydrogenphosphat 2,5Glucose 2,5pH 7,3 ± 0,2 bei 25°CZubereitung30 g in 1 l Aqua dest. suspendieren und bis zumvollständigen Lösen gut mischen. Den Nährboden mittelsFiltration sterilisieren oder 15 Minuten bei 121°Cautoklavieren.Die Bebrütung der Einheiten des Media Fill-Tests erfolgt für14 Tage 6 sowohl bei 20-25°C und 30-35°C. Eine visuellePrüfung der Einheiten sollte täglich oder zweitägigerfolgen. Kontaminierte Einheiten sollten subkultiviertwerden. Reinkulturen der Mikroorganismen sollten gemäßder jeweiligen Richtlinie bis zur Spezies bestimmtwerden 2,3,4,5 .BeschaffenheitDer Trockennährboden ist ein strohfarbenes,feinfließendes Pulver. Die zubereitete Lösung iststrohfarben.VorsichtsmaßnahmenNur für den Laborgebrauch.Nicht nach Ablauf des Verfallsdatums verwenden. BeiVerklumpungen, Verfärbungen oder anderen sichtbarenVerfallsanzeichen sollte das Produkt ebenfalls nichteingesetzt werden.Lagerung und HaltbarkeitTrockennährboden: fest verschlossen, lichtgeschützt,10–30 °C.Bei vorschriftsmäßiger Lagerung ist das Produkt bis zumangegebenen Verfallsdatum verwendbar.QualitätskontrolleSpeziesStaphylococcus aureusATCC 6538Pseudomonas aeruginosaATCC 9027Bacillus subtilisATCC 6633Aspergillus nigerATCC 16404Candida albicansATCC 10231Unbeimpfte LösungCulti-Loops ®C7016LC5210LC1221LC1100LC1503LWachstumWachstum mit TrübungWachstum mit TrübungWachstum mit Trübungund FlockungWeißes Mycel, mit oderohne schwarze SporenWachstum mit Trübungund FlockungKein WachstumLiteratur1. <strong>Oxoid</strong> manual 8 th edition, 1998, S. 2-2082. Europäische Pharmacopeia 4. Ausgabe 20023. Britische Pharmacopeia 20034. US Pharmacopeia 27 NF22 20045. Japanische Pharmacopeia XIV 20016. Microbiological Media Fills Explained by Nigel Hall, 2002.Sue Harwood Publishing Ltd., UK<strong>Oxoid</strong> Deutschland GmbHPostfach 10 07 53 • D-46467 Wesel - Am Lippeglacis 4-8 • 46483 WeselTelefon Service-Center (0281)152-233 • Fax (0281)152-214O:\Dt. Prodcuktbeschreibungen/CM Stand 06/2004