Stoffe trennen - Buchhandel.de
Stoffe trennen - Buchhandel.de
Stoffe trennen - Buchhandel.de
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
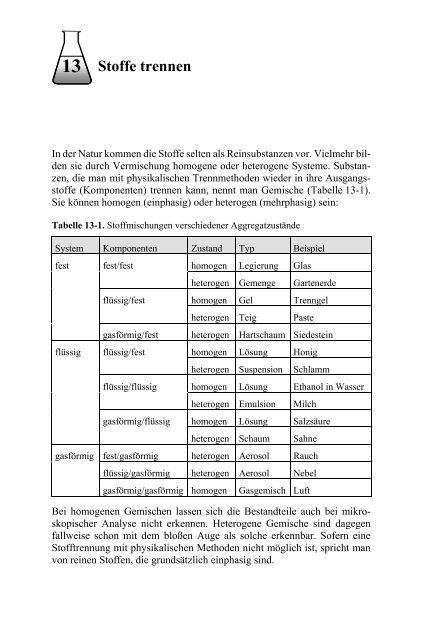
13<strong>Stoffe</strong> <strong>trennen</strong>In <strong>de</strong>r Natur kommen die <strong>Stoffe</strong> selten als Reinsubstanzen vor. Vielmehr bil<strong>de</strong>nsie durch Vermischung homogene o<strong>de</strong>r heterogene Systeme. Substanzen,die man mit physikalischen Trennmetho<strong>de</strong>n wie<strong>de</strong>r in ihre Ausgangsstoffe(Komponenten) <strong>trennen</strong> kann, nennt man Gemische (Tabelle 13-1).Sie können homogen (einphasig) o<strong>de</strong>r heterogen (mehrphasig) sein:Tabelle 13-1. Stoffmischungen verschie<strong>de</strong>ner Aggregatzustän<strong>de</strong>System Komponenten Zustand Typ Beispielfest fest/festhomogen Legierung Glasheterogen Gemenge Gartener<strong>de</strong>flüssig/fest homogen Gel Trenngelheterogen Teig Pasteflüssiggasförmiggasförmig/fest heterogen Hartschaum Sie<strong>de</strong>steinflüssig/fest homogen Lösung Honigheterogen Suspension Schlammflüssig/flüssig homogen Lösung Ethanol in Wasserheterogen Emulsion Milchgasförmig/flüssig homogen Lösung Salzsäureheterogen Schaum Sahnefest/gasförmig heterogen Aerosol Rauchflüssig/gasförmig heterogen Aerosol Nebelgasförmig/gasförmig homogen Gasgemisch LuftBei homogenen Gemischen lassen sich die Bestandteile auch bei mikroskopischerAnalyse nicht erkennen. Heterogene Gemische sind dagegenfallweise schon mit <strong>de</strong>m bloßen Auge als solche erkennbar. Sofern eineStofftrennung mit physikalischen Metho<strong>de</strong>n nicht möglich ist, spricht manvon reinen <strong>Stoffe</strong>n, die grundsätzlich einphasig sind.
148 13 <strong>Stoffe</strong> <strong>trennen</strong>Die schon lange tradierte lateinische Sentenz „Corpora non agunt nisisoluta“ (die <strong>Stoffe</strong> reagieren nur, wenn sie gelöst sind) gilt streng genommennur im physiologisch-biochemischen Kontext. Im Labor und in <strong>de</strong>rNatur sind chemische Reaktionen beispielsweise auch zwischen Feststoffen,zwischen Feststoffen und zwischen Gasen untereinan<strong>de</strong>r möglich. Zu<strong>de</strong>n Routineaufgaben im Labor gehört es, <strong>Stoffe</strong> aus Gemengen und/o<strong>de</strong>rGemischen für analytische o<strong>de</strong>r präparative Zwecke zu entfernen o<strong>de</strong>r inhochreiner Form zu isolieren. Für solche Stofftrennungen sind zahlreicheVerfahren entwickelt wor<strong>de</strong>n, von <strong>de</strong>nen dieses Kapitel nur einige Basistechnikenauswahlweise vorstellen kann. Einen orientieren<strong>de</strong>n Überblicküber die verschie<strong>de</strong>nen Verfahren bietet die nachfolgen<strong>de</strong> Tabelle 13-2:Tabelle 13-2. Trennverfahren in Chemie und Biochemie (Auswahl)Ausgangsgemisch optionales Trennverfahren behan<strong>de</strong>lt ingelöste Feststoffe (fraktionierte) Fällung Abschnitt 13.1Abdampfen / Einengen Abschnitt 13.1Gel-FiltrationChromatographie → Kapitel 15Elektrophorese → Kapitel 15suspendierte FeststoffeLösemittelgemischeVakuum<strong>de</strong>stillation Abschnitt 13.3Gefriertrocknung Abschnitt 13.1KristallisierenFiltration Abschnitt 13.2Zentrifugation → Kapitel 14(fraktionierte) Destillation Abschnitt 13.3Ausschütteln Abschnitt 13.4Ausfrieren
13.1 Fällung 14913.1 FällungDie Fällung, fallweise auch Ausfällung, Ausflockung, Koagulation o<strong>de</strong>rPräzipitation genannt, hat die Überführung eines gelösten <strong>Stoffe</strong>s in einemöglichst schwerlösliche Verbindung zum Ziel: Die Lösung wird dabeimit einer geeigneten Reagenzlösung (Fällungsreagenz) im leichten Überschussso versetzt, dass eine quantitative Entfernung <strong>de</strong>r zu gewinnen<strong>de</strong>nSubstanz aus <strong>de</strong>r Lösung erfolgt. Die ausgefällte Substanz nennt man Nie<strong>de</strong>rschlago<strong>de</strong>r Präzipitat. Fällungsreaktionen gelingen nicht mit allen <strong>Stoffe</strong>n.Sie sind im Allgemeinen möglich mit Ionen, die neben leicht- auchschwerlösliche Verbindungen eingehen. Ein Beispiel ist die Fällung vonSulfat-Ionen SO 2– 4 aus einer Lösung von Natriumsulfat Na 2 SO 4 mithilfevon Bariumchlorid BaCl 2 :2 Na + 2–+ SO 4 + Ba 2+ + 2 Cl – → BaSO 4 ↓ + [2 NaCl] [Gl. 13-1]Mit <strong>de</strong>m senkrecht nach unten weisen<strong>de</strong>n Pfeil ↓ in Gleichung 13-1 <strong>de</strong>utetman in Reaktionsgleichungen an, dass die so markierte Verbindung <strong>de</strong>nNie<strong>de</strong>rschlag bzw. das Präzipitat liefert, während die übrigen aufgeführtenKomponenten in Lösung bleiben.Für anschließen<strong>de</strong> quantitative Bestimmungen wird <strong>de</strong>r Nie<strong>de</strong>rschlagdurch Filtration (Abschnitt 13.2) o<strong>de</strong>r Zentrifugation (vgl. Kapitel 14) von<strong>de</strong>r Lösung abgetrennt. Soll aus dieser Lösung das Natriumchlorid NaClzurückgewonnen wer<strong>de</strong>n, führt <strong>de</strong>r Weg nicht über eine erneute Fällung,da im vorliegen<strong>de</strong>n Beispiel schwerlösliche Na-Salze fehlen, son<strong>de</strong>rn wiein allen ähnlichen Fällen über das Abdampfen <strong>de</strong>s Lösemittels Wasser.Auch gelöste Makromoleküle lassen sich durch Fällung anreichern.Proteine bleiben so lange in Lösung, wie ihre gela<strong>de</strong>nen Oberflächen mit<strong>de</strong>n Molekülen <strong>de</strong>s Lösemittels in Wechselwirkung stehen und beispielsweiseHydrathüllen ausbil<strong>de</strong>n können. Unterbin<strong>de</strong>t man diese Wechselwirkung,reagieren die Proteinmoleküle untereinan<strong>de</strong>r o<strong>de</strong>r zumin<strong>de</strong>st intramolekularund bil<strong>de</strong>n große, unlösliche Aggregate mit stark verän<strong>de</strong>rterRaumstruktur (Konformation). Zur Proteinfällung kann man daher alleVerfahren einsetzen, welche die Hydrathülle angreifen, beispielsweise anorganischeSalze o<strong>de</strong>r bestimmte organische Lösemittel wie Ethanol. Inbiochemischen Anwendungen wer<strong>de</strong>n Enzymproteine aus Rohextraktenmeist durch Zugabe von Ammoniumsulfat (NH 4 ) 2 SO 4 ausgefällt bzw. ausgesalzen,wobei Menge und Geschwindigkeit <strong>de</strong>r Salzzugabe vom jeweiligenProtein abhängt und eigens ausgetestet wer<strong>de</strong>n muss. Nur beischonen<strong>de</strong>r, schrittweise erfolgen<strong>de</strong>r (fraktionierter) (NH 4 ) 2 SO 4 -Zugabewird eine irreversible Denaturierung mit komplettem Funktionsverlustverhin<strong>de</strong>rt.
150 13 <strong>Stoffe</strong> <strong>trennen</strong>Eine in <strong>de</strong>r Biochemie häufig eingesetzte Metho<strong>de</strong> zur Entfernung vonSalzen o<strong>de</strong>r an<strong>de</strong>rer Komponenten relativ nie<strong>de</strong>rer Molekularmassen auseiner Protein-Lösung ist die Dialyse. Dazu wird die Protein-Lösung in einenDialysierschlauch gefüllt, <strong>de</strong>r in ein großes Volumen einer kalten Puffer-Lösungmit geringer Ionenstärke eintaucht. Das Schlauchmaterial istsemipermeabel (semiselektiv) und lässt nur Moleküle o<strong>de</strong>r Ionen niedrigerMolekularmasse, nicht jedoch die Proteinmoleküle passieren.Bei <strong>de</strong>r bereits oben erwähnten Metho<strong>de</strong> <strong>de</strong>s Abdampfens wird das Lösemittelaus einer Lösung entfernt, wobei <strong>de</strong>r gelöste Stoff eventuell in kristalliner(kristallisierter) Form anfällt. Mehrfaches Auflösen und erneutesRekristallisieren lässt sich auch dann einsetzen, wenn ein bestimmterStoff in beson<strong>de</strong>rs reiner Form gewonnen wer<strong>de</strong>n soll. Da die Verdampfungeines Lösemittels zwar durch Temperatur beschleunigt wer<strong>de</strong>n kann,aber eine stärkere Erwärmung bei thermolabilen Biomolekülen eventuellschädigend wirkt, bietet sich als Alternative die weitaus schonen<strong>de</strong>re Gefriertrocknungo<strong>de</strong>r Lyophilisation an: Die eingefrorene Lösung wird inkleinen Rundkolben o<strong>de</strong>r an<strong>de</strong>ren geeigneten Glasgefäßen an eine Vakuumpumpeangeschlossen. Unter Vakuumbedingungen geht das gefroreneWasser aus <strong>de</strong>r Probe durch Sublimation direkt in <strong>de</strong>n gasförmigen Zustandüber und wird aus <strong>de</strong>m Probenraum durch die Pumpe abgeführt. DieGefriertrocknung biologischer Materialien setzt man auch bei <strong>de</strong>r Probenaufbereitungfür die Elektronenmikroskopie ein.Das Gegenteil einer Osmose ist die Umkehrosmose. Hierbei wird dasLösemittel (Solvens, vgl. Kapitel 12.2) durch eine semipermeable (semiselektive)Membran unter stark erhöhtem Druck von seinem gelöstenStoff (Solut) getrennt: Die Lösemittelmoleküle passieren druckabhängigdie Membranzwischenräume, während das Solut gleichzeitig aufkonzentriertwird. Die aufzuwen<strong>de</strong>n<strong>de</strong>n Drucke betragen meist das Doppelte <strong>de</strong>sosmotischen Druckes in <strong>de</strong>r Ausgangslösung. Bei <strong>de</strong>r Meerwasserentsalzungarbeitet man gewöhnlich bei 60–80 bar. Ein weiteres wichtigesAnwendungsgebiet ist die Gewinnung von Reinstwasser für medizinischeZwecke o<strong>de</strong>r die Aufkonzentrierung von Traubenmost bei <strong>de</strong>r Weinbereitung.13.2 FiltrationBei <strong>de</strong>r Filtration durchläuft ein Stoffgemisch einen Filter, <strong>de</strong>ssen Porengrößeim Allgemeinen kleiner ist als die Partikeln, die er zurückhalten soll.Ein häufig verwen<strong>de</strong>tes Filtermaterial beim Filtrieren unter Normaldrucksind Papierfilter. Schwarzbandfilter zeichnen sich durch eine relativ große