Kunststoffe aus Makromolekülen
Kunststoffe aus Makromolekülen
Kunststoffe aus Makromolekülen
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Kunststoffe</strong><br />
<strong>aus</strong><br />
<strong>Makromolekülen</strong><br />
Dr. M. Müller<br />
Der Autor dankt vielen Kolleginnen und Kollegen<br />
für die hilfreiche Unterstützung<br />
überreicht durch<br />
BAYER AG, Leverkusen<br />
Alle Rechte vorbehalten außer schulinterner Vervielfältigung<br />
Aktualisierte Ausgabe 2001
Inhaltsverzeichnis<br />
1. EINLEITUNG ...............................................................................................................................3<br />
1.1. Allgemeine Informationen über Makromoleküle................................................................................3<br />
1.2. Vielseitigkeit der Kunststoffanwendungen........................................................................................5<br />
1.3. Heutige Entwicklung des Kunststoffmarktes.....................................................................................6<br />
2. MAKROMOLEKÜL UND KUNSTSTOFF: BEGRIFFSBESTIMMUNG....................................8<br />
3. STRUKTURPRINZIPIEN..........................................................................................................13<br />
3.1. Primärstruktur ............................................................................................................................14<br />
3.1.1. Copolymere ...........................................................................................................................18<br />
3.1.2. Verzweigte/vernetzte Makromoleküle ..........................................................................................20<br />
3.2. Sekundärstruktur und zwischenmolekulare Bindungskräfte............................................................23<br />
3.3. Tertiärstruktur ............................................................................................................................27<br />
4. STRUKTUR-EIGENSCHAFTS-BEZIEHUNGEN.....................................................................35<br />
4.1. Thermoplast, Duroplast, Elastomer, Duromer.................................................................................36<br />
4.2. Beispiele......................................................................................................................................38<br />
4.2.1. Fasern...................................................................................................................................38<br />
4.2.2. Elastomere.............................................................................................................................40<br />
5. POLYDISPERSITÄT DER KUNSTSTOFFE...........................................................................43<br />
6. POLYMERSYNTHESEN WICHTIGER KUNSTSTOFFE .......................................................45<br />
6.1. Allgemeine Hinweise.....................................................................................................................45<br />
6.2. Polykondensation ........................................................................................................................46<br />
6.3. Polymerisation.............................................................................................................................58<br />
6.3.1. Definition und Beispiele...........................................................................................................58<br />
6.3.2. Mechanismus und verfahrenstechnische Einteilung ........................................................................65<br />
6.4. Polyaddition................................................................................................................................69<br />
6.4.1. Polyurethane ..........................................................................................................................69<br />
6.4.1.1. Kautschukelastisches Polyurethan (Vulkollan ® )..........................................................................74<br />
6.4.1.2. Polyurethan-Schaumstoffe..................................................................................................78<br />
6.4.1.3. Ingenieurkunst als Partner der Chemie..................................................................................80<br />
6.4.2. Epoxidharze ...........................................................................................................................82<br />
7. MODIFIZIERUNG VON KUNSTSTOFFEN..............................................................................85<br />
2
8. NEUERE ENTWICKLUNGEN ..................................................................................................88<br />
8.1. Polymere <strong>aus</strong> neuen Monomeren....................................................................................................88<br />
8.1.1. Temperaturbeständige Polymere.................................................................................................88<br />
8.1.2. Polypyrrol - ein elektrisch selbstleitendes Polymer........................................................................93<br />
8.2. Neue <strong>Kunststoffe</strong> durch Variation der Molekülstruktur...................................................................95<br />
8.2.1. Leiter- und Kohlenstoff-Polymere...............................................................................................95<br />
8.2.2. Ionomere ...............................................................................................................................97<br />
8.2.3. Polymer-Blends......................................................................................................................99<br />
8.2.4. Flüssigkristalline Polymere..................................................................................................... 104<br />
8.2.5. Verbundwerkstoffe................................................................................................................. 109<br />
8.2.6. Kunststoff-Membranen für die Hämodialyse............................................................................... 115<br />
8.3 Neue Anwendungen mit „alten“ Polymeren ................................................................................... 118<br />
9. PHYSIKALISCHE UNTERSUCHUNGSMETHODEN.......................................................... 120<br />
10. WIEDERVERWERTUNG VON KUNSTSTOFFEN............................................................ 122<br />
11. VERSUCHSTEIL................................................................................................................. 128<br />
11.2. Inhaltsverzeichnis der verwendeten Chemikalien......................................................................... 152<br />
11.3. Gefahrensymbole und Gefahrenbezeichnungen........................................................................... 154<br />
11.4. Hinweise auf die besonderen Gefahren (R-Sätze) ......................................................................... 154<br />
11.5. Sicherheitsratschläge (S-Sätze) ................................................................................................... 157<br />
12. WEITERFÜHRENDE LITERATUR ..................................................................................... 161<br />
13. SACHREGISTER................................................................................................................. 165<br />
3
1. Einleitung<br />
1.1. Allgemeine Informationen über Makromoleküle<br />
Die Vorstellungen von den <strong>Makromolekülen</strong>, die Entdeckung ihrer chemischen Baupläne und die<br />
zunehmende Kenntnis physikalischer Eigenschaften der <strong>aus</strong> ihnen aufgebauten Materialien sind für<br />
Wissenschaft und Technik von großer Bedeutung.<br />
Viele bisher unbekannte Vorgänge in der lebenden Natur können heute erklärt werden. Alles Leben<br />
ist an die makromolekulare Struktur von Stoffen gebunden; überall, wo die Natur mit ihren Produk-<br />
ten Werkstoffeigenschaften erzielen will oder wo sie an ihre Stoffe wichtige biologische Funktionen<br />
knüpft, baut sie vorwiegend makromolekular. Aber auch synthetische Werkstoffe ("<strong>Kunststoffe</strong>")<br />
können aufgrund dieser Vorstellungen hergestellt, in ihren Eigenschaften erklärt und sogar<br />
vor<strong>aus</strong>geplant werden. Ihre Anwendung ist überraschend vielseitig. Zur Übersicht wird in Tabelle 1<br />
eine Einteilung der makromolekularen Stoffe nach Hermann Staudinger, dem Wegbereiter der<br />
Makromolekularen Chemie (1881-1965, Nobelpreis 1953), aufgeführt. Auf Naturstoffen basierende<br />
Polymere, wie Cellulose, Stärke, Wolle und Naturkautschuk spielen eine wichtige Rolle.<br />
Synthetische Polymere dagegen haben technisch die bei weitem größte Bedeutung erlangt. Daher<br />
werden im Rahmen dieses Buches auch nur solche makromolekularen Stoffe behandelt, die, auf<br />
synthetischem Wege aufgebaut, als Werkstoffe Verwendung finden. Zum besseren Verständnis<br />
dieser Werkstoffklasse - der sogenannten "<strong>Kunststoffe</strong>" - werden zunächst mit Hilfe der Physik der<br />
Hochpolymeren Einblicke in den Aufbau der ihnen zugrundeliegenden Makromoleküle gegeben und<br />
erst dann die verschiedenen Herstellungsmöglichkeiten (Synthesen) diskutiert. Die Bedeutung der<br />
<strong>Kunststoffe</strong> wird durch eine Vielzahl von Anwendungsbeispielen <strong>aus</strong> dem täglichen Leben<br />
veranschaulicht. Eine Reihe von Versuchen trägt nicht nur zum Verständnis der Theorie bei, sondern<br />
soll auch die kreative Lust zum Experimentieren wecken.<br />
Es ist uns seit Jahrhunderten geläufig, dass <strong>aus</strong> Erzen Metalle werden, <strong>aus</strong> Kaolin Porzellan entsteht,<br />
<strong>aus</strong> Sand Glas, <strong>aus</strong> tierischen Häuten Leder, <strong>aus</strong> Bäumen Tischlerholz. Aber dass <strong>aus</strong> Kohlenteer,<br />
3
<strong>aus</strong> Erdöl oder Erdgas (Hauptquelle für Kohlenwasserstoffe), <strong>aus</strong> dem Stickstoff der Atmosphäre<br />
(via Haber-Bosch-Verfahren), <strong>aus</strong> dem Wasser der Ozeane und Flüsse, <strong>aus</strong> dem Salz der Salzlager<br />
(via Chlor-Alkali-Elektrolyse) feste, harte, zähe, aber auch geschmeidige und elastische Werkstoffe<br />
hervorgehen oder auch Faserstoffe, die uns zur Bekleidung dienen, das ist das Ergebnis der<br />
Kunststoffchemie (siehe Abb. 1).<br />
Tabelle 1<br />
Einteilung der makromolekularen Stoffe 1)<br />
(nach H. Staudinger)<br />
I. Naturstoffe<br />
A. Kohlenwasserstoffe: Kautschuk, Guttapercha, Balata<br />
B. Polysaccharide: Cellulose, Stärke, Glykogen, Mannane, Pektine, Polyuronsäuren,<br />
Chitin<br />
C. Polynucleotide (Nucleinsäuren)<br />
D. Proteine und Enzyme<br />
E. Lignine und Gerbst offe (Übergang von den niedermolekularen zu den makromolekularen<br />
Stoffen)<br />
II. Umwandlungsprodukte von Naturstoffen<br />
A. Vulkanisierter Kautschuk (= Gummi)<br />
B. Zellwolle<br />
C. Celluloseether, -ester und -hydrate<br />
D. Leder<br />
E. Lanital ®<br />
F. Galalith usw.<br />
III. Synthetische Stoffe ("<strong>Kunststoffe</strong>")<br />
Entstanden durch:<br />
A. Polykondensation: z.B. Phenol-(Harnstoff-, Melamin-)Formaldehyd-Harze, Polyamide,<br />
Polyester, Polycarbonate, Silikone<br />
B. Polymerisation: z.B. Polyolefine (Polyethylen), Polyvinylchlorid, Polystyrol,<br />
Polybutadien, Polymethacrylsäuremethylester, Polyacrylnitril<br />
C. Polyaddition: z.B. Polyurethane, Epoxidharze<br />
4
1) Es handelt sich hier um die historische Betrachtungsweise H. Staudingers. Heute werden nahezu alle modernen<br />
<strong>Kunststoffe</strong> auf der Basis von Erdöl hergestellt.<br />
Abb.1<br />
Diesel- und Heizöle<br />
70%<br />
Vergaserkraftstoffe<br />
12,5%<br />
Vom Erdöl zum Kunststoff<br />
Erdöl<br />
100%<br />
Benzine<br />
20%<br />
Chemie-Rohstoffe<br />
7,5%<br />
<strong>Kunststoffe</strong><br />
4%<br />
5<br />
Sonstige<br />
10%<br />
andere Chemieprodukte<br />
96%<br />
Polyethylen PVC Polyurethane Polypropylen Polyamide Polyester Polystyrol<br />
1.2. Vielseitigkeit der Kunststoffanwendungen<br />
<strong>Kunststoffe</strong> sind <strong>aus</strong> unserem Leben und unserer Umgebung nicht mehr wegzudenken. Sie sind<br />
neuartige Werkstoffe, deren Verarbeitungsmöglichkeiten neue und überlegene Verfahren der<br />
Formgebung ermöglichen. In der Regel ist bei den <strong>Kunststoffe</strong>n nach der Formgebung keinerlei<br />
Nachbehandlung, etwa ein Anstrich, notwendig. Andererseits lassen sich <strong>Kunststoffe</strong> mit Pigmenten<br />
und anorganischen Füllstoffen versetzen, mit Glasfasern zu neuen Werkstoffen kombinieren oder<br />
mit Metallen zu Sandwich-Konstruktionen oder einseitig beschichteten Formkörpern verarbeiten.<br />
<strong>Kunststoffe</strong> gehören heute zum selbstverständlichen Rüstzeug des Konstrukteurs, des Architekten,<br />
des Modeschöpfers und des Künstlers. Sie sind Grundstoffe, Hilfsmittel, B<strong>aus</strong>toffe und<br />
Konstruktionselemente. <strong>Kunststoffe</strong> haben weitgehend den Ruf billiger Ersatzstoffe verloren; sie<br />
werden anerkannt als Werkstoffe hoher Güte, die es uns gestatten, auf neuen, arbeits- und
zeitsparenden Wegen zu völlig neuen Konstruktionen und Anwendungsgebieten zu gelangen. Sie<br />
tragen wesentlich zur Erforschung des Weltraums bei, helfen der Elektroindustrie, dem Maschinen-<br />
und Fahrzeugbau, dienen der Chemie bei der Gestaltung und Auskleidung von Apparaturen für<br />
moderne chemische Synthesen, erleichtern unser Leben und verschönern unseren Alltag. Moderne<br />
Raumgestaltung, <strong>aus</strong>reichende und zweckmäßige Kleidung, aber auch wichtige Fortschritte in der<br />
Medizin (Implantate, Dialysemembranen, Zahnersatz) und Informationstechnik (Fotoresists,<br />
Lichtleiter, Compact-Discs) wären undenkbar ohne die <strong>Kunststoffe</strong> - diesen Werkstoffen <strong>aus</strong> der<br />
Retorte.<br />
1.3. Heutige Entwicklung des Kunststoffmarktes<br />
Der stetig zunehmende Einsatz von <strong>Kunststoffe</strong>n im Werkstoffbereich spiegelt sich in einer seit<br />
Jahren steigenden Kunststoffproduktion wider. Die Massenkunststoffe Polyethylen, Polypropylen<br />
und Polyvinylchlorid machen zusammen etwa 60 Prozent aller erzeugten <strong>Kunststoffe</strong> <strong>aus</strong>. Neue<br />
Anwendungsgebiete und verbesserte Materialien sind in vielen Fällen das Ergebnis optimierter<br />
Herstellungs- und Verarbeitungsverfahren. Während neu entwickelte Polymerb<strong>aus</strong>teine nur für<br />
wenige, wenn auch bedeutende Spezialanwendungen eingesetzt werden, nehmen Mischungen<br />
bekannter Polymere mit überraschenden Eigenschaftskombinationen sowie mit Fasergebilden<br />
verstärkte Polymere einen zunehmenden Markt ein.<br />
Diese Aufwärtsentwicklung, deren Ende noch nicht abzusehen ist, verdanken die <strong>Kunststoffe</strong> ihren<br />
besonderen Eigenschaften, die den technischen Bedürfnissen unserer Zeit entgegenkommen. Es<br />
werden heute Stoffe benötigt, die für zahlreiche neue Einsatzgebiete besser sein müssen als die Natur<br />
sie zu liefern vermag.<br />
Aufgrund ihrer enorm gesteigerten Anwendungsmöglichkeiten und der riesigen Produktionsvolumina<br />
der <strong>Kunststoffe</strong> entstanden in den letzten Jahren für Industrie und Gesellschaft zunehmend neue<br />
Probleme und Aufgabenstellungen. Eine dieser wichtigen Technologiefragen ist das Problem des<br />
6
Recyclisierens von <strong>Kunststoffe</strong>n, das wir wegen seiner Bedeutung für die Zukunft in Kapitel 10<br />
dieses Buches <strong>aus</strong>führlich diskutieren.<br />
7
2. Makromolekül und Kunststoff: Begriffsbestimmung<br />
In der Tat ist es erstaunlich, wie vollkommen heute bereits die Eigenschaften vieler <strong>Kunststoffe</strong> sind.<br />
Ist es doch noch gar nicht lange her, seit Hermann Staudinger im Jahre 1922 erstmals die neue<br />
Bezeichnung "Makromoleküle" in Vorschlag brachte. Mittels polymeranaloger Umsetzungen, z.B.<br />
Verseifung von Polyvinylacetat zu Polyvinylalkohol und anschließendem Reacetylieren zum<br />
Polyvinylacetat (Abb. 2) sowie durch gezielten Abbau und Aufbau von Polyoxymethylenen (=<br />
Polyformaldehyd), konnte die Existenz von Riesenmolekülen, in denen alle Atome durch<br />
Hauptvalenzen verknüpft sind, eindeutig geklärt werden. Selbst danach hat es noch viele Jahre<br />
gedauert, bis sich die neuen Erkenntnisse endgültig durchsetzen konnten.<br />
Abb. 2: Umwandlung von Polyvinylacetat und Polyvinylalkohol ineinander<br />
H3C CO O CH<br />
H C CO O CH<br />
3<br />
CH 2<br />
CH 2<br />
H C 3 CO O<br />
CH2 CH<br />
H C 3 CO O<br />
CH2 CH<br />
Polyvinylacetat<br />
+ OH,<br />
-<br />
- CH -COO<br />
-<br />
3<br />
+ CH 3-COOH, - H 2O<br />
H C 3 CO O C<br />
H<br />
Vinylacetat<br />
8<br />
CH 2<br />
CH 2<br />
HO CH<br />
CH2 HO CH<br />
CH2 HO CH<br />
CH2 HO CH<br />
Polyvinylakohol<br />
Noch in den Jahren 1928 - 1930 hielten viele Forscher die Existenz derart großer Moleküle, wie sie<br />
für den Aufbau von <strong>Kunststoffe</strong>n benötigt werden, für unmöglich. Sie glaubten, die Eigenschaften<br />
polymerer Substanzen mit Assoziaten aufgrund von Nebenvalenzkräften (s. Kapitel 3.2.) erklären<br />
zu müssen. K.H. Meyer und H. Mark traten für einen micellaren Aufbau von Kolloidteilchen in den<br />
Lösungen makromolekularer Stoffe ein. Erst nach 1935 hat sich die makromolekulare Auffassung<br />
durchsetzen können. Leider ist für das Wort "<strong>Kunststoffe</strong>" bis heute noch keine allgemein anerkannte
Begriffsbestimmung gefunden worden. Die seit Jahren umstrittene Frage einer systematischen und<br />
einheitlichen Werkstoffbezeichnung konnte noch nicht gelöst werden, und die Klassifizierung der<br />
<strong>Kunststoffe</strong> wird noch immer nach verschiedenen Gesichtspunkten vorgenommen , so z.B.<br />
• nach ihrer chemischen Zusammensetzung<br />
• nach der Molekülgestalt<br />
• nach ihrem physikalischen Verhalten<br />
• nach den Verarbeitungsarten des Rohproduktes<br />
• nach Bildungsreaktionen usw.<br />
Zu den sogenannten <strong>Kunststoffe</strong>n zählen auch Kunstfasern, Kunstgläser, Synthesekautschuk,<br />
Schaumstoffe, Klebstoffe, Lackrohstoffe, viele Hilfsstoffe für die Leder-, Textil-, Papier- und<br />
Erdölindustrie. Zählt man einmal nach, so stellt man fest, dass es nur etwa zwei Dutzend wichtige<br />
Kunststoff-Typen, aber mehrere T<strong>aus</strong>end Handels- (also Phantasie-) Bezeichnungen bei den<br />
<strong>Kunststoffe</strong>n gibt. Hierdurch wird es schwierig, ohne Anleitung den richtigen Kunststoff für den<br />
richtigen Anwendungszweck <strong>aus</strong>zuwählen.<br />
Die Fülle der angebotenen Materialien erscheint unüberschaubar. Um den Überblick also nicht zu<br />
verlieren, benötigt man eine vernünftige Einteilung. Vom Fachnormen<strong>aus</strong>schuss <strong>Kunststoffe</strong> im<br />
Deutschen Normen<strong>aus</strong>schuss wurde eine Begriffsbestimmung vorgeschlagen, die für die Zwecke<br />
eines Lehrbuches so <strong>aus</strong>sagekräftig ist, dass sie hier herangezogen werden soll, obwohl sie<br />
inzwischen vielfach abgewandelt wurde:<br />
"<strong>Kunststoffe</strong>" oder "Plaste" sind danach Materialien, die<br />
A) in ihren wesentlichen Bestandteilen organischer Natur sind,<br />
B) <strong>aus</strong> <strong>Makromolekülen</strong> aufgebaut sind (d.h. mindestens 10 2 Grundb<strong>aus</strong>teine ent-<br />
halten, die durch Hauptvalenzen miteinander verknüpft sind),<br />
C) durch Synthese oder durch Umwandlung von Naturprodukten entstehen.<br />
9
zu A): Die <strong>Kunststoffe</strong> sind in ihren wesentlichen Bestandteilen organischer Natur<br />
Die <strong>Kunststoffe</strong> gehören somit aufgrund ihrer chemischen Konstitution in den Bereich der<br />
organischen Chemie, die allgemein auch als die Chemie der Kohlenstoffverbindungen bezeichnet<br />
wird. Mineralische Hochpolymere, wie z.B. Diamant, Glimmer, Graphit, Asbest oder Glas, gehören<br />
nicht zur Klasse der <strong>Kunststoffe</strong>.<br />
Das Element Kohlenstoff als der Grundstoff der organischen Chemie nimmt unter den Elementen<br />
insofern eine her<strong>aus</strong>ragende Sonderstellung ein, als seine Atome bekanntlich durch die seltene, aber<br />
entscheidende Fähigkeit <strong>aus</strong>gezeichnet sind, sich in vielseitiger Weise aneinander zu binden. Diese C-<br />
C-Bindungen können sowohl in Form von Ketten (acyclische Verbindungen) als auch in Form von<br />
Ringen (cyclische Verbindungen) auftreten. Auf der Fähigkeit zu derartigen Verknüpfungen beruht<br />
die unübersehbare Mannigfaltigkeit der Kohlenstoff-Verbindungen (weit über eine halbe Million) und<br />
damit auch die stoffliche Grundlage der Kunststoff-Chemie. Dies schließt natürlich nicht <strong>aus</strong>, dass<br />
<strong>Kunststoffe</strong>, wie auch organische Moleküle im allgemeinen, Heteroatome (insbesondere O, N, S, Cl)<br />
enthalten können.<br />
Auf dieser Stufe der Definition bleibt jedoch die Klasse der Silikone unberücksichtigt, da diese sich<br />
<strong>aus</strong> Si-O-Si-O-Sequenzen anstatt <strong>aus</strong> C-C-Ketten aufbauen.<br />
Zu B): Die <strong>Kunststoffe</strong> sind <strong>aus</strong> <strong>Makromolekülen</strong> aufgebaut<br />
In allen <strong>Kunststoffe</strong>n, mögen sie äußerlich noch so verschieden sein, ist das gleiche Bauprinzip, die<br />
gleiche Architektur im Allerkleinsten zu finden. Sie sind <strong>aus</strong> vielen kleinen Einheiten aufgebaut, um<br />
es mit einem Fach<strong>aus</strong>druck zu sagen: makromolekular.<br />
10
Solche Makromoleküle entstehen dadurch, dass eine Vielzahl kleiner gleichartiger oder artverwandter<br />
Moleküle (sogenannte Monomere oder Grundb<strong>aus</strong>teine) über Hauptvalenzbindungen (kovalente<br />
Bindungen) miteinander verknüpft werden.<br />
Derartige Makromoleküle sind fadenförmige Riesenmoleküle. Eine regelmäßige und häufige<br />
Aufeinanderfolge der Grundb<strong>aus</strong>teine ist charakteristisch für den Strukturaufbau der <strong>Kunststoffe</strong>.<br />
Dadurch unterscheiden sie sich bereits wesentlich von den uns bisher bekannten niedermolekularen<br />
Stoffen.<br />
Abb. 3: Verknüpfung von Monomeren zu Polymeren<br />
Viele kleine Moleküle großes Fadenmolekül<br />
H 2 C CH 2 + H 2 C CH 2 + H 2 C CH 2<br />
Wenn man eine Grenze zwischen makromolekularen und niedermolekularen Verbindungen ziehen<br />
will - beide Gruppen sind natürlich durch einen kontinuierlichen Übergang verbunden - so kann man<br />
die Stoffe, die ein Molekulargewicht über 10.000 haben, deren Molekül also <strong>aus</strong> etwa 1000 und mehr<br />
Atomen aufgebaut sind, als makromolekular bezeichnen. Moleküle mit einer geringeren Anzahl sich<br />
wiederholender Einheiten werden Oligomere genannt.<br />
Eine obere Grenze für die Größe der Makromoleküle lässt sich bis heute nicht angeben. Die als<br />
<strong>Kunststoffe</strong> verwendeten Polymeren haben im allgemeinen Molekulargewichte der Größenordnung<br />
10 4 - 10 6 . Bei natürlich vorkommenden Verbindungen sind Molekulargewichte von mehreren<br />
Millionen bekannt.<br />
11<br />
CH 2<br />
CH 2<br />
CH 2<br />
CH 2<br />
CH 2<br />
CH 2
Zu C): <strong>Kunststoffe</strong> entstehen durch Synthese oder Umwandlung von Naturprodukten<br />
Zur Herstellung hochpolymerer Werkstoffe bieten sich der Kunststoff-Chemie aufgrund der zur<br />
Verfügung stehenden Ausgangsprodukte zwei grundverschiedene Möglichkeiten:<br />
- Die Umwandlung von Naturprodukten, die bereits als hochmolekulare<br />
Verbindungen vorliegen (z.B. Cellulose, Kasein; ab 1875)<br />
- Die verschiedenen Methoden der Synthese wie: Polykondensation (ab 1910)<br />
12<br />
Polymerisation (ab 1930)<br />
Polyaddition (ab 1940)<br />
Die umgewandelten Naturprodukte werden an dieser Stelle - um den Rahmen der Betrachtungen<br />
nicht zu sprengen - nicht behandelt.<br />
Eine tiefgreifende stoffliche Erweiterung, durch die die <strong>Kunststoffe</strong> ihre heutige Bedeutung auf dem<br />
Weltmarkt erlangt haben, ist erst durch die Entwicklung der oben angeführten chemischen Synthese-<br />
Verfahren ermöglicht worden. Diese werden im Kapitel 6 <strong>aus</strong>führlich diskutiert.
3. Strukturprinzipien<br />
Die Feststellung, <strong>aus</strong> welchen Atomen ein Makromolekül zusammengesetzt ist, sagt noch nichts<br />
Entscheidendes über seinen Aufbau. So gibt es z.B. eine ganze Reihe makromolekularer Stoffe, die<br />
nur <strong>aus</strong> Kohlenstoff und Wasserstoff aufgebaut sind, aber ganz verschiedene Eigenschaften haben<br />
wie: Polyethylen, Polypropylen, Naturkautschuk, Polystyrol, Polyisobutylen, Polybutadien. Ent-<br />
scheidend ist, wie die verschiedenen Atome miteinander verbunden sind und wie ihr Verhältnis<br />
untereinander ist.<br />
Die Größe der Makromoleküle bedingt Variationsmöglichkeiten ihrer Gestalt und Ordnung, wie dies<br />
z.B. auch bei Gebäuden der Fall ist: So wie man hier <strong>aus</strong> der gleichen Anzahl von B<strong>aus</strong>teinen ganz<br />
verschiedene Häuser errichten kann, so unterscheiden sich auch die Makromoleküle weitgehend in<br />
ihrer Gestalt und Ordnung, aber auch durch die Art und Anordnung der an ihrem Aufbau beteiligten<br />
Atome (= chemischer Aufbau).<br />
Wissenschaftlich lassen sich diese Strukturprinzipien so beschreiben, dass man ein komplex<br />
aufgebautes Polymer gedanklich zuerst auf seine elementaren Atomb<strong>aus</strong>teine und deren gegenseitige<br />
chemische Verknüpfung zurückführt (Primärstruktur). Anschließend beschreibt man die räumliche<br />
Anordnung des so definierten einzelnen Makromoleküls (Sekundärstruktur). Zuletzt ist es jedoch<br />
von entscheidender Bedeutung zu erkennen, wie sich mehrere Makromoleküle zu mikroskopisch<br />
oder mit bloßem Auge sichtbaren Aggregaten zusammenfinden (Tertiär- oder Aggregatstruktur), da<br />
diese einen entscheidenden Einfluss auf die Werkstoffeigenschaften eines <strong>Kunststoffe</strong>s haben.<br />
Zum Verständnis von Struktur-Eigenschafts-Beziehungen ist diese Systematik der Struktur-<br />
prinzipien sehr hilfreich. Diese werden im folgenden im Detail erläutert.<br />
13
3.1. Primärstruktur<br />
Der chemische Aufbau der Polymeren hängt von der Art der eingesetzten Monomeren, bei<br />
Monomergemischen von dem Verhältnis und der Verknüpfungsart (statistisch, alternierend,<br />
sequentiell) der miteinander polymerisierenden Monomerb<strong>aus</strong>teinen ab. Die chemische<br />
Zusammensetzung gibt die relative Atomzusammensetzung wieder, wie sie in der Elementaranalyse<br />
erfasst wird. Der Aufbau der Polymerkette wiederum kann linear sein, das Polymer kann verzweigt<br />
(strauchartig) oder aber auch vernetzt sein. Vernetzte Polymere können prinzipiell auch in größeren<br />
Formteilen nur <strong>aus</strong> einem einzigen riesigen Polymermolekül bestehen. Die uns <strong>aus</strong> der organischen<br />
Chemie bekannten Strukturelemente zur exakten Wiedergabe eines Moleküls umfassen<br />
a) Konstitution (Beschreibung der Atomsequenz)<br />
b) Konfiguration (Beschreibung der räumlichen Anordnung ohne Berücksichtigung von<br />
Drehungen um Einfachbindungen)<br />
c) Konformation (Beschreibung der exakten räumlichen Anordnung unter Berücksichtigung<br />
von Drehungen um Einfachbindungen)<br />
Unterschiede in Konstitution, Konfiguration und Konformation führen bei niedermolekularen<br />
Verbindungen zu unterscheidbaren Isomeren. Die Primärstruktur von Polymeren wird durch<br />
Konstitution und Konfiguration der Kettenb<strong>aus</strong>teine bestimmt. Die Konformation der<br />
Polymerketten und ihre Beschreibung ist Gegenstand der Sekundärstruktur (s. 3.2.).<br />
Gerade die Art der Verknüpfung der Monomeren ist für viele Eigenschaften der <strong>Kunststoffe</strong> von<br />
Bedeutung. So können z.B. in Vinylpolymeren prinzipiell (s. Kapitel 6.3.1., Abb. 28) zwei<br />
verschiedene Anordnungsmöglichkeiten der Monomeren vorkommen, nämlich die Kopf-Schwanz-<br />
Struktur und die Kopf-Kopf-Struktur (Abb. 4).<br />
H H<br />
C<br />
C<br />
X<br />
H<br />
14<br />
n
Abb. 4: Konstitutions-Isomere: Kopf-Schwanz- bzw. Kopf-Kopf-Struktur<br />
X X X X X<br />
Kopf-Schwanz-Struktur<br />
1,3-Stellung der Substituenten X<br />
X<br />
15<br />
X<br />
X<br />
Kopf-Kopf-Struktur<br />
1,2-Stellung der Substituenten X<br />
Aus energetischen und sterischen Gründen ist die Kopf-Kopf-Struktur allerdings ein seltener<br />
Ausnahmefall. Die meisten Vinylpolymere bevorzugen die Kopf-Schwanz-Anlagerung, wobei es<br />
aber nur schwer zu beweisen ist, dass diese Regelmäßigkeit der Anordnung nicht doch in einigen<br />
wenigen Fällen unterbrochen ist.<br />
Bei der Polymerisation von 1,3-Dienen (z.B. Butadien) lassen sich zwei Konstitutionsisomere<br />
unterscheiden, die durch 1,2- bzw. 1,4-Polymerisation entstanden sind. Die sich im 1,4-<br />
Polybutadien neu bildenden Doppelbindungen können außerdem cis- und trans-konfiguriert sein.<br />
X<br />
X
Abb. 5: Isomere bezüglich Konstitution (1,2- bzw. 1,4-Anordnung) und Konfiguration<br />
(trans- bzw. cis-Anordnung)<br />
1,2-Polybutadien<br />
Butadien<br />
all-trans-1,4-<br />
Polybutadien<br />
R<br />
R<br />
all-trans-1,4-<br />
Polybutadien<br />
bzw. -isopren<br />
16<br />
R<br />
R<br />
2-Methyl-1,3-butadien<br />
oder Isopren<br />
R<br />
all-cis-1,4<br />
Polybutadien<br />
bzw. -isopren<br />
Die Bezeichnungen "all-trans"- bzw. "all-cis"- deuten bereits an, dass hiermit nur zwei Grenzfälle<br />
formuliert wurden. In der Praxis lässt sich durch präparative Kniffe das Verhältnis von cis- zu trans-<br />
konfigurierten Doppelbindungen ebenso wie das Verhältnis von 1,2- zu 1,4-Polymerisat in weiten<br />
Bereichen wählen. Dies hat entscheidenden Einfluss auf die Materialeigenschaften. So entspricht<br />
z.B. das all-cis-konfigurierte Polyisopren (s. Abb. 5 für R = CH3) dem Naturkautschuk mit seinen<br />
bekannten elastischen Eigenschaften. Das all-trans-1,4-Polyisopren hingegen kommt in der Natur als<br />
Guttapercha vor und ist kristallin und unelastisch. Im Kapitel 4.2.2. werden diese<br />
Eigenschaftsunterschiede <strong>aus</strong> den Strukturkennzeichen näher erläutert.
An dieser Stelle muss jedoch auf eine weitere Differenzierung der Primärstruktur von<br />
<strong>Makromolekülen</strong> bezüglich ihrer Konfiguration hingewiesen werden. Schon in den beiden<br />
vorangegangenen Abbildungen waren Makromoleküle mit tertiären C-Atomen innerhalb einer<br />
Vinylkette zu sehen, die vier unterschiedliche Substituenten enthielten. Diese tertiären C-Atome<br />
sind als Asymmetriezentren (vergl. z.B. Milchsäure) zu betrachten, an denen der Substituent X in<br />
zwei räumlich unterschiedlichen Anordnungen, R- bzw. S-Konfiguration, gebunden sein kann. Wenn<br />
alle Substituenten einer Vinylkette die gleiche Orientierung aufweisen (also alle R- oder alle S-<br />
Anordnung), dann nennt man das Makromolekül "isotaktisch". Wechseln beide Konfigurationen<br />
regelmäßig ab (R-S-R-S-R-S), dann spricht man von "syndiotaktischen" Polymeren.<br />
Die meisten radikalisch hergestellten Polymere haben keine regelmäßige sterische Anordnung der<br />
Substituenten. R- und S-Konfiguration folgen rein zufällig aufeinander. Man nennt diese Polymere<br />
"ataktisch" (Abb. 6).<br />
Abb. 6: Konstitutions-Isomere des Polypropylens bezüglich Taktizität<br />
a) isotaktische Anordnung<br />
b) syndiotaktische Anordnung<br />
c) ataktische Anordnung<br />
a)<br />
b)<br />
c)<br />
CH 3 CH 3 CH 3 CH 3 CH 3 CH 3 CH 3<br />
CH3 CH 3 CH3 CH3 CH 3 CH3 CH3 CH CH CH CH CH CH CH 3 3 3 3 3 3 3<br />
Während sich Polymere unterschiedlicher Taktizität in gelöstem Zustand sehr ähnlich verhalten,<br />
unterscheiden sie sich ansonsten deutlich. Während z.B. ataktisches Polypropylen ein weiches,<br />
elastisches, gummiartiges Material ist, zeigen iso- und syndiotaktisches Polypropylen einen hohen<br />
17
Anteil an Kristallinität, was die Verarbeitung zu Rohren, Folien oder Fäden ermöglicht.<br />
Polypropylen z.B. ist durch Wahl geeigneter Reaktionsbedingungen (Katalysator, Temperatur,<br />
Solvens) in allen drei stereoisomeren Formen darstellbar. Man spricht hierbei von stereospezifischen<br />
Polymerisationen.<br />
Bis zu dieser Stelle wurde die Primärstruktur von <strong>Makromolekülen</strong> an den einfachsten Beispielen,<br />
kettenförmigen <strong>aus</strong> nur einem Monomer aufgebauten Strukturen, erläutert (unverzweigte Homo-<br />
polymerisate). Die Primärstruktur umfasst auch die sehr bedeutenden Aspekte, dass Makromoleküle<br />
<strong>aus</strong> mehreren unterschiedlichen Monomeren aufgebaut sein und molekulare Verzweigungen und<br />
Vernetzungen aufweisen können. Diesen Themen sind die beiden folgenden Abschnitte gewidmet.<br />
3.1.1. Copolymere<br />
Wenn zwei (oder mehrere) unterschiedliche Monomere in eine Polymerkette eingebaut werden,<br />
entstehen sogenannte "Co- oder Mischpolymerisate". Je nach Art der Sequenz zweier in "einem"<br />
Makromolekül enthaltenen Monomere A und B spricht man von binären<br />
statistischen Copolymerisaten -A-A-B-A-B-B-A-B-A-A-A-<br />
alternierenden Copolymerisaten -A-B-A-B-<br />
und Block-Copolymerisaten oder Segment-Copolymerisaten -A-A-A-A-B-B-B-B-<br />
Sind bei einem verzweigten Produkt die Verzweigungen <strong>aus</strong> einem anderen Monomer aufgebaut als<br />
die Hauptkette, so spricht man von einem "Pfropfcopolymerisat".<br />
A-A-A-A-A-A-A-A-A-A-A-A-A-A-A-A<br />
B B<br />
B<br />
B B<br />
B<br />
B B<br />
B<br />
B B<br />
B<br />
18
Zur Begriffsabgrenzung sei an dieser Stelle darauf hingewiesen, dass ein Kunststoff auch <strong>aus</strong><br />
verschiedenen Monomeren in der Art aufgebaut sein kann, dass jedes enthaltene Makromolekül für<br />
sich ein Homopolymerisat darstellt, aber in verschiedenen Molekülen unterschiedliche Monomere<br />
eingebaut wurden. Es handelt sich bei diesem Kunststoff dann um eine Mischung verschiedener<br />
Polymere, die man auch Polymer-Blend oder Polymer-Legierung nennt (s. Kapitel 8.2.3.).<br />
19
3.1.2. Verzweigte/vernetzte Makromoleküle<br />
Für die Gestalt der Makromoleküle lassen sich ganz allgemein drei extreme Fälle denken:<br />
1) unverzweigte, lineare (faden- oder kettenförmige) Gestalt:<br />
2) verzweigte (strauchähnliche) Gestalt:<br />
3) (flächennetz- oder) raumnetzförmige Gestalt:<br />
Ausschnitt<br />
20<br />
höherfunktionelles Monomer<br />
= Vernetzer<br />
CH2-OH H C 3<br />
CH2-OH CH -OH 2<br />
oder<br />
Die flächennetzförmige Gestalt ist bisher nur bei Glimmer und Graphit, jedoch noch nicht bei<br />
nichtmineralischen hochpolymeren Werkstoffen gefunden worden.<br />
O<br />
H 3 C<br />
H 2<br />
C<br />
oder<br />
CH 3<br />
C<br />
H 2<br />
O<br />
O
Verzweigte Polykondensate (s. Kapitel 6.2.) entstehen in Gegenwart von Monomeren mit einer<br />
Funktionalität größer als zwei.<br />
Die Polymerisation (s. Kapitel 6.3.) von Alkenen führt schon bei Anwesenheit von bifunktionellen<br />
Monomeren zu verzweigten Strukturen. Das höherfunktionelle Monomer kann also Anlass zu<br />
Verzweigungen geben. Bei Anwesenheit vieler Verzweigungen in einem Makromolekül kann ein<br />
polymeres Material <strong>aus</strong> nur einem einzigen Molekül bestehen, das weitgehend vernetzt ist. Diese<br />
höherfunktionellen Monomere werden deshalb auch als Vernetzer bezeichnet. Man spricht im<br />
allgemeinen dann von vernetzten <strong>Makromolekülen</strong>, wenn diese durch zunehmende Verzweigung in<br />
allen Lösemitteln unlöslich geworden sind. Ein teilvernetztes Polymer hingegen besteht <strong>aus</strong> löslichen<br />
und unlöslichen <strong>Makromolekülen</strong>.<br />
Von der Struktur her besteht zwischen verzweigten und vernetzten <strong>Makromolekülen</strong> nur ein geringer<br />
Unterschied, nämlich die Höhe der Vernetzungsdichte. Abbildung 7a zeigt schematisch drei<br />
verzweigte Makromoleküle. Diese wurden durch Erhöhung der Vernetzungsdichte in vernetzte<br />
Makromoleküle überführt, indem die Anzahl der Verknüpfungspunkte (Abb. 7b) bzw. der<br />
Polymerisationsgrad (Abb. 7c) erhöht wurde.<br />
Dieser strukturelle Unterschied hat jedoch einen dramatischen Einfluss auf das qualitative Verhalten<br />
des Polymers. Das vernetzte Polymer ist in allen Lösemitteln unlöslich; in Abhängigkeit vom<br />
Vernetzungsgrad und der Art des Lösemittels quillt das Polymer bei Lösemittelkontakt nur an (es<br />
saugt das Lösemittel ähnlich wie ein Schwamm auf ).<br />
Es entsteht ein sogenanntes Gel. Der Grad der Quellung nimmt mit steigendem Vernetzungsgrad ab.<br />
Die Erscheinung der Quellung zeigen zwar alle Polymere hohen Polymerisationsgrades, jedoch<br />
gehen unvernetzte Polymere mit der Zeit in viskose Lösungen über, während die Quellung der<br />
vernetzten Polymere scharf begrenzt ist und eine Erhöhung der Lösemittelmenge nur zu einer<br />
separaten Lösemittelphase führt.<br />
21
Entstehen die Vernetzungsbindungen nicht zwischen verschiedenen wachsenden <strong>Makromolekülen</strong><br />
(intermolekulare Vernetzung), sondern zwischen verschiedenen Bereichen eines einzigen<br />
Makromoleküls (intramolekulare Vernetzung), so spricht man von der Bildung von Mikrogelen.<br />
Abb. 7: Vernetzung dreier verzweigter Makromoleküle (a) durch Erhöhung der Anzahl an<br />
a)<br />
Verknüpfungspunkten (b) bzw. durch Erhöhung des Polymerisationsgrades (c)<br />
b)<br />
c)<br />
Bei einer Polymerisation in Lösung kann die viskose Reaktionslösung innerhalb weniger Sekunden in<br />
ein vernetztes Gel übergehen. Dieses Phänomen erklärt sich zwangsläufig <strong>aus</strong> den obigen<br />
Ausführungen durch die Überschreitung einer kritischen Vernetzungsdichte. Der Zustand beim<br />
plötzlichen Überschreiten der kritischen Vernetzungsdichte wird als Gelpunkt bezeichnet.<br />
22
3.2. Sekundärstruktur und zwischenmolekulare Bindungskräfte<br />
Bevor die höchst interessante Sekundärstruktur der Makromoleküle näher erläutert wird, zunächst<br />
einige hierzu notwendige Bemerkungen über die sogenannten zwischenmolekularen Bindungskräfte<br />
(auch Nebenvalenz- oder Sekundärbindungskräfte genannt), die von entscheidendem Einfluss auf<br />
das Verhalten der <strong>Kunststoffe</strong> sind:<br />
Man versteht darunter die Bindungskräfte zwischen den einzelnen Molekülen. (Im Gegensatz dazu<br />
bezeichnet man die wesentlich stärkeren Bindungen der Atome innerhalb eines Moleküls als<br />
Hauptvalenz-, Primär- oder kovalente Bindungen).<br />
Die Stärke der Sekundärbindungskräfte ist abhängig<br />
- vom chemischen Aufbau, der Größe, Gestalt und Ordnung der Moleküle und<br />
- von äußeren Einflüssen (Temperatur) und Einwirkung von Fremdmolekülen.<br />
Niedermolekulare Substanzen mit einheitlichen Molekülen besitzen definierte Sekundärbindungs-<br />
kräfte. Sie liegen deshalb in bestimmten Aggregatzuständen vor:<br />
fest - flüssig - gasförmig<br />
Beim Erwärmen werden die Sekundärbindungskräfte an festliegenden Umwandlungspunkten<br />
(Schmelzpunkt - Siedepunkt) durch Wärmeenergie überwunden. Die Stärke der Sekundärbindungskräfte<br />
wächst mit der Berührungsfläche der Moleküle untereinander, also mit der Molekülgröße und<br />
dem Grad der Molekülordnung. Außerdem ist die Intensität dieser Sekundärkräfte von der Zahl<br />
polarer Gruppen (z.B. Carbonamidgruppen) im Molekül abhängig.<br />
Bei den makromolekularen Stoffen wird somit einerseits der Zusammenhalt der Moleküle durch ihre<br />
Größe begünstigt, andererseits durch mangelnde Molekülordnung beeinträchtigt. Außerdem ergeben<br />
schwankende Molekülgröße und wechselnder Ordnungsgrad Sekundärbindungskräfte sehr<br />
23
unterschiedlicher Stärke. Deshalb treten verschiedene <strong>Kunststoffe</strong> in einer breiten Skala von<br />
Übergangsformen zwischen dem festen und flüssigen Zustand auf.<br />
Beim Erwärmen eines Polymers, dessen Makromoleküle immer eine Molekulargewichtsverteilung<br />
aufweisen, werden die Sekundärbindungen auch zwischen den <strong>Makromolekülen</strong> in mehr oder<br />
weniger breiten Temperaturbereichen überwunden, wodurch eine mehr oder weniger schnelle<br />
Erweichung oder Verflüssigung eintritt.<br />
Die Sekundärbindungskräfte beruhen auf verschiedenen intermolekularen Anziehungskräften. Wir<br />
unterscheiden im wesentlichen zwischen:<br />
A) Van-der-Waals-Kräfte (Dispersionskräfte)<br />
Es sind dies in der Materie allgemein wirkende ungerichtete Anziehungskräfte zwischen den<br />
Molekülen. Es handelt sich bei ihnen letzten Endes um eine elektrostatische Wirkung, die durch den<br />
Aufbau der Atome und Moleküle <strong>aus</strong> Elektronen und positiv geladenen Kernen bedingt ist.<br />
B) Dipol-Dipol-Wechselwirkungen<br />
Hierunter versteht man die elektrostatische Anziehungskraft, die zwischen dem positiv geladenen<br />
(bzw. partiell positiv geladenen) Teil eines Moleküls und einem negativen Molekülteil wirkt.<br />
+<br />
-<br />
-<br />
+<br />
C) Wasserstoffbrücken-Bindungen<br />
Hier liegt eine besonders wirkungsvolle Dipol-Dipol-<br />
Anziehung vor, bei der ein Wasserstoffatom als Brücke<br />
24<br />
R<br />
H O<br />
R O H<br />
H<br />
R<br />
R N R<br />
O<br />
R
zwischen zwei elektronegativen Atomen (insbesondere O, N oder F) fungiert, wobei es mit dem<br />
einen Atom durch eine kovalente Bindung, mit dem anderen nur durch elektrostische Kräfte ( ... )<br />
verbunden ist.<br />
Mit 1 - 2 kJ/mol hat eine Wasserstoffbrücken-Bindung üblicherweise nur etwa 1/10 der Stärke einer<br />
kovalenten Bindung, ist aber viel <strong>aus</strong>geprägter als andere Dipol-Dipol-Anziehungen oder gar reine<br />
van-der-Waals-Kräfte. Gerade die Wasserstoffbrücken-Bindungen sind für die Festigkeit mancher<br />
Hochpolymere <strong>aus</strong>schlaggebend (Polyamide, Polyurethane, Polyvinylalkohol, Polynukleotide).<br />
Der Einfluss dieser drei unterschiedlichen Sekundärbindungskräfte auf die Sekundärstruktur eines<br />
Makromoleküls bzw. die Tertiärstruktur von Makromolekülaggregaten ist wohl am eingehendsten<br />
bei den Polypeptiden untersucht worden. Die Größe der sperrigen Seitenketten R beeinflusst dort<br />
die van-der-Waals-Kräfte, die polaren Peptidbindungen bewirken Dipol-Dipol-Wechselwirkungen<br />
und die C = O ... HN - Wasserstoffbrücken sind besonders für den Aufbau von α-helicalen (Abb. 8a)<br />
bzw. Faltblattstrukturen (Abb. 8b) verantwortlich.<br />
Abb. 8: Helix- (a) und Faltblattstruktur (b) von Polypeptiden<br />
a) b)<br />
25
Zur Erinnerung: Die Sekundärstruktur beschreibt die räumliche Anordnung eines einzelnen Makro-<br />
moleküls und wird durch die Sekundärbindungskräfte beeinflusst.<br />
Die helicale Sekundärstruktur ist hierbei ebenso die Ausnahme wie die Anordnung des<br />
Makromoleküls als gestreckte Kette. Bei synthetischen amorphen <strong>Makromolekülen</strong> ist das stati-<br />
stische Knäuel die dominierende Sekundärstruktur. Kristalline oder teilkristalline Polymere ent-<br />
halten besonders häufig gefaltete Makromolekülketten.<br />
Abb. 9: Sekundärstrukturen verzweigter und unverzweigter Makromoleküle<br />
a) gestreckte Kette<br />
b) ungeordnetes Knäuel<br />
c) gefaltete Kette<br />
d) Helix<br />
Wie bereits erwähnt beeinflussen die Sekundärbindungskräfte auch die Aggregation verschiedener<br />
Makromoleküle untereinander. Die entstehenden Tertiär- (oder Aggregat-) Strukturen werden im<br />
folgenden Kapitel erläutert.<br />
26
3.3. Tertiärstruktur<br />
Mit der Einführung der Tertiärstruktur wird der Übergang von der rein molekularen Ebene zu<br />
mikroskopisch oder sogar mit bloßem Auge sichtbaren Aggregaten verschiedener Makromoleküle<br />
beschritten. Diese Aggregate erzeugen nicht nur den sogenannten Aggregatzustand des Polymers<br />
zwischen fest und flüssig, sondern auch sein Maß an Kristallinität (z.B. in Form eines Fadens, einer<br />
Fransenmizelle, eines Sphärolithen oder eines lamellenartigen Einkristalls) bzw. die völlige<br />
Unordnung des amorphen Zustandes (z.B. in Form von ineinander verflochtenen statistischen<br />
Knäulen). Die hier erwähnten unterschiedlichen, möglichen Tertiärstrukturen sollen im folgenden<br />
kurz erklärt werden.<br />
Der amorphe Zustand wird in Abb. 10 a durch ein Bindfadenmodell verflochtener statistischer<br />
Knäule symbolisiert. Die Fadenmoleküle erfüllen den Raum als äußerst dicht verknäuelter Filz. Der<br />
einzelne Faden darin ist nicht geradlinig gestreckt, nicht starr, sondern in einem Zustand wechselnder<br />
Knäuelung entsprechend der Drehbarkeit der C-Atome gegeneinander. Die Makromoleküle solcher<br />
amorpher Thermoplaste (s. Kapitel 4.1.) werden bei tiefen Temperaturen durch Sekundärkräfte so<br />
stark festgehalten, dass sie sich nicht gegeneinander bewegen können. Amorphe <strong>Kunststoffe</strong> sind<br />
deshalb glasartig und spröde.<br />
Abb. 10: Tertiärstrukturen<br />
a) völlige Unordnung (amorpher<br />
Zustand): Bindfadenmodell von<br />
verflochtenen statistischen<br />
Knäulen<br />
27
) teilkristalliner Zustand:<br />
Bindfadenmodell von Fransenmizellen<br />
(Kristallite von 16 - 40 nm Länge)<br />
c) und elektronenmikroskopische Aufnahme<br />
einer Polyethylenbruchfläche, die die<br />
geordneten Bereiche deutlich zeigt.<br />
d) Kristalline Sphärolith-Bereiche (Durchmesser der kugelförmigen Überstrukturen bis 0,25 mm)<br />
liegen neben amorphen Bereichen vor<br />
28
e) Lichtmikroskopische Aufnahme<br />
eines Sphärolithen <strong>aus</strong> isotaktischem<br />
Polystyrol.<br />
f) Kristalliner Zustand z.B. schematisch als lamellenförmiger Einkristall dargestellt, dessen<br />
Zusammenlagerung über Korngrenzen hinweg in einer elektronenmikroskopischen Aufnahme des<br />
Polyethers Penton ® (Poly-3,3-di-(chlormethyl)oxacyclobutan) deutlich wird.<br />
Fasern sind durch eine große Zugfestigkeit in<br />
Faserrichtung gekennzeichnet. Diese hohe Zugfestigkeit<br />
einiger Kunstfasern kann durch<strong>aus</strong> vergleichbar mit jener<br />
des Stahls sein und resultiert <strong>aus</strong> dem molekularen<br />
Aufbau. Lange, "fadenartige" Molekülketten liegen<br />
nämlich streng räumlich gerichtet eine neben der anderen.<br />
Diese Einschränkung der Anordnungsmöglichkeiten bedingt natürlich einerseits eine ungünstige En-<br />
tropie (Maß für Unordnung) des Systems. Andererseits gestatten diese Regelmäßigkeit und der enge<br />
Zusammenhalt der Moleküle die Ausbildung starker intermolekularer Kräfte, die sich günstig auf die<br />
29
Enthalpie (den Wärmeinhalt) des Systems <strong>aus</strong>wirken. Verwendungsmöglichkeiten von<br />
<strong>Makromolekülen</strong> hängen entscheidend von diesem "Tauziehen" zwischen Enthalpie und Entropie<br />
ab. In einer Faser gewinnt die Enthalpie über die Entropie aufgrund dominierender intermolekularer<br />
Kräfte.<br />
Die Ausrichtung der Moleküle einer Faser kann durch Verstrecken eines amorphen <strong>Kunststoffe</strong>s in<br />
der Wärme erreicht werden. Durch das Strecken werden die zwischenmolekularen Kräfte maximal<br />
wirksam. Sind die zwischenmolekularen Kräfte sehr klein, so kann der Verband der statistisch<br />
ungeordneten Makromoleküle nach dem Aufheben der Zugspannung wieder in seine ungeordnete<br />
Gleichgewichtslage zurückkehren.<br />
Wenn sich jedoch beim Strecken z.B. Wasserstoffbrücken <strong>aus</strong>bilden können, wie z.B. beim<br />
Polyamid (Perlon ® oder Nylon ® ), dann wird die gestreckte Form fixiert, d.h. die makromolekulare<br />
Verbindung ist weitgehend in den kristallisierten Zustand übergegangen und hat Faserstruktur<br />
angenommen.<br />
Versuche Nr. 1 und 2<br />
Vor der Beschreibung weiterer Tertiärstrukturen sollen nun erst einige allgemeine Bemerkungen über<br />
den Kristallzustand gemacht werden.<br />
Ein Kunststoff liegt im allgemeinen nicht in völlig kristalliner Form vor. Mit einsetzender<br />
Verfestigung des M aterials wird die Bewegungsmöglichkeit der Makromoleküle so eingeschränkt,<br />
dass sie sich nicht mehr in einem so regelmäßigen Muster anordnen können, wie dies für die<br />
Kristallbildung erforderlich wäre. Die Ketten verstricken sich aufgrund behinderter Rotationen um<br />
Einfachbindungen ineinander, wodurch Feststoffe entstehen, in denen sehr kleine kristalline Gebiete<br />
(sog. Kristallite) in amorphes Material eingebettet sind (2-Phasenmodell). Der Kristallinitätsgrad<br />
eines Polymers beschreibt den Anteil, zu dem es <strong>aus</strong> Kristalliten aufgebaut ist.<br />
30
Definitionsgemäß bezeichnet man einen Körper als kristallin, wenn sich seine elementaren B<strong>aus</strong>teine,<br />
z.B. Grundmoleküle, in drei nicht in einer Ebene liegenden Raumrichtungen in regelmäßigen<br />
Abständen wiederholen. Durch drei nicht koplanare Vektoren wird ein Raumgitter festgelegt, durch<br />
dessen Gitterpunkte sich zahlreiche zueinander parallele Netzebenen legen lassen. Man kann einen<br />
Körper nur dann als kristallin bezeichnen, wenn solche Netzebenen existieren.<br />
In der Natur sind solche Kristallsysteme am meisten verbreitet, die sich auf die kubisch oder<br />
hexagonal dichteste Kugelpackung von Elementarteilchen zurückführen lassen. Die Kompliziertheit<br />
der Bindungskräfte und die Existenz der gerichteten Bindungen lassen bei den synthetischen<br />
Hochpolymeren im Gegensatz zu den anorganischen Kristallen wesentlich verwickeltere Strukturen<br />
entstehen. Es herrschen monokline, rhombische und trikline Kristallformen vor.<br />
Bei makromolekularen Stoffen befinden sich im kristallisierten Zustand die Atome der parallel (wie<br />
Streichhölzer in einer Schachtel) gelagerten Molekülketten abschnittsweise in kristalliner Ordnung.<br />
Sie besetzen die Gitterpunkte eines Kristallgitters. Die Ketten liegen dabei meist in Lamellen oder<br />
Netzebenen, die durch Nebenvalenzkräfte zusammengehalten werden.<br />
Die Kristallbildung wird durch die Struktur der Monomereinheiten und durch die Art der<br />
Polymerisation bzw. Polykondensation festgelegt. Sind die entstandenen Makromoleküle verknäuelt<br />
oder verfilzt, so wird auch bei der Lösung in beliebigen Lösemitteln und beim Schmelzen die<br />
Verknäuelung kaum verschwinden. Das Molekül "schwimmt" unter Einlagerung von Lösemitteln<br />
und scheidet sich dann als Ganzes beim Verdunsten oder der Extraktion des Lösemittels oder beim<br />
Abkühlen <strong>aus</strong>, wobei die ursprüngliche Gestalt nahezu erhalten bleibt.<br />
Polyamide kristallisieren teilweise beim raschen Abkühlen zum Beispiel in einer Spritzguss-<br />
maschine. Durch Zusatz von Keimbildnern lässt sich dieser Anteil erhöhen und die Größe der<br />
Kristallite beeinflussen. Die Temperaturbeständigkeit der Polyamide liegt in einem hohen<br />
Kristallinitätsgrad begründet.<br />
31
Möchte man die Kristallite von Polymeren untersuchen, die <strong>aus</strong> der Schmelze und <strong>aus</strong> Lösung nicht<br />
teilkristallin anfallen, so gibt es zwei Möglichkeiten: Der Aufbau der Polymere erfolgt von Anfang<br />
an sehr langsam. Auch bei nicht vorhandener Verknäuelung muss man den Molekülen zur<br />
Parallellagerung genügend Zeit lassen. Eine solche Umlagerung ist selbstverständlich nur dann<br />
möglich, wenn die Platzwechselvorgänge noch nicht eingefroren sind. Der zweite, üblicherweise<br />
leichter durchzuführende Weg beschreitet ein langes Tempern bei mittleren Temperaturen. Die<br />
Kristallisationsgeschwindigkeit wird durch die Keimbildungsgeschwindigkeit und die Wachstums-<br />
geschwindigkeit der so entstandenen Keime festgelegt.<br />
Kristalline und amorphe Zustände treten im Sinne des obigen 2-Phasenmodells in sehr vielen<br />
hochmolekularen Stoffen gemeinsam auf. Die statistische Verteilung kristalliner und amorpher<br />
Bereiche und deren Größe hat mit der Länge der Fadenmoleküle aber nichts zu tun. Ein einzelnes<br />
Molekül kann verschiedenen Bereichen angehören und wesentlich größer sein als ein Kristallit.<br />
Aufgrund des 2-Phasenmodells nahm man lange Zeit an, dass es für die optimalen<br />
Gebrauchseigenschaften der <strong>Kunststoffe</strong> wichtig sei, dass ihre kristallinen und amorphen Bereiche in<br />
einem gut <strong>aus</strong>gewogenen Verhältnis zueinander stehen, wobei die kristallinen Bereiche allein die hohe<br />
Festigkeit und Temperaturbeständigkeit, die amorphen die Elastizität bestimmen sollten.<br />
Diese Vorstellung ist inzwischen grundlegend revidiert worden. Es ist häufig übersehen worden, dass<br />
das amorphkristalline 2-Phasenmodell eine Abstraktion darstellt, die nur einen stark idealisierten<br />
Teilaspekt der tatsächlich vorliegenden Festkörperstrukturen wiedergibt. Entsprechendes gilt für den<br />
sog. "Kristallinitätsgrad", der zwar im Rahmen des 2-Phasenmodells klar definiert, im Hinblick auf<br />
reale Substanzen aber häufig unklar und verschwommen ist.<br />
Einerseits bilden teilkristalline Polymere keinen Molekularfilz mit eingestreuten Kristalliten, sondern<br />
Kristall-Lamellen mit einer hohen Konzentration an Kettenrückfaltungen in den<br />
Lamellenoberflächen. Andererseits sind die Kristallbereiche nicht störungsfrei. Am Beispiel des<br />
konventionellen Polyacrylnitrils (PAN) lässt sich zeigen, dass, obwohl die betreffenden<br />
Röntgendiagramme einige Kristallreflexe aufweisen, PAN keinesfalls teilkristallin vorliegt, sondern<br />
32
nur sogenannte Parakristallbereiche bildet. Ähnliches wie für das PAN gilt für viele andere<br />
Hochpolymere (z.B. Polyethylenterephthalat). Nach den älteren Vorstellungen konnten die<br />
Kristallbereiche als physikalische Netzstellen aufgefasst werden, so dass vor allem der<br />
"Kristallinitätsgrad" von Interesse war. Nach den neueren Vorstellungen bilden dagegen die<br />
Grenzflächen der Kristallbereiche wegen der hohen Konzentration an Rückfaltungen eher<br />
Schwachstellen. Statt des "Kristallinitätsgrades" gewinnt deshalb die Struktur dieser Grenzflächen<br />
mehr und mehr an Bedeutung.<br />
Die mechanischen Eigenschaften teilkristalliner Thermoplaste (s. Kapitel 4.1.) hängen außer vom<br />
Kristallinitätsgrad vor allem von der Struktur der Korngrenzen zwischen den Kristallbereichen ab.<br />
Prinzipielle Möglichkeiten für eine Optimierung der Korngrenzen sind u.a. durch eine Variation der<br />
Polymerisationskinetik wie auch durch eine gezielte Modifizierung des Kettenbaues gegeben (s.<br />
hierzu W. Holzmüller und K. Altenburg "Physik der <strong>Kunststoffe</strong>", Akademie-Verlag Berlin).<br />
Doch zurück zu möglichen Formen der Tertiärstruktur. In Abbildung 10 b ist der teilkristalline<br />
Zustand sehr anschaulich mit dem <strong>aus</strong> dem Jahre 1931 stammenden Modell einer Fransenmizelle<br />
beschrieben. Sie weist in regelloser Anordnung kristalline Bereiche auf, in denen die Ketten gestreckt<br />
sind und parallel liegen, und nichtkristalline Bereiche mit verknäuelten Ketten. Jedes Molekül geht<br />
durch mehrere Bereiche hindurch. Dieses Modell kann aber nur zutreffen, wenn keine Sphärolithe<br />
vorhanden und die Ketten nicht gefaltet sind.<br />
Das Wachstum der Kristallite in Hochpolymeren geschieht in sehr vielen Fällen von einem Kern <strong>aus</strong><br />
und setzt sich radial nach außen hin fort, besonders bei geringer Keimbildungsgeschwindigkeit. Es<br />
kommt dabei zu kugelförmig angeordneten kristallinen Bereichen, die man Sphärolithe nennt. Die<br />
Kettenmoleküle sind in den in Abbildung 10 d dargestellten Sphärolithen tangential geordnet. Sie<br />
bilden lamellenartige Mizellformationen, die sich mehr oder weniger symmetrisch um einen<br />
Kristallisationskeim lagern.<br />
33
In vielen Fällen sind die Sphärolithe aber so klein, dass sie mit der Wellenlänge des Lichtes zu<br />
vergleichen sind. Sie geben dann Veranlassung zu einer Trübung bzw. zum Auftreten von<br />
Opaleszenz. Manchmal sind sie ineinander gewachsen (Dendrite). Sphärolithe werden beobachtet<br />
bei leicht kristallisierenden makromolekularen Stoffen, insbesondere bei den Polyamiden, einigen<br />
Polyestern, bei Polyethylen usw. Ihr Einfluss auf die mechanischen und dielektrischen Eigenschaften<br />
wird intensiv untersucht.<br />
Neben den vorstehend geschilderten Kristallstrukturen wurden durch Untersuchungen von Keller,<br />
Stuart et al. bei einer Reihe von makromolekularen Stoffen (z.B. Polyethylen, Poly-3,3-di-(chlor-<br />
methyl)-oxacyclobutan = Penton ® u.a.) Faltungen der Fadenmoleküle festgestellt, wobei bei<br />
Kettenlängen von 500 bis 2000 nm mehrere hundert Schlingen parallel liegen und "Lamellenartige<br />
Strukturen" mit einer Dicke von ca. 12 nm entstehen (s. Abb. 10f). Diese Lamellen stellen<br />
Einkristalle dar, die im Elektronenmikroskop sichtbar werden. Zwischen den Einkristallen bestehen<br />
Korngrenzen. Die Kettenachsen verlaufen senkrecht zur Oberfläche der Lamellen.<br />
34
4. Struktur-Eigenschafts-Beziehungen<br />
Aus der Primär-, Sekundär- und Aggregatstruktur lassen sich einige wichtige Regeln für den prak-<br />
tischen Einsatz der <strong>Kunststoffe</strong> ableiten. Umgekehrt lässt das Verhalten der <strong>Kunststoffe</strong> wichtige<br />
Rückschlüsse auf die Gestalt der ihnen zugrundeliegenden Makromoleküle zu.<br />
Die Primärstruktur beeinflusst einige Eigenschaften polymerer Stoffe direkt, so z.B. das chemische<br />
Grundverhalten, das geringe spezifische Gewicht, das hohe elektrische Isoliervermögen und z.T. die<br />
Löslichkeit (s. Abb. 11 für einige Details). Auf die meisten Eigenschaften wirkt sich die Primär-<br />
struktur jedoch nur indirekt <strong>aus</strong>, indem sie den Grad der Beweglichkeit der Polymerkette beeinflusst.<br />
Damit wird natürlich auch die Sekundärstruktur bestimmt, die ihrerseits die Aggregatstruktur und<br />
das physikalische, vor allem mechanische Verhalten der Stoffe festlegt.<br />
Abb. 11: Struktureinfluss auf grundlegende Eigenschaften<br />
Primärstruktur<br />
intramolekulareWechselwirkungen<br />
Kettenbeweglichkeit<br />
Sekundärstruktur<br />
intermolekulareWechselwirkungen<br />
Aggregatstruktur<br />
bestimmt<br />
weitgehend<br />
bestimmt<br />
weitgehend<br />
- chemisches Grundverhalten wie hohe Chemikalienbeständigke<br />
- geringes spezifisches Gewicht (etwa zwischen 0,9 - 1,4 g/cm 3 ,<br />
oder bis 2,3 g/cm 3 bei Anwesenheit schwerer Elemente)<br />
vergl.<br />
Aluminium:<br />
Stahl:<br />
Kupfer:<br />
35<br />
2,7 g/cm 3<br />
7,6 g/cm 3<br />
8,9 g/cm 3<br />
- hohes elektrisches Isoliervermögen<br />
- z.T. Löslichkeit / Quellbarkeit<br />
- physikalisches Verhalten<br />
- mechanisches Verhalten (flüssig, plastisch, weichelastisch,<br />
hartelastisch, spröde)<br />
- z.T. Löslichkeit / Quellung
4.1. Thermoplast, Duroplast, Elastomer, Duromer<br />
<strong>Kunststoffe</strong> mit linearen (oder verzweigten) unvernetzten <strong>Makromolekülen</strong> sind prinzipiell<br />
plastisch verformbar<br />
Das Fließverhalten (Viskosität) von Polymeren hängt in starkem Maße vom Molekulargewicht ab.<br />
Polymere mit niedrigem Molekulargewicht sind häufig bei Raumtemperatur honigartig. Bestehen nur<br />
geringe Sekundärkräfte zwischen den Molekülketten, können diese leicht aneinander abgleiten. Das<br />
Material verändert ohne große Krafteinwirkung seine Form und verfliesst. Ferner sind derartige<br />
Produkte in der Regel leicht löslich.<br />
<strong>Kunststoffe</strong> höheren Molekulargewichts mit langen Ketten weisen im allgemeinen höhere Festigkeit<br />
auf. Ursachen dieser erhöhten Festigkeit sind verstärkte Wechselwirkungen zwischen den Ketten<br />
(van der Waals, Dipol-Dipol, H-Brücken-Bindungen), Verhakungen und Verschlaufungen der ver-<br />
schiedenen Polymerketten untereinander und kristalline Bereiche. Die Summation dieser Einzelkräfte<br />
und die Art der Tertiärstruktur (s. 3.3.) bewirken, dass die Ketten bei normaler Temperatur und in<br />
vielen Fällen auch noch bei sehr hoher Temperatur aneinander festgehalten werden und nur schwer<br />
voneinander abgleiten können. Erst bei höherer Temperatur werden die Sekundärbindungen durch die<br />
Wärmebewegung geschwächt, und die Kettenmoleküle gleiten unter Zug oder Druck aneinander ab;<br />
die Stoffe sind thermoplastisch.<br />
Thermoplaste sind bei normaler Temperatur spröde oder zähelastische <strong>Kunststoffe</strong>, die sich ohne<br />
wesentliche chemische Veränderung durch Erwärmen reversibel in den plastischen Zustand bringen<br />
und verformen lassen. Thermoplaste sind schmelzbar und bei nicht zu hohem Molekulargewicht in<br />
Abhängigkeit von ihrem chemischen Aufbau mehr oder weniger gut löslich. Das vielseitige Verhalten<br />
der zahlreichen verschiedenen Stoffe bei Raumtemperatur - vom transparenten zum<br />
undurchsichtigen, vom spröden zum zähelastischen Material - ermöglicht hinreichende Auswahl für<br />
jeden Zweck.<br />
36
Polymere mit räumlich vernetzten Molekülen sind nicht mehr (oder nur sehr wenig) plastisch<br />
verformbar. Einige spezielle Polymere mit lose vernetzten Molekülketten sind gummielastisch:<br />
Durch die Zug- oder Druckbeanspruchung können die verknäuelten Kettenteile zwischen den<br />
Netzbrücken aneinander abgleiten und sich strecken. Im ganzen werden die Ketten aber durch die<br />
vernetzenden Primärbindungen festgehalten (Abb. 12b). Sie können nicht aneinander vorbeifliessen.<br />
Beim Nachlassen der äußeren Kraft nehmen die Kettenteile aufgrund von Wärmebewegung wieder<br />
die ursprüngliche verknäuelte Lage ein (Abb. 12a). Derartige Polymere werden Elastomere genannt.<br />
Sie sind bei tiefer Temperatur spröde und hart, bei höherer Temperatur elastisch (= gummielastisch),<br />
nicht schmelzbar, unlöslich, aber quellbar.<br />
Abb. 12: a) Kautschukmoleküle in der wahrscheinlichsten Lage;<br />
b) Kautschukmoleküle im gedehnten Zustand<br />
a) b)<br />
Bei <strong>Kunststoffe</strong>n mit räumlich eng vernetzten Molekülen sind diese durch Primärbindungen allseitig<br />
miteinander verankert (theoretisch ein einziges großes Molekül!). Solche <strong>Kunststoffe</strong> sind - wie der<br />
Fachmann sagt - vernetzt und werden häufig als Duromere oder Duroplaste bezeichnet.<br />
37
Duroplaste sind bei normaler Temperatur sehr hart und spröde. Sie sind temperaturbeständig, nicht<br />
plastisch verformbar, nicht schmelzbar, nur schwer quellbar und unlöslich. Sie entstehen durch<br />
Vernetzung reaktionsfähiger linearer und verzweigter Makromoleküle. Man nennt einen solchen<br />
Prozess "Härtung". Das Harz muss zur Formgebung vor der Härtung plastisch geformt werden.<br />
Es sei darauf hingewiesen, dass diese Wortschöpfung widersinnig, jedoch gängig ist. Sinngemäß<br />
übersetzt wären Duroplaste nämlich "hartweiche Stoffe" (durus (lat.) = hart/plastikos (griech.) =<br />
formbar). Ein sprachlich besserer Gegensatz zu Thermoplast (warm/formbar) wäre Thermodur<br />
(bei Wärme hart); jedoch hat sich dieser Terminus nicht durchsetzen können. Hingegen wird<br />
häufig als Synonym für Duroplast auch Duromer (meros (griech.) = Teil/also: hartes Teil)<br />
verwandt, was jedoch sprachlich besser als Gegensatz zu Elastomer verstanden werden sollte,<br />
unabhängig vom thermoplastischen oder duroplastischen Charakter.<br />
Duroplastische Kunstharze sind nach dem Aushärten immer glasig-starr. Das nicht gerade günstige<br />
mechanische Verhalten wird häufig dadurch verbessert, dass die Harze zusammen mit Harzträgern<br />
oder Füllstoffen verarbeitet werden (z.B. Gesteinspulver, Talkum, Kieselsäure, Holzmehl, organi-<br />
sche oder anorganische Fasern, Glasfasern und Glasgewebe). Diese wirken je nach ihrer Art, verstär-<br />
kend wie Zuschläge und Bewehrung im Beton. Ihr Anteil am Endprodukt liegt etwa bei 40 -80%.<br />
Man spricht bei diesen "gefüllten" <strong>Kunststoffe</strong>n auch von Composites oder Verbundwerkstoffen, die<br />
es im übrigen auch auf Basis thermoplastischer Harze gibt (s. Kapitel 8.2.5.).<br />
4.2. Beispiele<br />
4.2.1. Fasern<br />
38
Zuerst soll ein Beispiel <strong>aus</strong> dem Gebiet der Fasern einen Eindruck geben, wie gut die Beziehung<br />
zwischen Eigenschaften und Struktur eines <strong>Kunststoffe</strong>s verstanden werden kann. Es wurde bereits<br />
darauf hingewiesen, dass sich in Fasern Makromoleküle nach Verstrecken entlang der Faserrichtung<br />
parallel <strong>aus</strong>richten, da hiermit ein den Entropieverlust überkompensierender Enthalpiegewinn<br />
erreicht wird.<br />
Die entscheidenden Forderungen zum Aufbau einer Faser sind demnach:<br />
- lineare Molekülgestalt, die die parallele Anordnung des Moleküls erlaubt<br />
- starke intermolekulare Anziehungskräfte, die diese Parallelordnung nach Verstrecken aufrecht<br />
erhalten und die das Aneinanderabgleiten der Moleküle verhindern.<br />
Die häufigsten Kunstfasern sind:<br />
A: Polyamide (Nylon ® , Perlon ® , Dorix ® ),<br />
Polyurethane (Dorlastan ® , Spondex ® , Lycra ® , Vycra ® )<br />
B: Polyester (Diolen ® , Trevira ® , Terylen ® , Dacron ® ), Polyacrylnitril (Orlon ® , Dralon ® ,<br />
Acrilan ® )<br />
C: Isotaktisches Polypropylen (Meraklon ® , Marvess ® )<br />
Die notwendigen, starken intermolekularen Anziehungskräfte in Polyamiden und Polyurethanen<br />
sind auf Wasserstoffbrücken-Bindungen zurückzuführen (s. Abb. 13). In Polyestern und Polyacryl-<br />
nitril sind dies Dipol-Dipol-Anziehungskräfte durch die Carboxyl- bzw. Cyanogruppen.<br />
Im isotaktischen Polypropylen hingegen passen die sterisch regelmäßigen Ketten so gut zusammen,<br />
dass Van-der-Waals-Kräfte <strong>aus</strong>reichen, um die lineare Faserstruktur aufrechtzuerhalten.<br />
Abb. 13: Wasserstoffbrücken-Bindungen in Nylon-6,6-Kristalliten<br />
39
4.2.2. Elastomere<br />
Ein weiteres Beispiel gut verstandener Struktur-Eigenschafts-Beziehungen stammt <strong>aus</strong> dem Gebiet<br />
der Elastomere. Makromoleküle, die ein Elastomer aufbauen sollen, müssen ein relativ hohes<br />
Molekulargewicht und einen gewissen nicht zu hohen Vernetzungsgrad aufweisen. Die Vernetzung<br />
verhindert das Abgleiten der Moleküle voneinander, ohne die Flexibilität der Ketten zu sehr<br />
einzuschränken. Natürlicher Kautschuk ist ein typisches Elastomer mit langen, flexiblen<br />
Molekülketten, die durch gelegentliche Verzweigungsstellen und schwache intermolekulare Kräfte<br />
(keine Dipole, keine H-Brücken) zusammengehalten werden.<br />
Abbildung 14 a) zeigt deutlich, dass wegen der all-cis-Konfiguration des den Kautschuk aufbauenden<br />
1,4-Polyisoprens auch die Van-der-Waals-Kräfte gering sein müssen, da eine parallele<br />
Kettenanordnung sterisch behindert ist. Und in der Tat resultiert <strong>aus</strong> einer Erhöhung dieser Van-der-<br />
Waals-Kräfte im entsprechenden all-trans-Isomeren (Guttapercha) ein vollständiger Verlust an<br />
Elastizität.<br />
Abb. 14:<br />
O<br />
O<br />
H<br />
N<br />
H<br />
N<br />
O H<br />
O<br />
H<br />
N<br />
N<br />
H<br />
N<br />
H<br />
O<br />
N<br />
O<br />
40<br />
O<br />
O<br />
O<br />
H<br />
N<br />
H<br />
N<br />
H<br />
N
a)<br />
b)<br />
und<br />
a) all-cis Polyisopren/Kautschuk<br />
b) all-trans Polyisopren/Guttapercha<br />
Bei der üblichen Schwefel-Vulkanisation des Kautschukes werden Vernetzungen durch<br />
Schwefelbrücken zwischen allylischen Positionen verschiedener Ketten aufgebaut. Hierdurch wird<br />
der Kautschuk härter, reißfester und weniger klebrig.<br />
Abb. 15: Kautschuk-Vulkanisation<br />
CH 2<br />
CH<br />
( S ) x<br />
H<br />
CH 2<br />
+ S8 CH<br />
( S ) x<br />
CH<br />
( S ) x<br />
41<br />
CH 2<br />
H<br />
(x=2-8)<br />
x = 1 - 8<br />
CH<br />
S<br />
CH 2<br />
+ S x-1
5. Polydispersität der <strong>Kunststoffe</strong><br />
Die Größe der Makromoleküle wird durch das Molekulargewicht M oder den Polymerisationsgrad P<br />
angegeben.<br />
Der Polymerisationsgrad ist die Zahl der zu einem Makromolekül vereinigten kleinen Moleküle<br />
(Monomere). Das Molekulargewicht ist die Summe der Atomgewichte der in einem Molekül<br />
enthaltenen Atome. Man erhält es durch Multiplikation des Molekulargewichtes des Monomeren<br />
M mon mit dem Polymerisationsgrad.<br />
M = P . Mmon<br />
Die Länge der linearen und verzweigten Makromoleküle beträgt bei <strong>Kunststoffe</strong>n im allgemeinen 10 -6<br />
bis 10 -3 mm (bei Naturstoffen bis 1 mm); die "Dicke" der Ketten beträgt ungefähr 2 - 3 x 10 -7 mm.<br />
Staudinger hat diese Molekülform sehr anschaulich beschrieben, indem er sagte, man könnte diese<br />
Moleküle unter dem normalen Mikroskop sehen, wenn sie nur nicht so dünn wären.<br />
<strong>Kunststoffe</strong> sind aber keine einheitlichen Verbindungen, sondern bestehen immer <strong>aus</strong> einem Gemisch<br />
verschieden großer Makromoleküle, zwar gleichartigen Baues, aber unterschiedlichen Molekular-<br />
gewichtes; man sagt, sie sind polydispers.<br />
So, wie sich ein in der Ferne gleichmäßig wogendes Kornfeld <strong>aus</strong> der Nähe betrachtet in verschieden<br />
lange Halme auflöst, so sind auch die einzelnen Makromolekülfäden unterschiedlich lang. Man kann<br />
deshalb bei <strong>Kunststoffe</strong>n nur einen mittleren Polymerisationsgrad und ein mittleres<br />
Molekulargewicht angeben, weshalb als übliches Symbol für Mittelwerte oben bereits die<br />
"quergestrichenen" Größen M und P gewählt wurden.<br />
43
Das mittlere Molekulargewicht bewegt sich bei den meisten <strong>Kunststoffe</strong>n zwischen 8000 und etwa<br />
300 000. Die Streubreite der tatsächlichen Molekulargewichte wird als Molekulargewichts-<br />
verteilung bezeichnet.<br />
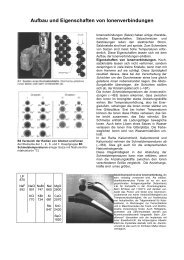
Abb. 16: Molekulargewichtsverteilung bei makromolekularen Stoffen<br />
Die Abbildung 16 zeigt die Verteilungskurve zweier makromolekularer Stoffe I und II. Beide Stoffe<br />
haben das gleiche mittlere Molekulargewicht. Stoff I ist einheitlicher als II. Es ist einleuchtend, dass<br />
sich diese beiden makromolekularen Stoffe, obwohl sie das gleiche mittlere Molekulargewicht haben,<br />
in ihren Eigenschaften wesentlich unterscheiden müssen. Die Uneinheitlichkeit des<br />
Molekulargewichts ist deshalb eine wichtige Kenngröße eines Polymers. Auf die physikalische<br />
Definition dieser Größe soll an dieser Stelle verzichtet werden, da der Begriff Uneinheitlichkeit zwar<br />
anschaulich ist, eine exakte Definition jedoch nur nach Beschreibung physikalischer Meßmethoden<br />
der Molekulargewichtsbestimmung möglich ist. Wie sich mechanische Eigenschaften der<br />
hochmolekularen Stoffe allein schon durch Änderung des mittleren Molekulargewichtes beeinflussen<br />
lassen, zeigt Tabelle 2.<br />
Häufigkeit<br />
M<br />
Tabelle 2<br />
Eigenschaften von Polyethylen: Abhängigkeit vom mittleren Molekulargewicht M<br />
mittleres Molekulargewicht 24000 28000 32000 37000 44000<br />
I<br />
44<br />
II<br />
Molekulargewicht
Zugfestigkeit (N/cm_): 1080 1280 1520 1570 1720<br />
Kältefestigleit (Versprödungstemperatur<br />
in °C)<br />
6. Polymersynthesen wichtiger <strong>Kunststoffe</strong><br />
6.1. Allgemeine Hinweise<br />
-30 -40 -70 -80 -100<br />
Werden <strong>aus</strong>schließlich monofunktionelle Monomere eingesetzt, so entstehen unvernetzte Polymere,<br />
die sich in der Regel thermoplastisch verhalten, soweit keine Vernetzung durch besondere<br />
"Verbrückungen" auftreten (z.B. verbrückende Propfäste, starke H-Brücken). Ist mindestens eine<br />
der Ausgangskomponenten bi- oder höherfunktionell, so entstehen vernetzte, unlösliche, unschmelzbare<br />
Polymere. Bevor nun die drei Grundtypen der Polyreaktionen - Polykondensation,<br />
Polymerisation und Polyaddition - erläutert werden, ist es notwendig, die Bedeutung<br />
makromolekularer Molekülformeln einmal zusammenzustellen.<br />
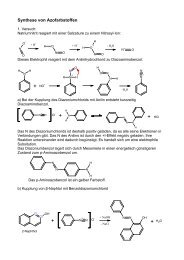
Die Polyreaktion von Styrol zu Polystyrol wird dargestellt durch die Reaktionsgleichung:<br />
Polystyrol wird hier durch eine Struktureinheit innerhalb eckiger Klammern gekennzeichnet, die<br />
sich n-fach aneinanderreiht. Dies besagt jedoch nichts über so wichtige Kenngrößen wie mittleres<br />
Molekulargewicht, Molekulargewichtsverteilung und Uneinheitlichkeit. Weiterhin macht obige<br />
Formel für Polystyrol keine Aussage über die Endgruppen, welche in Polymeren mit hohen<br />
Molekulargewichten in so untergeordneter Anzahl vorkommen, dass sie meist keinen<br />
wesentlichen Beitrag zu den Materialeigenschaften liefern (Dielektrische Eigenschaften polymerer<br />
Isoliermaterialien hingegen sind ein Beispiel für eine deutliche Endgruppen-abhängigkeit!).<br />
Wenn man weiß, dass Polystyrol z.B. in einer mit Phenyllithium gestarteten und mit Wasser<br />
abgebrochenen anionischen Polymerisation hergestellt wurde, so lassen sich die Endgruppen wie<br />
folgt angeben:<br />
n<br />
n<br />
1.)<br />
Li<br />
Radikalinitiator<br />
45<br />
n<br />
H
Hierbei ist jedoch Vorsicht geboten, da eine Angabe über die Endgruppen nur bei Kenntnis des<br />
genauen Reaktionsmechanismus möglich ist!<br />
Aber auch in einem anderen Sinn sind die Polymerformeln nicht gleichzusetzen mit den in der<br />
organischen Chemie üblichen Konstitutionsformeln. Eine exakte Polymerformel ist nämlich schon<br />
deshalb nicht angebbar, da jede Polyreaktion, wie jede organische Reaktion natürlich auch, von<br />
Nebenreaktionen begleitet ist. Im Gegensatz zur niedermolekularen Chemie führen diese<br />
Nebenreaktionen in den meisten Fällen nicht zu voneinander trennbaren Verbindungen, sondern<br />
zu Unregelmässigkeiten innerhalb einer einzigen Polymerkette oder verschiedener Polymerketten.<br />
Mögliche Unregelmässigkeiten können z.B. zurückzuführen sein auf gemischte 1,4und<br />
1,2-Polymerisation, die Entstehung von cis- und trans- bzw. Kopf-Kopf- und Kopf-<br />
Schwanz-Produkten, oder auch auf Taktizitätsunterschiede (s. Kapitel 3.1.). Häufig treten bei<br />
radikalischen Polymerisationsprozessen Übertragungs- oder Abbruchreaktionen auf, die zu<br />
verzweigten Polymeren führen können.<br />
Tabelle 3 gibt einen Überblick über die wichtigsten synthetischen <strong>Kunststoffe</strong>, deren<br />
grundlegende Syntheseverfahren in den drei folgenden Kapiteln beschrieben werden.<br />
6.2. Polykondensation<br />
Tabelle 3<br />
Übersicht über die wichtigsten synthetischen <strong>Kunststoffe</strong><br />
Polykondensate Polymerisate Polyaddukte<br />
Duroplaste Thermoplaste Thermoplaste Elastomere Duroplaste Thermoplaste<br />
Phenolplaste:<br />
Phenol-harze<br />
Resorcin-harze<br />
Aminoplaste:<br />
Melamin-harze<br />
Anilin-harze<br />
Harnstoff-harze<br />
Vernetzte Polyester:<br />
Alkydharze<br />
vernetzte ungesättigte<br />
Polyester<br />
Silikone<br />
Lineare gesättigte<br />
Polyester:<br />
Polyethylenterephthalat<br />
Polycarbonat<br />
Polyamid:<br />
Nylon<br />
Lactam-polyamid<br />
Polyolefine:<br />
Polyethylen<br />
Polypropylen<br />
Polyvinylchlorid<br />
Polymethylmethacrylate<br />
Polystyrol<br />
Polyacetal<br />
Polyoxymethylen<br />
Polyacrylnitril<br />
Polybutadien<br />
Polyisopren<br />
Butylkautschuk<br />
Polychloropren<br />
46<br />
Epoxid-harze<br />
Vernetzte Polyurethane:<br />
Vulkollan<br />
Moltopren<br />
Lineare Polyurethane<br />
Urethan-polyamid
Bei der Polykondensation werden durch eine chemische Reaktion zwischen zwei artgleichen oder<br />
artverschiedenen, aber reaktionsfähige Gruppen tragenden Verbindungen einfache, niedermolekulare<br />
Reaktionsnebenprodukte wie Wasser, Alkohole, Ammoniak, Salzsäure oder ähnliche<br />
Stoffe abgespalten.<br />
Als ein einfaches Beispiel dient die Synthese des Polyterephthalsäureglykolesters, der unter den<br />
Handelsnamen Diolen ® , Trevira ® , Terylen ® und Dacron ® technische Bedeutung erlangt hat<br />
(Whinfield und Dickson, 1941). Wie Abb.17 zeigt, handelt es sich um eine Umesterung, bei der<br />
die Alkoholkomponente Methanol des Ausgangsesters durch den zweiwertigen Alkohol<br />
Ethylenglykol ersetzt wird. Da beide Ausgangskomponenten bifunktionell sind, entsteht ein<br />
linearer Polyester.<br />
Abb. 17: Polykondensation von Terephthalsäuredimethylester und Ethylenglykol zu<br />
Polyterephthalsäureglykolester<br />
O O<br />
H C O<br />
O CH 3 3<br />
+ CH 3OH<br />
O O<br />
Alle Polykondensationsreaktionen sind chemische Gleichgewichtsreaktionen. Das Entfernen des<br />
flüchtigen Nebenproduktes ist beim Kondensationsprozess demnach für einen glatten und erfolgreichen<br />
Ablauf der Reaktion unbedingte verfahrenstechnische Notwendigkeit.<br />
Als technisch wichtige Kunststoffgruppen, die nach einem Polykondensationsverfahren<br />
hergestellt werden, sind u.a. zu nennen:<br />
1) die Gruppe der Phenol-Formaldehyd-Harze (= Phenoplaste) als typische Duroplaste<br />
2) Polyamide (Nylon ® - und Perlon ® -Typ) z.B. für Fasern<br />
3) lineare Polyester und Polycarbonate als Thermoplaste<br />
47<br />
+<br />
HO<br />
- CH 3OH<br />
H 2<br />
O O C<br />
C<br />
H 2<br />
O<br />
H2 C<br />
C<br />
H 2<br />
OH
4) vernetzbare Polyester als Lack- und Giessharze oder in faserverstärkter Form als<br />
Konstruktionswerkstoff<br />
Die technisch wichtigen und wissenschaftlich hochinteressanten Silikone gehören auch in diese<br />
Gruppe, sollen aber, wie im Kapitel 2 aufgeführt, <strong>aus</strong> Gründen der Einteilung hier nicht weiter<br />
behandelt werden.<br />
Die ersten vollsynthetischen <strong>Kunststoffe</strong> überhaupt waren die klassischen Kondensationsharze<br />
<strong>aus</strong> Phenol und Formaldehyd, auch Phenoplast oder Bakelit genannt (L.H. Baekeland, 1909). Sie<br />
sind auch heute noch eine wichtige Stoffklasse bei den Duroplasten und zeichnen sich vor allem<br />
durch gute Chemikalien- und Hitzebeständigkeit sowie durch einen niedrigen Preis <strong>aus</strong>.<br />
Für bestimmte Anwendungen ist allerdings ihre gelbe bis braune Eigenfarbe störend. Diese kann<br />
durch den Einsatz von Melamin oder Harnstoff (H 2 N-CO-NH 2 ) anstelle von Phenol vermieden<br />
werden (die Bildung der Melamin- bzw. Harnstoff-Formaldehyd-Harze kann ähnlich wie für das<br />
Phenol-Formaldehyd-Harz formuliert werden). Die Bildung von Phenol-Formaldehyd-Harzen<br />
kann durch elektrophilen Angriff des Formaldehyds (saure Katalyse erhöht Elektronegativität)<br />
auf die aktivierten o- und p-Positionen des somit trifunktionellen Phenols (bzw. Phenolats bei<br />
basischer Katalyse) verstanden werden (Abb. 18).<br />
N<br />
H 2<br />
N<br />
NH 2<br />
N<br />
N<br />
NH 2<br />
Melamin,<br />
Triaminotriazin, Cyanursäureamid<br />
Die entstandene Methylolverbindung greift ihrerseits ein zweites Phenolmolekül elektrophil an<br />
und bildet unter Wasserabspaltung die erste Diphenylmethan-Einheit. Technisch wird dieser Prozess<br />
durch fortlaufende Kondensation nur bis zur Entstehung löslicher und schmelzbarer Oligomere<br />
betrieben (sog. Novolake, Resol). Der Anwender führt die weitere Kondensation (Härtung)<br />
dann bei erhöhter Temperatur in beheizten Pressen (180 - 200o C) unter Formgebung durch, so<br />
dass ein engmaschiges Netzwerk entsteht. Oft wird vor dieser abschliessenden Härtung ein<br />
Füllstoff zugesetzt.<br />
48
Abb. 18: Polykondensation von Phenol und Formaldehyd zu einem Phenol-Formaldehyd-<br />
Harz<br />
OH<br />
H<br />
δ+ δ−<br />
O<br />
H<br />
[H+] oder [OH-]<br />
OH<br />
CH 2<br />
OH<br />
OH<br />
OH<br />
CH 2<br />
CH 2<br />
CH 2<br />
CH 2 OH<br />
OH<br />
OH<br />
CH 2<br />
OH<br />
OH<br />
- H2O<br />
CH 2<br />
CH 2<br />
CH 2<br />
OH<br />
CH 2<br />
OH<br />
OH<br />
OH<br />
49<br />
CH 2<br />
CH 2<br />
CH 2<br />
CH 2<br />
OH<br />
OH<br />
CH 2<br />
OH<br />
OH<br />
CH 2<br />
CH 2<br />
CH 2<br />
H<br />
H<br />
δ+ δ−<br />
O<br />
OH<br />
OH<br />
CH 2<br />
OH<br />
OH<br />
[ " Resol " ]<br />
Temperatur<br />
Als weiteres wichtiges Beispiel sei in vereinfachter Form die Herstellung eines linearen<br />
Polyesters der Kohlensäure, eines sogenannten Polycarbonats (Makrolon ® ) genannt. Diese neue<br />
Kunststoffgruppe wurde seit 1953 in der Bayer AG (H. Schnell) entwickelt. Aus diesem<br />
Material werden u.a. praktisch unzerbrechliche, transparente Platten hergestellt, die zudem bis<br />
135° C formbeständig und bis – 100° C schlagzäh sind. Abbildung 19 zeigt den Kölner<br />
Hauptbahnhof, der 1986 mit diesen Platten neu „verglast“ wurde, da die zuvor verwendeten<br />
Drahtglasscheiben aufgrund der Bewegungen der Stahlkonstruktion und täglicher wie<br />
jahreszeitlicher thermischer Wechselbeanspruchungen ständig barsten.<br />
Abb. 19: 1986 erhielt der Kölner Hauptbahnhof ein "Makrolondach" mit Glas übertreffenden<br />
Eigenschaften (Gesamtfläche entspricht etwa zwei Fussballfeldern).<br />
Druck
Die außergewöhnliche Eigenschaftskombination des Makrolons (gute Eigenschaften hinsichtlich<br />
Transparenz, Schlagzähigkeit, Steifigkeit, Dimensionsstabilität, Wärmeformbarkeit,<br />
physiologische Unbedenklichkeit, Sterilisierbarkeit) erlaubt seinen Einsatz für H<strong>aus</strong>haltsgeschirr<br />
und medizinische Geräte ebenso wie für Compact Discs (Abb. 20).<br />
Abb. 20: Etwa 75 % der in Europa verkauften Compact Discs bestehen <strong>aus</strong> Makrolon als<br />
Grundmaterial<br />
50
Doch nun zur Chemie dieses vielseitigen <strong>Kunststoffe</strong>s. Makrolon ® ist ein Polycarbonat, das<br />
durch die Kondensation von 2,2-Bis-(4-hydroxyphenyl)propan (=Bisphenol-A, Dian) mit<br />
Phosgen (COCl2 ) oder einem Kohlensäureester wie Diphenylcarbonat entsteht (Abb. 21).<br />
Abb. 21: Polykondensation von Bisphenol-A und Diphenylcarbonat zum Polycarbonat<br />
Makrolon ®<br />
... HO<br />
CH 3<br />
CH 3<br />
Polycarbonat, das über die Schmelze verarbeitet wurde, z.B. durch Spritzguss oder Extrusion, ist<br />
amorph und transparent. Das gleiche Material kann <strong>aus</strong> Lösung zu Folien vergossen werden, die<br />
auch Teilkristallinität aufweisen können.<br />
Eine weitere wichtige Gruppe von Polykondensaten sind die ungesättigten, vernetzbaren<br />
Polyester. Die wichtigsten Komponenten für ihre Herstellung sind:<br />
Dicarbonsäuren bzw. Anhydride: Maleinsäure, Phthalsäure, Malein- oder Phthalsäureanhydrid,<br />
Adipinsäure, Sebacinsäure<br />
Mehrwertige Alkohole: Ethylenglykol, Trimethylolpropan, Glycerin, 2,2-Bis-(4-hydroxy-<br />
phenyl)propan, Pentaerythrit.<br />
O<br />
O<br />
+ +<br />
Beliebige Kombinationen der verschiedenen Säuren und Alkohole erlauben die Gewinnung vieler<br />
verschiedenartiger Polyester. Bei der Verwendung von Alkoholen mit drei und mehr OH-<br />
Gruppen treten Verzweigungen und schließlich Teilvernetzungen der Makromoleküle auf (Abb.<br />
22). Hochwertige Harze erhält man durch geeignete Modifizierung, z.B. durch Einbau gesättigter,<br />
langkettiger Carbonsäuren. Die ungesättigten Polyester, wie die Roskydal ® -(Bayer) oder Palatal ® -<br />
(BASF)- Typen, sind meist Mischkondensate.<br />
51<br />
OH<br />
CH 3<br />
CH 3<br />
O O<br />
O<br />
O O<br />
-<br />
n<br />
OH<br />
HO<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
OH<br />
...
Versuch Nr. 3<br />
Die mechanischen Werte solcher Polyesterharze lassen sich durch Einarbeiten von Glasfasern<br />
oder -matten wesentlich erhöhen. Die glasfaserverstärkten Polyester besitzen bei geringem spezifischen<br />
Gewicht hohe Zug-, Biege-, Stoss- und Schlagfestigkeit. Je nach chemischer Zusammensetzung<br />
lassen sich - angepasst auf die jeweilige Anwendung - hochbeständige Systeme herstellen<br />
(wasser-, wetter-, chemikalienfest). Nach diesem Prinzip entstehen Konstruktionswerkstoffe<br />
z.B. für den Automobilbau.<br />
1983 wurde der "Pontiac Fiero" vorgestellt, dessen Außenhaut vollständig <strong>aus</strong> <strong>Kunststoffe</strong>n<br />
besteht (s. Abb. 23). Kotflügel, Türaußenhaut sowie Front- und Heckteil bestehen <strong>aus</strong><br />
glasfaserverstärktem Polyurethan (s. Kapitel 6.4.1.), dem sogenannten Bayflex ® . Motorhaube,<br />
Dach und Kofferraumdeckel sind <strong>aus</strong> glasfaserverstärktem Polyesterharz gefertigt.<br />
Abb. 22: Synthese eines ungesättigten Polyesters <strong>aus</strong> Maleinsäureanhydrid und Diol und seine<br />
Vernetzung durch Bildung von Polystyrol-Propfbrücken<br />
... HO - R - OH +<br />
O<br />
--- O - R - O<br />
O<br />
O<br />
O<br />
O<br />
+ HO - R - OH ...<br />
O - R - O ---<br />
52<br />
- H 2 O<br />
Vernetzung<br />
(schematische Darstellung<br />
siehe bei Versuch 3.1)<br />
+ n<br />
--- O - R - O<br />
O<br />
O<br />
ungesättigter Polyester<br />
O - R - O ---
Abb. 23: Pontiac Fiero mit einer "Kunststoff-Außenhaut"<br />
Nachdem schon zu Beginn dieses Kapitels ein durch Polykondensationen entstandener Polyester<br />
beschrieben wurde, der u.a. als Fasermaterial (Diolen ® , Trevira ® ) von Bedeutung ist, sollen nun<br />
abschließend Polyamide besprochen werden. Auch diese lassen sich zu wichtigen Fasern, wie<br />
Nylon ® und Perlon ® , verarbeiten. (Einen weiteren Einblick in die aktuelle Faserforschung bietet<br />
Kapitel 6.3.1. mit dem durch Polymerisation gebildeten Polyacrylnitril, der Dralon ® -Textilfaser).<br />
Polyamide entstehen durch Polykondensation von<br />
A) difunktionellen Aminen mit difunktionellen Carbonsäuren (s. Nylon ® )<br />
B) difunktionellen Aminen mit difunktionellen Carbonsäure-Derivaten wie z.B.<br />
Carbonsäurechloriden<br />
s. Versuch Nr. 4<br />
C) difunktionellen Molekülen, die sowohl eine Amino- als auch eine Carbonsäuregruppe tragen<br />
(s. Perlon ® ). Dieser Syntheseweg ist vergleichbar dem Aufbau von Wolle (Polypeptid) <strong>aus</strong><br />
Aminosäureb<strong>aus</strong>teinen.<br />
zu A) Die klassische Nylonfaser (W.H. Carothers, 1931) entsteht durch Polykondensation von<br />
Hexamethylendiamin mit Adipinsäure (Hexandicarbonsäure). Im<br />
gebildeten kettenför-migen Makromolekül (s. Abb. 24) befinden sich zwischen zwei<br />
Stickstoffatomen immer sechs Kohlenstoffatome, die entweder <strong>aus</strong> der<br />
Hexamethylenkette des Amins oder <strong>aus</strong> der Dicarbonsäurekette stammen. Deshalb wird<br />
dieses Polymer auch Nylon-6,6 genannt.<br />
53
Abb. 24: Polykondensation von Hexamethylendiamin mit Adipinsäure<br />
(Hexandicarbonsäure) zum Nylon-6,6<br />
H 2 N<br />
HN<br />
NH 2<br />
zu B) Die Polykondensation von Hexamethylendiamin mit Sebacinsäuredichlorid (Decandicarbonsäuredichlorid)<br />
zum Nylon-6,10 wird im Versuch Nr. 4 beschrieben.<br />
+<br />
zu C) Perlon entsteht bei Gegenwart von Wasserspuren <strong>aus</strong> dem cyclischen Amid ε-Caprolactam<br />
(P. Schlack, 1936). Formal ist diese Reaktion als Polykondensation der ω-<br />
Aminocapronsäure (6-Aminohexancarbonsäure) mit sich selbst zu verstehen. Die ω-<br />
Aminocapronsäure entsteht dabei in einem vorgelagerten Reaktionsschritt durch<br />
Hydrolyse des ω-Caprolactams. Ausführliche Untersuchungen der Kinetik dieser<br />
Reaktion haben jedoch gezeigt, dass dieser Mechanismus allein für die Startreaktion gilt.<br />
Im weiteren Reaktionsverlauf tritt eine direkte Reaktion der Aminofunktion der<br />
wachsenden Polymerkette mit dem ε-Caprolactam im Sinne einer Umamidierung auf.<br />
Zwischen zwei Stickstoffatomen im entstehenden Makromolekül (s. Abb. 25) befinden<br />
sich immer sechs "artgleiche Kohlenstoffatome" <strong>aus</strong> der ω-Aminocapronsäure, was den<br />
Namen Nylon-6 für das Polycaprolactam erklärt.<br />
H<br />
N<br />
54<br />
HO<br />
- H 2O<br />
O<br />
O<br />
O<br />
O<br />
OH
Abb. 25: Startreaktion der Bildung des Polycaprolactams (Perlon ® , Nylon ® -6) über<br />
Aminocapronsäure als Zwischenprodukt<br />
+ H N 2<br />
HN<br />
HN<br />
OH<br />
O<br />
O<br />
H<br />
N<br />
55<br />
O<br />
Caprolactam<br />
+ H2O<br />
Amidhydrolyse<br />
+ H2N O<br />
+<br />
OH<br />
Die Verstreckbarkeit (s.a. Kapitel 4.2.1.) und das Verhalten, sich zu Fäden verarbeiten zu lassen,<br />
werden demonstriert in den<br />
Versuchen 2, 5 und 6.<br />
- H 2 O<br />
Polyamide werden nach drei Verfahren versponnen (s. Abb. 26):<br />
1) Schmelzspinnen: Die Schmelze wird durch Düsen gedrückt, die entstandenen Fäden<br />
werden im Stickstoffstrom (der Oxidationsanfälligkeit des Materials<br />
wegen, Versuch Nr. 5) gekühlt und verstreckt.<br />
2) Lösungsspinnen:<br />
a) Nassspinnen: Die Polyamidlösung wird in ein Fällbad gesponnen.<br />
b) Trockenspinnen: Die Polyamidlösung wird gegen einen warmen Luftstrom gesponnen,<br />
wobei der Faden unter Verdampfen des Lösemittels entsteht.<br />
HN<br />
O<br />
O
Abb. 26: Spinnverfahren<br />
Polymerlösung<br />
Spinnpumpe<br />
Lösemittel-<br />
Rückgewinnung<br />
Nassspinnen<br />
zur<br />
Verstreckung<br />
Fällbad<br />
Düse<br />
Heißluft<br />
Trockenspinnen<br />
Polymerlösung<br />
Spinnpumpe<br />
Lösemittel-<br />
Rückgewinnung<br />
zur<br />
Verstreckung<br />
56<br />
Düse<br />
Polymerschmelze<br />
Rost<br />
Spinnpumpe<br />
zur<br />
Verstreckung<br />
Schmelzspinnen<br />
Die Abbildung 27 gibt noch zwei Beispiele für das vielseitige Anwendungsspektrum von<br />
Polyamiden auch außerhalb des Fasergebietes.<br />
Abb. 27: Stapelstuhl und Dübel <strong>aus</strong> Polyamid (Nylon-6 oder -6,6)
6.3. Polymerisation<br />
6.3.1. Definition und Beispiele<br />
Bei der Polymerisation handelt es sich um eine Reaktion aktivierter Doppelbindungen, die sich<br />
miteinander verbinden, ohne dabei Reaktionsnebenprodukte abzuspalten. Die Aktivierung der<br />
Doppelbindungen kann auf unterschiedlichste Weise erfolgen, so z.B. durch Energiezufuhr<br />
(Wärme, Bestrahlung, Ultraschall) oder den Einsatz stofflicher Initiatoren, die sich leicht zu<br />
Radikalen oder reaktiven Ionen anregen lassen und so die Polymerisation starten<br />
Technisch am bedeutendsten sind Radikalinitiatoren wie Peroxide und Azoverbindungen, jedoch<br />
spielen neben radikalischen und ionischen Initiatoren heute auch zunehmend Metall-Komplex-<br />
Initiatoren (wie z.B. Ziegler-Katalysatoren <strong>aus</strong> TiCl4 oder TiCl3 und Aluminiumalkylen) eine<br />
bedeutende Rolle, da nur mit ihnen in der Regel eine <strong>aus</strong>reichende Beeinflussung der<br />
stereochemischen Abläufe gewährleistet ist.<br />
Das Prinzip der radikalischen Polymerisation von einfachen Olefinen (Alkenen), Dienen und<br />
substituierten Vinylverbindungen (H 2 C=CHX) wurde bereits in den Kapiteln 2 und 3<br />
beschrieben, um z.B. Strukturprinzipien von <strong>Makromolekülen</strong> zu erläutern. Die radikalische und<br />
anionische Polymerisation von Styrol wurde in Kapitel 6.1. erwähnt. Die Polymerisation ist<br />
jedoch nicht auf olefinische Monomere beschränkt. Auch Formaldehyd oder dessen Trimeres,<br />
Trioxan, lassen sich z.B. ionisch polymerisieren.<br />
Jedoch sind die durch radikalische Vinylpolymerisation erhaltenen Polymerisate technisch am<br />
wichtigsten, so dass ihr Reaktionsprinzip in Abbildung 28 dargestellt ist.<br />
58
Abb. 28: Technisch bedeutende Polymerisate durch radikalische Polymerisation<br />
Monomer<br />
H<br />
59<br />
Polymerisat (Handelsname)<br />
H<br />
H<br />
X<br />
X X X<br />
X<br />
- H Eth(yl)en Polyeth(yl)en (Hostalen R ,......)<br />
Styrol Polystyrol<br />
- Cl Vinylchlorid Polyvinylchlorid (PVC)<br />
- CN Acrylnitril Polyacrylnitril (PAN, Dralon R , Orlon R )<br />
N<br />
N<br />
X Z<br />
O Vinylpyrrolidon Polyvinylpyrrolidon (Luviskol R K)<br />
Monomer<br />
H<br />
Z<br />
H<br />
X<br />
Vinylcarbazol Polyvinylcarbazol<br />
Polymerisat (Handelsname)<br />
X X X<br />
-Cl -Cl Vinylidenchlorid Polyvinylidenchlorid<br />
-CH 3 -COOCH 3 Methacrylsäuremethylester Polymethacrylsäureester, (Polymethylmethacrylat<br />
PMMA, Plexiglas R )<br />
-CN -COOR Cyanacrylsäureester Poly- α-cyanacrylester (Polycyanacrylat)<br />
Monomer<br />
Polymerisat (Handelsname)<br />
F<br />
F F F F F F<br />
F<br />
F<br />
F<br />
F<br />
F<br />
F<br />
F<br />
F<br />
F<br />
Tetrafluoreth(yl)en Polytetrafluoreth(yl)en (Teflon R )
Polyethylen (PE) wird als Thermoplast hauptsächlich zu Folien, Platten und Spritzgussteilen<br />
verarbeitet. Man findet es in vielen H<strong>aus</strong>halts- und Spielwaren oder als Schaumstoff im<br />
Fahrzeugbau. Je nach Molekulargewicht, Verzweigungsgrad und Kristallinität zeigt Polyethylen<br />
wachsartige bis harte Konsistenz.<br />
Man unterscheidet Polyethylen niederer Dichte ("low density": LDPE mit D = 0.91 - 0.92 g/cm 3<br />
/ Kristallinitätsgrad 40 - 55 %) von solchem mit hoher Dichte ("high density": HDPE mit D =<br />
0.94 - 0.96 g/cm 3 / Kristallinitätsgrad 75 - 85 %). LDPE wird durch eine<br />
Hochdruckpolymerisation (1400 - 3500 bar, 150 - 350o C) hergestellt. HDPE entsteht in einer<br />
Niederdruckpolymerisation (unter 60 bar, 60 - 250o C) mit heterogenen Übergangsmetall-<br />
Katalysatoren (Ziegler, Natta: Chemie-Nobelpreis 1963).<br />
Polystyrol (PS) wird vorwiegend thermoplastisch im Spritzguss verarbeitet und zu Platten und<br />
Folien extrudiert. Es ist ein glasklares, steifes und relativ sprödes Material, das z.B. für<br />
Lebensmittelverpackungen (z.B. Joghurtbecher) zugelassen ist. Teile <strong>aus</strong> schlagfestem Polystyrol<br />
werden z.B. in Kühlschränken, Telefonapparaten, Fernseh-, Radio- und Elektrogeräten<br />
verarbeitet. Treibmittelhaltiges Polystyrol lässt sich aufschäumen (Styropor ® ), wobei Wärme-,<br />
Kälte- und Schalldämmstoffe entstehen.<br />
Zur Verbesserung der Eigenschaften dienen folgende Modifizierungen:<br />
- Modifizierung mit Kautschuk: (high impact PS: HIPS: hochschlagzäh)<br />
- Propfcopolymer mit Butadien: schlagfest<br />
- Copolymerisation mit Acrylnitril: (SAN) fest, hart und formbeständig,<br />
transparent.<br />
Abb. 29 zeigt eine elektronenmikroskopische Aufnahme von schlagfestem Polystyrol:<br />
Die dunklen Bereiche stellen die elastische Polybutadien-Komponente dar. Diese elastische<br />
Kautschukphase nimmt die Energie bei Schlagbeanspruchung durch lokale Deformation auf, so<br />
dass es nicht zur Rissbildung kommt.<br />
60
Abb. 29: Polystyrolmatrix mit großen, kugelförmigen Modifizierteilchen, an denen Risse<br />
gestoppt sind.<br />
1<br />
Polyvinylchlorid (PVC) kommt als Hart-PVC in den Handel, sofern es keine Weichmacher als<br />
Additiv enthält. Es ist bis etwa 40o C hart, um 100o C thermoelastisch und oberhalb 160o C<br />
thermoplastisch formbar. Bei 140o C beginnt unstabilisiertes PVC jedoch Chlorwasserstoff<br />
abzuspalten. Es wird u.a. zu Rohren, Profilen, Folien, Platten und Hohlkörpern verarbeitet.<br />
Weichgemachte Typen (Weich-PVC) werden auch für Kunstleder, Fußbodenbeläge, Schläuche<br />
sowie Draht- und Kabelisolierungen verwendet.<br />
Polyacrylnitril (PAN) wird in erster Linie zu Fasern verarbeitet, die knitterfrei, leicht waschbar,<br />
schnell trocknend, tropen-, säure-, hitze-, Lösemittel- und alterungsbeständig sind. Die Fasern<br />
enthalten meistens neben Acrylnitril eine kleinere Menge eines Comonomers, um z.B. die<br />
Anfärbbarkeit zu verbessern. PAN-Fasern werden jedoch nicht nur in der Bekleidungsindustrie<br />
und für Heimtextilien (Dralon ® ) eingesetzt, sondern auch für technische Zwecke wie Filter, Filze<br />
und Siebe. Eine interessante und wichtige Anwendung von Polyacrylnitrilfasern zeichnet sich<br />
auch beim Asbest-Ersatz ab. Wegen ihrer hohen Alkali- und Witterungsbeständigkeit konnten<br />
kurze PAN-Fasern nämlich bereits erfolgreich als Verstärkungsfasern in Zement eingesetzt<br />
werden. Während die früher eingesetzten mineralischen Asbestfasern in feine Fibrillen von<br />
weniger als 3 µm Durchmesser aufspalteten, die in der Lunge unter ungünstigen Bedingungen zur<br />
Bildung von Karzinomen führen konnten, liegen die Abmessungen der PAN-Fasern weit oberhalb<br />
des "medizinisch kritischen Bereiches".<br />
Abb. 30 a zeigt die Vergrößerung einer PAN-Faser (Dralon ® ) unter dem Rasterelektronenmikroskop.<br />
Der kompakte Querschnitt der Faser verhindert die Aufnahme von größeren Mengen<br />
61
Feuchtigkeit. Für Sportbekleidung ist es jedoch wichtig, dass einerseits der Schweiß<br />
aufgenommen, andererseits die Luftdurchlässigkeit erhalten bleibt. Die Chemie-Faser Dunova ®<br />
besteht ebenfalls <strong>aus</strong> Polyacrylnitril, zeigt aufgrund ihrer "Kern-Mantel-Struktur" aber diese<br />
massgeschneiderten Eigenschaften. Die Abbildungen 30b und c zeigen den Faseraufbau <strong>aus</strong> einem<br />
äußeren Mantel, der durch feine Kapillaren den Schweiß wie Löschpapier aufsaugt, und einem<br />
inneren Kern, dessen Poren die Feuchtigkeit wie ein Schwamm speichern.<br />
Abb. 30: a) Elektronenmikroskopische Aufnahme von Dralon ®<br />
b) Modell und c) elektronenmikroskopische Aufnahme<br />
der neuen Textilfaser Dunova ® mit<br />
Kern-Mantel-Struktur<br />
Das 1939 von Reppe synthetisierte Polyvinylpyrrolidon (PVP) wurde im und nach dem zweiten<br />
Weltkrieg wegen seiner proteinähnlichen Eigenschaften als "Blutersatzmittel" verwendet. Es wird<br />
häufig als Bindemittel in Tabletten und in der Kosmetik verwandt. Copolymere mit Vinylacetat<br />
62
(s. Abb. 2) werden wegen ihrer Bindung an Keratin als Filmbildner in Haarsprays und<br />
Haarfestigern eingesetzt.<br />
Polyvinylcarbazol (PVK) ist ein thermoplastisches Polymerisat, das u.a. als organischer<br />
Halbleiter in der Elektronik und Elektrotechnik eingesetzt wird. Strukturell ist PVK von<br />
Interesse, da seine sperrigen Seitenketten eine enge Knäuelung des Makromoleküls verhindern<br />
und diesem eine mehr gestreckte Form aufzwingen.<br />
CH 2<br />
CH CH 2<br />
N<br />
N<br />
CH<br />
CH 2<br />
CH CH 2<br />
N<br />
Polyvinylidenchlorid (PVDC) kommt nur mit Copolymerisatbestandteilen (Vinylchlorid,<br />
Acrylnitril, Acrylate) zur Anwendung. Bei einem Vinylidenchloridgehalt von über 80 % sind<br />
diese Copolymerisate hochkristallin und daher sehr hart, abrieb- und wasserfest und auch<br />
chemikalienbeständig. Diese Materialien werden für Beschichtungen verschiedener Substrate u.a.<br />
auch für beschichtete Verpackungen im Lebensmittel- und Pharmabereich verwendet.<br />
Polymethylmethacrylat (PMMA) ist in unpigmentierter Form ein glasartig durchsichtiges, festes,<br />
hartes Polymerisat (Plexiglas ® ). Beim Abkühlen bildet das thermoplastische PMMA eine<br />
unregelmäßige, dreidimensionale Struktur, die durch Dipol-Dipol-Wechselwirkungen stabilisiert<br />
wird. In diesem amorphen Zustand fehlen die für einen Kristall erforderlichen regelmäßigen<br />
Anordnungen. Solche Substanzen heissen Gläser und sind lichtdurchlässig, da die für die<br />
Lichtreflexion notwendigen Kristallebenen fehlen.<br />
Versuche Nr. 7, 8 und 9<br />
Beispiele für den vielfältigen Einsatz von PMMA finden sich in der Bau- und<br />
Fahrzeugverglasung, der Lichtwerbung, bei Lichtleitern und Linsen. Aber auch Präzisionsteile wie<br />
Winkelmesser oder Prothesenbasen und Kunststoffzähne enthalten PMMA (s. Abb. 31).<br />
63<br />
N<br />
CH<br />
CH 2<br />
CH CH 2<br />
N<br />
N<br />
CH
Abb. 31: Beispiele für Präzisionsteile <strong>aus</strong> PMMA<br />
a) Winkelmesser b) Prothesenbasis und Kunststoffzähne<br />
(enthalten vernetzendes Comonomer<br />
und Pigmente)<br />
Eine Kuriosität stellt der Laufkäfer Abax ater dar, der seine Gegner durch Versprühen des<br />
Monomers Methacrylsäure <strong>aus</strong> einer Hinterleibsdrüse bekämpft. Der Effekt ist verblüffend: Der<br />
Feind wird durch Polymerisation der Methacrylsäure bewegungsunfähig.<br />
α-Cyanacrylester polymerisieren in Gegenwart von Feuchtigkeit zu Polycyanacrylaten und<br />
eignen sich in Abmischung mit Weichmachern, Verdickern und Stabilisatoren als<br />
Einkomponentenklebstoffe (Sekundenkleber). Die Polymere längerkettigerer Alkohole (Butyl-,<br />
Hexyl-, Heptylalkohol) werden von Blut gut benetzt und finden daher als Wundverband oder<br />
zum Kleben von Geweben Anwendung. Im Körper werden die entstehenden Polymerfilme mit<br />
der Zeit zu Harnstoff, Wasser und Kohlendioxid abgebaut.<br />
Polytetrafluorethylen (PTFE) ist ein Polymerisat hoher Kristallinität und außerordentlicher<br />
Chemikalien- und Wärmebeständigkeit (Teflon ® ). Es ist weiterhin physiologisch inert und nicht<br />
brennbar. Wegen seiner hohen Schmelzviskosität ist PTFE nicht plastisch formbar. Formkörper<br />
oder Beschichtungen (Brat- und Kochgeräte, chemische Apparate) entstehen durch Sintern des<br />
Polymerpulvers bei 370 - 380o C gegebenenfalls unter Druck.<br />
Auf die Bildung von Isomeren bei der Polymerisation von Monomeren wurde bereits in Kapitel<br />
3.1. hingewiesen:<br />
- Kopf-Schwanz- bzw. Kopf-Kopf-Produkte<br />
- 1,2- und 1,4-Polymerisat von 1,2-Dienen<br />
64
- cis- und trans-konfigurierte Olefine<br />
- R- bzw. S-Konfiguration an Asymmetriezentren, die in ihrer Aufeinanderfolge die Taktizität<br />
(ataktisch, isotaktisch, syndiotaktisch) festlegen.<br />
Im selben Kapitel wurden auch die Unterschiede zwischen linearen, verzweigten und vernetzten<br />
Polymerisaten sowie das Auftreten verschiedener Copolymerisate (statistische, alternierende,<br />
Block- und Pfropf-Copolymerisate) diskutiert.<br />
6.3.2. Mechanismus und verfahrenstechnische Einteilung<br />
Die Polymerisation von Monomeren kann durch unterschiedliche Art der Aktivierung der<br />
beteiligten Doppelbindungen <strong>aus</strong>gelöst werden (s. Kapitel 6.3.1.). Am häufigsten ist der Einsatz<br />
von Initiatoren, die in einer vorgelagerten Reaktion Radikale (vgl. z.B. Versuch Nr. 3 oder Nr. 9)<br />
oder Ionen (vgl. Versuch Nr. 7 oder 8) bilden. Im Falle der radikalischen Polymerisation löst das<br />
Startradikal R . eine Kettenreaktion <strong>aus</strong>, die reaktionskinetisch im wesentlichen durch drei<br />
Reaktionsphasen gekennzeichnet ist.<br />
Vorgelagerte Reaktion Initiator<br />
oder hν .<br />
R<br />
oder Monomer<br />
oder hν .<br />
R<br />
( = Wärmeenergie, hν = Strahlungsenergie)<br />
Startreaktion<br />
.<br />
R +<br />
H<br />
Wachstumsreaktion (n-mal)<br />
H H<br />
Abbruchreaktion<br />
+<br />
a) durch Rekombination<br />
H H<br />
H<br />
.<br />
X<br />
H<br />
H<br />
H<br />
H<br />
X<br />
. .<br />
b) durch Disproportionierung<br />
H<br />
+<br />
H<br />
H<br />
H<br />
X<br />
. .<br />
H<br />
X<br />
X<br />
+<br />
H<br />
H<br />
H H<br />
H H<br />
X<br />
X<br />
65<br />
H<br />
R<br />
H<br />
H<br />
H<br />
H<br />
X H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
.<br />
X<br />
H H<br />
H<br />
X<br />
H<br />
X<br />
X<br />
H<br />
.<br />
+<br />
X<br />
H H H<br />
H<br />
X<br />
H
Die benötigten Startradikale können z.B. durch den thermischen Zerfall von als Initiatoren<br />
zugesetzten Azoverbindungen oder Peroxiden gebildet werden:<br />
a) Die am häufigsten eingesetzte Azoverbindung ist das Azo-bis-isobutyronitril (AIBN), auf<br />
dessen Verwendung hier jedoch verzichtet wird, da die gebildeten Radikale zum<br />
gesundheitsschädlichen Tetramethylbernsteinsäuredinitril rekombinieren können:<br />
H 3 C<br />
CN<br />
CH 3<br />
N N<br />
CH<br />
CH 3<br />
3<br />
b) Ein häufig verwendeter peroxidischer Initiator ist das Dibenzoylperoxid (BPO)<br />
O<br />
O O<br />
CN<br />
O<br />
N 2<br />
2<br />
H 3 C<br />
2<br />
CH 3<br />
Die Praxis kennt verschiedene verfahrenstechnische Ausführungsformen der Polymerisation, z.B.<br />
in Substanz, Lösungspolymerisation, Emulsionspolymerisation, Suspensionspolymerisation.<br />
Diese verschiedenen Verfahren wurden entwickelt, weil die technische Durchführung der<br />
Polymerisation in erster Linie ein Problem des Wärme<strong>aus</strong>t<strong>aus</strong>ches ist. Die Monomere sind flüssig<br />
oder gasförmig und die gebildeten Polymere fest oder - bei höheren Temperaturen - zähplastisch.<br />
Die Polymerisation ist eine exotherme Reaktion. Um also ein "Durchgehen" der Reaktion zu<br />
verhindern, muss man genügend kühlen und durch starkes Rühren für guten Wärme<strong>aus</strong>t<strong>aus</strong>ch<br />
sorgen.<br />
Nur wenige Monomere polymerisieren so langsam, dass sie ohne Gefahr in Substanz, also unverdünnt,<br />
polymerisiert werden können. Aber nach diesem Verfahren erhält man die reinsten und<br />
gleichmäßigsten Polymerisate. Unter anderem können Polymethylmethacrylat, Polystyrol und<br />
Guss-Polyamid <strong>aus</strong> Caprolactam nach dieser Methode hergestellt werden (Versuche 9 und 10).<br />
Bei der Lösungspolymerisation wird das Monomer in einem Lösemittel gelöst (Versuch Nr. 8),<br />
das auch das entstehende Polymere gut zu lösen vermag. Das Lösemittel sollte möglichst unpolar<br />
sein (Toluol, Xylol, Pentan, Cyclohexan), um unerwünschte Nebenreaktionen zu vermeiden.<br />
Diese Art von Polymerisation wird vor allem für Klebstoff- und Lackrohstoffe angewendet, die<br />
.<br />
66<br />
CN<br />
O<br />
H C<br />
3<br />
NC<br />
CH 3<br />
CH 3<br />
CN<br />
CH 3<br />
.<br />
O<br />
2<br />
.<br />
- 2 CO2
in Lösung zur Verarbeitung gelangen, denn die Gewinnung des reinen Polymerisates <strong>aus</strong> der<br />
Lösung ist sehr schwierig, da das Polymerisat Reste von Lösemitteln hartnäckig festhält.<br />
Unter Fällungspolymerisation wird eine Polymerisation verstanden, bei der das Monomere im<br />
Reaktionsmedium löslich, das Polymere aber unlöslich ist und deshalb <strong>aus</strong>fällt.<br />
Die Substanzpolymerisation geht in eine Fällungspolymerisation über, wenn das Polymere im<br />
Monomeren unlöslich ist. Entsprechendes gilt für die Lösungspolymerisation. Bei der Fällungspolymerisation<br />
scheidet sich das Polymere als Niederschlag oder Gel ab. Durch Fällungspolymerisation<br />
werden beispielsweise Methacrylsäuremethylester in Wasser/Methanol (Versuch Nr. 10)<br />
oder Mischpolymerisate des Vinylchlorids in Kohlenwasserstoffen oder Alkoholen hergestellt.<br />
Bei der Emulsionspolymerisation (wasserlösliche Katalysatoren!) werden Monomere und<br />
Polymere mittels geeigneter Emulgatoren in feiner Verteilung im wässrigen Dispergiermittel<br />
gehalten. Das Polymerisat kann nach Beendigung des Prozesses nach verschiedenen Verfahren<br />
abgeschieden und zu feinem Pulver aufgearbeitet werden oder als feinteilige wässrige Dispersion<br />
(Latex mit Teilchendurchmesser zwischen 50 und 200 nm) zur Anwendung kommen.<br />
Polyvinylchlorid, Polystyrol, Polyacrylester, synthetischer Kautschuk <strong>aus</strong> cis-1,4-Polybutadien<br />
(Buna ® ) oder Butadien-Acrylnitril-Copolymeren (Perbunan ® N) und andere Vinylderivate entstehen<br />
auf diese Weise. Die Emulsionspolymerisation ist eines der wichtigsten großtechnischen<br />
Verfahren der organischen Chemie.<br />
Die Suspensionspolymerisation (im Monomeren lösliche Katalysatoren!) vollzieht sich in einer<br />
wässrigen Dispersion unter Zusatz gewisser Schutzkolloide. Die Reaktionskinetik der<br />
Suspensionspolymerisation ist der der Substanzpolymerisation ähnlich; jedes einzelne<br />
Monomertröpfchen stellt für sich ein System für eine Substanzpolymerisation dar, dessen<br />
Reaktionswärme durch das umgebende Wasser abgeführt wird. Das Polymerisat fällt hierbei in<br />
Form von Tröpfchen an, die sich absetzen und zu einem rieselfähigen Korn oder in Perlform<br />
erstarren. Wird die Suspensionspolymerisation so durchgeführt, dass das Polymerpulver <strong>aus</strong><br />
weitgehend gleichmäßigen, runden Kügelchen (meist zwischen etwa 10 und 100 µm<br />
Durchmesser) besteht, spricht man auch von einer Perlpolymerisation. Nach dem Verfahren der<br />
Suspensionspolymerisation werden Polymethacrylate,<br />
hergestellt.<br />
Polystyrol, Polyvinylchlorid u.a.<br />
Ein interessantes Verfahren, das in kürzester Zeit besondere Bedeutung gewonnen hat, ist die<br />
stereospezifische Polymerisation (Ziegler/Natta 1953/54) mit Ziegler´schen Mischkatalysatoren<br />
auf metallorganischer Basis. Die stereospezifische Polymerisation führt zu Polymeren mit einem<br />
hohen Kristallinitätsgrad. Auch bei niedrigem spezifischen Gewicht weisen solche stereoregulären<br />
67
Polymere (s. Kapitel 3.1. - Taktizität) außerordentlich gute mechanische Festigkeiten bei<br />
gleichermaßen verbesserten chemischen Eigenschaften auf. So wurden beispielsweise <strong>aus</strong><br />
isotaktischem Polypropylen Fasern mit einer Festigkeit bis zu 70 kg/mm 2 erhalten. Diese<br />
Festigkeit entspricht derjenigen des Stahls.<br />
68
6.4. Polyaddition<br />
Die letzte und neueste Grundreaktion zur Synthese von <strong>Makromolekülen</strong> als <strong>Kunststoffe</strong> im<br />
großtechnischen Massstab ist das Polyadditionsverfahren. Das Bildungsprinzip ist dadurch<br />
gekennzeichnet, dass verschiedenartig aufgebaute polyfunktionelle Verbindungen unter<br />
Wanderung von Wasserstoffatomen zu Polymeren verknüpft werden. Reaktionsnebenprodukte<br />
wie Wasser oder sonstige einfache niedermolekulare Verbindungen entstehen nicht. Zwei große<br />
Kunststoffgruppen werden heute nach diesem Verfahren hergestellt, die Polyurethane und die<br />
Epoxidharze.<br />
6.4.1. Polyurethane<br />
Die Polyurethan-Chemie ist eine Domäne der Bayer AG. Ihr Verknüpfungsprinzip, die<br />
Polyaddition, wurde im Jahre 1937 von Otto Bayer durch die Entdeckung der Polyurethane in die<br />
Kunststoffchemie eingeführt. Sie werden bevorzugt durch die Polyaddition von Di- oder<br />
Polyolen (Desmophen ® ) an Di- oder Polyisocyanate (Desmodur ® ) aufgebaut. Durch exotherme<br />
Reaktion der Hydroxyl-Gruppen mit den Isocyanat-Gruppen entstehen Carbamidsäureester-<br />
Gruppen (= Urethan-Gruppe) (Abb. 32).<br />
Abb. 32: Schema einer Polyaddition zu Polyurethanen<br />
HO R OH + O C N R +<br />
1 N C O HO R OH<br />
zweiwertiger<br />
Alkohol (Diol)<br />
O<br />
R 1<br />
Diisocyanat<br />
O R O N N O R O<br />
Urethan-Gruppe<br />
O<br />
O<br />
N N O R O<br />
zweiwertiger<br />
Alkohol (Diol)<br />
Diese Reaktion hat der ganzen Stoffklasse den Namen Polyurethane gegeben. Je nach den<br />
verwendeten Ausgangsstoffen kann man lineare oder vernetzte Polyurethane erhalten, die für<br />
viele Anwendungen in Schaumstoffen, Elastomeren, Lacken, Klebstoffen, Beschichtungen und<br />
Fasern eingesetzt werden. Diese Variationsbreite der Polyurethane wird von keiner anderen<br />
Kunststoffklasse erreicht.<br />
69<br />
R 1<br />
H H H H<br />
O
Lineare Polyurethane<br />
entstehen durch Polyaddidtion von Dialkoholen an Diisocyanate, z.B. von Hexamethylendiisocyanat<br />
an 1,4-Butandiol:<br />
HO-(CH 2 ) 4 -OH + OCN-(CH 2 ) 6 -NCO + HO-(CH 2 ) 4 -OH + OCN-(CH 2 ) 6 -NCO<br />
- - -O-(CH 2 ) 4 -O-CO-NH-(CH 2 ) 6 -NH-CO-O-(CH 2 ) 4 -O-CO-NH-(CH 2 ) 6 -NH -CO- - -<br />
Dieses Polyurethan (Thermoplast!) unterscheidet sich von Polyamiden wie Nylon-6,6 ® und<br />
Perlon ® (s. Kapitel 6.2., Abb. 24, 25) vorteilhaft durch seine geringe Wasseraufnahme. Es wird<br />
daher gern für hochwertige Borsten verwendet.<br />
Vernetzte Polyurethane<br />
werden <strong>aus</strong> Isocyanaten und hochmolekularen Alkoholen erhalten, wobei mindestens eine<br />
Komponente tri- oder höherfunktionell ist. Die Eigenschaften der vernetzten Polyurethane sind<br />
über einen weiten Bereich variierbar. Generell gilt: Der Vernetzungsgrad und damit die Härte<br />
steigen<br />
a) mit dem Gehalt an seitenständigen OH-Gruppen im Desmophen ®<br />
b) mit dem Anteil an Triisocyanaten<br />
c) mit dem Überschuss an Isocyanaten (Vernetzungsmechanismus s. Abb. 36)<br />
Es lassen sich kautschukelastische Polyurethane (Vulkollan ® ) sowie harte und weiche Schaumstoffe<br />
herstellen.<br />
Technisch wichtige di- und höherfunktionelle Isocyanate ("Polyisocyanate") werden in nachfolgender<br />
Tabelle zusammengestellt. Im Anschluss daran werden di- und höherfunktionelle Alkohole<br />
("Polyole") vorgestellt, die für technische Polyurethan-Synthesen bedeutend sind.<br />
70<br />
↓
Tabelle 4<br />
Technisch wichtige "Polyisocyanate"<br />
Name und Formel Hauptanwendungsgebiet<br />
2,4- bzw. 2,6,-Diisocyanato-toluol (Toluylen-diisocyanat)<br />
Desmodur R T<br />
OCN<br />
CH 3<br />
NCO<br />
CH 3<br />
NCO<br />
2,6-Isomer 2,4-Isomer<br />
NCO<br />
Diphenylmethan-4,4'-diisocyanat, Desmodur R 44<br />
OCN<br />
CH 2<br />
NCO<br />
Oligomeres Diphenylmethan-4,4'-diisocyanat<br />
Desmodur R 44 V<br />
CH 2<br />
CH 2<br />
71<br />
Schaumstoffe<br />
Lacke<br />
Elastomere<br />
Schaumstoffe<br />
Elastomere<br />
Klebstoffe<br />
Fasern<br />
OCN Schaumstoffe<br />
NCO<br />
OCN n<br />
n = 0,1,2,3 (Gemisch)
Name und Formel Hauptanwendungsgebiet<br />
1,6- Diisocyanato-hexan (Hexamethylendiisocyanat. HDI)<br />
Desmodur R H<br />
OCN NCO<br />
1,5-Diisocyanato-naphthalin, Desmodur R 15<br />
NCO<br />
NCO<br />
Triisocyanato-triphenylmethan, Desmodur R R<br />
OCN<br />
OCN<br />
CH<br />
NCO<br />
NCO<br />
Produkt uas Desmodur R T und Trimethylolpropan<br />
Desmodur R L<br />
H 3 C<br />
OCN<br />
N<br />
H<br />
O<br />
H 3 C<br />
O<br />
CH 2<br />
CH 2<br />
O<br />
O<br />
CH2 O<br />
O<br />
N<br />
H<br />
H<br />
N<br />
NCO<br />
CH 3<br />
CH 3<br />
NCO<br />
Hexamethylenbiuret-polyisocyanat, Demodur R N<br />
(idelalisierte Konstitution)<br />
O<br />
N<br />
NH<br />
O<br />
NH<br />
NCO<br />
72<br />
NCO<br />
elastische, lichtechte Polyurethane<br />
Lacke<br />
Hochleistungs-Elastomere<br />
Vulkollan R<br />
Klebstoffe<br />
Lacke<br />
Lacke
Name und Formel Hauptanwendungsgebiet<br />
Isophoron-diisocyanat (IPDI)<br />
Desmodur R Z<br />
Polyole<br />
H C 3<br />
H C 3<br />
Als Di- bzw. Triole werden fast <strong>aus</strong>schließlich OH-terminierte Polyether oder Polyester niederen<br />
bzw. mittleren Molekulargewichtes (von 62 bis 6.000) verwendet. Diese tragen an den Enden<br />
zwei bzw. - bei verzweigten Ketten - drei und mehr Hydroxyl-Gruppen. Die OH-terminierten<br />
Polyether werden auch Polyetherpolyole genannt. Die wichtigsten Polyether-polyole auf Basis<br />
von Ethylenoxid (Oxiran) und Propylenoxid (Methyloxiran) werden durch Basenkatalyse unter<br />
Verwendung von bi- und trifunktionellen kurzkettigen Startermolekülen, wie Wasser oder<br />
aliphatischen Diolen, durch ringöffnende Polymerisation erhalten:<br />
C<br />
H 2<br />
H 3 C<br />
O R + OH -<br />
CH<br />
HO CH 2<br />
CH<br />
R<br />
O<br />
CH 2<br />
NCO<br />
NCO<br />
R<br />
CH<br />
HO CH2 CH<br />
n<br />
O<br />
R<br />
+ H +<br />
Die OH-terminierten Polyester werden auch Polyesterpolyole genannt. Polyesterpolyole werden<br />
durch Schmelzkondensation eines Überschusses an Diolen (oder Triolen) mit Dicarbonsäuren<br />
gewonnen. So entsteht <strong>aus</strong> Ethandiol-(1,1) (Ethylenglykol) und Hexandisäure (Adipinsäure) der<br />
Adipinsäureglykolpolyester (Desmophen 2000 ® ) :<br />
O<br />
73<br />
+ n<br />
O R<br />
H2C CH<br />
HO CH 2<br />
CH<br />
R = H: (Poly)ethylenoxid<br />
R = CH 3: (Poly)propylenoxid<br />
n + 1 HO-CH 2 -CH 2 -OH + n HOOC-CH 2 -CH 2 -CH 2 -CH 2 -COOH<br />
O O<br />
HO--CH2-CH2-O-C-CH2-CH2-CH2-CH2-C-O--CH2-CH2-OH n<br />
R<br />
O<br />
Lacke<br />
CH 2<br />
R<br />
CH<br />
n<br />
OH<br />
- 2n H 2 O
Der Ersatz von Polyetherpolyolen durch Polyesterpolyole in vernetzten Polyurethanen führt zu<br />
einem verbesserten mechanischen Werteniveau. Besonders Zug- und Strukturfestigkeit bei<br />
Raumtemperatur werden verbessert sowie die Beständigkeit gegen oxidative Einflüsse. Diese<br />
Effekte werden durch die höhere Polarität der Ester-Gruppe und ihre geringere Neigung zur<br />
Bildung von Peroxiden bedingt. Die Polyester haben höhere Erweichungspunkte und eine Größere<br />
Kristallisationstendenz als die Polyether und sind in der Mehrzahl bei Raumtemperatur fest. Ein<br />
Nachteil der Polyester ist jedoch ihre leichte Hydrolysierbarkeit.<br />
6.4.1.1. Kautschukelastisches Polyurethan (Vulkollan ® )<br />
Als Beispiel für ein kautschukelastisches Polyurethan soll hier die Herstellung des Vulkollan ®<br />
schematisch beschrieben werden. Als ein Ausgangsmaterial dient der rein linear aufgebaute<br />
Polyester Desmophen 2000 ® . Dieser wird im allgemeinen durch drei Reaktionsschritte in ein<br />
weitmaschig vernetztes Produkt übergeführt.<br />
Versuch Nr. 10<br />
1. Vorverlängerung<br />
Durch Zugabe eines berechneten Überschusses Diisocyanat zur sorgfältigen entwässerten<br />
Schmelze des Polyesterpolyols erfolgt eine Verknüpfung von durchschnittlich zwei Polyestermolekülen<br />
zu einem Größeren Kettenmolekül mit endständigen Isocyanatgruppen (Makrodiisocyanat<br />
oder Präpolymer) (Abb. 33):<br />
74
Abb. 33: Vorverlängerung des Diisocyanats mit Adipinsäureglykolpolyester<br />
(Mol.-Gew. 2000 - 3000) der Formel:<br />
HO C<br />
H2 2. Verlängerung<br />
C<br />
H 2<br />
Das so entstandene Makrodiisocyanat (Präpolymer) erfährt durch Beimischung sogenannter<br />
Kettenverlängerer (Diamine, Wasser oder Diole) eine weitere Verlängerung (Abb. 34).<br />
Abb. 34: Reaktion des Diisocyanatpolyesters<br />
a) mit Diaminen zu Polyharnstoffen<br />
H N 2 R NH2 H2N R NH2 + +<br />
O C N N C O O C N N C O<br />
O C N<br />
O<br />
O C N R N C O<br />
(CH2 ) 4<br />
CO<br />
kurz:<br />
O<br />
CO<br />
C<br />
H 2<br />
H2 C<br />
HO OH<br />
CO<br />
CO<br />
CO<br />
N N R N N N<br />
H H H H H<br />
Polyharnstoff<br />
75<br />
O<br />
CO<br />
(CH 2 ) 4<br />
HO OH HO OH<br />
n<br />
CO<br />
O<br />
n<br />
H2 C<br />
N R N<br />
H H<br />
C<br />
H 2<br />
OH<br />
+ +<br />
O C N R N C O O C N R N C O<br />
CO CO<br />
CO<br />
O C N R N O O N R N O O<br />
H H H<br />
Diisocyanatpolyester (Präpolymer)<br />
kurz: O C N N C O<br />
CO<br />
N<br />
H<br />
R<br />
N C O
) mit Wasser zu Polyharnstoffen (Mechanismus vgl. Kap. 6.4.1.2)<br />
O C N N C O<br />
NH<br />
H O H H O H<br />
+ +<br />
O C N N C O<br />
76<br />
- CO 2<br />
CO<br />
CO<br />
NH NH NH<br />
n<br />
Polyharnstoff<br />
CO<br />
NH<br />
Bei der Reaktion von Diolen mit dem Präpolymer werden hochmolekulare Polyurethane gebildet<br />
(Abb. 35).<br />
Abb. 35: Reaktion des Diisocyanatpolyesters (s. Abb. 33) mit Diolen zum Polyurethan<br />
NH<br />
HO R OH HO R OH<br />
O C N N C O<br />
+<br />
O C N N C O<br />
+<br />
O N<br />
N<br />
H<br />
CO<br />
CO<br />
O R O N<br />
H<br />
Polyurethan<br />
NH<br />
CO<br />
O R O<br />
n<br />
3. Vernetzung<br />
Die gebildeten Polyharnstoffe und Polyurethane besitzen in ihren Ketten nucleophile NH-<br />
Einheiten, die durch Reaktion mit noch nicht abreagierten Isocyanatgruppen unter Ausbildung<br />
einer Biuret- bzw. Allophanat-Struktur zur Vernetzung führen (Abb. 36).
Abb. 36: Vernetzung durch die Reaktion mit noch nicht abreagierten Isocyanatgruppen<br />
a) mit Polyharnstoffen (s. Abb. 34)<br />
"Harnstoff-Vernetzung" Biuret-Struktur<br />
N<br />
H<br />
N<br />
H<br />
CO<br />
N<br />
H<br />
CO<br />
N<br />
H<br />
R<br />
R<br />
CO<br />
N<br />
H<br />
N<br />
H<br />
N C O<br />
b) mit Polyurethanen (s. Abb. 35)<br />
"Urethan-Vernetzung" Allophanat-Struktur<br />
N<br />
H<br />
N<br />
H<br />
N<br />
H<br />
HN<br />
CO<br />
N<br />
CO<br />
CO CO<br />
O R O N<br />
H<br />
N C O<br />
CO<br />
O R O<br />
HN<br />
CO<br />
N<br />
CO<br />
Außerdem erfolgt eine physikalische Vernetzung über Wasserstoffbrücken.<br />
N<br />
H<br />
CO<br />
CO<br />
NH N<br />
H<br />
NH<br />
NH<br />
Bei der Umsetzung von Desmophen ® und Desmodur ® zu kautschukelastischen <strong>Kunststoffe</strong>n<br />
sowie zu Lack- und Klebstoff-Filmen muss Feuchtigkeit im Reaktionsgemisch unbedingt<br />
<strong>aus</strong>geschlossen werden (s.a. Versuch Nr. 10). In anderen Fällen, z.B. bei der<br />
Schaumstoffherstellung, setzt man absichtlich Wasser zu.<br />
77<br />
N<br />
H<br />
R<br />
R<br />
N<br />
H<br />
N<br />
H<br />
CO<br />
O R O<br />
CO<br />
O R<br />
O
6.4.1.2. Polyurethan-Schaumstoffe<br />
Wasser reagiert mit Isocyanaten unter Entwicklung von Kohlendioxid zu Harnstoffen, die mit<br />
weiterem Isocyanat ein Biuret bilden:<br />
R<br />
N<br />
C O<br />
O C N R<br />
+ H 2 O<br />
R N H<br />
R N<br />
H<br />
CO<br />
N<br />
H<br />
R<br />
instabile<br />
Carbamidsäure<br />
78<br />
O<br />
R<br />
N<br />
C O<br />
-CO 2<br />
OH R NH 2<br />
R<br />
N<br />
H<br />
HN<br />
R<br />
CO<br />
N<br />
Ist Wasser im Reaktionsgemisch zugegen (z.B. im Desmophen ® -Aktivatorgemisch des Versuchs<br />
Nr. 11), so hat das Diisocyanat zwei mögliche Reaktionspartner: das Wasser und das<br />
Desmophen ® . Es reagiert mit beiden, mit Wasser unter Entwicklung von Kohlendioxid, mit dem<br />
Desmophen ® unter Bildung von Polyurethan. Während sich das Polyurethan bildet, wird es von<br />
dem freiwerdenden Kohlendioxid aufgebläht: es entsteht ein Schaumstoff. Die Umsetzung<br />
zwischen den Reaktionspartnern ist stark exotherm; sie tritt beim Zugeben der Komponenten<br />
bereits bei Zimmertemperatur ein.<br />
Derartige Schaumstoffe kann man in den verschiedensten Härtegraden gewinnen: Von einem<br />
<strong>aus</strong>gesprochenen Hartschaum bis zu einem weichen und elastischen Schaum-Material sind alle<br />
Zwischenstufen (auch unterschiedlichster Dichte) möglich. Es kommt vor allem auf das<br />
verwendete Desmophen ® an.<br />
Man unterscheidet bei den Schaumstoffen den Weichschaum, Hartschaum und Integralschaum.<br />
Der Weichschaum nimmt darunter eine führende Stellung ein. In erster Linie wird er im<br />
Polsterbereich eingesetzt. Für den Treibprozess wird die Kohlendioxid liefernde<br />
Isocyanat/Wasser-Reaktion (s.o.) eingesetzt.<br />
CO<br />
R
Versuch Nr. 11<br />
Das Aufschäumen des Hartschaums erfolgte bisher fast <strong>aus</strong>schließlich mit niedrigsiedenden<br />
Fluorchlorkohlenwasserstoffen (FCKW), z.B. dem Trichlorfluormethan (Frigen 11 ® ). Das<br />
Treibgas, das in den geschlossenen Zellen verbleibt, verleiht aufgrund seiner geringen<br />
Wärmeleitfähigkeit dem Schaum seine hervorragenden Dämmeigenschaften. Diese Eigenschaften<br />
wurden beim Einsatz in Kühlschränken und Kühltruhen genutzt.<br />
In Europa sind z. Zt. ca. 90 Prozent aller H<strong>aus</strong>haltskühlschränke und 100 Prozent aller<br />
Tiefkühltruhen mit Polyurethan-Hartschaum isoliert. Wegen der niedrigen Wärmeleitzahl des<br />
Schaumstoffs konnten die Kühlmöbelhersteller das Fassungsvermögen der Geräte bei gleichen<br />
Aussenabmessungen beträchtlich erhöhen. Im Verbund mit harten Deckschichten, wie Stahl oder<br />
anderen <strong>Kunststoffe</strong>n (Sandwichverfahren), wird der Hartschaum in steigendem Masse für<br />
konstruktive Anwendungen eingesetzt.<br />
Wegen der Ozonproblematik haben die Hersteller von Polyurethanschäumen bis Ende des Jahres<br />
1992, wo immer möglich, auf FCKW-freie Verfahren umgestellt. Wo dies nicht erreichbar ist,<br />
wird die Verwendung von FCKW auf das unumgängliche Maß reduziert. Nach Einführung<br />
geeigneter Ersatzstoffe wird der Einsatz von FCKW zum frühstmöglichen Zeitpunkt eingestellt.<br />
Ersatzstoffe sind die sogenannten "weichen" FKW, d.h. teilfluorierte Kohlenwasserstoffe mit<br />
geringem ozonschädlichen Potential. Die Patentlösung ist jedoch die "Null-Lösung", d.h. rein<br />
durch CO2 oder niedrigsiedende Kohlenwasserstoffe getriebener Schaum. In vielen Fällen kann<br />
durch Rezeptur-Änderung schon heute ganz auf FCKWs verzichtet werden.<br />
Vor mehr als 20 Jahren wurde mit den halbharten und harten Polyurethan-Schaumstoffen ein<br />
völlig neues Anwendungsgebiet erschlossen, das sich als recht zukunftsträchtig erwies. Es wurde<br />
beobachtet, dass schäumungsfähige Reaktionsgemische auf Polyurethan-Basis in geschlossenen,<br />
temperierten Formwerkzeugen, wenn sie unter Druck <strong>aus</strong>härten, Formteile bilden, deren<br />
Dichteverteilung über den Querschnitt kontinuierlich variiert: die Dichte nimmt von der Mitte des<br />
Formteils zu den Rändern hin stetig zu, so dass eine Art Sandwich-Struktur entsteht, die dem<br />
Schaumstoff hervorragende mechanische Eigenschaften verleiht. Das Integralschaum-Formstück<br />
besitzt sofort eine feste, schützende Außenhaut. Durch den Schäumdruck wird die Oberfläche<br />
des Formwerkzeuges exakt im Formteil abgebildet. In der Automobilindustrie werden halbharte<br />
Integralschaumstoffe für Armlehnen, Armaturenabdeckungen und Stossstangen eingesetzt.<br />
Hochabriebfeste Schuhsohlen lassen sich in einem Arbeitsgang direkt an den Schuhschaft<br />
anschäumen. Auch technische Teile <strong>aus</strong> Integralschaumstoffen lassen sich umweltfreundlich ohne<br />
Verwendung von FCKWs herstellen.<br />
79
Die einzelnen Polyurethan-Kunststoffgattungen zeigen, wie weit die Skala der Eigenschaften der<br />
Polyurethan-<strong>Kunststoffe</strong> reicht, die durch Änderungen am Makromolekül hergestellt werden<br />
können. Die Arbeiten auf diesem Gebiet sind in vollem Gange und bei weitem noch nicht<br />
abgeschlossen, so dass die Zukunft sicher neue interessante Entwicklungen auf diesem Gebiet<br />
bringen wird. Über eine besondere Klasse der Polyurethane, die Polyurethan-Ionomere, wird im<br />
Kapitel 8.2.2. berichtet.<br />
6.4.1.3. Ingenieurkunst als Partner der Chemie<br />
Im vorliegenden Buch wurden <strong>Kunststoffe</strong> vorwiegend <strong>aus</strong> chemischer Sicht beschrieben. Auf<br />
dem Weg vom Makromolekül zum verarbeiteten Werkstoff bietet jedoch allein die<br />
partnerschaftliche Zusammenarbeit mit Physikern, Mathematikern und Ingenieuren der<br />
verschiedenen Fachrichtungen die Möglichkeit zu wirklichen Innovationen. Ein Beispiel <strong>aus</strong> der<br />
Polyurethan-Chemie mag dies exemplarisch belegen. Das neu entdeckte Verfahren der in-situ-<br />
Verschäumung von Polyurethanen während der Polyaddition war zwar im<br />
Demonstrationsversuch (s. Abb. 37) konkurrenzlos elegant, aber vor allem deshalb, weil derartige<br />
Techniken vorher gar nicht existierten und natürlich auch keine geeigneten Maschinen dafür.<br />
Abb. 37: Polyaddition von Desmodur ® und<br />
Desmophen ® zu einem Polyurethan-<br />
Schaum<br />
So konnten Polyurethan-Schaumstoffe zunächst nur ganz primitiv "von Hand" durch<br />
Zusammenrühren der Ausgangsprodukte hergestellt werden. Polyurethane galten noch bis Mitte<br />
der sechziger Jahre als exotische Spezialprodukte; mengenmässig waren sie unbedeutend (1963:<br />
270 000 t weltweit).<br />
Erst durch die Entwicklung einer auf das Diisocyanat-Polyadditionsverfahren abgestimmten und<br />
für die verschiedenen Anwendungsgebiete aufgefächerten Zwei-Komponenten-Maschinen-<br />
80
technik zur Förderung, Dosierung und Vermischung sowie zur kontinuierlichen Block-, Plattenund<br />
Formverschäumung wurden die Vor<strong>aus</strong>setzungen dafür geschaffen, dass sich <strong>aus</strong> dem teuren<br />
Spezialpolymer eine großtechnisch umfangreiche Produktgruppe entwickeln konnte.<br />
Vor allem die Hochdrucktechnik - zunächst mit den in Dieselmotoren üblichen<br />
Reihenkolbenpumpen realisiert - verhalf der Polyurethan-Herstellung zu ihrem Siegeszug in der<br />
Kunststoffproduktion. Rasche Förderung und exakte Dosierung, extrem schnelle und intensive<br />
Vermischung durch Gegenstrominjektion und damit hohe Ausstossmengen bis zu 600 kg pro<br />
Minute ermöglichten die sichere Verarbeitung auch hochreaktiver Systeme und damit optimale<br />
Wirtschaftlichkeit.<br />
Der Aufbau harter oder weicher, kompakter oder im Kern geschäumter, vernetzter Elastomere<br />
mit der <strong>aus</strong> der Schaumstoff-Technik hervorgegangenen "reaction injection moulding" (RIM)-<br />
Technik nimmt zur Zeit weltweit einen rasanten Aufschwung. Dabei werden die flüssigen<br />
Ausgangskomponenten maschinell exakt dosiert, vermischt und in geschlossene Formen<br />
eingespritzt, worin sie in kürzester Zeit <strong>aus</strong>härten und der Form entnommen werden können. Die<br />
chemische Reaktion, der Polymeraufbau, läuft also nicht in der chemischen Fabrik ab, sondern<br />
unmittelbar beim Verarbeiter, z.B. dem Autohersteller, und führt direkt zum fertigen Formteil,<br />
z.B. einem ummantelten Lenkrad oder einem Karosserieteil (Abb. 38).<br />
Abb. 38: Beispiel für die Fertigung eines gesamten Frontendes ("softend") eines Fahrzeugs<br />
<strong>aus</strong> Polyurethan-RIM<br />
Beim RIM-Verfahren werden Reaktionszeiten in der Größenordung von wenigen Sekunden<br />
gefordert. Es können also auch Diamine, deren Umsetzung mit Diisocyanaten im Labor ohne<br />
Verdünnungsmittel aufgrund ihrer hohen Reaktivität nicht beherrschbar ist, als Reaktionspartner<br />
81
eingesetzt werden (Polyharnstoff-RIM). Die entstehenden Polyharnstoffe sind steifer und<br />
thermostabiler als die entsprechenden Polyurethane, vor allem aber lassen sie sich rascher<br />
entformen. Dies ist ein eindrucksvolles Beispiel dafür, wie die Einführung und Entwicklung einer<br />
neuen Technik rückwirkend zu einer Erweiterung der chemischen Basis eines Verfahrens führen<br />
kann. Hochreaktive Aminoendgruppen tragende Polyether und Polyester wurden attraktive<br />
B<strong>aus</strong>teine für das RIM-Verfahren, wodurch die Synthese dieser Produkte neue Impulse erhielt.<br />
6.4.2. Epoxidharze<br />
Ähnlich wie Isocyanate mit Alkoholen, Aminen und Säuren zu reagieren vermögen, liefern diese<br />
sogenannten "Härter" auch Polyadditionsprodukte mit Epoxiden. Da die Härter häufig höher als<br />
bifunktionell sind und die eingesetzten Bis-Epoxide auch selbst noch reaktive OH-Gruppen<br />
tragen, entstehen vernetzte Polymere, die Epoxidharze.<br />
Die wichtigsten Bis-Epoxide werden durch eine Kondensationsreaktion zwischen dem vom<br />
Polycarbonat her bekannten "Bisphenol-A" (2,2-Bis-(4-hydroxyphenyl)propan) und Epichlorhydrin<br />
gebildet (Handelsname Lekutherm ® ). Diese Bis-Epoxide (s. Abb. 39) sind zähflüssige oder<br />
schmelzbare Produkte. Die Formgebung und die anschliessende Härtung des Giessharzes erfolgt<br />
ohne Druck und ohne Abspaltung flüchtiger Substanzen. Als Härtungsmittel können praktisch<br />
alle mit Epoxygruppen reagierende, mindestens bifunktionelle Verbindungen eingesetzt werden,<br />
z.B. Polyalkohole, Polycarbonsäuren (und ihre Anhydride), Amine, Amide usw. (s. Abb. 40).<br />
Versuch 12<br />
Epoxidharze werden wie vernetzte ungesättigte Polyester verarbeitet und verwendet. Besondere<br />
Merkmale sind gute Haftfestigkeit auf Metallen (Metallkleber, Kitte), gute elektrische und<br />
mechanische Eigenschaften sowie hohe Chemikalienfestigkeit.<br />
82
Abb. 39: Bildung von Bisepoxiden <strong>aus</strong> einer (I) bzw. drei Bisphenol-A-Einheiten (II) durch<br />
Kondensation mit Epichlorhydrin<br />
C<br />
H 3<br />
Cl<br />
CH 3<br />
O<br />
CH CH 2<br />
CH 2<br />
Cl<br />
CH 2<br />
C<br />
H 2<br />
O<br />
CH<br />
OH<br />
CH<br />
+<br />
CH 2<br />
CH 2<br />
HO<br />
C<br />
H 3<br />
C<br />
H 3<br />
83<br />
CH 3<br />
CH 3<br />
OH<br />
O<br />
+ C CH<br />
O O CH2 CH 2<br />
CH Cl<br />
+ 2 NaOH<br />
OH<br />
- 2 NaCl<br />
- 2 H 2O Kondensation<br />
C<br />
H 3<br />
H 2<br />
ringöffnende Addition<br />
CH 3<br />
O O CH 2<br />
(I)<br />
CH<br />
O<br />
C<br />
H 3<br />
H C 2<br />
CH2 CH O O<br />
CH CH 2 2<br />
CH O<br />
O OH (II)<br />
Symbol für (I) und (II):<br />
+ 1/2 Bisphenol A<br />
CH 3<br />
O<br />
O O<br />
CH 2<br />
CH<br />
OH<br />
CH 2<br />
CH 2<br />
O<br />
CH 2<br />
Cl<br />
C<br />
H 3<br />
CH 3<br />
O CH 2<br />
CH CH 2<br />
O
Abb. 40: Schema der Härtung eines Bis-Epoxides entsprechend Abb. 39 mit einem Polyamin<br />
H 2 N ~ NH ~ NH 2 (~ : Alkylenkette)<br />
HO<br />
HO<br />
HO<br />
x<br />
O<br />
HO OH<br />
HN ~ N ~ NH<br />
OH<br />
N ~ N ~ NH<br />
OH<br />
O<br />
N ~ N ~ N<br />
84<br />
+ y H 2N ~ NH ~ NH 2<br />
OH HO OH OH HO<br />
N ~ N ~ N<br />
N ~ N ~ N<br />
HO<br />
HO<br />
HO<br />
OH<br />
OH<br />
N ~ N ~ N<br />
HO<br />
HO
7. Modifizierung von <strong>Kunststoffe</strong>n<br />
Der Überblick über die Grundreaktionen und der Vergleich der verschiedenen Bildungsprinzipien<br />
makromolekularer Stoffe sollte zeigen, dass die Synthese der beiden großen Kunststoffgruppen - der<br />
Thermoplaste und der Duroplaste - nicht an ein bestimmtes Reaktionsverfahren gebunden ist,<br />
sondern dass vielmehr eine beachtliche Anzahl von Hochpolymeren nach den genannten drei<br />
Reaktionsverfahren aufgebaut werden kann (s. Tabelle 3).<br />
Die Grundeigenschaften der so hergestellten Werkstoffe reichen aber nicht <strong>aus</strong>, um die<br />
verschiedenartigen und immer höher geschraubten Anforderungen <strong>aus</strong> der Praxis zu erfüllen.<br />
Unabdingbare Eigenschaften von Werkstoffen sind:<br />
- hohe Festigkeit bei hoher Temperatur<br />
- gute Zähigkeit bei tiefer Temperatur<br />
- hoher Schmelzpunkt<br />
- Widerstandsfähigkeit gegen schroffe Temperaturänderung<br />
- (Thermoschock)<br />
- möglichst geringes Gewicht<br />
- Beständigkeit gegen Kernstrahlung und kosmische Strahlung<br />
- hohe Korrosionsbeständigkeit gegen Chemikalien usw.<br />
Es ist einleuchtend, dass kein Werkstoff alle diese Bedingungen, die sich z.T. <strong>aus</strong>zuschließen<br />
scheinen, erfüllen kann. Amerikanische Experten nannten den Idealwerkstoff daher<br />
"Unobtainium" (das "Unerreichbare").<br />
85
Durch die Entwicklung neuer Verbindungen, durch neue Arbeitsweisen und Kombinationen<br />
bekannter Stoffe sind jedoch bereits bemerkenswerte Ergebnisse erzielt worden, die den<br />
<strong>Kunststoffe</strong>n den Beinamen "Werkstoffe nach Maß" eingebracht haben.<br />
Polymer-Modifizierungen erhält man durch Beimischen relativ kleiner Anteile an (z.T. polymeren)<br />
Hilfsstoffen z.B. mittels Knetmaschinen oder Extrudern zur Verbesserung der Werkstoff- und<br />
Verarbeitungseigenschaften.<br />
<strong>Kunststoffe</strong> sind so, wie sie bei den geschilderten Reaktionen anfallen, nur Rohstoffe. Sie werden<br />
erst durch zahlreiche Nachbehandlungen zum Werkstoff mit genau festgelegten Eigenschaften (=<br />
Handelsprodukt). Auch der beste Kunststoffrohstoff muss z.B. stabilisiert werden gegen Angriffe<br />
(d.h. Aufbrechen der Makromoleküle in Bruchstücke) durch Wärme, Licht oder Sauerstoff.<br />
Versuch Nr. 13<br />
Er muss meist mit sogenannten Gleitmitteln (hochmolekularen Wachsen) versehen werden, damit<br />
beim formgebenden Verarbeiten eine einwandfreie Ausfüllung auch komplizierter Formen<br />
gewährleistet ist. Oft wird von Kunden eine ansprechende Einfärbung verlangt. Es kann auch sein,<br />
dass der Kunststoff von sich <strong>aus</strong> zu spröde für einen vorgesehenen Einsatzzweck ist. Dann muss er<br />
weichgemacht werden. Der Grund z.B., dass PVC mengenmäßig ein so bedeutender<br />
thermoplastischer Kunststoff ist, ist hauptsächlich darin zu suchen, dass <strong>aus</strong> PVC mit Hilfe von<br />
Weichmachern Werkstoffe mit sehr unterschiedlichen Eigenschaften hergestellt werden können.<br />
Während reines PVC ein hartes und sprödes Material darstellt, kann man durch Zusatz von<br />
Weichmachern mehr oder weniger weiche und elastische Erzeugnisse erhalten.<br />
Versuch Nr. 14<br />
Häufig sind Haftvermittler erforderlich, damit z. B. Beschichtungen auf Papier oder Geweben<br />
<strong>aus</strong>reichend haften. An Transportbänder, Fußbodenbeläge, Verpackungsfolien usw. wird häufig die<br />
86
Forderung gestellt, dass sie sich nicht elektrisch aufladen dürfen. Also müssen Antistatica<br />
eingearbeitet werden. Für die Verwendung in den Tropen wird immer häufiger die Forderung nach<br />
Termitenbeständigkeit, z.B. für Kabelummantelungen, Kunstleder für Fahrzeugpolster usw. gestellt.<br />
Diesen Ansprüchen kann man durch Einarbeitung von Termitenschutzmitteln gerecht werden. Zur<br />
Erzielung bestimmter mechanischer Eigenschaften müssen oft Füllstoffe, wie z.B. Kaolin,<br />
Schiefermehl, Sand, Carbonate, Sulfate, Silikate (Aerosile), Ruß, Glasfasern usw., eingearbeitet<br />
werden. Zur Verbesserung der Flammwidrigkeit verwendet man unter anderem Antimontrioxid oder<br />
Phosphorverbindungen. Zur Schimmelfestmachung stehen neuerdings geeignete Fungizide zur<br />
Verfügung. In neuerer Zeit wird die Galvanisierung von <strong>Kunststoffe</strong>n stark in den Blickpunkt des<br />
allgemeinen Interesses gerückt. Galvanisierte Kunststoffteile bringen besonders dort große Vorteile,<br />
wo für die Herstellung eines entsprechenden dekorativen Metallteiles mehrere und aufwendige<br />
mechanische Bearbeitungsvorgänge, z.B. Drehen, Fräsen, Bohren, Abkanten, Löten usw.,<br />
erforderlich sind.<br />
Die Bearbeitung jedes dieser Gebiete erfordert heute bereits Spezialisten.<br />
87
8. Neuere Entwicklungen<br />
Auch bei dem gegenwärtigen hohen Stand der Kunststoffchemie kommt der Suche nach neuartigen<br />
<strong>Kunststoffe</strong>n <strong>aus</strong> bisher noch nicht verwendeten monomeren B<strong>aus</strong>teinen oder nach neuen<br />
Strukturprinzipien eine wichtige Bedeutung zu. Naturgemäß können solche neuen Polymere bei<br />
Markteinführung nur Spezialwerkstoffe für besondere Anwendungen sein, die sich nicht zuletzt<br />
wegen ihres erhöhten Preises einen größeren Markt erst erschließen müssen.<br />
8.1. Polymere <strong>aus</strong> neuen Monomeren<br />
( - Variation der Primärstruktur - )<br />
8.1.1. Temperaturbeständige Polymere<br />
Als ein Anwendungsbeispiel unter vielen für <strong>Kunststoffe</strong> <strong>aus</strong> neuen Monomeren sollen hier einige<br />
temperaturbeständige Polymere vorgestellt werden. Diese Forschungsrichtung wurde anfangs durch<br />
die Entwicklungen in Luft- und Raumfahrt initiiert. Heute sind aber Anwendungen im Fahrzeug- und<br />
Maschinenbau sowie in der Elektro- und Elektronikindustrie mehr in den Vordergrund gerückt.<br />
Temperaturbeständige Polymere enthalten B<strong>aus</strong>teine, in denen sehr stabile Bindungen in Aromaten<br />
bzw. C-F-Bindungen (Bindungsenergie = 441 kJ/mol) an die Stelle von aliphatischen C-C- bzw. C-<br />
H-Bindungen (Bindungsenergie = 413 kJ/mol) getreten sind (s. z.B. PTFE-Beschichtungen in<br />
Kapitel 6.3.1.). Hinzu kommt häufig ein steifer Aufbau der Polymerketten mit starken<br />
Wechselwirkungskräften und einem hohen Anteil an Kristallinität.<br />
Exemplarisch wird je ein Polymer <strong>aus</strong> den drei Verbindungsklassen Polyaryle, heterocyclische<br />
Polymere und Leiterpolymere, vorgestellt. Die Temperaturbeständigkeit von Fluorpolymeren<br />
(Teflon, Kapitel 6.3.1.) wurde bereits erwähnt. Auf flüssigkristalline Polymere soll in anderem<br />
Zusammenhang noch eingegangen werden (s. Kapitel 8.2.4.).<br />
88
Polyaryle<br />
In Polyarylen sind Benzolringe durch heteroatomhaltige Gruppen X und Y verbunden. Technisch<br />
sind dabei die drei folgenden Substanzklassen von Bedeutung:<br />
Das seit 1972 käufliche PPS ist ein Polykondensat, das durch nucleophilen Angriff von Sulfid auf p-<br />
Dichlorbenzol bei erhöhter Temperatur und erhöhtem Druck gebildet wird:<br />
X<br />
a) X = Y = S: Polyphenylensulfid (PPS: hochkristallin)<br />
b) X = O, Y = SO 2 : Polyethersulfone (PES: amorph)<br />
c) X = O, Y = CO: Polyetherketone (PEK: teilkristallin)<br />
Cl<br />
n<br />
+ n Na2S Cl<br />
Die Schmelztemperatur von PPS liegt bei 285 o C; es ist oberhalb 300 o C nach gängigen Verarbei-<br />
tungsprozessen für Thermoplaste (Spritzgießen, Extrudieren) verarbeitbar. Dieses Material hält<br />
Temperaturbelastungen bis zu 275 o C auch über mehrere Tage ohne Schaden <strong>aus</strong> (s. Abb. 41).<br />
Y<br />
- 2n NaCl<br />
89<br />
n<br />
PPS<br />
S<br />
n
Abb. 41: Ein Löffel <strong>aus</strong> einem Standardkunststoff mit geschmolzenem Lötzinn (260 o C) wird<br />
zerstört. Den PPS-Löffel "lässt diese Temperatur kalt"<br />
PPS wird jedoch durch Oxidationsprozesse unter UV-Bestrahlung angegriffen. Durch weitere<br />
Forschung könnte dieser kleine Fehler im Gesamtbild des neuen Werkstoffes beseitigt werden.<br />
Heterocyclische Polymere<br />
Polyimide entstehen in einer zweistufigen Reaktion <strong>aus</strong> einem aromatischen Diamin und einem<br />
aromatischen Dianhydrid wie z.B. 1,2,4,5-Benzoltetracarbonsäuredianhydrid (Pyromellitsäuredianhydrid).<br />
Nach dem einleitenden Polyadditionsschritt sind die erhaltenen Polymere noch löslich und<br />
zu Filmen oder Fasern verarbeitbar (s. Abb. 43). Beim anschließenden Erhitzen tritt unter Wasserabspaltung<br />
eine Polycyclokondensation zum Polyimid ein, das sich an der Luft erst oberhalb 550 o C<br />
merklich zersetzt. Die hohe Wärmebeständigkeit hat jedoch den Nachteil, dass das Material nach<br />
thermoplastischen Techniken nicht verarbeitbar ist.<br />
90
Abb. 43: Bildung von Polyimid <strong>aus</strong> aromatischem Diamin und 1,2,4,5-Benzoltetracarbonsäuredianhydrid<br />
O<br />
O<br />
O<br />
N<br />
Auch das Polybenzimidazol (PBI) kann wegen seiner Glastemperatur von 425 o C nicht in Substanz,<br />
sondern nur <strong>aus</strong> der Lösung verarbeitet werden. Seine Synthese verläuft ebenfalls zweistufig (Abb.<br />
44). Isophthalsäurediphenylester wird unter Freisetzung von Phenol zuerst einer Polykondensation<br />
mit 3,3´,4,4´-Tetraaminobiphenyl zu einem Polyamid unterzogen. Dieses Präpolymer cyclisiert<br />
anschließend in einer Festphasenpolykondensation unter Wasser<strong>aus</strong>tritt zum Polybenzimidazol.<br />
PBI-Gewebe sind nicht brennbar und haben, da sie ca. 15 % Feuchtigkeit aufzunehmen vermögen,<br />
einen gewissen Tragekomfort. Dadurch sind sie für feuerfeste Schutzanzüge und feuerblockierende<br />
Gewebe und Vliese für Flugzeugsitze einsetzbar.<br />
O<br />
O<br />
O<br />
+ Ar<br />
H 2 N NH 2<br />
O O<br />
O<br />
Polyimid<br />
O<br />
N<br />
Ar<br />
n<br />
Polyaddition<br />
91<br />
HOOC<br />
H<br />
N<br />
O<br />
O<br />
Ar<br />
N<br />
H<br />
COOH<br />
Cyclokondensation<br />
- 2n H 2O<br />
n
Abb. 44: Bildung von Polybenzimidazol <strong>aus</strong> 3,3´,4,4´-Tetraaminobiphenyl und<br />
Isophthalsäurediphenylester<br />
H 2 N<br />
Leiter- und Kohlenstoff-Polymere sind weitere Beispiele für <strong>Kunststoffe</strong> mit extremer<br />
Temperaturbeständigkeit. Sie sollen unter dem Gesichtspunkt neuer Molekülstrukturen im Kapitel<br />
8.2. behandelt werden.<br />
PhO<br />
n H2N NH<br />
2 + n<br />
HN<br />
H 2 N<br />
N<br />
N<br />
H<br />
NH 2<br />
92<br />
O<br />
1. Cyclokondensation<br />
- 2n PhOH<br />
NH 2<br />
N<br />
H<br />
O<br />
O<br />
2. Polykondensation<br />
- 2n H 2 O<br />
N<br />
H<br />
N<br />
Polybenzimidazol<br />
n<br />
n<br />
O<br />
OPh
8.1.2. Polypyrrol - ein elektrisch selbstleitendes Polymer<br />
Aus der Erkenntnis, dass in der Reihe Ethylen, Butadien, Hexatrien mit zunehmender Kettenlänge<br />
die Elektronen im π-System immer "freier" beweglich werden, hat man schon recht früh daran<br />
gedacht, ob nicht Polymere mit einem delokalisierten π-System elektrische Leiter sind. 1954 hat<br />
Ziegler bereits Polyacetylen als schwarzes Pulver hergestellt. Es leitet den elektrischen Strom nicht.<br />
Physikalische Überlegungen bezüglich eindimensionaler Leiter (und darum handelt es sich beim<br />
Polyacetylen) zeigen, dass es anstelle der gewünschten Bindungsdelokalisierung zu einer<br />
Bindungsalternanz (Einfach-/Doppelbindung) kommt, die die Beweglichkeit der Elektronen so<br />
einschränkt, dass man keine Leitfähigkeit beobachtet.<br />
Durch partielle Oxidation des Polyacetylens, beispielsweise mit Jod, erhält man ein polymeres Salz,<br />
in dem die Elektronenbeweglichkeit so hoch ist, dass Leitfähigkeiten bis 100 S/cm, (S=Siemens), bei<br />
spezieller Orientierung und Defektfreiheit sogar bis 100 000 S/cm, messbar sind.<br />
Elektrisch leitfähiges Polypyrrol lässt sich mit geringerem Aufwand als Polyacetylen herstellen. Bei<br />
der oxidativen Polymerisation des Pyrrols erhält man das leitfähige Polymer direkt als schwarzes<br />
Pulver (Abb. 45).<br />
n<br />
Polyacetylen<br />
+ +<br />
I 3 - I 3 -<br />
93
Abb. 45: Oxidative Polymerisation von Pyrrol<br />
N<br />
H<br />
2<br />
H<br />
+<br />
- e- +<br />
+ + - 2 H +<br />
H H<br />
N<br />
H<br />
. H<br />
N<br />
H<br />
H H<br />
N<br />
H<br />
N<br />
H<br />
(II) (III) (IV)<br />
Entsprechend entstehen <strong>aus</strong> (IV) oder höheren Homologen Radikalkationen (V)<br />
N<br />
H<br />
Grenzstrukturen:<br />
N<br />
H<br />
+<br />
X -<br />
N<br />
H<br />
N<br />
H<br />
n<br />
N<br />
H<br />
(V)<br />
N<br />
H<br />
N<br />
H<br />
n<br />
N<br />
H<br />
N<br />
H<br />
H<br />
+<br />
N<br />
H<br />
.<br />
H<br />
H<br />
N<br />
N . H<br />
H (I)<br />
H (II)<br />
N<br />
H<br />
+ II<br />
X -<br />
+<br />
- 2 H +<br />
N<br />
H<br />
n<br />
N<br />
H<br />
N<br />
H<br />
Durch Oxidation wird im ersten Reaktionsschritt dem Pyrrol I ein Elektron entzogen. Das gebildete<br />
Pyrrolradikalkation II dimerisiert zum Dikation III, das durch Deprotonierung in das Bipyrrol IV<br />
übergeht. IV ist leichter oxidierbar als Pyrrol, so dass ein weiteres Pyrrolradikalkation II erst gebildet<br />
wird, wenn alle höhermolekularen Pyrrolderivate als Radikalkation V vorliegen. Letztendlich bildet<br />
sich ein Polymer, in dem jede dritte Pyrroleinheit eine positive Ladung trägt. Diese wird durch das<br />
Gegenion X - neutralisiert, das <strong>aus</strong> dem Oxidationsmittel stammt (z.B. Chlorid <strong>aus</strong> Eisen-III-chlorid).<br />
94<br />
N<br />
H<br />
N<br />
H<br />
N<br />
H<br />
N<br />
H<br />
n<br />
N<br />
H<br />
N<br />
H<br />
+<br />
N<br />
H<br />
+<br />
X -<br />
N<br />
H<br />
N<br />
H<br />
N<br />
H<br />
+<br />
N<br />
H<br />
n/3<br />
Nach dem Trocknen zeigen derartige Polypyrrolproben eine Leitfähigkeit bis 30 S/cm.<br />
X -<br />
N<br />
H<br />
X -<br />
N<br />
H<br />
N<br />
H<br />
N<br />
H<br />
n
Versuch Nr. 15<br />
8.2. Neue <strong>Kunststoffe</strong> durch Variation der Molekülstruktur<br />
(Sekundär- und Tertiärstruktur)<br />
Im Gegensatz zur Entwicklung von Polymeren <strong>aus</strong> neuen Monomeren, stehen Bemühungen, neue<br />
<strong>Kunststoffe</strong> <strong>aus</strong> monomeren B<strong>aus</strong>teinen aufzubauen, die heute schon durch die Petrochemie in<br />
<strong>aus</strong>reichender Menge und vor allem billig zur Verfügung stehen. Hier kommt es darauf an, die<br />
wenigen in Frage kommenden Monomeren auf neue Art und Weise so zu kombinieren oder zu<br />
verknüpfen, dass neuartige <strong>Kunststoffe</strong> mit vor<strong>aus</strong>geplanten Eigenschaften entstehen. In diesem<br />
Zusammenhang gewinnen die bereits bekannten Verfahren der Copolymerisation (s. Kap. 3.1.1.)<br />
sowie der stereospezifischen Polymerisation (s. Kap. 6.3.2.) immer größere Bedeutung.<br />
8.2.1. Leiter- und Kohlenstoff-Polymere<br />
Durch Verstrecken von ataktischem Polyacrylnitril lässt sich eine Anordnung der Nitrilgruppen<br />
erzwingen, die bei erhöhter Temperatur unter Cyclisierung und Dehydrierung zu einem sogenannten<br />
Leiter-Polymer [s. Abb. 46a (nicht zu verwechseln mit polymeren Leitern im Kapitel 8.1.2.)] führt.<br />
Unter Leiter-Polymeren werden solche Polymere zusammengefasst, bei denen 2 Hauptvalenzketten<br />
in regelmäßigen Abständen miteinander verbunden sind. Ein solches Produkt ist wegen der starken<br />
Konjugation der Doppelbindungen (vgl. Versuch Nr. 13, zersetztes PVC) schwarz. Es ist aber<br />
thermisch so stabil, dass dar<strong>aus</strong> hergestellte Stoffe (z.B. Gewebe) sogar dunkle Rotglut <strong>aus</strong>halten.<br />
Derartige Stoffe besitzen Halbleitereigenschaften, was sie für die Elektronikfachleute interessant<br />
macht. Ähnliche Polymerisate kann man auch <strong>aus</strong> isotaktischem Poly-1,2-butadien herstellen,<br />
dessen Vinyl-Seitenketten sich kationisch mit AlCl3 unter Ausbildung einer Leiter-Struktur<br />
polymerisieren lassen. Die abschließende Dehydrierung führt zu einem Material, das als sogenannte<br />
Pluton ® -Faser vermarktet wird (s. Abb. 46 b).<br />
95
Das <strong>aus</strong> dem Polyacrylnitril erhaltene Leiter-Polymer geht bei starkem Erhitzen unter Stickstoff (1.<br />
Carbonisierung: 1 - 3 h bei 1500 o C / 2. Graphitierung: kurzzeitig 2500 o C) in eine Struktur mit<br />
Graphitdomänen über. Diese Kohlenstoff-Fasern haben neben hervorragenden mechanischen<br />
Eigenschaften eine Temperaturbeständigkeit bis 3000 o C unter Inertgas und sind elektrisch leitend.<br />
Sie werden u.a. als Verstärkungsfaser eingesetzt. Das Prinzip der Carbonisierung, also einer<br />
"Verkohlung" unter exakt definierter Temperaturführung, wurde auch auf Phenol-Formaldehyd-<br />
Harze und -Schäume übertragen. Die so entstandenen Materialien werden als Kohlenstoff-Glas und<br />
Kohlenstoff-Schaum bezeichnet und finden Einsatz in der Raumfahrt, in Heißgasleitungen oder in<br />
Bremsscheiben von Flugzeugfahrwerken. Hierbei sind kohlen-faserverstärkte Kohlenstoff-<br />
Werkstoffe (CFC) von besonderem Interesse.<br />
Abb. 46: Herstellung von Leiter-Polymeren <strong>aus</strong>:<br />
a) verstrecktem Polyacrylnitril<br />
b) isotaktischem Poly-1,2-butadien sowie<br />
96
8.2.2. Ionomere<br />
c) Carbonisierung und Graphitierung zur Kohlenstoff-Faser<br />
a) b)<br />
H 2<br />
H C<br />
C<br />
H 2<br />
H<br />
C<br />
C<br />
Eine interessante Variation der Tertiärstruktur findet bei den sogenannten Ionomeren statt. Dies sind<br />
Copolymerisate insbesondere von Ethylen und etwa 15 % Methacrylsäure oder anderen<br />
carboxylgruppenhaltigen Monomeren. Diese unterscheiden sich aber wesentlich von den üblichen<br />
Mischpolymerisaten dadurch, dass die im Material entlang der Polymerkette enthaltenden<br />
Carboxylgruppen durch Kationen miteinander verknüpft sind.<br />
H 2<br />
H<br />
C<br />
C<br />
H<br />
C<br />
N N N N<br />
c)<br />
N N N N<br />
N N N N<br />
1500 -<br />
2500 °C<br />
H 2<br />
C<br />
Cyclisierung<br />
Dehydrierung<br />
97<br />
H 2<br />
H C<br />
C<br />
H2 H C<br />
C<br />
H2 H C<br />
C<br />
H<br />
C<br />
H<br />
2<br />
C<br />
HC HC HC HC<br />
CH 2 CH2 CH 2 CH2<br />
H H H H<br />
R<br />
Pluton -Faser
Abb. 47: Schematischer Aufbau eines Ionomers (M = Na + , Ca 2+ , Mg 2+ , Zn 2+ ...)<br />
H2 C<br />
C<br />
H 2<br />
CH3 H<br />
2<br />
H2 C C<br />
H<br />
2<br />
C<br />
H<br />
2<br />
C<br />
H<br />
2<br />
C<br />
C<br />
H<br />
2<br />
C<br />
H2 C<br />
H2 - O O - O O<br />
H2 C<br />
O<br />
C<br />
H 2<br />
M M<br />
-<br />
O<br />
O<br />
-<br />
O<br />
CH 3<br />
H2 C<br />
C<br />
H2 Es liegen sowohl ionisierte als auch freie Carboxylgruppen im Ionomeren vor. Die kristalline<br />
Struktur des zugrundeliegenden Polyethylens wird gestört, so dass der Kunststoff völlig klar und<br />
transparent wird. Trotz Ionenbindungen weist diese neue Stoffklasse aber alle Kennzeichen echter<br />
Thermoplaste auf. Die Ionenbindung bewirkt zwar eine hohe Festigkeit der Schmelze, eine<br />
wesentliche Steigerung der Zugfestigkeit und eine erhöhte Haftfestigkeit zu Trägermaterialien, wird<br />
aber durch die bei der Verarbeitung herrschende hohe Temperatur (ca. 300 o C) reversibel aufgehoben.<br />
Durch Änderung des Molekulargewichtes, des Carboxylgruppengehaltes sowie der Art und Menge<br />
der Kationen kann das Eigenschaftsbild in weiten Grenzen beeinflusst werden.<br />
Durch den Einbau ionischer oder im sauren bzw. basischen Bereich Ionen bildender Gruppen in<br />
Polyurethane erhält man Polyurethan-Ionomere. Sie liefern wässrige Dispersionen, die ohne<br />
Emulgatoren und ohne Anwendung von Scherkräften hergestellt werden können. Solche wässrigen<br />
Polyurethansysteme verdrängen z.T. Produkte, mit denen in organischen Lösemitteln gearbeitet<br />
werden musste. Das wässrige System ermöglicht neue Einsatzmöglichkeiten, wie Antifilz<strong>aus</strong>rüstung<br />
von Wolle, Leimungs- und Beschichtungsmittel für Papier, Glasfaser<strong>aus</strong>rüstung, Weichmacher für<br />
Fotogelatine, Herstellung dünnwandiger Materialien durch Tauchkoagulation (Abscheidung auf der<br />
heißen Oberfläche einer Form), sowie Gerbstoff- und Färbereihilfsmittel.<br />
C<br />
H 2<br />
H2 C<br />
98<br />
C<br />
H 2<br />
CH 3<br />
CH 3<br />
C<br />
H 2<br />
C<br />
H 2<br />
H<br />
2<br />
C
Die Polyurethanherstellung in wässrigen Zweiphasensystemen bietet neue Möglichkeiten. Zu der<br />
hohen chemischen Variabilität der Grundb<strong>aus</strong>teine kommt die Wahlmöglichkeit zwischen anioni-<br />
schen, kationischen, zwitterionischen und nichtionisch-hydrophilen einbaufähigen Komponenten<br />
hinzu. Im Gegensatz zu echten Lösungen, bei denen das Molekulargewicht des gelösten Stoffes <strong>aus</strong><br />
Viskositätsgründen nach oben begrenzt ist, können <strong>aus</strong> Dispersionen auch extrem hochmolekulare,<br />
verzweigte, ja sogar völlig vernetzte Polyurethane verarbeitet werden (Abb. 48).<br />
Abb. 48: Schematischer Aufbau einer Polyurethan-Harnstoff-Ionomer-Dispersion<br />
4 O C N N C O + HO +<br />
O<br />
Diisocyanat Triol "Ionomer-B<strong>aus</strong>tein"<br />
C<br />
N<br />
N<br />
H<br />
8.2.3. Polymer-Blends<br />
CO<br />
O<br />
O CO<br />
1.) Einrühren in H 2O/OH -<br />
2.) Reaktion mit Diamin oder Wasser<br />
O<br />
CO<br />
N<br />
H<br />
N<br />
H<br />
OH<br />
OH<br />
Die Anforderungen der Kunststoffanwender können häufig mit reinen Basispolymeren nicht oder<br />
nur schwer erfüllt werden. Für spezifische Einsatzgebiete jeweils neue Polymere auf Basis neuer<br />
B<strong>aus</strong>teine zu entwickeln, ist meistens zu kostenaufwendig. Beispielsweise belaufen sich die Kosten<br />
für die Entwicklung und den Bau der Produktionsanlagen eines neuen thermoplastischen<br />
99<br />
N<br />
H<br />
HOCH 2<br />
N C O<br />
CO<br />
OCH 2<br />
Polyurethan - Harnstoff - Ionomer - Dispersion<br />
CH 3<br />
CH 2 OH<br />
COOH<br />
CH CO N<br />
3 H<br />
CH2O COOH<br />
N C O
<strong>Kunststoffe</strong>s auf mehrere 100 Millionen DM, wobei die Entwicklungsdauer im Normalfall länger 10<br />
Jahre ist.<br />
Um technische Thermoplaste mit neuen spezifischen Eigenschaftskombinationen herzustellen,<br />
bedient man sich daher lieber der Blendtechnologie.<br />
Polymer-Blends (oft auch als Polymer-Legierung bezeichnet) sind verarbeitungsfertige Mischungen<br />
(z.B. in Granulatform) von mindestens zwei unterschiedlichen Polymeren in höherprozentigem<br />
Anteil. Das Mischen ("Compoundieren") der Bestandteile erfolgt unter definierten<br />
Temperaturbedingungen unter großer Scherkraft. Die Eigenschaften des entstehenden Polymer-<br />
Blends ergeben sich, ähnlich wie bei Metall-Legierungen, nicht einfach additiv <strong>aus</strong> den Eigenschaften<br />
der Einzelkomponenten, sondern es entstehen neue Eigenschaftsprofile.<br />
Es bestehen jedoch keine kovalenten Bindungen zwischen den Blendbestandteilen, wie etwa<br />
zwischen den Comonomeren eines Copolymerisates (s. Kapitel 3.1.1.). Der Anteil zumindest einer<br />
beigefügten Komponente ist mindestens 10 % und damit größer als der Anteil der Hilfsstoffe in<br />
Polymer-Modifizierungen (s. Kapitel 7). Polymer-Mischungen letztlich unterscheiden sich von<br />
den Blends dadurch, dass in einem Schritt die verschiedenen Polymere gemischt und zum Formteil<br />
verarbeitet werden.<br />
Der wichtigste Anwender für Polymer-Blends ist zur Zeit die Kfz-Industrie. Obwohl schon Blends<br />
<strong>aus</strong> fünf Polymerkomponenten in der Literatur beschrieben wurden, liegt der Schwerpunkt doch bei<br />
binären und ternären Systemen.<br />
Die moderne Technik bedient sich gern der ternären Blends <strong>aus</strong> amorphen und teilkristallinen Blend-<br />
Komponenten sowie eines Schlagzähmodifikators. Die teilkristallinen Blend-Komponenten tragen<br />
vor allem zur Chemikalienbeständigkeit sowie zur dynamischen Belastbarkeit und<br />
Wärmeformbeständigkeit bei; die amorphen Bestandteile erhöhen die Zähigkeit.<br />
100
Vollständig gemischte Polymer-Blends kann man bespielsweise <strong>aus</strong> PVC und hochmolekularen<br />
Polyestern herstellen; ein anderes wohlbekanntes System besteht <strong>aus</strong> Polyphenylenoxid und<br />
Polystyrol (Noryl ® ).<br />
Die weit<strong>aus</strong> überwiegende Zahl der Polymer-Blends ist inhomogen oder nur partiell gemischt und<br />
zeigt eine heterogene Morphologie. Ein charakteristisches und technisch wertvolles Merkmal für<br />
heterogene Mehrphasensysteme ist, dass Produkteigenschaften erreicht werden können, die <strong>aus</strong> dem<br />
Eigenschaftsniveau der Einzelkomponenten nicht zu erwarten sind. Im folgenden seien einige<br />
illustrative Beispiele erklärt.<br />
Polymer-Blends für Kfz-Schalttafeln<br />
Anforderungen: Heute ist für Kfz-Schalttafeln wegen der flachen Anordnungen der Windschutz-<br />
scheiben eine hohe Wärmeformbeständigkeit erforderlich. In südlichen Ländern sind auf der<br />
Schalttafeloberfläche in der Mittagssonne schon Temperaturen von mehr als 120 o C gemessen<br />
worden. Auch die Anforderungen an die Zähigkeit sind gestiegen. Seit Mitte der 70er Jahre wird eine<br />
Schalttafel gefordert, die sich bei einem Aufprall mit 24 km/h noch als bruchfest und splitterfrei<br />
erweist.<br />
Lösung: Die geforderte Eigenschaftskombination wird durch den thermoplastischen Polymer-Blend<br />
mit dem Namen Bayblend ® in idealer Weise erreicht (kurz "PC/ABS-Blend"). Bayblend ® ist ein<br />
Polymer-Blend, der <strong>aus</strong> Polycarbonat (PC: siehe Kapitel 6.2.) und einem ABS-Polymer besteht.<br />
Diese drei Buchstaben, ABS, stehen für die über<strong>aus</strong> erfolgreiche eigenständige Polymerentwicklung<br />
eines <strong>Kunststoffe</strong>s mit einer Matrix <strong>aus</strong> Styrol und Acrylnitril und der eingebetteten Elastomerphase<br />
auf Basis Butadien. Das ABS-Polymer selbst wird unter der Bezeichnung Novodur ® vermarktet und<br />
ist u.a. als Material der Lego-Steine in viele Kinderzimmer vorgedrungen (s. Abb. 49).<br />
Abb. 49: Eine weitbekannte Anwendung des schlagzähen Polymer-Blends ABS <strong>aus</strong><br />
Acrylnitril, Butadien und Styrol<br />
101
Doch zurück zur Kfz-Schalttafel <strong>aus</strong> Bayblend ® (s. Abb. 50). Die Wärmeformbeständigkeit dieses<br />
Blends liegt zwischen jener von reinem ABS und Polycarbonat. Aufgrund eines synergistischen<br />
Effektes weist das Material bei tiefen Temperaturen eine höhere Zähigkeit auf als die beiden<br />
Blendkomponenten in reiner Form.<br />
Abb. 50: Armaturentafel <strong>aus</strong> Bayblend ®<br />
Polymer-Blends für Kfz-Stoßfänger<br />
102
Anforderungen: - Steifigkeit<br />
- Zähigkeit (auch bei tiefer Temperatur)<br />
- Wärmeformbeständigkeit (Wärmestrahlung vom Motor und bei Lackierung)<br />
- Chemikalienbeständigkeit (Benzin, Öl, Reinigungsmittel)<br />
- leichte Verarbeitbarkeit (Formbarkeit, Lackierbarkeit)<br />
Lösung: Es gelang, dieses komplexe Anforderungsprofil durch die Entwicklung eines Blends mit<br />
Namen Makroblend ® auf Basis eines amorphen und eines teilkristallinen Thermoplasten unter Mit-<br />
verwendung eines Elastomermodifikators zu erfüllen. Kombinationen <strong>aus</strong> Polycarbonat (s. Kapitel<br />
6.2.) und Polybutylenterephthalat (s. Kapitel 6.2., Abb. 17, entsprechendes Produkt mit 1,4-Butan-<br />
diol statt Ethylenglykol, Handelsname Pocan ® ) haben sich für dieses Einsatzgebiet besonders be-<br />
währt (Abb. 51). Als Elastomermodifikatoren kommen Polybutadiene (s. Kapitel 3.1.) und Poly-<br />
acrylate (s. Kapitel 6.3.1.) in Betracht. "Polycarbonat + Modifikator" allein war zu spannungs-<br />
rissempfindlich, "Polybutylenterephthalat + Modifikator" allein als zu wenig dimensionsstabil.<br />
Abb. 51: Stoßfänger <strong>aus</strong> einem Polycarbonat/Polyesterblend bei einem VW-Golf<br />
103
Eine Übersicht der Hersteller von Konstruktionswerkstoffen zeigt, dass bereits 1985 etwa 60<br />
verschiedene Blendtypen als Verkaufsprodukte angeboten wurden.<br />
Im Gegensatz zu den oben beschriebenen Polycarbonat-Blends sind z.B. Polymer-Blends auf Basis<br />
von Polyamid und amorphen Thermoplasten relativ neue Entwicklungen, die z.T. noch der<br />
Optimierung bedürfen. Sehr interessant ist auch die Entwicklung flammfester Polymer-Blends, bei<br />
denen es gelungen ist, auf antimon- und bromhaltige Additive zur Flammschutz<strong>aus</strong>rüstung zu<br />
verzichten.<br />
8.2.4. Flüssigkristalline Polymere<br />
Flüssigkristalline Polymere (kurz: LCP von engl. = Liquid Crystal Polymer) zeigen in der Schmelze<br />
die Eigenschaften flüssiger Kristalle. Der flüssigkristalline Zustand liegt zwischen dem kristallinen<br />
Zustand mit seinen starken Bindungskräften, die zu dreidimensionalen Gitterstrukturen führen, und<br />
dem flüssigen Zustand, in dem es nur die Anziehung zu den direkten Nachbarmolekülen, aber keine<br />
Vorzugsrichtungen gibt. Physikalische Eigenschaften von Flüssigkeiten sind daher<br />
richtungsunabhängig ( - isotropes Verhalten - ). In Flüssigkristallen hingegen ist der Ordnungszustand<br />
besser als in isotropen Flüssigkeiten, aber schlechter als in Kristallen, denn es bricht beim Schmelzen<br />
flüssiger Kristalle zwar das Kristallgitter zusammen, die Moleküle behalten jedoch eine gewisse<br />
Vorzugsrichtung bei. Eigenschaften dieser Flüssigkristall-Phasen (auch Mesophasen genannt) sind<br />
daher richtungsabhängig ( - anisotropes Verhalten - ). Dieses Verhalten tritt bei formanisotropen<br />
Molekülen wie z.B. stäbchenförmigen Molekülen auf. Stäbchenförmige und steife Makromoleküle<br />
erleiden keinen Verlust ihrer Form durch Rotation um Bindungen. Ein Modell dafür sind<br />
Baumstämme auf einem See.<br />
Wird ein Polymer <strong>aus</strong> kettensteifen <strong>Makromolekülen</strong> z.B. beim Verspinnen durch eine Düse<br />
gepresst, kommt es im Schergefälle zu einer weiteren parallelen Ausrichtung der steifen,<br />
stäbchenförmigen Molekülsegmente (s. Abb. 52). Das Ergebnis dieses Fließorientierungsprozesses<br />
104
ist eine makroskopische Orientierung, die z.B. im Bruchbild eines LCP-Prüfstabs gut zu erkennen ist<br />
(s. Abb. 53). Spritzgegossene Teile <strong>aus</strong> LCP haben in Abhängigkeit von der Fließrichtung der<br />
Polymerschmelze unterschiedliche mechanische Eigenschaften.<br />
Abb. 52: Fließorientierung eines flüssigkristallinen Polymers in einer Düse<br />
Abb. 53: Bruchbild eines LCP-Prüfstabs<br />
105
Im Folgenden sind einige Grundstrukturen aufgeführt, die aufgrund ihrer stäbchenförmigen, steifen<br />
Struktur in der Lage sind, Mesophasen zu bilden (R = Alkyl, Alkoxyl u.a.):<br />
R R<br />
R R<br />
Symbolisiert man diese stäbchenförmigen Strukturelemente, die sogenannten Mesogene, durch ein<br />
Kästchen innerhalb eines Makromoleküls, so ergeben sich fast spielerisch verschiedene<br />
Anordnungsmöglichkeiten:<br />
Obwohl die wissenschaftliche Erforschung aller dieser Systeme in vollem Gange ist, liegen<br />
Schwerpunkte bei LC-Hauptkettenpolymeren mit linear angeordneten Mesogenen. Zwei Beispiele<br />
sollen auftretende Probleme erläutern:<br />
R<br />
R<br />
106<br />
O<br />
O<br />
O<br />
N<br />
H<br />
R<br />
LC - Hauptkettenpolymer<br />
LC - Seitenkettenpolymer
Poly(1,4-phenylenterephthalamid) (Handelsname Kevlar ® ) durch Polykondensation <strong>aus</strong> p-<br />
Phenylendiamin und Terephthalsäuredichlorid (Abb. 54).<br />
Abb. 54: Bildung des Poly(1,4-phenylenterephthalamids) in einer Polykondensation von<br />
O<br />
p-Phenylendiamin und Terephthalsäuredichlorid<br />
Die treibende Kraft bei Schmelz- und Lösevorgängen ist der eintretende Entropiegewinn (die<br />
"Unordnung" nimmt zu). Ein solcher Energiegewinn muss bei LC-Polymeren dieser Art gering sein,<br />
da die steifen Mesogene kaum Bewegungsfreiheitsgrade beim Zusammenbruch des Kristallverbandes<br />
erfahren. Kevlar ® und ähnliche LC-Polymere verkohlen unter Zersetzung und sind weitestgehend<br />
unlöslich. Hierdurch wird ihre Verarbeitung insbesondere im industriell technischen Maßstab<br />
erheblich erschwert. Kevlar ® gehört zu den lyotropen LC-Polymeren, d.h. seine<br />
Flüssigkristallstruktur wird in Lösung erhalten; als Lösemittel ist hierbei konzentrierte Schwefelsäure<br />
nötig.<br />
O<br />
Cl Cl<br />
- Poly(1,4-phenylenterephthalester) durch Polykondensation von Hydrochinon und<br />
Terephthalsäure (Abb. 55)<br />
H 2N NH 2<br />
Abb. 55: Bildung des Poly(1,4-phenylenterephthalesters) durch Polykondensation von<br />
Hydrochinon und Terephthalsäure<br />
+<br />
(Die Klasse der aromatischen Polyamide wird auch als Aramide bezeichnet)<br />
HO OH +<br />
O<br />
HO<br />
OH<br />
O<br />
- 2 HCl<br />
- H 2O<br />
+ H 2O<br />
107<br />
O<br />
O<br />
O<br />
N<br />
H<br />
O<br />
O<br />
N<br />
H<br />
O<br />
n<br />
n
Auch dieses Polymer ist sehr schwer löslich und zersetzt sich vor dem Aufschmelzen. Thermotrope<br />
LC-Polymere, d.h. LCPs, deren Mesophase <strong>aus</strong> der Schmelze zugänglich ist, lassen sich durch<br />
solche Strukturvariationen erhalten, die zu einem Entropiegewinn beim Schmelzen führen. Dies<br />
wurde bei den folgenden Beispielen erreicht, indem Copolymere gebildet wurden, die<br />
a) nicht lineare Kettenelemente<br />
oder<br />
b) flexible Ketten in bzw. an der Hauptkette<br />
enthalten.<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
(CH 2 ) n CH 3<br />
Flüssigkristalline Polymere haben mechanische Eigenschaften, die das Niveau von Stahl erreichen<br />
können, und werden genutzt wegen ihrer geringeren Dichte und hohen Wärmeform- sowie<br />
Lösemittel-Beständigkeit. Sie werden für einige hochwertige Elektronikbauteile, als Verstärkungs-<br />
fasern in der Reifen- und Flugzeugindustrie oder auch für kugelfeste Westen verwendet.<br />
Es handelt sich jedoch um durchweg teure Produkte, deren richtungsabhängige Eigenschaften z.B. für<br />
die Anwendung als optische Speicherelemente (LC-Seitenkettenpolymere) notwendig sind, für die<br />
Faseranwendung zumindest nicht stören, jedoch für manche andere Anwendungen hinderlich sind.<br />
O<br />
108<br />
O<br />
O (CH 2 ) m<br />
n<br />
O<br />
O<br />
O<br />
p
8.2.5. Verbundwerkstoffe<br />
Als Verbundwerkstoffe oder Composites werden im allgemeinen alle Werkstoffe bezeichnet, die <strong>aus</strong><br />
einer Kombination von mindestens einer unschmelzbaren Komponente mit einem oder mehreren<br />
verarbeitbaren Polymeren bestehen und deren Eigenschaften die der Einzelkomponenten übertreffen.<br />
Im engeren Sinne handelt es sich um <strong>Kunststoffe</strong>, in die faser- oder pulverförmige Materialien<br />
eingebettet sind. Man spricht von einem "gefüllten" oder "armierten" Kunststoff. Die Polymermatrix<br />
kann <strong>aus</strong> Duromeren oder Thermoplasten bestehen. Die eingebetteten Materialien wirken<br />
verstärkend auf die Polymermatrix und bestehen häufig <strong>aus</strong> Glas, Kohlenstoff oder Aramid, wobei<br />
die Verstärkung mit Fasern am bedeutendsten ist (Abb. 57). Die erzielte Verstärkung wirkt sich<br />
insbesondere vorteilhaft auf so wichtige Eigenschaften wie Steifigkeit, mechanische Festigkeit,<br />
Wärmeformbeständigkeit und Dimensionsstabilität <strong>aus</strong>.<br />
Abb. 56: Aufbau eines Faserverbundwerkstoffes<br />
Polymermatrix <strong>aus</strong><br />
Duromeren wie z.B.<br />
ungesättigte Polyester<br />
(s. Kap. 6.2)<br />
Epoxidharze (s. Kap. 6.4.2)<br />
oder<br />
30-80%<br />
Thermoplasten wie z.B.<br />
Polypropylen (s. Kap. 3.1)<br />
Polybutylenterephthalat<br />
(s. Kap. 8.2.3)<br />
F<br />
A<br />
S<br />
E<br />
R<br />
V<br />
E<br />
R<br />
B<br />
U<br />
N<br />
D<br />
Verstärkungsfaser <strong>aus</strong><br />
Glas<br />
oder<br />
Kohlenstoff<br />
20-70% (s. Kap. 8.2.1)<br />
oder<br />
Aramid<br />
(s. Kap. 8.2.4)<br />
Glasfasern in glasfaserverstärkten <strong>Kunststoffe</strong>n (GFK) können in verschiedensten Formen<br />
eingesetzt werden. Armierungen von Thermoplasten mit Kurzglasfasern (0,5 mm x 9 - 14 µm)<br />
führen zu spritzguss- und extrudierbaren Verbundwerkstoffen (Abb. 58). Endlos-Glasfasern in<br />
Polyesterharzen ergeben hochbelastbare Elemente für den B<strong>aus</strong>ektor, wobei sie den Spannbeton<br />
109
substituieren können und dabei Vorteile aufgrund ihrer Leichtigkeit und Korrosions- sowie<br />
Witterungsbeständigkeit zeigen. Beispielsweise wurden in Düsseldorf einige Fußgänger- und eine<br />
Autobahnbrücke mit dieser Technologie gebaut. Weiterhin werden zu Matten und Geweben<br />
verarbeitete Glasfasern zur Verstärkung eingesetzt (Abb. 59). Als ein Anwendungsbeispiel zeigt die<br />
Abbildung 60 einen Polyurethanschaum (s. Kapitel 6.4.1.2.), der mit Endlos-Glasfasermatten<br />
verstärkt z.B. für Autositze geeignet ist.<br />
In Abbildung 60 wird noch ein Beispiel für einen Verbundwerkstoff mit pulverförmiger Armierung<br />
gegeben. Die gezeigten Stützisolatoren bestehen <strong>aus</strong> quarzmehlgefülltem Epoxidharz (s. Kapitel<br />
6.4.2.), das mit Säureanhydriden vernetzt wurde.<br />
Abb. 57: Spritzgussteile <strong>aus</strong> kurzglasfaserverstärktem Polybutylenterephthalat (Pocan ® ,<br />
s. Kapitel 8.2.3.)<br />
a) Bügeleisengehäuse<br />
<strong>aus</strong> glasfaserverstärktem,<br />
flammgeschützem Pocan ® :<br />
gute Oberflächenqualität,<br />
wärmeformbeständig und<br />
farbstabil, gute Wärme-<br />
isolation<br />
b) Lampenfassungen <strong>aus</strong><br />
glasfaserverstärktem Pocan ® :<br />
temperaturbeständig,<br />
maßhaltig<br />
110
Abb. 58: Glasfasermatte<br />
Abb. 59: Stützisolatoren <strong>aus</strong> quarzmehlgefülltem Lekutherm ® (Epoxidharz)<br />
für Spannungen zwischen 5 und 110 kV<br />
111
Während Verbundwerkstoffe mit kugelförmigen Füllstoffen isotrope Eigenschaften (s. Kapitel<br />
8.2.4.) zeigen, ist dies in der Regel bei Faserverbundwerkstoffen nicht der Fall. Abbildung 61 zeigt<br />
ein Beispiel eines kurzglasfasergefüllten Duromers, das nach einer Presstechnik verarbeitet wurde.<br />
Die Glasfasern haben keine deutliche Vorzugsrichtung, so dass sich der entsprechende Werkstoff<br />
weitgehend isotrop verhalten sollte.<br />
Abb. 61: Raster-Elektronenmikroskop-Aufnahme der Bruchstelle eines glasfaserverstärkten,<br />
ungesättigten Polyesterharzes (s. Kapitel 6.2.)<br />
Schon bei spritzgegossenen Thermoplasten erhalten die Kurzglasfasern in der Düse eine gewisse<br />
Orientierung (ähnlich Abb. 52, Kapitel 8.2.4.).<br />
112
In Hochleistungsverbundwerkstoffen (HLV) mit Endlosfasern tritt natürlich eine deutliche<br />
Anisotropie auf, indem die außerordentlichen mechanischen Eigenschaften nur in Faserrichtung,<br />
nicht aber senkrecht dazu auftreten. Beim Einsatz z.B. als Spannglieder ist dies nicht störend, da die<br />
Festigkeit auch nur in Faserrichtung benötigt wird. In flächigen Bauteilen treten jedoch meist<br />
mehrachsige Belastungen auf. Zur Lösung dieses Problems fügt man mehrere unidirektionale<br />
Schichten, unter bestimmten Winkeln gegeneinander versetzt, zu einem Schichtlaminat zusammen<br />
(s. Abb. 62). In diesem mitteln sich die Anisotropien jeder Einzelschicht quasi her<strong>aus</strong>.<br />
113
Abb. 62: Aufbau-Schema von flächigen Hochleistungsverbundwerkstoffen<br />
<strong>aus</strong> mehreren Lagen unidirektionaler Schichten<br />
Unidirektionale<br />
Schicht (Band)<br />
- stark vergrößert -<br />
Stapelung<br />
(Gewebe)<br />
Diese Bauweise findet man besonders bei den Kohlenstoffaser-verstärkten <strong>Kunststoffe</strong>n (CFK). Die<br />
Verarbeitung dieser Hochleistungsverbundwerkstoffe wird durch Verwendung sogenannter "Pre-<br />
pregs" vereinfacht. Der Name soll darauf hinweisen, dass es sich dabei um ein mit einem Harzfilm<br />
"vorimprägniertes" Faserband von 100 bis 200 Einzelfasern handelt. Die erhaltenen dünnwandigen,<br />
noch reaktionsfähigen und klebrigen Halbzeuge werden z.B. im Flugzeugbau verwendet.<br />
Abb. 63: Seitenleitwerk des Airbus A 340 <strong>aus</strong> einem Hochleistungsverbundwerkstoff unter<br />
Verwendung von Kohlenstofffaser-Gewebe-Prepregs.<br />
114<br />
Faserrichtung<br />
0°<br />
45°<br />
90°<br />
45°<br />
0°<br />
45°<br />
90°<br />
45°<br />
0°<br />
0<br />
Schichtlaminat<br />
90°
In diesem Kapitel wurde eine besondere Strukturvariation, jene durch Zugabe von<br />
Verstärkungsfasern oder pulverförmigen Füllstoffen, beschrieben. Dabei wurde auf eine mehr<br />
phänomenologische Beschreibung Wert gelegt. Für die Qualität eines Verbundwerkstoffes ist dabei<br />
im wahrsten Sinne des Wortes die Verbundhaftung zwischen Matrix und Verstärkungsmaterial von<br />
<strong>aus</strong>schlaggebender Bedeutung. Die Vorgänge in dieser Grenzschicht sind deshalb Gegenstand großen<br />
Forschungsinteresses.<br />
8.2.6. Kunststoff-Membranen für die Hämodialyse<br />
Das große Gebiet der Kunststoffanwendung in der Medizin, zu dem Kunststoff-Implantate wie z.B.<br />
Hüftgelenke <strong>aus</strong> kohlenstoffaserverstärkten <strong>Kunststoffe</strong>n (s. Kapitel 8.2.5.), Prothesen sowie<br />
sterilisierbare, hygienische Einwegartikel gehören, kann hier des Umfanges wegen nicht behandelt<br />
werden. Als ein Beispiel <strong>aus</strong> der medizinischen Anwendung soll eine extracorporal, d.h. außerhalb<br />
des Körpers angewendete Kunststoff-Membran zur Blutreinigung beschrieben werden. Diese<br />
Entwicklung passt gut zum Oberthema - neue <strong>Kunststoffe</strong> durch Variation der Molekülstruktur - da<br />
für die zu beschreibende Anwendung eine Tertiärstruktur mit definierten Porendurchmessern von<br />
wenigen Nanometern zu fordern ist. Doch zunächst zur Aufgabenstellung:<br />
Unsere Nieren filtrieren kontinuierlich "Abfallstoffe" unseres Stoffwechsels (u.a. Harnstoff) und<br />
körperfremde Stoffe (z.B. nichtresorbierte Arzneimittel) <strong>aus</strong> unserem Blut her<strong>aus</strong>. Dies geschieht in<br />
den Nieren an mikroporösen, semipermeablen Membranen, die die relativ kleinen Abfallstoffe in den<br />
Urin passieren lassen, die großen wichtigen Moleküle wie Blutkörperchen und Blutplättchen, jedoch<br />
zurückhalten. Bei Versagen der Nierenfunktion kann das Patientenleben nur durch ein Spenderorgan<br />
oder durch eine sogenannte "künstliche Niere" gerettet werden. Bei dieser "künstlichen Niere"<br />
handelt es sich um ein Dialysegerät, an das der Patient an jedem zweiten oder dritten Tag zur<br />
Blutreinigung angeschlossen werden muss. Das Kernstück dieser Dialysatoren sind ebenfalls Mem-<br />
branen. Überwiegend werden noch Membranen auf Cellulosebasis verwendet, die jedoch hinsichtlich<br />
ihrer Trennleistung und Blutverträglichkeit nicht optimal sind.<br />
115
Es wurde deshalb eine neue Membran entwickelt, die <strong>aus</strong> einem Blockcopolymer besteht, das <strong>aus</strong><br />
Polycarbonat (s. Kapitel 6.2.) und Polyethylenoxid (s. Kapitel 6.4.1.) aufgebaut ist. Das Copolymer<br />
vereint die mechanische Festigkeit des Polycarbonats mit der Durchlässigkeit des hydrophilen<br />
Polyethylenoxids und wird so zu einem idealen Membranmaterial.<br />
Der mikroskopische Aufbau dieser neuen Membran zur Hämodialyse <strong>aus</strong> polymeren Hohlfasern<br />
wird in Abbildung 64 gezeigt. Abbildung 65 zeigt den Aufbau eines Hohlfaser-Membran-Moduls.<br />
Abb. 64: Raster-Elektronen-Mikroskop-Aufnahme einer einzelnen polymeren Hohlfaser (links)<br />
und deren Membranstruktur bei mittlerer (Mitte) und starker Vergrößerung (rechts).<br />
Abb. 65: Aufbau eines Hohlfaser-Membran-Moduls<br />
a) schematisch b) aufgeschnittenes Modul mit <strong>aus</strong>tretenden Fasern<br />
116
Aus einer Arterie wird dem Dialyse-Patienten Blut entnommen und in dem in Abbildung 65<br />
gezeigten M odul über die Hohlfaser-Membran geleitet, deren mikroskopisch kleine Poren alle<br />
Stoffwechselschlacken <strong>aus</strong> dem Blut passieren lassen. Auf der anderen Seite der Membran wird die<br />
sogenannte Dialyse-Flüssigkeit vorbeigepumpt. Es geschieht nun folgendes: Da die schädlichen<br />
Stoffe im Blut danach streben, in der Dialyseflüssigkeit die gleiche Konzentration zu erreichen wie<br />
im Blut, durchdringen sie die Membran und diffundieren in die Dialyseflüssigkeit, mit der sie dann<br />
ähnlich wie Abfallstoffe im Urin, weggespült werden. Zusätzlich zu dieser Osmose treibt der etwas<br />
höhere Druck des Blutes auch Wasser und die darin gelösten Schadstoffe durch die Membran<br />
hindurch (Ultrafiltration).<br />
Mit dem neuartigen Membranmaterial werden bessere Reinigungsquoten insbesondere bei<br />
mittelgroßen Schadstoffmolekülen, die ein besonderes Problem darstellen, erreicht. Die<br />
Biokompatibilität ist gegenüber den herkömmlichen Cellulose-Materialien deutlich verbessert.<br />
117
8.3 Neue Anwendungen mit „alten“ Polymeren<br />
Als Superabsorbierende Polymerisate (SAP) bezeichnet man Verbindungen, die das Vielfache<br />
ihres Eigengewichtes an Wasser speichern können. Sie bestehen <strong>aus</strong> schwach vernetzten<br />
Polyacrylsäuren, die zu etwa 70% als Natriumsalz vorliegen.<br />
COONa<br />
COO H<br />
CO ONa COONa COONa CO OH COO Na COONa<br />
O<br />
O<br />
O O<br />
COONa COONa CO OH COONa CO ONa<br />
Derartige Polyacrylsäuresalze lassen sich beispielsweise durch Polymerisation von Acrylsäure in<br />
Gegenwart geringer Mengen (ca. 1 bis 2 Gew.-%, bezogen auf Acrylsäure) an Vernetzern, wie z.<br />
B. Glykoldiacrylat oder Divinylbenzol, herstellen. Die vernetzte polymere Carbonsäure wird<br />
dann zu 70% mit NaOH neutralisiert, getrocknet, gemahlen und auf eine Korngröße im Bereich<br />
von 100 bis 850 µm gesiebt. Zur Vermeidung des sog. „Gel-blocking“-Effektes werden die<br />
fertigen SAP-Teilchen noch einer speziellen Vernetzungsreaktion an ihrer Oberfläche unterzogen.<br />
Die auf diese Weise erhaltenen Superabsorber sind praktisch farblose Pulver. Sie finden in der<br />
Medizin als superabsorbierende Pflaster für die trockene Wundheilung Anwendung. In der<br />
Landwirtschaft werden Superabsorber-Granulate zur Speicherung von Regenwasser in ariden<br />
Gebieten eingesetzt. Ein weiteres Verwendungsgebiet ist die Abdichtung von Elektrokabeln, um<br />
Kurzschlüsse zu verhindern, die durch Eindringen von Wasser als Folge einer mechanischen<br />
Beschädigung der Kabelummantelung entstehen können. Das größte Einsatzgebiet für SAPs liegt<br />
allerdings auf dem Hygienesektor mit einem weltweiten Absatz von ca. 1 Million Tonnen im<br />
Jahre 1999. Ca. 95% der weltweiten SAP-Produktion finden dabei Verwendung bei der<br />
Herstellung von Babywindeln, Inkontinenzprodukten und Artikeln für die Damenhygiene.<br />
118<br />
COONa
Mit einem Gramm Superabsorber kann man 500 bis 1.000 ml destilliertes Wasser zu einem Gel<br />
erstarren lassen oder anders <strong>aus</strong>gedrückt: mit einem Gramm Superabsorber kann man die<br />
fünfhundert- bis t<strong>aus</strong>endfache Menge an Wasser binden. Da SAPs aufgrund ihrer Struktur einen<br />
sehr hohen Gehalt an –COO - - und Na + -Ionen aufweisen, bestimmt die Differenz zwischen der<br />
Ionenkonzentration innerhalb eines superabsorbierenden Polymeren und der das Polymere<br />
umgebenden wässrigen Lösung die Höhe des vorhandenen osmotischen Drucks. Dieser<br />
osmotische Druck befähigt das superabsorbierende Polymerisat zur Absorption von großen<br />
Wassermengen. Außerdem haben auch die hydrophilen –COOH- und –COONa-Gruppen der<br />
SAPs eine starke Affinität zum Wasser, was ebenfalls mit zu dessen schneller Absorption<br />
beiträgt. Resultierend dar<strong>aus</strong> sollten SAPs unbegrenzte Wassermengen aufnehmen bis die<br />
Ionenkonzentration innerhalb und außerhalb der Moleküle gleich ist. Um aber die Absorption von<br />
Wasser bis zu einem gewünschten Niveau zu regulieren, muss ein SAP-Molekül mit einer<br />
spezifischen Kautschukelastizität <strong>aus</strong>gestattet sein, welche es durch den Grad seiner Vernetzung<br />
erhält. Die Kautschukelastizität eines Polymeren steigt mit seiner Vernetzungsdichte an. Als<br />
Folge davon erreicht die Absorptionskapazität eines gegebenen SAP’s sein Maximum wenn seine<br />
Kautschukelastizität mit seiner Aufnahmekraft für Wasser im Gleichgewicht ist.<br />
Die Einsatzmengen von Superabsorbern in modernen Babywindeln liegen zwischen 12 und 15 g<br />
pro Windel. Dabei wird das SAP-Granulat in ca. derselben Menge an Zellstoff gleichmäßig<br />
verteilt. Dieser sog. Absorptionskern ist das zentrale Bauteil einer Windel. Durch die großen<br />
SAP-Mengen kann somit der Anteil an voluminösem Zellstoff reduziert werden, was die<br />
Konstruktion extrem dünner Windeln erlaubt. Im Vergleich zu destilliertem Wasser absorbieren<br />
die SAPs ca. nur 1/10 der entsprechenden Mengen an Urin oder physiologischer Kochsalzlösung<br />
(0,9% NaCl).<br />
Der Grund für diese Tatsache liegt darin, dass diese wässrigen Lösungen zusätzliche positiv<br />
geladene Ionen enthalten, die mit zunehmender Konzentration die negativen Ladungen der<br />
Carboxylatgruppen besser abschirmen („Elektrolyteffekt“). Dadurch wird die Abstoßung der<br />
Polymerketten untereinander geringer und damit auch das Bestreben, Wasser aufzunehmen.<br />
119
Außerdem ist auch der vorhandene osmotische Druck niedriger. Daher kann man mit einem<br />
Gramm Superabsorber "nur" ca. 50 bis 100 ml physiologische Kochsalzlösung in ein Gel<br />
überführen.<br />
Der Superabsorber lässt sich problemlos <strong>aus</strong> Windeln isolieren und für Experimente einsetzen!<br />
9. Physikalische Untersuchungsmethoden<br />
Am Ende dieser Ausführungen bleibt die Frage, wie man zu derartigen Aussagen über die<br />
Eigenschaften der <strong>Kunststoffe</strong> und zu einem Einblick in ihren Aufbau <strong>aus</strong> <strong>Makromolekülen</strong> kommt.<br />
Dabei hilft dem Chemiker die Physik.<br />
Das Instrumentarium, mit dem diese Aufgaben gelöst werden, ist eindrucksvoll: Aus den Messungen<br />
des Elastizitätsmoduls und der Schwingungsdämpfung als Funktion der Temperatur kann auf den<br />
Einfluss spezieller Atomgruppierungen auf die Kettenbeweglichkeit und Konformation geschlossen<br />
werden.<br />
Durch Infrarot-Spektren werden Schwingungen einzelner Atomgruppen aufgezeigt. Die<br />
Magnetische Kernresonanzspektroskopie macht Aussagen über den Bindungszustand und die<br />
räumliche Umgebung bestimmter Atome. Dielektrische Messungen lassen Rückschlüsse nicht nur<br />
auf die Eignung der <strong>Kunststoffe</strong> zu Isolierzwecken, sondern auch auf den Bewegungsmechanismus<br />
einzelner Molekülabschnitte zu. Die Dilatometrie gestattet die kinetische Verfolgung der<br />
Polymerisationen, die Differentialthermoanalyse liefert Angaben über Umwandlungspunkte, wie<br />
auch die Refraktometrie und die Kalorimetrie. Mit der Röntgenanalyse werden Kristallstrukturen<br />
und andere Ordnungszustände in Polymeren untersucht, mit dem Elektronenmikroskop ihre<br />
Morphologie.<br />
Eine ganze Gruppe von Methoden dient zur Erforschung des Lösungszustandes der Polymeren und<br />
der Ermittlung von Daten über Molekulargewichte, Molekül<strong>aus</strong>dehnung, Verzweigungen und<br />
120
spezifischen Wechselwirkungen zwischen Lösemitteln und Polymeren. Hierher gehören<br />
Osmometrie, Viskosimetrie, Lichtstreu-Experimente und Untersuchungen mittels Ultrazentrifuge.<br />
121
10. Wiederverwertung von <strong>Kunststoffe</strong>n<br />
Höherer Wohlstand führt zu steigender Produktion und zu einem vermehrten Verbrauch von Gütern.<br />
Damit entsteht letztlich auch mehr Abfall, dessen Entsorgung allen Industrienationen große<br />
Schwierigkeiten bereitet. Die bestehenden Entsorgungswege reichen schon heute nicht mehr <strong>aus</strong>, alle<br />
Probleme befriedigend zu lösen. Sie müssen früher oder später völlig versagen, wenn nicht neue<br />
Wege gefunden werden, die Abfallentsorgung in der Zukunft diesen negativen Rand-erscheinungen<br />
unserer Wohlstandsgesellschaft anzupassen.<br />
Wohlstand ist sinnlos ohne eine intakte Umwelt. Deshalb ist ihre Erhaltung wichtigstes Ziel, nicht<br />
nur für die Bevölkerung, sondern auch für die Industrie, die die technischen Lösungen dafür<br />
erarbeiten muss. Dem Verbraucher ist vornehmlich die H<strong>aus</strong>müll-Problematik gegenwärtig. Es wird<br />
häufig übersehen, dass der gesamte Kunststoffanteil im H<strong>aus</strong>müll zur Zeit bei maximal 7% liegt.<br />
Weitere Abfälle entstehen bei der kunststofferzeugenden und -verarbeitenden Industrie.<br />
Es ist sicherlich ein Versäumnis unserer Industrie-Gesellschaft, die Vorteile zu nutzen, die sich <strong>aus</strong><br />
technischen Weiterentwicklungen ergeben, ohne sich aber genügend darum zu kümmern, was mit<br />
<strong>aus</strong>rangierten Wirtschaftsgütern und den Abfällen bei ihrer Erzeugung geschieht. Auch die<br />
<strong>Kunststoffe</strong>rzeuger und -verarbeiter haben diesem Thema in der Vergangenheit zu wenig<br />
Aufmerksamkeit geschenkt. Gerade in den letzten Jahren wurde jedoch viel dazugelernt.<br />
Es hat sich heute schon weitgehend die Erkenntnis durchgesetzt, dass in einer ganzheitlichen<br />
Betrachtung nicht nur Herstellung und Gebrauch von <strong>Kunststoffe</strong>rzeugnissen, sondern auch die<br />
umweltgerechte Wiederverwertung oder Entsorgung berücksichtigt werden müssen. Hinzu kommt<br />
ein elementares wirtschaftliches Interesse. Kunststoffabfälle sind eben kein Müll im herkömmlichen<br />
Sinne, sondern vielfach wichtige Rohstoffe, die natürliche Ressourcen schonen können. Die<br />
Dynamik dieser Entwicklung ist daran zu erkennen, dass es heute bereits über 160 Firmen in<br />
Deutschland gibt, die sich mit Kunststoff-Recycling beschäftigen. In der "Entwicklungsgesellschaft<br />
122
für die Wiederverwertung von <strong>Kunststoffe</strong>n m.b.H." (kurz: EWK) bilden Bayer, BASF und Hoechst<br />
gemeinsam eine "Drehscheibe für vorhandenes Know-how" bilden. Ende 1989 wurde vom<br />
europäischen Kunststoffhersteller-Verband das "Plastics Waste Management Institute" (kurz:<br />
PWMI) mit Sitz in Brüssel gegründet.<br />
Das gegenwärtige Entsorgungskonzept besteht konkret <strong>aus</strong> folgenden Elementen:<br />
1. Verringerung des Materialeinsatzes<br />
Für die Entwicklung von Kunststoffanwendungen ist die Minimierung des Materialeinsatzes eine<br />
grundsätzliche Zielvorgabe. Dadurch können die Vorteile der <strong>Kunststoffe</strong> gegenüber anderen<br />
Werkstoffen noch besser genutzt werden. Moderne Techniken - wie Computer Aided Engineering -<br />
sind u.a. auch deshalb entwickelt worden, um immer mehr an die Leistungsgrenzen der <strong>Kunststoffe</strong><br />
herangehen zu können, d.h. mit immer weniger Materialverbrauch die geforderten Funktionen zu<br />
erfüllen. Der Wettbewerb unter den Werkstoffen, auch unter den <strong>Kunststoffe</strong>n selbst, ist die<br />
treibende Kraft, die diesen Prozess auch in der Zukunft in Gang hält. Weniger Materialeinsatz aber<br />
bedeutet auch Ressourcenschonung und weniger Umweltbelastung.<br />
2. Stoffliche Verwertung (Materialrecycling)<br />
a) von Produktionsabfällen<br />
Gängige Praxis zur Abfallvermeidung bei der Herstellung von Kunststoffartikeln ist das<br />
innerbetriebliche Materialrecycling. Darüber hin<strong>aus</strong> werden Produktionsabfälle auch durch<br />
darauf spezialisierte Unternehmen außerhalb der Produktionsbetriebe verwertet.<br />
Zum Beispiel verarbeitet die Firma Janßen und Angenendt, Krefeld, heute schon über<br />
5000 jato thermoplastische Produktionsabfälle von Bayer und von Bayer-Kunden. Diese<br />
Firma stellt <strong>aus</strong> hochwertigen Rohstoffen Produkte mit Qualitätszertifikat her. Dabei hat<br />
sie sich auf weitgehend sortenreine Kunststoffabfälle konzentriert und kann deshalb dem<br />
Markt Regranulate anbieten, die sich für Kunstsstoffartikel mit etwas geringeren<br />
Qualitätsanforderungen eignen.<br />
123
) gebrauchter Teile<br />
Für das Materialrecycling gilt allgemein das Prinzip, dass die Wiederverwertung am<br />
einfachsten und damit auch am wirtschaftlichsten ist, wenn die <strong>Kunststoffe</strong> sortenrein<br />
getrennt sind. Die hierfür nötige "Ordnungswirtschaft" ist leider, insbesondere beim<br />
H<strong>aus</strong>müll noch unzureichend organisiert.<br />
Besonders im Automobilbau arbeitet man deshalb an recyclinggerechten Konstruktionen, die<br />
das Ausbauen von Kunststoffteilen erleichtern sollen. Eine zusätzliche Materialco-dierung<br />
ermöglicht dann nach dem Ausbau eine sortenreine Trennung. Das gibt den<br />
Aufbereitungsfirmen eine breitere Materialbasis.<br />
Das Materialrecycling von <strong>aus</strong>gedienten Folien, Flaschen und Säcken ist schon gut<br />
etabliert.<br />
Wichtig ist, dass für jedes Regenerat auch ein aufnahmefähiger Markt vorhanden sein bzw.<br />
entwickelt werden muss. An dieser Stelle ist auch weiterhin Kreativität gefordert.<br />
Minderwertige Produkte sind nämlich oft nur Scheinlösungen, da sie durch vorzeitigen<br />
Verschleiß häufiger ersetzt werden müssen. Es kann deshalb kein Zweifel daran bestehen,<br />
dass für anspruchsvolle Anwendungen nur hochwertige Originalwerkstoffe eingesetzt<br />
werden sollten. Denn nur hiermit ist gewährleistet, dass umfassende Qualitätssicherung,<br />
Einhaltung enger Spezifikationen und minimaler Materialeinsatz realisierbar sind.<br />
3. Thermische Verwertung ("Energie-Recycling")<br />
Eine weitere wichtige Verwertungsschiene für Kunststoffabfälle ist die Nutzung ihres<br />
Energieinhaltes, der vergleichbar mit dem von Erdöl ist. Das bedeutet: <strong>Kunststoffe</strong> sind hochwertige<br />
Energieträger (s. Abb. 66).<br />
124
Abb. 66: Energieinhalt von Kunststoffabfällen<br />
10 200 kcal 11 000 kcal 4 800 kcal<br />
1 kg Heizöl<br />
1 kg Kunststoffabfall<br />
z.B.<br />
Polyolefine<br />
125<br />
1 kg<br />
Braun<br />
kohle<br />
Das sogenannte "Energie-Recycling" stellt in entsprechend <strong>aus</strong>gelegten Anlagen einen<br />
umweltgerechten Entsorgungsweg dar, der neben dem Materialrecycling schnellstens weiter<br />
<strong>aus</strong>gebaut werden muss. Moderne Müllheizkraftwerke mit der erforderlichen Rauchgasreinigung<br />
gehören nach dem Maßstab der TA Luft zu den saubersten Verbrennungsanlagen, die es in<br />
Deutschland gibt. Mit dieser Technik ist neben der Wiederfreisetzung gespeicherter Energie eine<br />
beträchtliche Volumenreduktion der zu entsorgenden Abfälle gewährleistet. Das spart knappen<br />
Deponieraum. Schließlich stellt die zu deponierende Schlacke <strong>aus</strong> der Verbrennung eine geringere<br />
Umweltbelastung dar als der unverbrannte Abfall. Ebenso müssen die Abfälle <strong>aus</strong> der Rauchgas-<br />
Wäsche und -Entstaubung umweltgerecht entsorgt werden.<br />
Würde in Deutschland der gesamte H<strong>aus</strong>müll in Müllheizkraftwerken energetisch verwendet,<br />
entstünden ca. 7 Milliarden kWh Strom. Das entspricht ungefähr zwei 600-MW-Kraftwerken auf<br />
Basis fossiler Brennstoffe. Der Energieinhalt der <strong>Kunststoffe</strong> kann also zur Ressourcenschonung<br />
genutzt werden.<br />
4. Chemische Verwertung<br />
Unter chemischem Recycling versteht man die Rückführung von Kunststoffabfällen in Chemie-Roh-<br />
stoffe. Hierfür sind verschiedene Verfahren bekannt, die sich aber z.T. noch in der Entwicklungs-<br />
phase befinden und deren Wirtschaftlichkeit noch nicht abschließend bewertet werden kann.
Man kann die verschiedenen Methoden des chemischen Recyclings nach Art der<br />
"Aufschlußreaktion", wie folgt, einteilen:<br />
- Hydrolyse<br />
- Alkoholyse<br />
- Pyrolyse<br />
- Hydrierung<br />
Bei der Alkoholyse z.B. von Polyurethanen oder Polyestern entstehen Polyole als Regenerate.<br />
Bereits heute realisiert ist die Verwendung von gut standardisierten Regenerat-Polyolen in der<br />
amerikanischen Polyurethan-Hartschaumindustrie. Man gewinnt jährlich <strong>aus</strong> diesen Abfällen ca.<br />
27 000 t Polyole. Bayer vermarktet in den USA Systeme und Know-how für die Herstellung von<br />
Hartschaumstoffen <strong>aus</strong> solchen "Abfall"-Esterpolyolen. In den USA werden auch sortenreine<br />
Polyethylenterephthalat-Abfälle <strong>aus</strong> Getränkeflaschen und Röntgenfilmen durch Alkoholyse<br />
gespalten.<br />
Welche Kriterien müssen also für die Entscheidung zugunsten eines klassischen Materials bzw.<br />
zugunsten eines <strong>Kunststoffe</strong>s herangezogen werden?<br />
Die Entscheidung, für ein bestimmtes Bauteil einen "klassischen" Werkstoff oder einen Kunststoff<br />
zu verwenden, hängt heute nicht nur von der wirtschaftlichen Gesamtbewertung, sondern auch von<br />
der Berücksichtigung von Ressourcenschonung und Umweltbelastung ab. Die notwendige<br />
ganzheitliche Betrachtung muss den gesamten Energieaufwand von der Herstellung über den<br />
Gebrauch bis zur Entsorgung des Bauteils umfassen. Diese Bilanz kann immer nur von Fall zu Fall<br />
und nicht p<strong>aus</strong>chal aufgestellt werden. Dafür zwei Beispiele:<br />
Eine im Jahre 1987 aufgestellte ganzheitliche Betrachtung für Kunststoffverpackungen zeigt, dass<br />
der Ersatz aller <strong>Kunststoffe</strong> in Verpackungen durch Papier, Glas oder Metall eine ganze Reihe von<br />
Nachteilen brächte:<br />
- Anstieg des Materialverbrauchs auf über 400%<br />
- Verdoppelung des Abfallvolumens<br />
126
- Verdoppelung des Energieverbrauchs und der dar<strong>aus</strong> resultierenden Umweltbelastung<br />
- Anstieg der Kosten auf über 200%<br />
Die langjährigen, erfolgreichen Bemühungen, Materialverbrauch sowie Gewicht und Volumen bei<br />
Packmitteln laufend zu reduzieren, wären bei einfachem Ersatz durch klassische Materialien in<br />
sinnloser Weise in Frage gestellt.<br />
Auch eine kritische Betrachtung der in der Automobilindustrie benutzten Materialien ergab eine<br />
vorteilhafte Ökobilanz für <strong>Kunststoffe</strong>: Die unbestrittene Tatsache der niedrigeren Herstellungs-<br />
kosten einfach geformter Bauteile <strong>aus</strong> <strong>Kunststoffe</strong>n im Vergleich zu Stahl geht Hand in Hand mit<br />
bisher nicht sichtbaren "ökologischen Nebenkosten". So wird der enorme Energieaufwand bei der<br />
Erzeugung von Stahl <strong>aus</strong> Kohle und Erz, verglichen mit dem sehr viel niedrigeren Energieaufwand zur<br />
Herstellung von <strong>Kunststoffe</strong>n, im allgemeinen nicht unter ökologischen Gesichtspunkten betrachtet.<br />
Während der Lebensdauer des Fahrzeuges bringt der konstruktiv sinnvolle Einsatz von <strong>Kunststoffe</strong>n<br />
deutliche Gewichtsvorteile und führt dadurch zur Verringerung des Treibstoffverbrauchs, die bei<br />
einer angenommenen Fahrstrecke von 100.000 km bereits dem Gesamtgewicht des Fahrzeuges<br />
entspricht. Dar<strong>aus</strong> ergibt sich, dass der akkumulierte Energieverbrauch für die Herstellung und das<br />
Betreiben eines Kraftfahrzeuges bei Verwendung von <strong>Kunststoffe</strong>n deutlich geringer ist als bei<br />
metallischen Werkstoffen. Bis zu diesem Punkt der Betrachtung ist eine Wiederverwertung des<br />
Kunststoffs noch nicht einmal berücksichtigt.<br />
Die Kunststoffteile können jetzt entweder für das Materialrecycling <strong>aus</strong>gebaut oder aber der<br />
energetischen Verwertung zugeführt werden. Beide Wege schonen unsere Ressourcen.<br />
127
11. VERSUCHSTEIL<br />
Versuch Nr. 1: Orientierbarkeit von <strong>Makromolekülen</strong><br />
Versuchsdurchführung:<br />
a) Ein Gummiband (am besten ein "Einweckgummi") wird bei Zimmertemperatur (kontrolliert<br />
durch Anlegen des Stückes an die temperaturempfindliche Stirn) rasch hintereinander und<br />
kräftig gedehnt. Durch erneutes Anlegen an die Stirn stellt man eine deutliche Temperatur<br />
erhöhung fest. Bei Entspannung nimmt das Stück wieder seine ursprüngliche Länge ein und<br />
zeigt wieder nur Zimmertemperatur an. Dieses Experiment lässt sich beliebig oft wiederholen.<br />
Aufgrund der neuen Transportbestimmungen ist die Beschaffung von flüssigem Stickstoff äußerst<br />
schwierig. Dennoch soll hier ein weiteres Experiment beschrieben werden:<br />
b) Das Band wird wiederum stark gereckt, mit einem geeigneten Gegenstand gespannt und in<br />
flüssigen Stickstoff getaucht. Das gedehnte Band behält seine Länge bei, auch wenn nun die<br />
Spannung aufgehoben wird. Wird das Band wieder erwärmt, so zieht es sich wieder auf seine<br />
alte Länge zusammen. Auch das lässt sich beliebig oft wiederholen.<br />
Achtung: Berührung mit flüssigem Stickstoff vermeiden!<br />
Entsorgung : Gummiband: Wiederverwenden oder H<strong>aus</strong>müll (Entsorgungssatz E 3), flüssigen<br />
Stickstoff → im Dewar-Gefäß verdampfen lassen<br />
Erklärungen:<br />
Gummibänder werden <strong>aus</strong> Naturkautschuk hergestellt, der im wesentlichen <strong>aus</strong> fadenförmigem cis-<br />
Polyisopren besteht (s. Abb. 14, Seite 40). Die Moleküle liegen wirr durcheinander, sind unpolar<br />
und völlig amorph. Durch Einwirkung von Zug und Druck erfolgt eine molekulare Orientierung in<br />
eine bevorzugte Richtung. Die Parallellagerung der Moleküle vergrößert den Ordnungszustand und<br />
verkleinert die Entropie. Aufgrund des "Gough-Joule-Effektes" wird bei der Orientierung<br />
128
"Kristallisationswärme" erzeugt. Der gedehnte hochmolekulare Körper besitzt eine etwas geringere<br />
spezifische Wärme als der ungedehnte.<br />
Die eingetretene entropieelastische Verformung wird im orientierten Körper die ursprüngliche<br />
Verknäuelung wieder herzustellen suchen. Wird also die Belastung aufgehoben, so schrumpft das<br />
Kautschukteil auf seine Anfangslänge, die Moleküle verknäueln sich und das Material ist wieder<br />
amorph. Dabei wird "Schmelzwärme" verbraucht. Zum Beweis seien zwei Röntgenaufnahmen einer<br />
ungedehnten und einer gedehnten Kautschukprobe aufgeführt.<br />
Abb. 67: a) Diagramm von ungedehntem, b) Faserdiagramm von gedehntem<br />
nicht gefrorenem Kautschuk Kautschuk<br />
Hier<strong>aus</strong> ist zu erkennen, dass es beim gedehnten Kautschuk zu einer Parallelorientierung (die aber<br />
nicht vollständig ist!) der kristallinen Bereiche (Texturbildung) und unter Umständen zu einer<br />
Vergrößerung der Kristalle gekommen ist. Darauf deuten die im Röntgenbild zu findenden<br />
äquatorialen Reflexe und manchmal Sicheln hin.<br />
Wird das gespannte Gummiband stark abgekühlt, so werden die Kettenbewegungen der<br />
Makromoleküle "eingefroren". Auch nach Entlastung bleiben die <strong>aus</strong>gerichteten Moleküle in einem<br />
Zustand des Zwanges, das Kautschukteil behält seine neue Länge. Erst bei Zufuhr von Wärme,<br />
129
wenn die Molekülbewegung gesteigert und der Spannungszustand überwunden wird, geht der Faden<br />
in seine ursprüngliche Länge zurück. Es liegt dann wieder der regellose, amorphe Zustand vor.<br />
130
Versuch Nr. 2: Kaltverstreckbarkeit von <strong>Makromolekülen</strong><br />
Versuchsdurchführung:<br />
Ein Perlonfaden, unverstreckt, so wie er heißflüssig als "mono-file" <strong>aus</strong> der Spinndüse kam, wird<br />
gereckt und an die Stirn gelegt. Man fühlt ebenfalls Temperaturerhöhung (freigewordene<br />
Kristallisationswärme!). Beim Entspannen bleibt die neue Länge auch bei Raumtemperatur erhalten.<br />
Man legt ihn auf eine über 100 o C heiße Wärmeplatte; er büsst einen Teil seiner Länge ein.<br />
Entsorgung : Perlonfaden: H<strong>aus</strong>müll (Entsorgungssatz E 3)<br />
Erklärungen:<br />
Unter "Kaltverstreckbarkeit" versteht man die durch Zugreckung bei Raumtemperatur eintretende,<br />
bleibende Dehnung eines linearen Hochpolymeren mit polaren Gruppen. Sie ist ein Charakteristikum<br />
für fadenförmige Polyamide und Polyurethane, die um das 2- bis 5-fache ihrer Länge gestreckt<br />
werden können. Dabei erfolgt eine erhebliche Steigerung der mechanischen Festigkeit.<br />
Lineares Polyamid ist polar. In ungerecktem Zustand liegen seine Moleküle wie beim Kautschuk<br />
durcheinander verknäuelt vor. Beim Strecken erfolgt eine Orientierung der Molekülketten in<br />
Längsrichtung. Der Grad der Kristallinität nimmt zu; Kristallisationswärme wird frei. Beim<br />
Entlasten behält der Faden im Gegensatz zum Kautschuk seine neue Länge bei; er ist<br />
"kaltverstreckbar".<br />
Der Grund für dieses Phänomen liegt in einer während des Reckens entstandenen Neben-<br />
valenzverknüpfung in Form von Wasserstoffbrücken-Bindungen zwischen den polaren CO- und<br />
NH-Gruppen benachbarter Fadenmoleküle (vergl. Abb. 13).<br />
Unter Einfluss stärkerer Erwärmung allerdings wird diese Quasivernetzung durch die gesteigerte<br />
Molekülbewegung aufgehoben; der alte Zustand der Unordung tritt wieder ein, der Faden schrumpft.<br />
131
Versuch Nr. 3: Kalthärtung eines ungesättigten Polyesterharzes<br />
Versuchsdurchführung:<br />
In einem 200 ml-Becherglas oder Pappbecher mischt man unter gutem Rühren in 50 g<br />
Roskydal K 27 (Polyesterharz in Styrol gelöst, ca. 70 %ige Lösung) 1,5 g BPO<br />
(Benzoylperoxid) ein!<br />
Anschließend wird diese Mischung - nach eventueller Formgebung - sich selbst überlassen.<br />
Bei obiger Katalysator-Dosierung beträgt die Zeit bis zur beginnenden Verfestigung ungefähr<br />
10, die gesamte Aushärtezeit etwa 20 min.<br />
Zur Beachtung:<br />
a) Roskydal K 27 ist verschlossen, kühl, trocken und vor Licht geschützt aufzubewahren. Es<br />
enthält Styrol; bei seiner Verarbeitung sind die entsprechenden Vorsichtsmaßregeln zu<br />
beachten.<br />
b) Beim Umgang mit Peroxiden muss eine Schutzbrille getragen werden!<br />
c) Im Abzug arbeiten!<br />
d) Dieser Versuch darf nicht von Schülern <strong>aus</strong>geführt werden!<br />
Entsorgung : kalt gehärtetes Polyesterharz: H<strong>aus</strong>müll (Entsorgungssatz E 3)<br />
Erklärungen:<br />
Die Harzkomponente ist ein ungesättigter Polyester. Die ungesättigten Polyester sind meist<br />
Mischkondensate von gesättigten und ungesättigten Dicarbonsäuren (z.B. Maleinsäure) mit<br />
2-wertigen Alkoholen (z.B. unterschiedliche Ethylenglykole). Sie kommen in Styrol gelöst in den<br />
Handel (vergl. S. 48, 49).<br />
Nach Zusatz eines Peroxid-Katalysators erfolgt Pfropf- und Copolymerisation des Styrols mit dem<br />
ungesättigten Polyester, wobei Gelierung und schließlich Aushärtung eintritt, d.h. die ungesättigten<br />
132
Gruppen des Polyesters reagieren mit denen des Lösemittels, wobei das Monomer Brücken<br />
zwischen den langkettigen Polyestermolekülen bildet. Es entsteht ein räumliches Netzwerk:<br />
vor der Härtung nach der Härtung<br />
: ungesättigter Polyester<br />
: Monomer, z.B. Styrol<br />
Der Stryolgehalt beträgt etwa 30 - 40%. Die Reaktionstemperaturen liegen normalerweise zwischen<br />
80 und 120 °C. Durch einen bereits im Roskydal K 27 enthaltenen Beschleuniger in Form eines<br />
tertiären, aromatischen Amins kann bei Raumtemperatur gehärtet werden (Kalthärtung).<br />
133
Versuch Nr. 4: "Nylon-Seil-Trick"<br />
(Grenzflächenkondensation von Sebacinsäuredichlorid und Hexamethylendiamin zum Nylon-6,10)<br />
Versuchsdurchführung:<br />
In 0,55 g (4,7 mmol) Hexamethylendiamin und 45 ml Wasser werden 0,4 g (10,0 mmol, 2 Plätzchen)<br />
festes NaOH in einem schmalen 100 ml Becherglas gelöst. Die Lösung wird mit wenig<br />
Phenolphthalein angefärbt. Anschließend überschichtet man mit einer Lösung von 1 ml (4,7 mmol)<br />
Sebacinsäuredichlorid in 20 ml Heptan. An der Trennfläche der beiden Lösungen entsteht eine dünne<br />
Haut, die man mit einer Pinzette langsam abheben und zu einem Faden <strong>aus</strong>ziehen kann. Der Faden<br />
lässt sich z.B. über einen Holzstab oder auch mit Hilfe einer kleinen Winde kontinuierlich aufspulen<br />
(Abb. 70). Wird das Polymer einige Male mit Wasser/Ethanol (50:50) gewaschen und bei 60 °C im<br />
Vakuumtrockenschrank getrocknet, so lässt sich seine Schmelztemperatur bei etwa 215 °C<br />
bestimmen.<br />
Vermischt man die beiden Phasen mit einem Glas- oder Holzstab durch intensives Rühren, so<br />
vergrößert sich die Grenzfläche derart, dass die Reaktion wesentlich schneller vor sich geht. Man<br />
erhält eine "Qualle" - ein stark Lösemittel haltiges Polymergebilde. Nach etwa einer halben Stunde<br />
entfärbt sich der Indikator vollkommen, was das Ende der Reaktion anzeigt. Das Diamin ist<br />
praktisch quantitativ in das Polyamid übergeführt worden und die Natronlauge wird durch die<br />
abgespaltene Salzsäure neutralisiert.<br />
134
Abb. 70: Grenzphasenkondensation zum Nylon-6,10 (vergl. auch Abb. 24)<br />
H Cl (CH )<br />
2 8<br />
N<br />
N<br />
H<br />
H<br />
O<br />
O<br />
(CH 2 ) 8<br />
O<br />
O<br />
Cl<br />
H<br />
N<br />
H<br />
H<br />
N<br />
H<br />
(CH2 ) 6 N<br />
Entsorgung : Polyamidfaden einschließlich Aufrollstab und Zweiphasengemisch: in gekennzeichneten<br />
Glasbehältern sammeln „organische Abfälle - halogen-haltig“ (Entsorgungssatz E 10),<br />
dann der Sondermüllbeseitigung zuführen (Entsorgungssatz E 3). Adresse zu erfragen bei der<br />
Kreis- oder Stadtverwaltung<br />
135<br />
- HCl<br />
H<br />
(CH 2 ) 6 N<br />
H<br />
O<br />
Cl (CH 2 ) 8<br />
O<br />
(CH 2 ) 8<br />
Sebacinsäurechlorid in Heptan<br />
O<br />
O<br />
Cl<br />
H<br />
N<br />
Hexamethylendiamin in H 2O und wenig Alkali<br />
H<br />
H<br />
N
Versuch Nr. 5: Schmelzspinnen von Polyamid<br />
Versuchsdurchführung:<br />
Polyamid-Pulver oder -Granulat wird im Reagenzglas vorsichtig über dem Bunsenbrenner<br />
aufgeschmolzen (bei Luftzutritt erfolgt leichte Gelb-Braun-Färbung, Kunststoff ist<br />
oxidationsanfällig; Rückbildung der Monomeren).<br />
Mit einem in die Schmelze getauchten Glasstab lassen sich zahlreiche seidenglänzende Fäden<br />
"spinnen", die anschließend verstreckt werden können.<br />
Entsorgung Schmelzspinnen Polyamid: H<strong>aus</strong>müll (Entsorgungssatz E 3)<br />
Die Kartuschen von "Schmelzklebepistolen" (Heimwerkermarkt) enthalten ein modifiziertes<br />
Polyamid. Durch die Modifizierung wird die Schmelztemperatur erniedrigt und die Klebrigkeit<br />
erhöht. Mit einer Schmelzklebepistole kann man das Schmelzspinnen praktisch ohne Abfall<br />
demonstrieren. Man schaltet die Klebepistole an und stellt sie auf ein Stück Papier ab, bis sich <strong>aus</strong><br />
der Schmelzdüse ein Polymertropfen gebildet hat, der dann auf das Papier abtropft. Entfernt man<br />
nun das Papier von der Düse, so bildet sich ein mindestens 2 m langer Faden. Übt man während<br />
dieses Vorgangs einen leichten Druck auf den "Abzugshahn" der Klebepistole <strong>aus</strong>, so kann man ganz<br />
leicht Fäden bis zu 100 m Länge und mehr spinnen.<br />
Entsorgung Schmelzgesponnenes Polyamid: H<strong>aus</strong>müll (Entsorgungssatz E 3)<br />
136
Versuch Nr. 6: a) "Nassspinnen" von Polyacrylnitril (PAN)<br />
b) Folienherstellung<br />
c) Trockenspinnen von Polyvinylacetat<br />
Materialien: 10 %ige Lösung von Polyacrylnitril in Dimethylacetamid<br />
Polyacrylnitril<br />
Dimethylacetamid (DMA)<br />
UHU ® nicht tropffrei!!!<br />
Der Lösevorgang von PAN ist wie bei allen hochmolekularen Stoffen grundsätzlich sehr viel<br />
langsamer als bei niedermolekularen. Die Ausgangsmaterialien PAN und DMA sind beigegeben, um<br />
das Löseverhalten hochmolekularer Stoffe zu demonstrieren.<br />
Versuchsdurchführung:<br />
a) Ein 500 ml-Becherglas, das zu 1/3 mit Wasser gefüllt ist, wird mit einer Hand leicht bewegt.<br />
Mit der anderen Hand gießt man einem dünnen, gleichmäßigen Strahl der 10 %igen PAN-<br />
Lösung in DMA. Dabei fällt ein Polyacrylnitrilfaden <strong>aus</strong>.<br />
Entsorgung Polyacrylnitrilfäden und die Lösungen: in gekennzeichneten Glasbehältern sammeln<br />
„organische Abfälle - halogenfrei“ (Entsorgungssatz E 10), dann der Sondermüllbeseitigung zuführen<br />
(Entsorgungssatz E 8). Adresse zu erfragen bei der Kreis- oder Stadtverwaltung<br />
Erklärungen:<br />
PAN ist in DMA löslich, in Wasser dagegen nicht. Wasser und DMA sind miteinander unbegrenzt<br />
mischbar. Beim Eingießen fällt daher PAN unter Ausbildung eines Fadens <strong>aus</strong>. Dieses "Nass-<br />
spinnen" (vgl. Abb. 26) wird auch heute noch technisch zur Herstellung von Polyacrylnitrilfäden<br />
angewandt. In zunehmendem Maße werden PAN-Fasern nach dem Trockenspinn-Verfahren<br />
hergestellt. Hierbei wird der Faden durch Verdunsten des Lösemittels <strong>aus</strong> der DMA-Lösung<br />
erhalten. Siehe UHU-Versuch weiter unten.<br />
137
) Ein kleiner Teil der PAN-Lösung wird auf einer Glasplatte <strong>aus</strong>gestrichen und diese zur<br />
Entfernung des Lösemittels in einen Trockenschrank gelegt. Nach etwa 5 Minuten lässt sich<br />
eine durchsichtige Folie von der Glasplatte abziehen.<br />
Entsorgung: Polyacrylnitrilfolie: H<strong>aus</strong>müll (Entsorgungssatz E 3)<br />
UHU ® ist eine 40%ige Lösung von Polyvinylacetat in Aceton/Methylacetat. Wegen der niedrigen<br />
Siedepunkte der Lösemittel lässt sich hier der Trockenspinnprozess sehr schön demonstrieren (bitte<br />
keinen tropffreien UHU verwenden!): Man gibt etwa ein halbes Gramm UHU auf ein Stück Papier.<br />
Mit einem zweiten Stück Papier kontaktiert man die Polymermasse. Durch Vergrößerung des<br />
Abstandes des Papiere bilden sich Fäden, die in Abhängigkeit vom Lösemittelgehalt unterschiedlich<br />
lang sind. Mit etwas Übung kann man problemlos Fäden von 2m Länge erzeugen.<br />
Entsorgung: UHU-Fäden und UHU-Reste:H<strong>aus</strong>müll (Entsorgungssatz E 3)<br />
138
Versuch Nr. 7: Redox-Fällungspolymerisation von Methacrylsäuremethylester<br />
Versuchsdurchführung:<br />
In einem 200 ml-Becherglas löst man in einer Mischung <strong>aus</strong><br />
60 ml Ethanol und 40 ml Wasser<br />
5 g Methacrylsäuremethylester (stabilisiert).<br />
Dazu gibt man unter Rühren mit einem Glasstab zuerst<br />
1 g Kaliumperoxodisulfat K2S2O8, gelöst in 10 ml Wasser (etwas anwärmen),<br />
und dann eine Lösung <strong>aus</strong><br />
1 g Natriumdisulfit Na2S2O5 und 10 ml Wasser.<br />
Die zuvor farblose, klare Lösung wird innerhalb einer Minute trübe und es fällt zunehmend<br />
Polymethacrylsäuremethylester <strong>aus</strong>. Man kann den Vorgang beschleunigen, indem man das<br />
Becherglas in heißes Wasser stellt und unter Rühren auf ca. 50 °C erhitzt. Nach etwa 30<br />
Minuten wird das Polymer durch Filtrieren abgetrennt, mit etwas Ethanol oder Wasser<br />
gewaschen und durch Abpressen zwischen Filterpapieren getrocknet. Ausbeute: ca. 2,5 g<br />
Polymerisat. Das erhaltene Polymerisat der nachstehenden Struktur lässt sich z.B. gut in<br />
Toluol (5 ml) lösen.<br />
Entsorgung : Polymer : H<strong>aus</strong>müll (Entsorgungssatz E3), Reste: in gekennzeichneten<br />
Glasbehältern sammeln „organische Abfälle – halogenfrei“ (E 10), dann der<br />
Sondermüllbeseitigung zuführen. (E 8)<br />
Erklärungen:<br />
H2 C<br />
CH 3<br />
O OCH 3 n<br />
139
Unter "Redox-Polymerisation" versteht man die zur Polymerisation eines Monomeren notwendige<br />
Aktivierung durch Kombination eines Oxidationsmittels mit einem Reduktionsmittel. Da Spuren von<br />
Schwermetallionen den Reaktionsablauf beschleunigen, sind mehrwertige Metalle in ihrer niedrigeren<br />
Oxidationsstufe (vor allem Eisen) als Reduktionsmittel besonders geeignet.<br />
Geeignete Systeme:<br />
Oxidation Reduktion<br />
H2O2<br />
140<br />
Sulfit oder Fe(II)-Salze<br />
Peroxodisulfate Hydrogensulfit und Disulfit<br />
Peroxide Thiosulfate oder Sulfinsäuren<br />
Chlorate Mercaptane<br />
Ein günstiges Aktivator-Redoxsystem für die Polymerisation von Acrylnitril ist z.B.<br />
Wasserstoffperoxid/Eisen(II)-ammoniumsulfat, für die Methacrylsäuremethylester das System<br />
Kaliumperoxodisulfat/Natriumdisulfit. Auch die Redox-Polymerisation ist im Grunde eine<br />
Radikalpolymerisation. Durch die Oxidation des Reduktionsmittels werden nach HABER und<br />
WILLSTAETTER Radikale gebildet. Folgenden Mechanismus formulierte z.B. KERN 1943 für das<br />
System Peroxide/Eisen(II)-Salze:<br />
1. + Fe2+ R O O R<br />
2.<br />
.<br />
R O<br />
+<br />
Styrol<br />
.<br />
R O + Fe3+ R O<br />
+<br />
Radikal Anion<br />
R<br />
O<br />
H2 C<br />
.<br />
CH<br />
Polymerisation (s. Kap. 6.3)<br />
usw.
Versuch Nr. 8: Copolymerisation von Methacrylsäuremethylester und Ethylenglykoldi-<br />
methacrylat<br />
Versuchsdurchführung:<br />
- wie Versuch Nr. 7, jedoch wird statt des Methacrylsäuremethylesters ein Gemisch <strong>aus</strong><br />
2,5 g Ethylenglykoldimethacrylat (Vernetzer) und<br />
2,5 g Methacrylsäuremethylester<br />
verwendet.<br />
Entsorgung : Polymer : H<strong>aus</strong>müll (Entsorgungssatz E3), Reste: in gekennzeichneten<br />
Glasbehältern sammeln „organische Abfälle – halogenfrei“ (E10), dann der<br />
Sondermüllbeseitigung zuführen. (E 8)<br />
Das erhaltene Polymerisat besteht praktisch <strong>aus</strong> einem einzigen stark vernetzten Makromolekül, das<br />
in keinem Lösemittel mehr gelöst werden kann (vgl. Kap. 3.1.2.):<br />
H2 C<br />
CH 3<br />
O OCH 3<br />
H<br />
2<br />
C<br />
CH 3<br />
H<br />
2<br />
C<br />
O OCH 3<br />
H2 C<br />
CH 3<br />
O O<br />
C<br />
H 2<br />
CH 2<br />
O O<br />
141<br />
CH 3<br />
H2 C<br />
H2 C<br />
CH 3<br />
O OCH 3<br />
CH 3<br />
O OCH 3
Versuch Nr. 9: Fotopolymerisation von Methacrylsäuremethylester<br />
Versuchsdurchführung:<br />
10,0 g Methacrylsäuremethylester werden mit 0,1 g Benzildimethylketal vermischt und in ein<br />
kleines Aluschälchen gegossen. Die Aluminiumschale wird in kurzem Abstand von oben mit<br />
einer Hg-Dampflampe bestrahlt, wobei in Abhängigkeit von der Strahlungsleistung innerhalb<br />
einiger Minuten die Polymerisation erfolgt. (Nach Beginn der Polymerisation steigt die<br />
Viskosität deutlich an, so dass man einen flachen Gegenstand wie bemaltes Papier auflegen und<br />
mit einer zweiten Schicht Methacrylsäuremethylester/Benzildimethylketol bedecken kann.<br />
Hierdurch wird der Gegenstand zwischen "Plexiglasscheiben" einpolymerisiert).<br />
Entsorgung : Polymer : H<strong>aus</strong>müll (Entsorgungssatz E 3)<br />
Erklärungen:<br />
Es handelt sich bei dieser Reaktion um eine radikalische Fotopolymerisation, die durch Radiale<br />
initiert wird, welche beim durch Belichten <strong>aus</strong>gelösten Zerfall des Fotoinitiators Benzildimethylketal<br />
entstehen. Das Benzildimethylketal zerfällt unter UV-Strahlung in einer sogenannten Norrish Typ I-<br />
Reaktion zum Benzyl- und Dimethoxybenzyl-Radikal. Letzteres reagiert unter Abspaltung eines<br />
Methylradikals weiter zum Benzoesäuremethylester:<br />
O<br />
OCH 3<br />
OCH 3<br />
.<br />
OCH 3<br />
OCH 3<br />
hν<br />
142<br />
.<br />
CH 3<br />
O<br />
.<br />
+ O<br />
+<br />
OCH 3<br />
OCH 3<br />
.<br />
OCH 3
143
Versuch Nr. 10: Vulkollan ® -Herstellung<br />
Chemikalien (vgl. Kap. 6.4.1.)<br />
100 g Desmophen 2000 ®<br />
18 g Desmodur 15 ®<br />
2 g 1,4-Butandiol<br />
Versuchsdurchführung:<br />
Die Desmophen ® -Komponente wird in einem mit Rührer <strong>aus</strong>gestatteten Becherglas (mit<br />
Schliffdeckel) im Vakuum bei 125 - 130 o C im Verlauf einer Stunde sorgfältig entwässert.<br />
Danach erst wird unter Rühren Desmodur ® zugegeben. Hierbei fällt die Temperatur auf ca.<br />
110 °C ab, steigt aber im Verlaufe der exothermen Reaktion wieder auf 125 - 130 °C<br />
selbständig an. Man wartet auf jeden Fall Temperaturkonstanz ab (ca. 15 Minuten); erst dann<br />
wird der Vernetzer (1,4-Butandiol) von Hand eingerührt. Die fertige Mischung hat eine<br />
Gießzeit von etwa 4 Minuten. Ihre Vernetzung nimmt bei 110 °C etwa 24 Stunden in<br />
Anspruch.<br />
Entsorgung : Vulkollan: H<strong>aus</strong>müll (Entsorgungssatz E 3)<br />
Anmerkung: Die Zugabe des Desmodur 15 ® , das Einrühren des Vernetzers und das evtl. Gießen des<br />
Reaktionsgemisches in Formen oder auf ebene Flächen muss im Abzug erfolgen, da bei den hohen<br />
Temperaturen Isocyanatdämpfe entweichen können. Bei allen Versuchen ist eine Schutzbrille zu<br />
tragen, beim Umgang mit Isocyanaten zusätzlich Schutzhandschuhe. Die Arbeiten mit Diisocyanaten<br />
erfordern einen gut ziehenden Abzug.<br />
Weitere Erklärungen zum Versuch werden in Kap. 6.4.1. gegeben.<br />
144
Versuch Nr. 11: Herstellung von Polyurethanschaum<br />
Chemikalien (vgl. Kap. 6.4.1.)<br />
50 g Desmodur 44 V20 ® (p,p´-Diisocyanatodiphenylmethan im Gemisch mit Isomeren<br />
und Homologen)<br />
33 g Desmophen ® /Aktivator-Gemisch<br />
Versuchsdurchführung:<br />
In ein 1-Ltr. Becherglas stellt man einen der Glaswandung angepaßten Polyethylenbeutel. In<br />
diesen Beutel gibt man zuerst 33 g Desmophen ® /Aktivator-Gemisch und dann 50 g<br />
Desmodur ® 44 V20. Diese Mischung wird mit einem Holzstab so lange gerührt, bis die<br />
eintretende Gasentwicklung den Beginn der Reaktion anzeigt. Dann überlässt man die<br />
Schaumbildung sich selbst. Man kann den Versuch natürlich auch direkt im Becherglas<br />
<strong>aus</strong>führen. Dann bereitet allerdings die Säuberung des Gefäßes Schwierigkeiten; denn beim<br />
Her<strong>aus</strong>drehen des erkalteten Produktes bleiben immer Schaumreste an den Wandungen des<br />
Becherglases kleben, die nur schwer zu entfernen sind (großer Verbrauch an Lösemittel).<br />
Entsorgung : Polyurethanschaum: H<strong>aus</strong>müll (Entsorgungssatz E 3)<br />
Anmerkung: Der Versuch muss so durchgeführt werden, dass kein Desmophen ® bzw. Desmodur ®<br />
auf die Haut gelangt. Sollte dies trotzdem geschehen, so ist sofort die betreffende Hautstelle unter<br />
fließendem Wasser intensiv abzuspülen.<br />
Erklärungen: siehe Kap. 6.4.1.<br />
145
Versuch Nr. 12: Kalthärtung eines Epoxidharzes<br />
Versuchsdurchführung:<br />
80 g Lekutherm E 320 ® (Epoxidharz <strong>aus</strong> "Bisphenol A" und Epichlorhydrin im Verhältnis 1:2,<br />
s. Abb. 39) werden in einem Pappbecher oder einer sauberen Blechdose mit 16 g eines<br />
Kalthärters (z.B. T 3, siehe unten) gut verrührt und dann - nach entsprechender Formgebung -<br />
sich selbst überlassen (im Abzug). Nach etwa 30 - 40 Minuten geliert (d.h. verfestigt) sich die<br />
Mischung unter kontinuierlichem Temperaturanstieg (exotherme Reaktion) bis auf ca. 230 °C.<br />
Entsorgung : Epoxidharz: H<strong>aus</strong>müll (Entsorgungssatz E 3)<br />
Erklärungen:<br />
Die Überführung der Epoxidharze in den duroplastischen Zustand erfolgt durch Zugabe von<br />
Härtungsmitteln (Härtern). Dies sind polyfunktionelle Verbindungen mit reaktionsfähigen<br />
Wasserstoffatomen oder Carbonsäureanhydride, die unter Polyaddition mit den Epoxidgruppen und<br />
sekundären OH-Gruppen reagieren und ohne Abspaltung von Nebenprodukten eine<br />
Molekülvergrößerung unter dreidimensionaler Vernetzung herbeiführen. Je nach der zur Anwendung<br />
gelangenden Temperatur unterscheidet man zwischen Heißhärtung und Kalthärtung. Die Wahl<br />
zwischen diesen beiden richtet sich nach den gewünschten Verarbeitungsbedingungen, vor allem aber<br />
nach den geforderten Eigenschaften der Endprodukte. Bei der Kalthärtung werden als Härter meist<br />
aliphatische (Poly)Amine oder (Poly)Amide benutzt, z.B.<br />
Triethylentetramin H2N-CH2-CH2-NH-CH2-CH2-NH-CH2-CH2-NH2<br />
Dipropylentriamin H2N-CH2-CH2-CH2-NH-CH2-CH2-CH2-NH2<br />
Pentaethylenhexamin H2N-(CH2-CH2-NH)4-CH2-CH2-NH2 (Kalthärter T3)<br />
Allgemeines Reaktionsschema (vergl. auch Abb. 40):<br />
146
Bei der Heißhärtung werden für die Vernetzung folgende Stoffe eingesetzt:<br />
z.B. Härter P: Phthalsäureanhydrid<br />
Härter H: Hexahydrophthalsäureanhydrid<br />
Allgemeines Reaktionsschema:<br />
147
Versuch Nr. 13: Thermischer Abbau von Polyvinylchlorid (PVC)<br />
Chemikalien: Polyvinylchlorid: 2 x 10 g Vestolit S 6058<br />
Versuchsdurchführung:<br />
Stabilisator: 0,4 (± 0,1) g 2-Phenylindol (Stabilisator I, Bayer)<br />
Indikator: Kongorot- oder Universalindikatorpapier<br />
10 g PVC-Pulver werden mit 0,4 g Phenylindol in einer Reibschale gut gemischt und in ein<br />
Reagenzglas gefüllt. Das zweite Reagenzglas füllt man mit 10 g reinem PVC-Pulver. Zu beiden<br />
Proben fügt man einen Streifen angefeuchtetes Indikatorpapier, und erhitzt in einem Heizbad<br />
auf 170 - 180 o C. Bei Erreichen der Zersetzungstemperatur beobachtet man:<br />
a) stabilisierte Probe und Indikatorpapier bleiben unverändert<br />
b) die andere Probe verfärbt sich, der Farbumschlag zeigt einen sauren pH-Bereich an.<br />
Entsorgung :Alle Reste: in gekennzeichneten Glasbehältern sammeln „organische Abfälle –<br />
halogenhaltig“ (E 10), dann der Sondermüllbeseitigung zuführen (E8). Adresse zu erfragen bei<br />
der Kreis- oder Stadtverwaltung<br />
Erklärungen:<br />
Unter den technisch verwendeten synthetischen Hochpolymeren nimmt PVC einen der ersten Plätze<br />
ein; gerade dieses Polymere zeigt aber in besonders auffälliger Weise Zersetzungserscheinungen, die<br />
bei Temperaturen oberhalb von ca. 100 o C bemerkbar werden. Unter Abspaltung nachweisbarer<br />
Mengen von Chlorwasserstoff entstehen Ketten mit konjugierten Doppelbindungen. Sie sind an der<br />
während der Zersetzung auftretenden Farbänderung (nach braunrot) zu erkennen.<br />
148
Die Ursache dieses Abbaues liegt in einem katalytischen Effekt von Eisenspuren. Durch Zugabe<br />
eines geeigneten Stabilisators kann die Zersetzung verhindert werden (Bindung der Eisenspuren).<br />
149
Versuch Nr. 14: Weichmachung von Polyvinylchlorid (PVC)<br />
Versuchsdurchführung:<br />
a) Polyvinylchlorid-Pulver wird auf eine Heizplatte (150 - 160 o C) gestreut und fest mit<br />
einer Metallplatte (z.B. Bügeleisen) angedrückt. Wenn überhaupt, so bildet sich ein<br />
harter, spröder, trüber Kunststoff-Film.<br />
b) Mischt man dagegen PVC-Pulver mit gleichen Teilen eines Weichmachers (z.B.<br />
Dioctylphthalat = DOP), gießt die erhaltene, dünne, weiße Flüssigkeit auf eine<br />
Heizplatte (110 o C) und drückt kurz mit einer Metallplatte an, so kann man kurz danach<br />
eine klare, geschmeidige Folie abziehen, die eine erhebliche Festigkeit aufweist und sich<br />
dehnen lässt.<br />
Entsorgung : Alle Reste: in gekennzeichneten Glasbehältern sammeln „organische Abfälle –<br />
halogenhaltig“ (E 10), dann der Sondermüllbeseitigung zuführen (E8) Adresse zu erfragen bei<br />
der Kreis- oder Stadtverwaltung<br />
Erklärungen:<br />
Die Atome des Polymeren sind durch starke "primäre" Bindungen verknüpft. Die Makromoleküle<br />
wiederum werden untereinander durch sogenannte Sekundärkräfte (s. Kap. 3.2.) zusammengehalten.<br />
In einem PVC-Molekül stellen die Chloratome stark polare Gruppen dar, welche die Anziehung<br />
zwischen den Molekülen verstärken; diese Anziehungskraft nimmt aber mit dem Abstand der<br />
Moleküle voneinander ab.<br />
Die weichmachende Wirkung durch das DOP beruht nun darauf, dass die zwischenmolekularen<br />
Kräfte geschwächt werden, das Molekül insgesamt also weicher und geschmeidiger wird.<br />
Ein wirksamer Weichmacher muss aber ebenfalls eine gewisse Polarität aufweisen, um zwar in der<br />
Lage zu sein, die zwischenmolekularen Kräfte des Polymerisates zu schwächen, aber gleichzeitig an<br />
deren Stelle ein System von Polymerisat-Weichmacher-Polymerisat-Wechselwirkungen herzustellen.<br />
150
Bei den polaren Gruppen der PVC-Weichmacher handelt es sich in den meisten Fällen um Ester-<br />
Gruppierungen. Weichmachung erzielt man durch Zusatz von Substanzen, die eine lösende oder<br />
quellende Wirkung auf das Polymere haben. Für PVC sind besonders geeignet Adipinsäureester,<br />
Phosphorsäureester, Phthalsäureester (z.B. DOP), Sulfonsäureester als sogenannte monomere<br />
Weichmacher oder auch Polymerisate wie z.B. Polybutadienacrylnitril- oder Ethylenvinylacetat-<br />
Copolymerisate als sogenannte Polymerweichmacher.<br />
151
Versuch Nr. 15: Herstellung von elektrisch selbstleitendem Polypyrrol<br />
Versuchsdurchführung:<br />
Reagenzien<br />
2 ml 6%ige FeCl3-Lösung in Wasser (1 g FeCl3 x 6H2O in 9 ml H2O oder 0,6 g FeCl3<br />
wasserfrei in 9,4 ml H2O)<br />
0,25 ml Pyrrol-iso-Propanol-Gemisch (1:1)<br />
In eine Kristallisierschale legt man ein Filterpapier (Durchmesser ca. 7 cm) und beträufelt es mit 2 ml<br />
6% Eisen-III-chloridlösung. Nachdem das Filterpapier vollständig benetzt ist, tropft man auf die<br />
Mitte des Filterpapiers 0,25 ml Pyrrol/iso-Propanol-Gemisch. Man beobachtet sofort eine<br />
Dunkelfärbung. Nach 10 - 15 Minuten nimmt man mit einer Pinzette das nun schwarze Filterpapier<br />
<strong>aus</strong> der Kristallisierschale und wäscht es gründlich mit Wasser. Nach dem Trocknen (mindestens 2<br />
Stunden) zeigt das Filterpapier einen Widerstand von 5 000 bis 10 000 Ω, gemessen mit einem<br />
Universalmessgerät durch Aufdrücken der Kontakte in einem Abstand von 1 cm. In Abhängigkeit<br />
von der Art des Filterpapiers kann die Leitfähigkeit auf das Zentrum oder auch auf nur eine Seite des<br />
Filterpapiers beschränkt sein.<br />
Vor der Behandlung hat das Filterpapier einen Widerstand von mindestens 10 10 Ω. Durch den<br />
Einbau des Polypyrrol reduziert sich der elektrische Widerstand also sehr stark.<br />
Die Trockenzeit kann durch Verwendung eines Trockenschrankes (nicht über 50°C) auf unter 30<br />
min. verkürzt werden. In einem Parallelversuch mit einem mit FeCl 3-Lösung getränkten Filterpapier<br />
sollte gezeigt werden, dass keine Artefakte gemessen werden.<br />
Entsorgung : Papierfilter mit Polypyrrol: H<strong>aus</strong>müll (Entsorgungssatz E3); überschüssige<br />
Eisen-III-chloridlösung: stark mit Wasser verdünnen 152 und in den Ausguss geben (E 1)
11.2. Inhaltsverzeichnis der verwendeten Chemikalien<br />
Bei der Durchführung der Versuche sind die Vorgaben der Schulbehörden streng zu<br />
berücksichtigen!<br />
Die Einstufung der Chemikalien entspricht der Gefahrstoff-Verordnung (GefStoffV) und der<br />
Mitteilung der Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe "Maximale<br />
Arbeitsplatzkonzentrationen und biologische Arbeitstoleranzwerte", her<strong>aus</strong>gegeben von der<br />
Deutschen Forschungsgemeinschaft. Da sich hier häufig Änderungen in den Einstufungen ergeben,<br />
werden diese als Extrablätter zum Manuskript geliefert. Soweit möglich, sind die Buchstaben der<br />
Gefahrensymbole, die R- und S-Sätze, die Einstufung nach der Verordnung für brennbare<br />
Flüssigkeiten (VbF) und die Wassergefährdungsklasse (WGK), angegeben.<br />
153
11.3. Gefahrensymbole und Gefahrenbezeichnungen<br />
Seit 1995 ist anstelle des Begriffs "mindergiftig" der Ausdruck "gesundheitsschädlich" vorge-<br />
schrieben.<br />
1.4. Hinweise auf die besonderen Gefahren (R-Sätze)<br />
R 1 In trockenem Zustand explosionsgefährlich<br />
R 2 Durch Schlag, Reibung, Feuer oder andere Zündquellen explosionsgefährlich<br />
R 3 Durch Schlag, Reibung, Feuer oder andere Zündquellen besonders xplosionsgefährlich<br />
R 4 Bildet hochempfindliche explosionsgefährliche Metallverbindungen<br />
R 5 Beim Erwärmen explosionsfähig<br />
R 6 Mit und ohne Luft explosionsfähig<br />
R 7 Kann Brand verursachen<br />
154
R 8 Feuergefahr bei Berührung mit brennbaren Stoffen<br />
R 9 Explosionsgefahr bei Mischung mit brennbaren Stoffen<br />
R 10 Entzündlich<br />
R 11 Leichtentzündlich<br />
R 12 Hochentzündlich<br />
R 13 Hochentzündliches Flüssiggas<br />
R 14 Reagiert heftig mit Wasser<br />
R 15 Reagiert mit Wasser unter Bildung leicht entzündlicher Gase<br />
R 15.1 Reagiert mit Säure unter Bildung leicht entzündlicher Gase<br />
R 16 Explosionsgefährlich in Mischung mit brandfördernden Stoffen<br />
R 17 Selbstentzündlich an der Luft<br />
R 18 Bei Gebrauch Bildung explosionsfähiger/leichtentzündlicher<br />
Dampf-Luft-Gemische möglich<br />
R 19 Kann explosionsfähige Peroxide bilden<br />
R 20 Gesundheitsschädlich beim Einatmen<br />
R 21 Gesundheitsschädlich bei Berührung mit der Haut<br />
R 22 Gesundheitsschädlich beim Verschlucken<br />
R 23 Giftig beim Einatmen<br />
R 24 Giftig bei Berührung mit der Haut<br />
R 25 Giftig beim Verschlucken<br />
R 26 Sehr giftig beim Einatmen<br />
R 27 Sehr giftig bei Berührung mit der Haut<br />
R 28 Sehr giftig beim Verschlucken<br />
R 29 Entwickelt bei Berührung mit Wasser giftige Gase<br />
R 30 Kann bei Gebrauch leicht entzündlich werden<br />
R 31 Entwickelt bei Berührung mit Säure giftige Gase<br />
R 31.1 Entwickelt bei Berührung mit Alkalien giftige Gase<br />
R 32 Entwickelt bei Berührung mit Säure sehr giftige Gase<br />
R 33 Gefahr kumulativer Wirkungen<br />
R 34 Verursacht Verätzungen<br />
R 35 Verursacht schwere Verätzungen<br />
R 36 Reizt die Augen<br />
R 37 Reizt die Atmungsorgane<br />
R 38 Reizt die Haut<br />
R 39 Ernste Gefahr irreversiblen Schadens<br />
R 40 Irreversibler Schaden möglich<br />
R 41 Gefahr ernster Augenschäden<br />
R 42 Sensibilisierung durch Einatmen möglich<br />
R 43 Sensibilisierung durch Hautkontakte möglich<br />
R 44 Explosionsgefahr bei Erhitzen unter Einschluss<br />
R 45 Kann Krebs erzeugen<br />
R 45.1 Kann Krebs erzeugen (Gefahrstoffverordnung Gruppe I)<br />
R 45.2 Kann Krebs erzeugen (Gefahrstoffverordnung Gruppe II)<br />
R 45.3 Kann Krebs erzeugen (Gefahrstoffverordnung Gruppe III)<br />
155
R 46 Kann vererbbare Schäden verursachen<br />
R 47 Kann Mißbildungen verursachen<br />
R 48 Gefahr ernster Gesundheitsschäden bei längerer Exposition<br />
R 49 Kann Krebs erzeugen beim Einatmen<br />
R 50 Sehr giftig für Wasserorganismen<br />
R 51 Giftig für Wasserorganismen<br />
R 52 Schädlich für Wasserorganismen<br />
R 53 Kann in Gewässern längerfristig schädliche Wirkung haben<br />
R 54 Giftig für Pflanzen<br />
R 55 Giftig für Tiere<br />
R 56 Giftig für Bodenorganismen<br />
R 57 Giftig für Bienen<br />
R 58 Kann längerfristig schädliche Wirkungen auf die Umwelt haben<br />
R 59 Gefährlich für die Ozonschicht<br />
156
11.5. Sicherheitsratschläge (S-Sätze)<br />
S 1 Unter Verschluss aufbewahren<br />
S 2 Darf nicht in die Hände von Kindern gelangen<br />
S 3 Kühl aufbewahren<br />
S 4 Von Wohnplätzen fernhalten<br />
S 5 Unter ... aufbewahren (geeignete Flüssigkeit ist vom Hersteller anzugeben)<br />
S 5.1 Unter Wasser aufbewahren<br />
S 5.2 Unter Petroleum aufbewahren<br />
S 6 Unter ... aufbewahren (inertes Gas ist vom Hersteller anzugeben)<br />
S 6.1 Unter Stickstoff aufbewahren<br />
S 6.2 Unter Argon aufbewahren<br />
S 6.3 Unter Kohlendioxid aufbewahren<br />
S 7 Behälter dicht geschlossen halten<br />
S 8 Behälter trocken halten<br />
S 9 Behälter an einem gut gelüfteten Ort aufbewahren<br />
S 12 Behälter nicht gasdicht verschließen<br />
S 13 Von Nahrungsmitteln, Getränken und Futtermitteln fernhalten<br />
S 14 Von ... fernhalten (inkompatible Substanzen sind vom Hersteller anzugeben)<br />
S 14.1 Von Reduktionsmitteln, Schwermetallverbindungen, Säuren und Alkalien fern halten<br />
S 14.2 Von oxidierenden und sauren Stoffen sowie Schwermetallverbindungen fernhalten<br />
S 14.3 Von Eisen fernhalten<br />
S 14.4 Von Wasser fernhalten<br />
S 14.5 Von Säuren fernhalten<br />
S 14.6 Von Laugen fernhalten<br />
S 14.7 Von Metallen fernhalten<br />
S 14.8 Von oxidierenden und sauren Stoffen fernhalten<br />
S 14.9 Von brennbaren, organischen Substanzen fernhalten<br />
S 14.10 Von Säuren, Reduktionsmitteln und brennbaren Materialien fernhalten<br />
S 14.11 Von brennbaren Substanzen fernhalten<br />
S 15 Vor Hitze schützen<br />
S 16 Von Zündquellen fernhalten - Nicht rauchen<br />
S 17 Von brennbaren Stoffen fernhalten<br />
S 18 Behälter mit Vorsicht öffnen und handhaben<br />
S 20 Bei der Arbeit nicht essen und trinken<br />
S 21 Bei der Arbeit nicht rauchen<br />
S 22 Staub nicht einatmen<br />
S 23 Gas/Rauch/Dampf/Aerosol nicht einatmen (geeignete Bezeichnungen<br />
sind vom Hersteller anzugeben)<br />
S 23.1 Gas nicht einatmen<br />
S 23.2 Dampf nicht einatmen<br />
S 23.3 Aerosol nicht einatmen<br />
S 23.4 Rauch nicht einatmen<br />
157
S 23.5 Dampf/Aerosol nicht einatmen<br />
S 24 Berührung mit der Haut vermeiden<br />
S 25 Berührung mit den Augen vermeiden<br />
S 26 Bei Berührung mit den Augen gründlich mit Wasser abspülen und Arzt konsultieren<br />
S 27 Beschmutzte, getränkte Kleidung sofort <strong>aus</strong>ziehen<br />
S 28 Bei Berührung mit der Haut sofort abwaschen mit viel ... (ist vom Hersteller<br />
anzugeben)<br />
S 28.1 Bei Berührung mit der Haut sofort abwaschen mit viel Wasser<br />
S 28.2 Bei Berührung mit der Haut sofort abwaschen mit viel Wasser und Seife<br />
S 28.3 Bei Berührung mit der Haut sofort abwaschen mit viel Wasser und Seife,<br />
möglichst auch mit Polyethylenglycol 400<br />
S 28.4 Bei Berührung mit der Haut sofort abwaschen mit viel Polyethylenglycol 300<br />
und Ethanol (2:1) und anschließend mit viel Wasser und Seife<br />
S 28.5 Bei Berührung mit der Haut sofort abwaschen mit viel Polyethylenglykol 400<br />
S 28.6 Bei Berührung mit der Haut sofort abwaschen mit viel Polyethylenglykol 400<br />
und anschließend Reinigung mit viel Wasser<br />
S 28.7 Bei Berührung mit der Haut sofort abwaschen mit viel Wasser und saurer Seife<br />
S 29 Nicht in die Kanalisation gelangen lassen<br />
S 30 Niemals Wasser hinzugießen<br />
S 33 Maßnahmen gegen elektrostatische Aufladungen treffen<br />
S 34 Schlag und Reibung vermeiden<br />
S 35 Abfälle und Behälter müssen in gesicherter Weise beseitigt werden<br />
S 35.1 Abfälle und Behälter dürfen erst nach Behandeln mit 2%iger Natronlauge<br />
beseitigt werden<br />
S 36 Bei der Arbeit geeignete Schutzkleidung tragen<br />
S 37 Geeignete Schutzhandschuhe tragen<br />
S 38 Bei unzureichender Belüftung Atemschutzgerät tragen<br />
S 39 Schutzbrille/Gesichtsschutz tragen<br />
S 40 Fußboden und verunreinigte Gegenstände mit ... reinigen (ist vom Hersteller<br />
anzugeben)<br />
S 40.1 Fußboden und verunreinigte Gegenstände mit Wasser reinigen<br />
S 41 Explosions- und Brandgase nicht einatmen<br />
S 42 Beim Räuchern/Versprühen geeignetes Atemschutzgerät anlegen (geeignete<br />
Bezeichnung(en) sind vom Hersteller anzugeben)<br />
S 43 Zum Löschen ... (ist vom Hersteller anzugeben) verwenden.<br />
Wenn Wasser die Gefahr erhöht, anfügen: Kein Wasser verwenden<br />
S 43.1 Zum Löschen Wasser verwenden<br />
S 43.2 Zum Löschen Wasser oder Pulverlöschmittel verwenden<br />
S 43.3 Zum Löschen Pulverlöschmittel, kein Wasser verwenden<br />
S 43.4 Zum Löschen Kohlendioxid, kein Wasser verwenden<br />
S 43.5 Zum Löschen Halone, kein Wasser verwenden<br />
S 43.6 Zum Löschen Sand, kein Wasser verwenden<br />
S 43.7 Zum Löschen Metallbrandpulver, kein Wasser verwenden<br />
S 43.8 Zum Löschen Sand, Kohlendioxid oder Pulverlöschmittel, kein Wasser verwenden<br />
158
S 44 Bei Unwohlsein ärztlichen Rat einholen (wenn möglich, dieses Etikett vorzeigen<br />
S 45 Bei Unfall oder Unwohlsein sofort Arzt zuziehen (wenn möglich, dieses Etikett<br />
vorzeigen<br />
S 46 Bei Verschlucken sofort ärztlichen Rat einholen und Verpackung oder Etikett<br />
vorzeigen<br />
S 47 Nicht bei Temperaturen über ... °C aufbewahren (ist vom Hersteller anzugeben)<br />
S 48 Feucht halten mit ... (geeignetes Mittel ist vom Hersteller anzugeben)<br />
S 48.1 Feucht halten mit Wasser<br />
S 49 Nur im Originalbehälter aufbewahren<br />
S 50 Nicht mischen mit ... (ist vom Hersteller anzugeben)<br />
S 50.1 Nicht mischen mit Säuren<br />
S 50.2 Nicht mischen mit Laugen<br />
S 50.3 Nicht mischen mit starken Säuren, starken Basen, Buntmetallen und deren Salze<br />
S 51 Nur in gut belüfteten Bereichen verwenden<br />
S 52 Nicht großflächig für Wohn- und Aufenthaltsräume zu verwenden<br />
S 53 Exposition vermeiden - vor Gebrauch besondere Anweisungen einholen<br />
S 54 Vor Ableiten in Kläranlagen Einwilligung der zuständigen Behörden einholen<br />
S 55 Vor Ableitung in die Kanalisation oder in Gewässer nach dem Stand der<br />
Technik behandeln<br />
S 56 Nicht in die Kanalisation oder die Umwelt ableiten, an genehmigte Sondermüllsammelstelle<br />
abgeben<br />
S 57 Durch geeigneten Einschluss Umweltverschmutzungen vermeiden<br />
S 58 Als gefährlichen Abfall entsorgen<br />
S 59 Informationen zur Wiederverwendung/Wiederverwertung beim Hersteller/<br />
Lieferanten erfragen<br />
S 60 Dieser Stoff und/oder sein Behälter sind als gefährlicher Abfall zu entsorgen<br />
Selbstverständlich können R- und S-Sätze auch in Kombination auftreten!<br />
Wassergefährdungsklasse<br />
Einstufungen<br />
WGK 0 Im Allgemeinen nicht gefährdende Stoffe<br />
WGK 1 Schwach wassergefährdende Stoffe<br />
WGK 2 Wassergefährdende Stoffe<br />
WGK 3 Stark wassergefährdende Stoffe<br />
Verordnung für brennbare Flüssigkeiten<br />
Einstufungen<br />
A I Flammpunkt < 21°C<br />
A II Flammpunkt 21 - 55°C<br />
159
A III Flammpunkt >55 - 100°C<br />
B Flammpunkt < 21°C, Flüssigkeiten, die oder deren brennbaren Bestandteile<br />
mit Wasser bei 15 °C beliebig mischbar sind.<br />
160
12. Weiterführende Literatur<br />
A) PRAKTIKUMS BÜCHER<br />
Wiskamp, V., M. Hörter, B. Köhler und B. Nau, „Abfallfreie Versuche zur Polymerchemie“<br />
26 (1992) 6, 232 ff<br />
.<br />
Braun, Cherdron, Kern, "Praktikum der makromolekularen organischen Chemie",<br />
3. Aufl., Alfred Hüthig Verl. 1979 (334 Seiten).<br />
Haenle, Gnauck, Harsch, "Praktikum der Kunststofftechnik",<br />
Carl Hanser Verl. 1972 (336 Seiten).<br />
R. Flügel, "<strong>Kunststoffe</strong>, Versuche in Loseblatt-Form", Phywe 1963.<br />
W. Sorensen, T. Campbell, "Präparative Methoden der Polymeren-Chemie",<br />
Verl. Chemie 1962 (323 Seiten).<br />
G. D´Alelio "Kunststoff-Praktikum", Carl Hanser Verlag 1952 (201 Seiten).<br />
Rau, "Kunststoff-Schule", Mappen mit Kunststoffproben und Erläuterungen, Pickardt Verlag.<br />
B) LEHRBÜCHER<br />
B. Vollmert, "Grundriss der makromolekularen Chemie", Band 1 - 5,<br />
E. Vollmert-Verl. 1985 (5 Taschenbücher von ca. 250 Seiten).<br />
H. Batzer, "Polymere Werkstoffe, Bd. I - Chemie und Physik", Thieme Verl. 1985 (734 Seiten).<br />
(Band II ("Technologie 1") und III ("Technologie 2") beschreiben u.a. die Verarbeitung und<br />
Modifizierung von Polymeren einschließlich Verbundwerkstoffe, Elastomere, Film- und<br />
Faserstoffe.)<br />
Elias, Vohwinkel, "Neue polymere Werkstoffe für die industrielle Anwendung - Struktur, Synthese,<br />
Eigenschaften, Verarbeitung", Carl Hanser Verl. 1983 (408 Seiten).<br />
Elias, "Makromoleküle, Struktur - Eigenschaften - Synthesen - Stoffe - Technologie",<br />
4. Aufl., Hüthig & Wepf Verl. 1981 (1097 Seiten).<br />
G. Menges, J. Thim, H. Kaufmann, "Lernprogramm Technologie der <strong>Kunststoffe</strong>",<br />
2. Aufl., Carl Hanser Verl. 1981 (218 Seiten).<br />
G. Menges, "Werkstoffkunde - <strong>Kunststoffe</strong>", 3. Aufl.,<br />
161
Carl Hanser Verl. 1990 (309 Seiten).<br />
162
Becker, Braun, "Kunststoff-Handbuch Bd. I - Chemie, Physik, Technologie",<br />
Carl Hanser Verl. 1990 (1089 Seiten).<br />
(Die 10 Folgebände beschäftigen sich mit einzelnen Stoffklassen.)<br />
H. Dominingh<strong>aus</strong>, "Die <strong>Kunststoffe</strong> und ihre Eigenschaften", 3. Aufl.,<br />
VDI Verl. 1988 (905 Seiten).<br />
Mair, Roth, "Elektrisch leitende <strong>Kunststoffe</strong>", 2. Ausgabe,<br />
Carl Hanser Verl. 1989 (569 Seiten).<br />
Houben-Weyl, "Methoden der Organischen Chemie", 4. Aufl., Bd. E 20<br />
Makromolekulare Stoffe / Teil 1 bis 3, Thieme Verl. 1987.<br />
J. Cowie, "Chemie und Physik der Polymeren", Verl. Chemie 1976 (321 Seiten).<br />
Hellerich, Harsch, Haenle, "Werkstoff-Führer <strong>Kunststoffe</strong>", 5. Aufl., Carl Hanser Verl. 1989.<br />
K. Biederbick, "<strong>Kunststoffe</strong> - kurz und bündig", 3. Aufl., Vogel Verl. 1974 (272 Seiten).<br />
H. Dominingh<strong>aus</strong>, "<strong>Kunststoffe</strong> Bd. I - Aufbau und Eigenschaften, Kunststoffsorten,<br />
Anwendungen", VDI Verl. 1972 (223 Seiten).<br />
C) ARTIKEL AUS FACHZEITS CHRIFTEN ZU S PEZIELLEN THEMEN<br />
Chemie in unserer Zeit:<br />
34 (2000) 276 B. Huckestein, Plesnivy, Th., „Möglichkeiten und Grenzen des<br />
Kunststoffrecycling“<br />
33 (1999) 279 A. Lendlein, „Polymere als Implantatwerkstoffe“<br />
32 (1998) 197 D. Paul, „Polymermembranen für die Stofftrennung“<br />
29 (1995) 260 A. Steinbüchel, „Mikrobielle und chemische Synthese von biologisch<br />
abbaubaren Polyestern<br />
28 (1994) 197 M. Aulbach, F. Kuber, „Metallocene – maßgeschneiderte Werkzeuge zur<br />
Herstellung von Polyolefinen“<br />
24 (1990) 135 D. Dieterich, "Polyurethane - nach 50 Jahren immer noch jung"<br />
Angewandte Chemie:<br />
102 (1990) 1302 P.M. Hergenrother, "Entwicklungsperspektiven für hochtemperaturbeständige<br />
Polymere"<br />
102 (1990) 1296 J. Economy, "Hochleistungsmaterialien - Trends und Möglichkeiten am Beispiel<br />
flüssigkristalliner Polymere"<br />
99 (1987) 840H. Finkelmann, "Flüssigkristalline Polymere"<br />
163
Nachrichten <strong>aus</strong> Chemie, Technik und Laboratorium:<br />
38 (1990) 333 "Verwertung von polymeren Abfallstoffen durch Pyrolyse"<br />
38 (1990) 23 "K wie Abfall"<br />
Spektrum der Wissenschaft:<br />
April 1988, 54 R.B. Kaner, A.B. MacDiarmid, "Elektrisch leitende <strong>Kunststoffe</strong>"<br />
Praxis der Naturwissenschaften - Chemie:<br />
39 (1990) 29 R. Becker, L. Preis, "Glasfasern als Verstärkungselemente in Hochleistungsverbundwerkstoffen<br />
mit Polymermatrix"<br />
38 (1989) 2 K. Großberger, A. Schleip, "Kleben im Alltag"<br />
37 (1988) 29 G. Streckert, R. Köntges, "Bestimmung der molaren Massen von Polymeren<br />
über Viskositätsmessungen" (mit Versuchsbeschreibung)<br />
164
13. Sachregister<br />
2<br />
2,2-Bis-(4-hydroxyphenyl)propan...............52, 53, 85<br />
2-Phasenmodell.......................................... 31, 33<br />
A<br />
Abax ater........................................................67<br />
ABS .....................................................105, 106<br />
Aggregatstruktur......................................... 14, 36<br />
AIBN.............................................................69<br />
amorph.............................................53, 132, 133<br />
anisotropes Verhalten.......................................108<br />
Asbest-Ersatz ...................................................64<br />
ataktisch ................................................... 18, 68<br />
Azo-bis-isobutyronitril.......................................69<br />
B<br />
Bakelit ...........................................................49<br />
Benzoylperoxid ..............................................135<br />
Bindungen ......................24, 32, 92, 104, 108, 151<br />
kovalente .............................................. 12, 24<br />
Bindungskräfte........................................... 24, 32<br />
Bisphenol A..................................................148<br />
Biuret....................................................... 80, 81<br />
BPO.......................................................69, 135<br />
C<br />
Carothers ........................................................55<br />
CFC............................................................100<br />
Copolymerisate ................................... 66, 68, 101<br />
Copolymerisate: ...............................................68<br />
D<br />
Dendrite..........................................................34<br />
Dibenzoylperoxid..............................................69<br />
Dispersionskräfte...............................................25<br />
Duromer ................................................... 38, 40<br />
Duroplast .................................................. 38, 40<br />
E<br />
Elastomer.............................................38, 40, 42<br />
Emulsionspolymerisation ............................. 69, 70<br />
Epoxidharze............................... 5, 72, 85, 86, 148<br />
F<br />
Fällungspolymerisation......................................70<br />
Faltblattstruktur................................................26<br />
Faserstruktur.........................................30, 31, 41<br />
FCKW..................................................... 82, 83<br />
Flammwidrigkeit ..............................................91<br />
Fransenmizelle ........................................... 28, 34<br />
Füllstoff .........................................................50<br />
G<br />
Galvanisierung .................................................91<br />
Gel .....................................................22, 23, 70<br />
Gelpunkt.........................................................23<br />
165<br />
Grenzflächenkondensation................................. 137<br />
gummielastisch................................................39<br />
Guttapercha.......................................5, 18, 42, 43<br />
H<br />
Hämodialyse........................................... 119, 120<br />
Hart-PVC .......................................................64<br />
Hartschaum................................................81, 82<br />
Härtung..........................................40, 50, 85, 88<br />
HDPE............................................................63<br />
Hexamethylendiisocyanat ...................................73<br />
HIPS.............................................................63<br />
Hohlfaser...................................................... 120<br />
Homopolymerisat .............................................20<br />
I<br />
Integralschaum.................................................81<br />
Ionomere ...................................................... 101<br />
isotaktisch..................................................18, 68<br />
isotropes Verhalten.......................................... 108<br />
K<br />
Kautschuk.............. 5, 42, 43, 63, 70, 133, 134, 161<br />
Kettenreaktion..................................................69<br />
Knäuel ...........................................................27<br />
Kohlenstoff-Glas ............................................ 100<br />
Kohlenstoff-Schaum ........................................ 100<br />
Konfiguration ....................................... 15, 17, 18<br />
Konformation ...........................................15, 125<br />
Konstitution......................................... 11, 15, 17<br />
Kopf-Kopf-Struktur......................................15, 16<br />
Kopf-Schwanz-Struktur......................................15<br />
Kristallite........................................29, 31, 32, 34<br />
Kristallzustand.................................................31<br />
Kunstfasern.......................................... 10, 30, 41<br />
Kunststoff....... 9, 10, 20, 31, 90, 102, 113, 130, 139<br />
L<br />
Latex .............................................................70<br />
LCP .............................................. 108, 109, 112<br />
Lösungspolymerisation.................................69, 70<br />
Lösungsspinnen ...............................................58<br />
M<br />
Makromolekül9, 14, 18, 19, 20, 22, 44, 55, 56, 83, 144<br />
Mesogene .............................................. 110, 111<br />
Mesophasen ........................................... 108, 110<br />
Mischpolymerisate.......................................19, 70<br />
Molekulargewicht ......12, 38, 42, 44, 45, 46, 63, 103<br />
Molekulargewichtsverteilung..........................45, 46<br />
Molekülformeln ...............................................46<br />
N<br />
Naturkautschuk ................................3, 14, 17, 132<br />
Novolake........................................................50
Ö<br />
Ökobilanz .....................................................131<br />
Oligomere................................................. 12, 50<br />
P<br />
Parakristallbereiche............................................33<br />
PC/ABS-Blend ..............................................105<br />
Perlpolymerisation ............................................71<br />
Phenol-Formaldehyd-Harz...................................49<br />
Phenoplast ......................................................49<br />
Fotopolymerisation .........................................145<br />
Plaste.............................................................10<br />
Poly(1,4-phenylenterephthalamid).......................111<br />
Poly(1,4-phenylenterephthalester)........................111<br />
Polyacetylen ....................................................97<br />
Polyacrylnitril.............. 41, 55, 64, 65, 99, 100, 140<br />
Polyaddition.........................5, 13, 46, 72, 83, 148<br />
Polyamid.................31, 59, 95, 108, 134, 137, 139<br />
Polyaryle .................................................. 92, 93<br />
Polybenzimidazol ....................................... 95, 96<br />
Polybutadien................................................5, 14<br />
Polybutylenterephthalat .............................107, 114<br />
Polycarbonat.............52, 53, 85, 105, 106, 107, 120<br />
Polyester.........5, 41, 48, 49, 53, 54, 76, 77, 85, 135<br />
ungesättigte .................................................86<br />
Polyethylen<br />
high density......................... 5, 7, 14, 35, 45, 62<br />
Polyharnstoff-RIM ............................................85<br />
Polyimid .................................................. 94, 95<br />
Polyisopren............................................... 17, 43<br />
all-trans-1,4 .................................................17<br />
Polykondensation5, 13, 32, 46, 48, 50, 52, 55, 56, 95,<br />
111<br />
Polymer14, 15, 22, 55, 92, 97, 98, 108, 112, 137, 141<br />
Legierung.............................................20, 104<br />
Polymer......................................................22<br />
Polymerisation5, 13, 16, 22, 23, 32, 46, 47, 55, 60, 61,<br />
67, 68, 69, 70, 71, 76, 97, 98, 99, 142, 145<br />
Polymerisation:................................................71<br />
Polymerisationsgrad .................................... 22, 44<br />
Polymethacrylsäuremethylester....................... 5, 141<br />
Polymethylmethacrylat................................. 66, 69<br />
Polypropylen ...............................7, 14, 19, 41, 71<br />
ataktisches...................................................19<br />
syndiotaktisches ...........................................19<br />
Polypyrrol................................................97, 152<br />
Polystal ® ...............................................114, 117<br />
Polystyrol................. 5, 14, 30, 46, 63, 70, 71, 105<br />
Polyterephthalsäureglykolester .............................48<br />
Polytetrafluorethylen..........................................67<br />
Polyurethan............................... 53, 73, 77, 79, 81<br />
kautschukelastisches ......................................77<br />
Polyvinylacetat.................................... 9, 140, 141<br />
Polyvinylalkohol..........................................9, 26<br />
Polyvinylcarbazol..............................................66<br />
Polyvinylchlorid...............5, 7, 64, 70, 71, 150, 151<br />
Polyvinylidenchlorid .........................................66<br />
Polyvinylpyrrolidon ..........................................65<br />
PPS......................................................... 93, 94<br />
PVC.......................64, 90, 99, 105, 150, 151, 152<br />
166<br />
Q<br />
Quellung ........................................................22<br />
R<br />
Recycling .............................................. 129, 130<br />
Redox-Polymerisation ..................................... 142<br />
Reppe ............................................................65<br />
Resol.............................................................50<br />
S<br />
SAN..............................................................63<br />
Schichtlaminat............................................... 117<br />
Schmelzspinnen ........................................57, 139<br />
Sekundärstruktur ................... 14, 15, 24, 26, 27, 36<br />
Sekundenkleber................................................67<br />
Silikone ................................................5, 11, 49<br />
Startreaktion....................................................56<br />
Staudinger ...........................................3, 5, 9, 44<br />
Struktur-Eigenschafts-Beziehungen ............ 14, 36, 42<br />
Styropor ® .......................................................63<br />
Substanzpolymerisation .....................................70<br />
Superabsorber................................................ 122<br />
Suspensionspolymerisation............................69, 70<br />
T<br />
Taktizität............................................. 18, 68, 71<br />
Tauchkoagulation ........................................... 102<br />
Teflon ® ..........................................................67<br />
Tempern.........................................................33<br />
Tertiärstruktur...............26, 28, 34, 38, 99, 101, 119<br />
Terylen ® ....................................................41, 48<br />
Thermoplast ....................................38, 40, 62, 73<br />
Trevira ® ............................................... 41, 48, 54<br />
Trockenspinnen.........................................58, 140<br />
U<br />
Uneinheitlichkeit.........................................45, 46<br />
V<br />
Verbundwerkstoffe............................ 113, 116, 160<br />
Vernetzer ..........................................22, 144, 146<br />
Vernetzung...... 23, 40, 42, 46, 54, 80, 146, 148, 149<br />
intermolekulare ............................................23<br />
intramolekulare ............................................23<br />
Vernetzungsdichte........................................22, 23<br />
Verordnung für brennbare Flüssigkeiten ............... 159<br />
Vulkollan ® ..........................................73, 77, 146<br />
Vycra ® ...........................................................41<br />
W<br />
Wassergefährdungsklasse.............................. 159<br />
Weichmacher..............................64, 102, 151, 152<br />
Weich-PVC.....................................................64<br />
Weichschaum...................................................81<br />
WGK........................................................... 159<br />
Z<br />
Ziegler-Katalysatoren.........................................60
Stand Januar 2001<br />
Inhaltsverzeichnis<br />
der verwendeten Chemikalien<br />
mit<br />
Einstufungen<br />
<strong>aus</strong> dem Manuskript von<br />
Dr. M. Müller<br />
"<strong>Kunststoffe</strong> <strong>aus</strong> <strong>Makromolekülen</strong>"<br />
11.2. Inhaltsverzeichnis der verwendeten Chemikalien mit
Kennzeichnung entsprechend Gefahrstoffverordnung<br />
Bei der Durchführung der Versuche ist die Technische Regel für Gefahrstoffe (TRGS) 450<br />
in der jeweils neuesten Fassung zu beachten!<br />
Die Einstufung der Chemikalien entspricht der Gefahrstoff-Verordnung (GefStoffV, Stand<br />
06.08.1986).<br />
Die mit * gekennzeichneten Materialien werden nicht verschickt.<br />
Versuch 1: * Flüssige Luft: O, R 8-34, S 21<br />
* Gummiband: /<br />
Versuch 2: Perlonfäden: /<br />
Versuch 3: Dieser Versuch darf nicht von Schülern durchgeführt werden,<br />
da Benzoylperoxid als explosionsgefährlich eingestuft wird!<br />
Roskydal ® (enthält Styrol): Xi, R 10-20-36/38, S 23, fruchtschädigend<br />
Klasse C<br />
Benzoylperoxid: X i, E, R 3-36/37/38, S 3/7/9-14, 9-27-37/39<br />
Versuch 4: Hexamethylendiamin: C, R 21/22-34-43, S 26-36/39<br />
Natriumhydroxid: C, R 35, S 2-26-37/39<br />
* Phenolphthalein: /<br />
Sebacinsäuredichlorid: C, R 34, S 26<br />
Heptan: F, R 11, S 9-16-23-29-33<br />
* Ethanol: F, R 11, S 7-16<br />
Versuch 5: Da bei zu starkem Erhitzen Pyrolyseprodukte gebildet werden<br />
können, ist der Versuch unbedingt im Abzug durchzuführen!<br />
Polyamid-Pulver: /
Versuch 6: Dimethylacetamid (DMAC): X n, R 20/21-36, S 26-28-36<br />
fruchtschädigend Klasse C<br />
Polyacrylnitril (PAN) in Dimethylacetamid (10%ig):<br />
wie DMAC<br />
Polyacrylnitril: /<br />
Versuch 7: Ethanol: F, R 11, S7-16<br />
fruchtschädigend Klasse D<br />
Methacrylsäuremethylester: X i, F, R 11-36/37/38-43,<br />
S 9-16-29-33,<br />
fruchschädigend Klasse C, Gefahr der Sensibilisierung<br />
Kaliumperoxodisulfat: X n, R 22-42/43, S 17-26-43<br />
Natriumdisulfit: X i, R 31-36/37, S 26<br />
Versuch 8: Methacrylsäuremethylester: siehe Versuch 7<br />
Ethylenglykoldimethacrylat: X i, R 36/37<br />
Versuch 9: Methacrylsäuremethylester: siehe Versuch 7<br />
Benzildimethylketal: R 20/21/22, S 14.8-26-28.2-46<br />
Versuch 10: Dieser Versuch muß unter dem Abzug durchgeführt<br />
werden, da in sehr geringen Mengen HCN freiwerden kann!<br />
Desmophen ® 2000 (Polyesterpolyol): /<br />
Desmodur ® 15 (Naphtylen-1,5-diisocyanat): X n, R 20-36/37/38-42,<br />
S 22-26-28-38-45<br />
1,4-Butandiol: X n, R 22<br />
Versuch 11: Desmodur ® 44V20 (Gemisch von Diphenylmethandiisocyanaten<br />
(MDI)-Isomeren mit polymeren Anteilen): X n, R 20-36/37/38-42,<br />
S 26-28-38-45<br />
Desmophen/Aktivatorgemisch: /<br />
Versuch 12: Lekutherm ® E 320 (Bisphenol-A-Epichlorhydrin): X i,<br />
R 36/38-43, S 28-27/39
Kalthärter ® T3 (Pentaethylenhexamin): C, R 34/43,<br />
S 26/36/37/39<br />
Versuch 13: Dieser Versuch muß unter dem Abzug durchgeführt<br />
werden, da Pyrolyse-Produkte freigesetzt werden!<br />
Polyvinylchlorid (PVC): /<br />
Stabilisator I (Phenylindol): X i, R 20/21/22-36/38,<br />
S 26-28, 2-44-45-46<br />
Versuch 14: PVC-Pulver: siehe Versuch 13<br />
Mesamoll: /<br />
Unterliegt nicht der VbF<br />
Versuch 15: Eisen(III)-chlorid 6H 2O: X n, R 22-38-41, S 26<br />
Pyrrol / iso-Propanol-Gemisch (1/1): F, R 11, S 7-6<br />
/ = Das Produkt ist aufgrund der vorliegenden Erkenntnisse kein gefährlicher<br />
Stoff bzw. keine gefährliche Zubereitung im Sinne von Anhang I, Nr. 1.1.
der GefStoffV.<br />
Die beim Umgang mit Chemikalien üblichen Vorsichtsmaßregeln sind<br />
jedoch zu beachten.
Entsorgungsvorschläge zu den Experimenten des Manuskripts Dr. Müller „<strong>Kunststoffe</strong><br />
<strong>aus</strong> <strong>Makromolekülen</strong>“<br />
Die Empfehlungen beziehen sich auf die „Richtlinien zur Sicherheit im naturwissenschaftlichen<br />
Unterricht - Empfehlung der Kultusministerkonferenz“. Dementsprechend sind auch die<br />
Entsorgungsratschläge (E-Sätze) angegeben. Für übriggebliebene Ausgangsprodukte gelten die<br />
Hinweise auf dem Sicherheitsdatenblatt.<br />
Versuch Nr. 1: Gummiband: Wiederverwenden oder H<strong>aus</strong>müll (E 3)<br />
Versuch Nr. 2: Perlonfaden: H<strong>aus</strong>müll (E 3)<br />
Versuch Nr. 3: kaltgehärtetes Polyesterharz: H<strong>aus</strong>müll (E 3)<br />
Versuch Nr. 4: Polyamidfaden einschließlich Aufrollstab und Zweiphasengemisch: in<br />
gekennzeichneten Glasbehältern sammeln „organische Abfälle - halogenhaltig“<br />
(E 10), dann der Sondermüllbeseitigung zuführen.* (E 8)<br />
Versuch Nr. 5: Schmelzspinnen Polyamid: H<strong>aus</strong>müll (E 3)<br />
Versuch Nr. 6a: Polyaacrylnitrilfäden und die Lösungen: in gekennzeichneten Glasbehältern<br />
sammeln „organische Abfälle - halogenfrei“ (E 10), dann der Sondermüllbeseitigung<br />
zuführen.* (E8)<br />
Versuch Nr. 6b: Polyacrylnitrilfolie: H<strong>aus</strong>müll (E 3)<br />
Versuch Nr. 7: Polymer: H<strong>aus</strong>müll (E3); Reste: in gekennzeichneten Glasbehältern sammeln<br />
„organische Abfälle - halogenfrei“ (E 10), dann der Sondermüllbeseitigung<br />
zuführen.* (E8)<br />
Versuch Nr. 8: Polymer: H<strong>aus</strong>müll (E3); Reste: in gekennzeichneten Glasbehältern sammeln<br />
„organische Abfälle - halogenfrei“ (E 10), dann der Sondermüllbeseitigung<br />
zuführen.* (E8)<br />
Versuch Nr. 9: Polymer: H<strong>aus</strong>müll (E3)<br />
Versuch Nr. 10: Vulkollan: H<strong>aus</strong>müll (E3)<br />
Versuch Nr. 11: Polyurethanschaum: H<strong>aus</strong>müll (E3)<br />
Versuch Nr. 12: Epoxidharz: H<strong>aus</strong>müll (E3)<br />
Versuch Nr. 13: Alle Reste: in gekennzeichneten Glasbehältern sammeln „organische Abfälle -<br />
halogenhaltig“ (E 10), dann der Sondermüllbeseitigung zuführen.* (E 8)<br />
Versuch Nr. 14: Alle Reste: in gekennzeichneten Glasbehältern sammeln „organische Abfälle -<br />
halogenhaltig“ (E 10), dann der Sondermüllbeseitigung zuführen.* (E 8)<br />
Versuch Nr. 15: Papierfilter mit Polypyrrol: H<strong>aus</strong>müll (E3); überschüssige Eisen-III-chloridlösung:<br />
stark mit Wasser verdünnen und in den Ausguß geben (E 1).<br />
* Adresse zu erfragen bei der Kreis- oder Stadtverwaltung