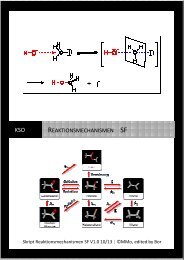
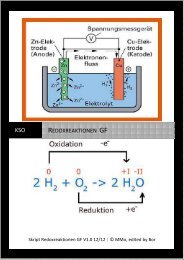
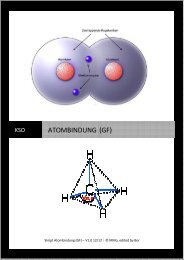
Übungsaufgaben Teil 3
Übungsaufgaben Teil 3
Übungsaufgaben Teil 3
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Übungsaufgaben</strong> <strong>Teil</strong> 3<br />
1. Unter den Hauptgruppenelementen beobachtet man im Periodensystem ein Ansteigen<br />
der Elektronegativität:<br />
1. von links nach rechts und von oben nach unten<br />
2. von rechts nach links und von unten nach oben<br />
3. von links nach rechts und von unten nach oben<br />
4. von rechts nach links und von oben nach unten<br />
5. mit zunehmendem Atomgewicht der Elemente<br />
2. Was gibt die Gruppennummer der Hauptgruppenelemente im Periodensystem für die<br />
Elemente an?<br />
1. Die Zahl Ihrer Protonen<br />
2. Die Ordnungszahl<br />
3. Die Zahl Ihrer Elektronen<br />
4. Die Zahl Ihrer Valenzelektronen<br />
5. Die Zahl der für chemische Reaktionen zur Verfügung stehenden Elektronen<br />
(A) nur 1 ist richtig<br />
(B) nur 3 ist richtig<br />
(C) nur 4 ist richtig<br />
(D) nur 1 und 3 sind richtig<br />
(E) nur 4 und 5 sind richtig<br />
3. Was besagt die Oktettregel?<br />
1. Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein<br />
Elektronensextett zu erlangen.<br />
2. Atome von Elementen der zweiten Periode können maximal vier kovalente Bindungen<br />
ausbilden.<br />
3. Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst eine<br />
würfelartige Gestalt anzunehmen.<br />
4. Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst eine<br />
optimale Raumausnutzung zu erreichen.<br />
5. Es stehen nur vier Orbitale für Bindungen zur Verfügung.<br />
(A) nur 1 ist richtig<br />
(B) nur 2 ist richtig<br />
(C) nur 4 ist richtig<br />
(D) nur 1 und 3 sind richtig<br />
(E) nur 2 und 4 sind richtig<br />
4. Welche Aussagen zur Valenzbindungstheorie treffen zu?
1. In der VB-Theorie geht man von einzelnen Atomen aus und betrachtet die<br />
Wechselwirkung der Atome bei der Annäherung.<br />
2. In der VB-Theorie geht man von einem einheitl. Elektronensystem des Moleküls aus.<br />
3. Die Elektronen halten sich NICHT in Atomorbitalen auf, die zu bestimmten Kernen<br />
gehören, sondern in Molekülorbitalen.<br />
4. Bei der Annäherung zweier Atome kommt es zur Überlappung der Orbitale.<br />
5. Je stärker zwei Atomorbitale überlappen, umso stärker ist die Elektronenpaarbindung.<br />
(A) nur 1 ist richtig<br />
(B) nur 2 ist richtig<br />
(C) nur 1,2 und 3 sind richtig<br />
(D) nur 1,3 und 4 sind richtig<br />
(E) nur 1,4 und 5 sind richtig<br />
5. Wie entsteht eine kovalente Bindung zwischen zwei Atomen?<br />
1. durch die Übertragung eines Elektrons von einem Atom auf ein weiteres<br />
2. durch die Nutzung gemeinsamer Elektronenpaare<br />
3. durch van-der-Waals-Wechselwirkungen<br />
4. durch die Übertragung eines Elektronenpaares von einem Atom auf ein weiteres<br />
5. durch die elektrostatische Anziehung der Atome<br />
6. Was wird unter einer Elektronenmangel-Verbindung verstanden?<br />
1. eine Verbindung, bei der ein Elektronenoktett unterschritten wird<br />
2. eine Verbindung, die Elektronen aufnimmt<br />
3. eine Verbindung, die Elektronen abgibt<br />
4. eine Verbindung, bei der ein Elektronenoktett überschritten wird<br />
5. eine Verbindung, bei der durch Elektronenunterschuß ein Elektronenoktett erreicht<br />
wird<br />
7. Welche Atomorbitale werden zu einem sp3-Hybridorbital kombiniert?<br />
1. ein s- und drei p-Atomorbitale<br />
2. das ist abhängig von der Periode in der sich das Element befindet<br />
3. ein s- und drei p-Atomorbitale, wenn mindestens 4 Elektronen zur Verfügung stehen<br />
4. das ist abhängig von der Anzahl der mit Elektronen besetzten Orbitale<br />
5. ein s- und zwei p-Atomorbitale, wenn mindestens drei Elektronen zur Verfügung<br />
stehen<br />
8. Was wird im Allgemeinen unter Bindigkeit verstanden?
1. die Anzahl der unterschiedlichen Elemente in einem Molekül<br />
2. die Zahl der Atombindungen, die ein bestimmtes Atom ausbilden kann.<br />
3. die Summe aller Elektronenpaare in einem Molekül<br />
4. die Summe aller Elektronen in einem Molekül<br />
5. die Anzahl der Nachbarn eines Zentralatoms im Molekül<br />
(A) nur 1 ist richtig<br />
(B) nur 2 ist richtig<br />
(C) nur 3 ist richtig<br />
(D) nur 5 ist richtig<br />
(E) nur 1,4 und 5 sind richtig<br />
9. Wie verändert sich der Radius eines positiven Ions eines Elementes mit zunehmender<br />
Ladung?<br />
1. der Radius nimmt ab<br />
2. der Radius nimmt zu<br />
3. der Radius bleibt gleich<br />
4. der Radius kann in Abhängigkeit vom Ion sowohl zu als auch abnehmen<br />
5. von einem Element gibt es keine unterschiedlichen positiven Ionen<br />
10. Welche Größe kann helfen, die Polarität einer chemischen Bindung abzuschätzen?<br />
1. die Elektronenaffinität der gebundenen Atome<br />
2. die Elektronegativität der gebundenen Atome<br />
3. die Ionisierungsenergie der gebundenen Atome<br />
4. die Anzahl der direkt gebunden Atome<br />
5. die Dissoziationsenergie der Bindung<br />
(A) nur 1 ist richtig<br />
(B) nur 2 ist richtig<br />
(C) nur 3 ist richtig<br />
(D) nur 5 ist richtig<br />
(E) nur 1,4 und 5 sind richtig<br />
11. Was besagt die Oktetttheorie von Lewis?<br />
1. Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein<br />
Elektronensextett zu erlangen.<br />
2. Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein<br />
Elektronenoktett zu erlangen.<br />
3. Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst eine<br />
würfelartige Gestalt anzunehmen.<br />
4. Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst eine<br />
optimale Raumausnutzung zu erreichen.<br />
5. Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst den<br />
Atomabstand zu verringern.<br />
12. Was ist Voraussetzung für die Überschreitung eines Elektronenoktetts?
1. unbesetzte Orbitale<br />
2. unbesetzte d-Orbitale<br />
3. antibindende Orbitale<br />
4. unbesetzte p-Orbitale<br />
5. unbesetzte p- und d- Orbitale<br />
13. Was kann eine Lewisformel NICHT richtig wiedergeben?<br />
1. die räumliche Anordnung der Atome<br />
2. die Zahl der Außenelektronen eines jeden Elementes<br />
3. Doppelbindungen<br />
4. Dreifachbindungen<br />
5. Radikale<br />
(A) nur 1 ist richtig<br />
(B) nur 2 ist richtig<br />
(C) nur 1,2 und 3 sind richtig<br />
(D) nur 1,3 und 4 sind richtig<br />
(E) nur 1,4 und 5 sind richtig<br />
14. Wann entsteht eine chemische Bindung?<br />
1. wenn Atome mit der richtigen Orientierung aufeinander treffen<br />
2. wenn sich Elektronegativität deutlich von der Ionisierungsenergie und der<br />
unterscheidet<br />
3. wenn die Gesamtenergie der gebundenen Atome geringer ist, als die der freien Atome<br />
4. wenn sich Elektronegativität deutlich von der Ionisierungsenergie unterscheidet<br />
5. wenn sich Elektronegativität deutlich von der Elektronenaffinität unterscheidet<br />
(A) nur 1 ist richtig<br />
(B) nur 2 ist richtig<br />
(C) nur 3 ist richtig<br />
(D) nur 1, 2 und 4 sind richtig<br />
(E) nur 1, 2 und 5 sind richtig<br />
15. Acetylen (C2H2) wird zum Schweißen benutzt. Welche Bindungsordnung liegt hier<br />
zwischen den Kohlenstoffatomen vor?<br />
1. 1<br />
2. 2<br />
3. 3<br />
4. 4<br />
5. Kann man bei diesem Molekül NICHT sinnvoll angeben<br />
16. Wie entsteht eine Bindung zwischen verschiedenartig geladenen Ionen?
1. die Ionen nutzen gemeinsame Elektronen<br />
2. die Bindung beruht auf elektrostatischer Anziehung<br />
3. die bindenden Elektronen wechseln zwischen den Ionen hin und her<br />
4. die bindenden Elektronen wechseln NICHT zwischen den Ionen hin und her<br />
5. die Ionen nutzen gemeinsame Elektronenpaare<br />
17. Was wird als Mesomerie bezeichnet?<br />
1. Mesomerie bedeutet, dass sich eine Verbindung mit der Lewisschreibweise nur<br />
ungenau darstellen lässt<br />
2. Mesomerie bedeutet, dass sich eine Verbindung mit der Lewisschreibweise nicht<br />
eindeutig darstellen lässt und sich nur näherungsweise durch gleichwertige<br />
Grenzstrukturen annähern lässt<br />
3. Mesomerie bedeutet, dass sich die Struktur einer Verbindung mit der<br />
Lewisschreibweise nur annähern lässt<br />
4. Mesomerie bedeutet, dass eine Verbindung in unterschiedlichen Modifikationen<br />
existiert<br />
5. Mesomerie bedeutet, dass sich die Geometrie in einer Verbindung nicht exakt<br />
voraussagen lässt<br />
18. Aus welchen Bindungen besteht eine Dreifachbindung?<br />
1. aus zwei σ-Bindungen und einer π-Bindung<br />
2. aus einer σ -Bindung und zwei π -Bindungen<br />
3. aus drei σ -Bindungen<br />
4. aus drei π -Bindung<br />
5. aus zwei σ -Bindung und zwei π –Bindungen<br />
19. Welche Elemente kommen nur einbindig vor?<br />
1. Chalkogene und Halogene<br />
2. Wasserstoff und Halogene<br />
3. Halogene und Alkalimetalle<br />
4. Wasserstoff und Alkalimetalle<br />
5. Elemente sind niemals einbindig<br />
(A) nur 1 ist richtig<br />
(B) nur 2 ist richtig<br />
(C) nur 1,2 und 3 sind richtig<br />
(D) nur 1,3 und 4 sind richtig<br />
(E) nur 1,4 und 5 sind richtig<br />
20. Welche Struktur kann ein zweiatomiges Molekül aufweisen?
1. es kann gewinkelt sein<br />
2. es kann linear sein<br />
3. es kann gewinkelt oder linear sein<br />
4. zweiatomige Moleküle haben keine Struktur<br />
5. Struktur wird nicht von der Anzahl der Atome im Molekül bestimmt<br />
21. Ein Kohlenstoffatom besitzt als Valenzelektronen jeweils zwei gleichwertige p-<br />
Elektronen und zwei gleichwertige s-Elektronen. Wie ist Methan (CH 4 ) aufgebaut?<br />
1. planar<br />
2. tetraedrisch verzerrt<br />
3. exakt tetraedrisch<br />
4. quadratisch planar<br />
5. alle Winkel im Molekül betragen 109°28’’<br />
22. Ein Kohlenstoffatom besitzt im Grundzustand zwei gepaarte und zwei ungepaarte<br />
Elektronen. Wie viele äquivalente Bindungen kann es ausbilden?<br />
1. 2<br />
2. 3<br />
3. 4<br />
4. 5<br />
5. keine äquivalenten Bindungen<br />
23. Wie nennt sich das Phänomen, welches es dem Kohlenstoffatom erlaubt vier<br />
äquivalente Bindungen auszubilden?<br />
1. Hybridisierung<br />
2. Gemischtvalenz<br />
3. Isomerie<br />
4. Mesomerie<br />
5. Aktivierung<br />
24. Wie hoch kann die Bindigkeit von Stickstoff maximal sein?<br />
1. zweibindig<br />
2. dreibindig<br />
3. vierbindig<br />
4. einbindig<br />
5. fünfbindig<br />
25. Mit Hilfe welcher Methode lassen sich Gitterenergien abschätzen?
1. mit dem Carnotschen Kreisprozess<br />
2. mit dem Born-Haber-Kreisprozess<br />
3. mit der Born-Oppenheimer-Näherung<br />
4. mit dem Haber Bosch Verfahren<br />
5. Gitterenergien lassen sich nicht abschätzen<br />
26. Welche Partialladungsverteilung liegt im HF-Molekül vor?<br />
1. keine<br />
2. Fluor ist partial negativ geladen<br />
3. Fluor ist partial positiv geladen<br />
4. kann sowohl partial negativ als auch positiv geladen sein<br />
5. hängt von der Temperatur ab<br />
27. Das Nitrat-Ion besitzt einen Stickstoff und drei Sauerstoffe, welche durch insgesamt 4<br />
Elektronenpaare an ihn gebunden sind. Welches Sauerstoffatom ist doppelt gebunden?<br />
1. immer das, welches am weitesten vom Gegenion entfernt ist<br />
2. immer das, welches am nächsten am Gegenion gelegen ist<br />
3. kann man nicht sagen, da die zusätzliche Bindung delokalisiert ist<br />
4. kann man nicht sagen, da alle Bindungen im Molekül sind gleich lang<br />
5. immer das, welches die stärkste Partialladung im Molekül trägt<br />
(A) nur 1 ist richtig<br />
(B) nur 2 ist richtig<br />
(C) nur 3 ist richtig<br />
(D) nur 1 und 3 sind richtig<br />
(E) nur 3 und 4 sind richtig<br />
28. Vergleichen Sie ein Mol Wasser und ein Mol Ammoniak.<br />
Welche der folgenden Größen sind für beide gleich?<br />
(1) Zahl der Atome<br />
(2) Zahl der Moleküle<br />
(3) Gewicht<br />
(F) nur 1 ist richtig<br />
(G) nur 2 ist richtig<br />
(H) nur 3 ist richtig<br />
(I) nur 1 und 3 sind richtig<br />
(J) nur 2 und 3 sind richtig<br />
29. Welche der angegebenen Strahlungen ist keine elektromagnetische Welle?
(A) α-Strahlung<br />
(B) γ-Strahlung<br />
(C) Röntgenstrahlung<br />
(D) sichtbares Licht<br />
(E) infrarote Strahlung<br />
30. In welcher Reihenfolge werden den auf Argon folgenden Elementen die<br />
Energieniveaus mit Elektronen besetzt?<br />
(A) 3d 4s 4p 5s 4d<br />
(B) 4s 3d 4p 5s 6s<br />
(C) 3d 4s 4p 4d 5s<br />
(D) 4d 4p 3d 4d 5s<br />
(E) 4s 3d 4p 5s 4d<br />
31. Welche Aussagen über das Periodensystem der Elemente treffen zu?<br />
(1) Chemisch verwandte Elemente stehen in der gleichen Periode.<br />
(2) Die Elemente sind nach steigender Kernladungszahl angeordnet.<br />
(3) Ausgehend vom Wasserstoff werden die Energieniveaus entsprechend ihrer<br />
energetischen Reihenfolge mit Elektronen besetzt.<br />
(4) Elemente mit zunehmender Massenzahl folgen immer direkt aufeinander.<br />
(A) nur 2 ist richtig<br />
(B) nur 1 und 4 sind richtig<br />
(C) nur 2 und 3 sind richtig<br />
(D) nur 3 und 4 sind richtig<br />
(E) 1-4 = alle sind richtig<br />
32. Bei welchen einzelnen neutralen Atomen der folgenden Elemente liegt eine<br />
abgeschlossene äußere Elektronenschale vor?<br />
(1) Lithium<br />
(2) Kohlenstoff<br />
(3) Fluor<br />
(A) bei keinem<br />
(B) nur bei 1<br />
(C) nur bei 2<br />
(D) nur bei 3<br />
(E) nur bei 1 und 2
33. Die Edelgase besitzen nach der relativen Pauling-Skala die höchste Elektronegativität<br />
innerhalb ihrer Periode,<br />
weil<br />
unter den Hauptgruppenelemente einer Periode das Edelgas die elektronenreichste<br />
Valenzschale aufweist.<br />
Antwort Aussage 1 Aussage 2 Verknüpfung<br />
A richtig richtig richtig<br />
B richtig richtig falsch<br />
C richtig falsch -<br />
D falsch richtig -<br />
E falsch falsch -<br />
34. Welche Aussage zum PSE treffen zu?<br />
(1) Innerhalb der Hauptgruppe nimmt der Ionenradius mit steigender Ordnungszahl zu.<br />
(2) Innerhalb der Hauptgruppe nimmt die Elektronennegativität mit steigender<br />
Ordnungszahl zu.<br />
(3) Elemente der 2. Periode können maximal vier kovalente Bindungen eingehen.<br />
(4) Der metallische Charakter wächst innerhalb einer Hauptgruppe mit steigender<br />
Ordnungszahl.<br />
(5) Die Ionisierungsenergie steigt innerhalb einer Gruppe mit wachsender Ordnungszahl.<br />
(A) nur 1 ist richtig<br />
(B) nur 4 und 5 sind richtig<br />
(C) nur 1, 3 und 4 sind richtig<br />
(D) nur 1, 4 und 5 sind richtig<br />
(E) nur 2, 3 und 4 sind richtig<br />
35. Die erste Ionisierungsenergie nimmt beim Übergang vom Stickstoff zum Sauerstoff<br />
ab,<br />
weil<br />
die Abspaltung eines Elektrons beim Sauerstoff zu einer günstigeren Elektronen-<br />
Konfiguration führt als beim Stickstoff.<br />
Antwort Aussage 1 Aussage 2 Verknüpfung<br />
A richtig richtig richtig<br />
B richtig richtig falsch<br />
C richtig falsch -<br />
D falsch richtig -<br />
E falsch falsch -
36. Welche Aussage trifft zu?<br />
Die Elektronegativität<br />
(A) wird auch Elektronenaffinität genannt<br />
(B) gibt die Oxidationszahl eines <strong>Teil</strong>chens an<br />
(C) wächst mit abnehmender Rumpfladung<br />
(D) wächst mit zunehmender Rumpfladung<br />
(E) wächst mit zunehmender Rumpfgröße<br />
(F) keine der obigen Aussagen trifft zu<br />
37. Der Ionenradius von Anionen ist größer als der Radius der entsprechenden neutralen<br />
Atome,<br />
weil<br />
die auf die Elektronenhülle wirkenden Anziehungskräfte beim Atom größer sind als beim<br />
Anion.<br />
Antwort Aussage 1 Aussage 2 Verknüpfung<br />
A richtig richtig richtig<br />
B richtig richtig falsch<br />
C richtig falsch -<br />
D falsch richtig -<br />
E falsch falsch -<br />
38. Welche Aussage über die Kräfte, die zwei punktförmige elektrische Ladungen<br />
aufeinander ausüben, trifft NICHT zu?<br />
(A) Die Kräfte sind umgekehrt proportional dem Quadrat des Abstandes der beiden<br />
Ladungen.<br />
(B) Bei Ladungen gleichen Vorzeichens ergeben sich abstoßende Kräfte zwischen den<br />
Ladungen.<br />
(C) Die Kräfte sind proportional zu jeder der beiden Ladungen.<br />
(D) Die Kräfte haben die Richtung der Verbindungslinie der beiden Ladungen.<br />
(E) Die Kräfte sind proportional dem Quadrat der beiden Ladungen.<br />
39. Beim Auflösen von Ionenverbindungen in Wasser wird das Kristallgitter zerstört,<br />
weil<br />
beim Lösevorgang einer Ionenverbindung in Wasser immer eine chemische Reaktion<br />
mit den H 2 O + -Ionen des Wassers erfolgt.<br />
Antwort Aussage 1 Aussage 2 Verknüpfung<br />
A richtig richtig richtig<br />
B richtig richtig falsch<br />
C richtig falsch -<br />
D falsch richtig -<br />
E falsch falsch -
40. Ordnen Sie bitte den Bindungsarten der Liste 1 den jeweils in engstem<br />
Zusammenhang stehenden Begriffe aus Liste 2 zu.<br />
Liste 1 Liste 2<br />
1. Atombindung (A) Ligendenfeld<br />
2. Ionenbindung (B) „Elektronengas“<br />
3. Metallbindung (C) Coulomb Kräfte = Elektrisches Feld<br />
(D) Reduktion<br />
(E) Hybridisierung<br />
41. Welche Aussage über die Atombindung trifft NICHT zu?<br />
(A) Sie ist entlang der Kernverbindungsachse ausgerichtet.<br />
(B) Sie tritt vorzugsweise bei Elementen ähnlicher Elektronegativität auf.<br />
(C) Ihre Ladungsdichteverteilung zwischen den Kernen ist stets symmetrisch.<br />
(D) Sie kommt durch Überlappen von Atomorbitalen zustande.<br />
(E) Sie kann sowohl homolytisch als auch heterolytisch gespalten werden.<br />
42. Welche Aussage trifft zu?<br />
Unter der Bindigkeit eines Atoms in einem Molekül versteht man die<br />
(A) Anzahl der nächsten Nachbarn im Ionengitter<br />
(B) Bindungsstärke einer kovalenten Einfachbindung zwischen einem Atom und einem<br />
Bindungspartner<br />
(C) Dissoziationsenergie der Bindung zwischen einem Atom und einem Bindungspartner<br />
(D) Anzahl der Atome in einem Molekül<br />
(E) Anzahl der Atombindungen, die ein bestimmtes Atom eingehen kann<br />
43. Das Wassermolekül besitzt ein Dipolmoment,<br />
weil<br />
Wasserstoff elektronegativer als Sauerstoff ist.<br />
Antwort Aussage 1 Aussage 2 Verknüpfung<br />
A richtig richtig richtig<br />
B richtig richtig falsch<br />
C richtig falsch -<br />
D falsch richtig -<br />
E falsch falsch -
44. Ordnen Sie bitte den Begriffen der Liste 1 der jeweils zutreffende Charakterisierung<br />
aus der Liste 2 zu!<br />
Liste 1<br />
1. Aktivierungsenergie<br />
2. Bindungsenergie<br />
Liste 2<br />
(A) die zur Auslösung einer Reaktion erforderlichen Mindestenergie<br />
(B) Differenz zwischen Energieinhalt zweier isolierter Atome und der entsprechenden<br />
gebundenen Atome<br />
(C) Energie, die zur vollständigen Abtrennung des Valenzelektrons von einem Atom<br />
aufzuwenden ist<br />
(D) Ausgetauschte Energie bei der Anlagerung eines Elektrons an ein Atom<br />
(E) Maß für die Fähigkeit eines Atoms, in einer kovalenten Bindung Elektronen<br />
anzuziehen<br />
45. Bei welcher der folgenden Verbindungen ist der ionische Charakter am stärksten<br />
ausgeprägt?<br />
(A) HCl<br />
(B) CH 4<br />
(C) NaCl<br />
(D) NaF<br />
(E) KF<br />
46. Welche Aussagen zum CO 2 -Molekül treffen zu?<br />
(1) Sein Kohlenstoff ist sp-hybridisiert.<br />
(2) Es ist linear gebaut.<br />
(3) Es besitzt ein Dipolmoment.<br />
(4) Es ist gewinkelt aufgebaut.<br />
(A) nur 1 ist richtig<br />
(B) nur 1 und 2 sind richtig<br />
(C) nur 1 und 3 sind richtig<br />
(D) nur 3 und 4 sind richtig<br />
(E) nur 1, 2 und 4 sind richtig<br />
47. Welche Aussage über die metallische Bindung trifft NICHT zu?<br />
(A) Sie führt zur Ausbildung einer Gitterstruktur.<br />
(B) Sie ist durch keine gerichteten Bindungskräfte charaktisiert.<br />
(C) Sie wird durch bewegliche Valenzelektronen der Metallatome ermöglicht.<br />
(D) Sie lässt, bis auf wenige Ausnahmen, fein verteilte Metalle schwarz erscheinen.<br />
(E) Sie resultiert aus der Beteiligung der gesamten Elektronenhülle der Metallatome.
48. In welcher Reihenfolge werden den auf Argon folgenden Elementen die<br />
Energieniveaus mit Elektronen besetzt?<br />
(A) 3d 4s 4p 5s 4d<br />
(B) 4s 3d 4p 5s 6s<br />
(C) 3d 4s 4p 4d 5s<br />
(D) 4d 4p 3d 4d 5s<br />
(E) 4s 3d 4p 5s 4d<br />
49. Welche Aussagen über das Periodensystem der Elemente treffen zu?<br />
(5) Chemisch verwandte Elemente stehen in der gleichen Periode.<br />
(6) Die Elemente sind nach steigender Kernladungszahl angeordnet.<br />
(7) Ausgehend vom Wasserstoff werden die Energieniveaus entsprechend ihrer<br />
energetischen Reihenfolge mit Elektronen besetzt.<br />
(8) Elemente mit zunehmender Massenzahl folgen immer direkt aufeinander.<br />
(A) nur 2 ist richtig<br />
(B) nur 1 und 4 sind richtig<br />
(C) nur 2 und 3 sind richtig<br />
(D) nur 3 und 4 sind richtig<br />
(E) 1-4 = alle sind richtig<br />
50. Die Edelgase besitzen nach der relativen Pauling-Skala die höchste Elektronegativität<br />
innerhalb ihrer Periode,<br />
weil<br />
unter den Hauptgruppenelemente einer Periode das Edelgas die elektronenreichste<br />
Valenzschale aufweist.<br />
Antwort Aussage 1 Aussage 2 Verknüpfung<br />
A richtig richtig richtig<br />
B richtig richtig falsch<br />
C richtig falsch -<br />
D falsch richtig -<br />
E falsch falsch -
51. Welche Aussage zum PSE treffen zu?<br />
(1) Innerhalb der Hauptgruppe nimmt der Ionenradius mit steigender Ordnungszahl zu.<br />
(2) Innerhalb der Hauptgruppe nimmt die Elektronennegativität mit steigender<br />
Ordnungszahl zu.<br />
(3) Elemente der 2. Periode können maximal vier kovalente Bindungen eingehen.<br />
(4) Der metallische Charakter wächst innerhalb einer Hauptgruppe mit steigender<br />
Ordnungszahl.<br />
(5) Die Ionisierungsenergie steigt innerhalb einer Gruppe mit wachsender Ordnungszahl.<br />
(A) nur 1 ist richtig<br />
(B) nur 4 und 5 sind richtig<br />
(C) nur 1, 3 und 4 sind richtig<br />
(D) nur 1, 4 und 5 sind richtig<br />
(E) nur 2, 3 und 4 sind richtig<br />
52. Die erste Ionisierungsenergie nimmt beim Übergang vom Stickstoff zum Sauerstoff<br />
ab,<br />
weil<br />
die Abspaltung eines Elektrons beim Sauerstoff zu einer günstigeren Elektronen-<br />
Konfiguration führt als beim Stickstoff.<br />
Antwort Aussage 1 Aussage 2 Verknüpfung<br />
A richtig richtig richtig<br />
B richtig richtig falsch<br />
C richtig falsch -<br />
D falsch richtig -<br />
E falsch falsch -<br />
53. Der Ionenradius von Anionen ist größer als der Radius der entsprechenden neutralen<br />
Atome,<br />
weil<br />
die auf die Elektronenhülle wirkenden Anziehungskräfte beim Atom größer sind als<br />
beim Anion.<br />
Antwort Aussage 1 Aussage 2 Verknüpfung<br />
A richtig richtig richtig<br />
B richtig richtig falsch<br />
C richtig falsch -<br />
D falsch richtig -<br />
E falsch falsch -
54. Welche Aussage über die Kräfte, die zwei punktförmige elektrische Ladungen<br />
aufeinander ausüben, trifft NICHT zu?<br />
(A) Die Kräfte sind umgekehrt proportional dem Quadrat des Abstandes der beiden<br />
Ladungen.<br />
(B) Bei Ladungen gleichen Vorzeichens ergeben sich abstoßende Kräfte zwischen den<br />
Ladungen.<br />
(C) Die Kräfte sind proportional zu jeder der beiden Ladungen.<br />
(D) Die Kräfte haben die Richtung der Verbindungslinie der beiden Ladungen.<br />
(E) Die Kräfte sind proportional dem Quadrat der beiden Ladungen.<br />
55. Beim Auflösen von Ionenverbindungen in Wasser wird das Kristallgitter zerstört,<br />
weil<br />
beim Lösevorgang einer Ionenverbindung in Wasser immer eine chemische Reaktion<br />
mit den H 2 O + -Ionen des Wassers erfolgt.<br />
Antwort Aussage 1 Aussage 2 Verknüpfung<br />
A richtig richtig richtig<br />
B richtig richtig falsch<br />
C richtig falsch -<br />
D falsch richtig -<br />
E falsch falsch -<br />
56. Ordnen Sie bitte den Bindungsarten der Liste 1 den jeweils in engstem<br />
Zusammenhang stehenden Begriffe aus Liste 2 zu.<br />
Liste 1 Liste 2<br />
Atombindung<br />
(A) Ligendenfeld<br />
Ionenbindung<br />
(B) „Elektronengas“<br />
Metallbindung<br />
(C) Coulomb Kräfte = Elektrisches Feld<br />
(D) Reduktion<br />
(E) Hybridisierung<br />
57. Welche Aussage über die Atombindung trifft NICHT zu?<br />
(A) Sie ist entlang der Kernverbindungsachse ausgerichtet.<br />
(B) Sie tritt vorzugsweise bei Elementen ähnlicher Elektronegativität auf.<br />
(C) Ihre Ladungsdichteverteilung zwischen den Kernen ist stets symmetrisch.<br />
(D) Sie kommt durch Überlappen von Atomorbitalen zustande.<br />
(E) Sie kann sowohl homolytisch als auch heterolytisch gespalten werden.
58. Welche Aussage trifft zu?<br />
Unter der Bindigkeit eines Atoms in einem Molekül versteht man die<br />
(A) Anzahl der nächsten Nachbarn im Ionengitter<br />
(B) Bindungsstärke einer kovalenten Einfachbindung zwischen einem Atom und einem<br />
Bindungspartner<br />
(C) Dissoziationsenergie der Bindung zwischen einem Atom und einem Bindungspartner<br />
(D) Anzahl der Atome in einem Molekül<br />
(E) Anzahl der Atombindungen, die ein bestimmtes Atom eingehen kann<br />
59. Das Wassermolekül besitzt ein Dipolmoment,<br />
weil<br />
Wasserstoff elektronegativer als Sauerstoff ist.<br />
Antwort Aussage 1 Aussage 2 Verknüpfung<br />
A richtig richtig richtig<br />
B richtig richtig falsch<br />
C richtig falsch -<br />
D falsch richtig -<br />
E falsch falsch -<br />
60. Bei welcher der folgenden Verbindungen ist der ionische Charakter am stärksten<br />
ausgeprägt?<br />
(A) HCl<br />
(B) CH 4<br />
(C) NaCl<br />
(D) NaF<br />
(E) KF<br />
61. Welche Aussage über die metallische Bindung trifft NICHT zu?<br />
(A) Sie führt zur Ausbildung einer Gitterstruktur.<br />
(B) Sie ist durch keine gerichteten Bindungskräfte charaktisiert.<br />
(C) Sie wird durch bewegliche Valenzelektronen der Metallatome ermöglicht.<br />
(D) Sie lässt, bis auf wenige Ausnahmen, fein verteilte Metalle schwarz erscheinen.<br />
(E) Sie resultiert aus der Beteiligung der gesamten Elektronenhülle der Metallatome.