Pharmakovigilanz - Uni-marburg.de
Pharmakovigilanz - Uni-marburg.de
Pharmakovigilanz - Uni-marburg.de
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Zusatzqualifikation im<br />
Pharmarecht<br />
Recht <strong>de</strong>r Arzneimittelsicherheit<br />
Sommersemester 2013<br />
Dr. Elmar Kroth
Übersicht (1/2)<br />
1.Teil: Nationale Arzneimittelsicherheit<br />
• Einführung / rechtl. Grundlagen<br />
• Aufgaben <strong>de</strong>r Behör<strong>de</strong>n<br />
Allgem. Verwaltungsvorschrift Stufenplan<br />
• Ablauf von Stufenplanverfahren<br />
• Maßnahmenbefugnis <strong>de</strong>r Behör<strong>de</strong>n<br />
• Aufgaben <strong>de</strong>s Unternehmers<br />
Stufenplanbeauftragter<br />
Informationsbeauftragter<br />
• Formale Anfor<strong>de</strong>rungen<br />
• Aufgaben<br />
2<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Übersicht (2/2)<br />
Internationale Arzneimittelsicherheit =<br />
<strong>Pharmakovigilanz</strong><br />
• Einführung / rechtl. Grundlagen<br />
• Aufgaben <strong>de</strong>r Behör<strong>de</strong>n (international)<br />
• Ablauf von <strong>Pharmakovigilanz</strong>verfahren<br />
• Maßnahmenbefugnis <strong>de</strong>r Behör<strong>de</strong>n<br />
• Beispiele<br />
3<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einführung in die<br />
Arzneimittelsicherheit
<strong>Pharmakovigilanz</strong> - Definition<br />
Definition <strong>de</strong>r <strong>Pharmakovigilanz</strong> (WHO)<br />
• Aktivitäten, die zur Ent<strong>de</strong>ckung, Beurteilung<br />
sowie zum Verständnis und zur Vorbeugung<br />
von unerwünschten Wirkungen o<strong>de</strong>r an<strong>de</strong>ren<br />
Problemen in Verbindung mit AM* dienen.<br />
Dazu gehört<br />
• Analyse und Abwehr von Arzneimittelrisiken<br />
• Risikomanagement<br />
• Vorbeugung von Therapiefehlern<br />
• Vermittlung von Arzneimittelinformationen<br />
• För<strong>de</strong>rung <strong>de</strong>r rationalen Therapie mit AM<br />
* AM = Arzneimittel<br />
5<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einführung / rechtl. Grundlagen (1/6)<br />
Arzneimittelrisiken<br />
• Anwendung durch viele verschie<strong>de</strong>ne Patienten<br />
• neue wissenschaftliche Erkenntnisse<br />
Überwachung<br />
• Zuständige Bun<strong>de</strong>soberbehör<strong>de</strong>n (BfArM, PEI, BVL),<br />
pharm. Unternehmer, Heilberufe, Patient<br />
Nutzen / Risiko<br />
• darf ein vertretbares Maß nicht überschreiten<br />
6<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einführung / rechtl. Grundlagen (2/6)<br />
Was sind Arzneimittelrisiken ?<br />
• Fehlerhafte Anwendungen / medication errors<br />
Aufgabe <strong>de</strong>s Gesundheitssystems<br />
• Produktfehler, pharm. Mängel<br />
Minimierung im Herstellungsprozess (GMP)<br />
• Nebenwirkungen, Wechselwirkungen, ...<br />
Aufgabe <strong>de</strong>r Arzneimittelsicherheit<br />
7<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einführung / rechtl. Grundlagen (3/6)<br />
Dimension <strong>de</strong>r medication errors (Norwegische<br />
Studie)<br />
• Von 732 verstorbenen Patienten aus insges.<br />
13.992 Krankenhausaufnahmen wur<strong>de</strong> in 133<br />
Fällen <strong>de</strong>r Tod als Folge einer unerwünschten<br />
AM-Wirkung i<strong>de</strong>ntifiziert<br />
• Von 133 To<strong>de</strong>sfällen rund 50 % auf falsche<br />
Wahl <strong>de</strong>s AM, falsche Dosierung o<strong>de</strong>r falsche<br />
Darreichungsform zurückzuführen<br />
(Buajor<strong>de</strong>t J, Ebbsen J, Broers O, Hoberg T., Fatal adverse drug events: the<br />
paradox of drug treatment. Journal of Internal Medicine 2001; 250: 327-341)<br />
8<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Probleme bei <strong>de</strong>r Nebenwirkungserfassung<br />
NW* sind …<br />
• zumeist nur Befindlichkeitsstörungen (Hautrötungen,<br />
schlechter Geschmack, Unwohlsein…)<br />
• in <strong>de</strong>r Regel selbst limitierend<br />
• schwere Beeinträchtigungen relativ selten<br />
• zumeist in klin. Entwicklung ent<strong>de</strong>ckt<br />
• keine Zulassung bei zu hohen Risiken<br />
• seltene NW schwer zu ent<strong>de</strong>cken<br />
• NW bei 1/1.000 Patienten, erfor<strong>de</strong>rt Prüfung von<br />
3.000 Patienten (statistische 3/n-Regel)<br />
~ Umfang klin. Prüfungen, d.h. seltenere NW statistisch<br />
nicht erfassbar, nur über Post-Marketing-<br />
Bereich zu ent<strong>de</strong>cken<br />
* NW = Nebenwirkung<br />
9<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Probleme bei <strong>de</strong>r Nebenwirkungserfassung<br />
Häufigkeitsangaben von NW<br />
• sehr häufig: > 1 von 10 Behan<strong>de</strong>lten (> 10 %)<br />
• häufig: 1-10 Behan<strong>de</strong>lten von 100 (1-10 %)<br />
• gelegentlich: 1-10 B. von 1.000 (0,1 - 1 %)<br />
• selten: 1-10 B. von 10.000 (0,01 - 0,1 %)<br />
• sehr selten: < als 1 B. von 10.000 (< 0,01 %)<br />
• nicht bekannt: Häufigkeit aufgrund <strong>de</strong>r Datenlage<br />
nicht abschätzbar<br />
10<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Probleme bei <strong>de</strong>r Nebenwirkungserfassung<br />
NW sind vielschichtig<br />
• bekannt/unbekannt bzw. (un)erwartet<br />
• unterschiedlich häufig (bis hin zu Einzelfällen)<br />
• treten rasch o<strong>de</strong>r verzögert auf (Spätfolgen)<br />
• treten bisweilen nur bei bestimmten Patienten<br />
auf (z.B. mit genetischer Prädisposition o<strong>de</strong>r<br />
Organfunktionseinschränkung)<br />
• ähneln u.U. <strong>de</strong>r Indikation (u.a. Medikamenten-induzierter<br />
Kopfschmerz)<br />
• sind reversibel o<strong>de</strong>r irreversibel<br />
• sind dosisabhängig o<strong>de</strong>r -unabhängig (z.B.<br />
allerg. Reaktionen)<br />
11<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einführung / rechtl. Grundlagen (4/6)<br />
Dimension <strong>de</strong>r Nebenwirkungen<br />
• Zwischen 3 – 6 % aller Krankenhausaufnahmen<br />
erfolgen aufgrund von NW<br />
• Davon führen 2 – 5 % zum Tod<br />
• Überwiegend beteiligt sind bekannte Stoffe wie<br />
NSAIDs, Diuretika, Warfarin,...<br />
• Über 70 % dieser Nebenwirkungen vermeidbar<br />
Lazarou J et al., 1998<br />
Pouyanne P et al., 2000<br />
Pirmohamed M et al., 2004<br />
12<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Wahrnehmung von Nutzen und Risiken<br />
Schwierige Einschätzung freiwilliger<br />
und unfreiwilliger Risiken<br />
• Rauchen: 1 To<strong>de</strong>sfall auf 600 Menschen pro Jahr<br />
• Übergewicht: 1 To<strong>de</strong>sfall auf 600 Menschen / Jahr<br />
• Alkohol: 1 To<strong>de</strong>sfall auf 8.000 Menschen / Jahr<br />
• Alle AM zusammen: 1 To<strong>de</strong>sfall auf 100.000 – 1<br />
Mio. Anwendungen / Jahr<br />
• AM gegen lebensbedrohen<strong>de</strong> Krankheiten: 1<br />
To<strong>de</strong>sfall auf 1.000 – 10.000 Anwendungen / Jahr<br />
Aus: Klaus Heilmann, Das Risiko <strong>de</strong>r Sicherheit, 2002<br />
13<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Wahrnehmung von Nutzen und Risiken<br />
Typisches Beispiel (stark vereinfacht)<br />
• 1 % <strong>de</strong>r Patienten sterben an einer unbehan<strong>de</strong>lten<br />
Krankheit (z.B. FSME)<br />
Bei 100.000 Erkrankten = 1.000 To<strong>de</strong>sopfer<br />
• 0,01 % <strong>de</strong>r behan<strong>de</strong>lten Kranken versterben an<br />
einer NW<br />
Bei 100.000 Erkrankten = 10 To<strong>de</strong>sopfer<br />
Nutzen-Risiko-Bilanz = 990 Leben gerettet<br />
Aus: Klaus Heilmann, Das Risiko <strong>de</strong>r Sicherheit, 2002<br />
14<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Wahrnehmung von Nutzen und Risiken<br />
Warnkampagne: Je<strong>de</strong>r 5. Patient stellt<br />
Behandlung ein, d.h.<br />
• 20.000 unbehan<strong>de</strong>lte Patienten:<br />
2 To<strong>de</strong>sfälle weniger durch NW (- 2), aber<br />
200 To<strong>de</strong>sfälle mehr durch Erkrankung (+ 200)<br />
„Erfolg“ <strong>de</strong>r Warnkampagne:<br />
• Nutzen-Risiko-Bilanz: 198 zusätzliche To<strong>de</strong>sfälle<br />
Aus: Klaus Heilmann, Das Risiko <strong>de</strong>r Sicherheit, 2002<br />
15<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
1. Teil:<br />
Nationale<br />
Arzneimittelsicherheit<br />
- Aufgaben <strong>de</strong>r Behör<strong>de</strong>n -
§ 5 AMG<br />
Verbot be<strong>de</strong>nklicher Arzneimittel<br />
• Es ist verboten, be<strong>de</strong>nkliche AM* in <strong>de</strong>n Verkehr<br />
zu bringen o<strong>de</strong>r bei einem an<strong>de</strong>ren Menschen<br />
anzuwen<strong>de</strong>n.<br />
• Be<strong>de</strong>nklich sind AM, bei <strong>de</strong>nen nach <strong>de</strong>m jeweiligen<br />
Stand <strong>de</strong>r wiss. Erkenntnisse <strong>de</strong>r begrün<strong>de</strong>te<br />
Verdacht besteht, dass diese bei bestimmungsgemäßem<br />
Gebrauch schädliche Wirkungen haben,<br />
die über ein nach <strong>de</strong>n Erkenntnissen <strong>de</strong>r med.<br />
Wissenschaft vertretbares Maß hinausgehen.<br />
Viele unbestimmte Rechtsbegriffe, teilweise<br />
schwierig zu interpretieren<br />
* AM = Arzneimittel<br />
17<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einführung / rechtl. Grundlagen (5/6)<br />
Arzneimittelgesetz<br />
Zehnter Abschnitt: Beobachtung, Sammlung<br />
und Auswertung von Arzneimittelrisiken<br />
§ 62 Organisation<br />
§ 63 Stufenplan<br />
§ 63a Stufenplanbeauftragter<br />
§ 63b-j Allgemeine und beson<strong>de</strong>re Regelungen zur<br />
<strong>Pharmakovigilanz</strong><br />
18<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einführung / rechtl. Grundlagen (6/6)<br />
§ 62 AMG „Organisation“<br />
"Die zuständige Bun<strong>de</strong>soberbehör<strong>de</strong> hat zur Verhütung einer unmittelbaren<br />
o<strong>de</strong>r mittelbaren Gefährdung <strong>de</strong>r Gesundheit von Mensch<br />
o<strong>de</strong>r Tier die bei <strong>de</strong>r Anwendung von Arzneimitteln auftreten<strong>de</strong>n Risiken,<br />
insbeson<strong>de</strong>re Nebenwirkungen, Wechselwirkungen mit an<strong>de</strong>ren<br />
Mitteln, Verfälschungen sowie potenzielle Risiken für die Umwelt aufgrund<br />
<strong>de</strong>r Anwendung eines Tierarzneimittels, zentral zu erfassen,<br />
auszuwerten und die nach diesem Gesetz zu ergreifen<strong>de</strong>n Maßnahmen<br />
zu koordinieren. Sie wirkt dabei mit <strong>de</strong>n Dienststellen <strong>de</strong>r<br />
Weltgesundheitsorganisation, <strong>de</strong>r Europäischen Arzneimittelagentur,<br />
<strong>de</strong>n Arzneimittelbehör<strong>de</strong>n an<strong>de</strong>rer Län<strong>de</strong>r, <strong>de</strong>n Gesundheits- und<br />
Veterinärbehör<strong>de</strong>n <strong>de</strong>r Bun<strong>de</strong>slän<strong>de</strong>r, <strong>de</strong>n Arzneimittelkommissionen<br />
<strong>de</strong>r Kammern <strong>de</strong>r Heilberufe, nationalen <strong>Pharmakovigilanz</strong>zentren<br />
sowie mit an<strong>de</strong>ren Stellen zusammen, die bei <strong>de</strong>r Durchführung ihrer<br />
Aufgaben Arzneimittelrisiken erfassen."<br />
19<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Aufgaben <strong>de</strong>r Behör<strong>de</strong>n - Stufenplan<br />
§ 63 AMG „Stufenplan“<br />
(Allgemeine Verwaltungsvorschrift zur Beobachtung,<br />
Sammlung und Auswertung von Arzneimittelrisiken)<br />
„Das Bun<strong>de</strong>sministerium erstellt durch allgemeine Verwaltungsvorschrift<br />
mit Zustimmung <strong>de</strong>s Bun<strong>de</strong>srates zur<br />
Durchführung <strong>de</strong>r Aufgaben nach § 62 AMG einen<br />
Stufenplan. In diesem wer<strong>de</strong>n die Zusammenarbeit <strong>de</strong>r<br />
beteiligten Behör<strong>de</strong>n und Stellen auf <strong>de</strong>n verschie<strong>de</strong>nen<br />
Gefahrenstufen sowie die Einschaltung <strong>de</strong>r pharmazeutischen<br />
Unternehmer näher geregelt und die jeweils nach<br />
<strong>de</strong>n Vorschriften dieses Gesetzes zu ergreifen<strong>de</strong>n Maßnahmen<br />
bestimmt. In <strong>de</strong>m Stufenplan können ferner<br />
Informationsmittel und -wege bestimmt wer<strong>de</strong>n.“<br />
20<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Aufgaben <strong>de</strong>r Behör<strong>de</strong>n - Stufenplan<br />
Allgemeine Verwaltungsvorschrift zur Beobachtung,<br />
Sammlung und Auswertung von Arzneimittelrisiken<br />
nach § 63 AMG (Stufenplan) vom 09. Februar 2005<br />
1. Zweck <strong>de</strong>r Allgemeinen Verwaltungsvorschrift<br />
2. Beteiligte Behör<strong>de</strong>n und Stellen (Stufenplanbeteiligte)<br />
3. Arzneimittelrisiken<br />
4. Sammlung von Meldungen über Arzneimittelrisiken<br />
5. Vorgehen in Gefahrenstufen<br />
6. Maßnahmenkatalog<br />
7. Gegenseitige Information <strong>de</strong>r Beteiligten<br />
8. Routinesitzung<br />
9. Son<strong>de</strong>rsitzung<br />
10. Information <strong>de</strong>r Öffentlichkeit<br />
21<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplan - Beteiligte<br />
Stufenplanbeteiligte (u.a.)<br />
• Oberste Gesundheits- und Veterinärbehör<strong>de</strong>n<br />
• Arzneimittel-Kommissionen <strong>de</strong>r Heilberufe<br />
• Bun<strong>de</strong>sverbän<strong>de</strong> <strong>de</strong>r Arneimittelindustrie<br />
• BMGS und an<strong>de</strong>re Bun<strong>de</strong>sministerien<br />
• nat. <strong>Pharmakovigilanz</strong>zentren, Vergiftungszentralen,<br />
Patientenbeauftragte <strong>de</strong>r Bun<strong>de</strong>sregierung<br />
• zuständige Stellen <strong>de</strong>r EU-Mitgliedstaaten<br />
• EMA und ihre Ausschüsse, EDQM<br />
• Dienststellen <strong>de</strong>r WHO<br />
• Arzneimittelbehör<strong>de</strong>n an<strong>de</strong>rer Staaten<br />
22<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplan - Arzneimittelrisiken<br />
Arzneimittelrisiken<br />
• NW inkl. WW mit an<strong>de</strong>ren Mitteln<br />
• Resistenzbildung<br />
• Missbrauch, Fehlgebrauch<br />
• Gewöhnung, Abhängigkeit<br />
• Mängel <strong>de</strong>r Qualität<br />
• Mängel <strong>de</strong>r Behältnisse / äußeren Umhüllungen<br />
• Mängel <strong>de</strong>r Kennzeichnung und <strong>de</strong>r FI/GI<br />
• Arzneimittelfälschungen<br />
• potentielle Umweltrisiken bei Tier-AM<br />
• zu kurze Wartezeit<br />
23<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplan - Routinesitzungen<br />
Stufenplan-Routinesitzung<br />
• Sachstand über eingegangene Meldungen zu<br />
unerwünschten Wirkungen von AM<br />
• Bericht über laufen<strong>de</strong> Stufenplanverfahren und<br />
Informationsaustausch über Maßnahmen<br />
• Aktuelle Probleme <strong>de</strong>r Arzneimittelsicherheit<br />
24<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)<br />
25
26<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
27<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
28<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
29<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
30<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
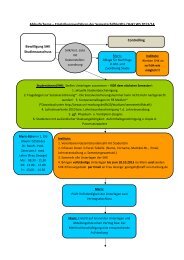
Stufenplan - Vorgehen in Gefahrenstufen<br />
Auslöser: Nebenwirkungsmeldungen, Studien,<br />
Gutachten, etc.<br />
Stufe I<br />
Mögliches Risiko<br />
Stufe II<br />
Pharmazeutischer Unternehmer:<br />
Stellungnahme<br />
Verdacht entkräftet eigenverantwortl. Maßnahmen Verdacht<br />
Pharmazeutischer Unternehmer:<br />
Anhörung (schriftl., mündl. Son<strong>de</strong>rsitzung)<br />
eigenverantwortliche<br />
Maßnahmen<br />
Verdacht entkräftet<br />
angeordnete Maßnahmen<br />
Rechtsmittel<br />
31<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Mögliche Maßnahmen
Stufenplan - Maßnahmenkatalog (1/4)<br />
Maßnahmen <strong>de</strong>r zuständigen BOB:<br />
• Einholung von Sachverständigen-Gutachten,<br />
Vergabe von Forschungsaufträgen<br />
• Auflagen nach § 28 AMG bezüglich<br />
• Kennzeichnung <strong>de</strong>r Behältnisse und <strong>de</strong>r äußeren<br />
Umhüllungen<br />
• Formulierung <strong>de</strong>r FI und GI<br />
• Therapiegerechte Packungsgrößen<br />
• Gestaltung von Behältnissen (z.B. Kin<strong>de</strong>rsicherung)<br />
• Rücknahme, Wi<strong>de</strong>rruf o<strong>de</strong>r Ruhen <strong>de</strong>r<br />
Zulassung (§ 30 AMG)<br />
33<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplan - Maßnahmenkatalog (2/4)<br />
Maßnahmen <strong>de</strong>r (Bun<strong>de</strong>s-)Län<strong>de</strong>r:<br />
• Intensivierung <strong>de</strong>r Überwachungsmaßnahmen<br />
(§§ 64, 65 AMG)<br />
• Maßnahmen nach § 69 Abs. 1 AMG<br />
• Untersagung <strong>de</strong>s Inverkehrbringens<br />
• Anordnung <strong>de</strong>s Rückrufs<br />
• Sicherstellung von Arzneimitteln im Bereich <strong>de</strong>s<br />
betroffenen Bun<strong>de</strong>slan<strong>de</strong>s<br />
34<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplan - Maßnahmenkatalog (3/4)<br />
Maßnahmen <strong>de</strong>r Bun<strong>de</strong>sministerien, v.a.<br />
<strong>de</strong>s BMG (1/2):<br />
• Maßnahmen zum Schutz <strong>de</strong>r Gesundheit<br />
(RV* nach § 6 AMG)<br />
• Anordnung von Warnhinweisen<br />
(RV nach § 12 Abs. 1 Nr. 3 AMG)<br />
• Unterstellung unter …<br />
• Apothekenpflicht (RV nach § 46 AMG)<br />
• Betäubungsmittelrecht<br />
• Verschreibungspflicht (RV nach § 48 AMG)<br />
* RV = Rechtsverordnung<br />
35<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplan - Maßnahmenkatalog (4/4)<br />
Maßnahmen <strong>de</strong>r Bun<strong>de</strong>sministerien, v.a.<br />
<strong>de</strong>s BMG (1/2):<br />
• Aufhebung von Standardzulassungen<br />
(RV nach § 36 AMG)<br />
• Maßnahmen bei Zulassung und Chargenprüfung<br />
(RV nach § 35 AMG)<br />
• Verbot <strong>de</strong>r Einfuhr (RV nach 72a AMG)<br />
36<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplan - Rechtsmittel<br />
• Bescheid = Verwaltungsakt<br />
• Grundsatz <strong>de</strong>s dt. Verwaltungsrechts:<br />
Rechtsmittel haben aufschieben<strong>de</strong> Wirkung,<br />
Maßnahme muss nicht umgesetzt wer<strong>de</strong>n<br />
• Ausnahme: Anordnung eines Sofortvollzuges<br />
• § 25 Abs. 2 Nr. 5 i.V.m. § 30 Abs. 3 S. 2-3:<br />
Ungünstiges Nutzen-Risiko-Verhältnis<br />
(Sofortvollzug im Gesetz vorgesehen)<br />
• § 28 Abs. 3c, Satz 2-3: Auflagen bei<br />
biologischen / biotechnischen Arzneimitteln<br />
37<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplanverfahren<br />
Praktische<br />
Beispiele<br />
38<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
1. Teil:<br />
Nationale<br />
Arzneimittelsicherheit<br />
- Aufgaben <strong>de</strong>r<br />
Zulassungsinhaber -
Übersicht<br />
• Einführung / rechtl. Grundlagen<br />
• Aufgaben <strong>de</strong>r Behör<strong>de</strong>n<br />
insbes. Allgem. Verwaltungsvorschrift Stufenplan<br />
• Ablauf von Stufenplanverfahren<br />
• Maßnahmenbefugnis <strong>de</strong>r Behör<strong>de</strong>n<br />
• Aufgaben <strong>de</strong>s Unternehmers<br />
Stufenplanbeauftragter / QPPV<br />
Informationsbeauftragter<br />
• Formale Anfor<strong>de</strong>rungen<br />
• Aufgaben<br />
40<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Verantwortlichkeiten <strong>de</strong>s<br />
Stufenplanbeauftragten<br />
und <strong>de</strong>r QPPV
Der<br />
Stufenplanbeauftragte<br />
42 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplanbeauftragter – Anfor<strong>de</strong>rungen (1/5)<br />
Stufenplanbeauftragter (StB)<br />
zentraler Ansprechpartner für Arzneimittel-<br />
Risiken<br />
• innerhalb <strong>de</strong>s Betriebes<br />
• für Zulassungs- und Überwachungsbehör<strong>de</strong>n<br />
Verpflichtung zur Bestellung eines StB:<br />
• alle pharm. Unternehmer, die im Geltungsbereich<br />
<strong>de</strong>s AMG Fertigarzneimittel in Verkehr<br />
bringen<br />
43<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplanbeauftragter – Anfor<strong>de</strong>rungen (2/5)<br />
Ausnahmen: pharm. Unternehmer, die<br />
• ausschließlich Bulkware o<strong>de</strong>r Wirkstoffe in<br />
Verkehr bringen<br />
• nach § 13 Abs. 2 Nr. 1, 2, 3 o<strong>de</strong>r 5 AMG keine<br />
Herstellungserlaubnis benötigen<br />
• Herstellung im üblichen Apothekenbetrieb,<br />
• Herstellung in Krankenhausapotheken,<br />
• Herstellung für die tierärztliche Hausapotheke,<br />
• Umfüllen, Abpacken, Kennzeichnen im Einzelhan<strong>de</strong>l<br />
• Großhändler, wenn sie keine Fertig-AM herstellen<br />
44<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplanbeauftragter – Anfor<strong>de</strong>rungen (3/5)<br />
Qualifikation <strong>de</strong>s StB (§ 63a Abs. 1 AMG):<br />
Der pharm. Unternehmer hat<br />
„eine in einem Mitgliedstaat <strong>de</strong>r EU ansässige<br />
qualifizierte Person mit <strong>de</strong>r erfor<strong>de</strong>rlichen<br />
Sachkenntnis und <strong>de</strong>r zur Ausübung ihrer<br />
Tätigkeit erfor<strong>de</strong>rlichen Zuverlässigkeit“<br />
als Stufenplanbeauftragten zu beauftragen.<br />
Kein <strong>de</strong>finiertes Qualifikationsprofil (mehr)<br />
Keine Vorlage von Nachweisen<br />
45<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplanbeauftragter – Anfor<strong>de</strong>rungen (4/5)<br />
Personalunion (§ 63a Abs. 2 AMG)<br />
Der StB kann (bei entsprechen<strong>de</strong>r Sachkenntnis<br />
und Erfahrung) gleichzeitig<br />
• Informationsbeauftragter nach § 74a AMG<br />
• sachkundige Person nach § 14 AMG<br />
• verantwortliche Person nach § 20c AMG sein.<br />
sein.<br />
46<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplanbeauftragter – Anfor<strong>de</strong>rungen (5/5)<br />
Benennung <strong>de</strong>s Stufenplanbeauftragten<br />
(§ 63a Abs. 3 AMG)<br />
• Namentliche Nennung bei <strong>de</strong>r zuständigen<br />
(Lan<strong>de</strong>s-)Behör<strong>de</strong> und Bun<strong>de</strong>soberbehör<strong>de</strong><br />
• Nachweis <strong>de</strong>r Zuverlässigkeit (ggf.)<br />
• Je<strong>de</strong>n Wechsel vorher mitzuteilen<br />
47<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Anzeige <strong>de</strong>s Stufenplanbeauftragten<br />
48<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Sitz <strong>de</strong>s Stufenplanbeauftragten<br />
§19 Abs. 6 AMWHV:<br />
Der/die Stufenplanbeauftragte soll<br />
• von <strong>de</strong>n Verkaufs- und Vertriebseinheiten<br />
unabhängig sein und<br />
• kann sich nur von Personen vertreten<br />
lassen, die über die Sachkenntnis nach §<br />
63a Abs. 2 AMG verfügen und<br />
• muss in Deutschland o<strong>de</strong>r einem an<strong>de</strong>ren<br />
Mitgliedstaat <strong>de</strong>r EU ansässig sein.<br />
49<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Die Qualified Person for<br />
Pharmacovigilance<br />
(QPPV)<br />
50 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Rahmenbedingungen nach EU-Recht<br />
Art. 104 Abs. 3 RL* 2001/83<br />
“Im Rahmen seines <strong>Pharmakovigilanz</strong>-Systems<br />
muss <strong>de</strong>r MAH**<br />
a) ständig und kontinuierlich über eine für die<br />
<strong>Pharmakovigilanz</strong> verantwortliche, entsprechend<br />
qualifizierte Person verfügen...”<br />
*RL: Richtlinie<br />
** MAH: Marketing Authorisation Hol<strong>de</strong>r = Zulassungsinhaber<br />
51<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Rahmenbedingungen nach EU-Recht<br />
Art. 103 RL 2001/83 (alter Stand)<br />
Diese qualifizierte Person ist in <strong>de</strong>r Gemeinschaft<br />
ansässig und für Folgen<strong>de</strong>s verantwortlich:<br />
• <strong>Pharmakovigilanz</strong>system einrichten / führen<br />
• Berichte (Einzelfallberichte und PSURs) an die<br />
zuständigen Behör<strong>de</strong>n gemäß <strong>de</strong>n in Volume<br />
9a festgelegten Anfor<strong>de</strong>rungen einreichen<br />
• Beantwortung von Behör<strong>de</strong>nanfragen (korrekt,<br />
rasch, vollständig)<br />
• Information <strong>de</strong>r Behör<strong>de</strong>n über Än<strong>de</strong>rungen<br />
<strong>de</strong>s Nutzen Risiko-Verhaltnisses.<br />
52<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Rahmenbedingungen nach EU-Recht<br />
Art. 104ff RL 2001/83 (neuer Stand)<br />
Alle <strong>Pharmakovigilanz</strong>-Verpflichtungen<br />
wer<strong>de</strong>n <strong>de</strong>m MAH aufgetragen!<br />
Folgerichtig:<br />
• § 63bff AMG (Stand: 2. AMG-Än<strong>de</strong>rungsgesetz):<br />
Allgemeine <strong>Pharmakovigilanz</strong>-Pflichten <strong>de</strong>s<br />
Inhabers <strong>de</strong>r Zulassung<br />
• § 63c AMG: Dokumentations- und Mel<strong>de</strong>pflichten<br />
<strong>de</strong>s Inhabers <strong>de</strong>r Zulassung ...<br />
53<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Good Vigilance Practice –<br />
das “Kleingedruckte” <strong>de</strong>r<br />
<strong>Pharmakovigilanz</strong>
GVP-Module<br />
55 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
GVP-Modul I<br />
56 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
GVP Modul I: Aufgaben <strong>de</strong>s MAH<br />
GVP Modul I: Responsibilities of the MAH in<br />
relation to the QPPV [I.C.1.1.]<br />
“...the MAH shall have permanently and continuously<br />
at its disposal an appropriately<br />
qualified person responsible for pharmacovigilance<br />
in the EU (QPPV).”<br />
Lt. Abschnitt I.C.1.3: Sitz im Europäischen<br />
Wirtschaftsraum (EWR - EU + Liechtenstein, Island und<br />
Norwegen)<br />
57<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Aufgaben <strong>de</strong>s<br />
Stufenplanbeauftragten<br />
58 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplanbeauftragter - Aufgaben<br />
Rechtsgrundlagen:<br />
• § 63a Abs. 1 AMG<br />
• § 19 AMWHV*<br />
(Außer<strong>de</strong>m: § 63b-j AMG)<br />
*AMWHV: Arzneimittel- und Wirkstoff-Herstellungs-Verordnung<br />
59<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplanbeauftragter - Aufgaben<br />
• Einrichtung / Führung eines <strong>Pharmakovigilanz</strong>-Systems<br />
• bekannt gewor<strong>de</strong>ne Meldungen über Arzneimittel-Risiken<br />
sammeln<br />
• unverzügliche Überprüfung <strong>de</strong>r Meldungen<br />
• Bewertung dieser Meldungen, ob<br />
• Arzneimittelrisiko vorliegt,<br />
• wie schwerwiegend es ist und<br />
• welche Maßnahmen zur Risikoabwehr geboten sind.<br />
• Koordinierung ggf. notwendiger Maßnahmen<br />
60<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplanbeauftragter - Aufgaben<br />
• Anzeigepflichten<br />
• Information <strong>de</strong>r BOB über Nutzen-Risiko-<br />
Bewertung einschließlich eigener Bewertungen<br />
(auf Verlangen)<br />
• Benachrichtigung <strong>de</strong>r Behör<strong>de</strong>n bei Rückrufen<br />
(ggf. Mitteilung, wohin AM exportiert wur<strong>de</strong>)<br />
• Benachrichtigung bei Verdacht auf Arzneimittel-<br />
o<strong>de</strong>r Wirkstofffälschungen (auch MAH)<br />
• ähnliche Anfor<strong>de</strong>rungen auch bei Prüfpräparaten<br />
(Zusammenarbeit mit Sponsor)<br />
61<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stufenplanbeauftragter - Aufgaben<br />
• Aufzeichnungen führen:<br />
• Inhalt <strong>de</strong>r Meldungen<br />
• Art <strong>de</strong>r Überprüfung<br />
• Ergebnis <strong>de</strong>r Bewertung<br />
• koordinierte Maßnahmen<br />
• Anzeigen<br />
• Benachrichtigungen<br />
• Mitwirkung bei diversen Aufgaben (PSMF,<br />
Vorbereitung, Begleitung und Nachbereitung behördlicher<br />
<strong>Pharmakovigilanz</strong>-Inspektionen,...)<br />
62<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Aufgaben <strong>de</strong>r QPPV<br />
63 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
GVP Modul I: Aufgaben <strong>de</strong>s MAH<br />
GVP Modul I: Responsibilities of the MAH in<br />
relation to the QPPV [I.C.1.1.]<br />
“Each PV system can have one QPPV.<br />
A QPPV may be<br />
• employed by more than one MAH, for a shared<br />
or for separate PV system or<br />
• may fulfil the role of QPPV for more than one<br />
PV system of the same MAH,<br />
provi<strong>de</strong>d that the QPPV is able to fulfil all<br />
obligations.”<br />
64<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Formale Anfor<strong>de</strong>rungen an eine QPPV<br />
• Sitz und Tätigkeit in einem EWR-Land [I.C.1.3]<br />
• D.h.: Wohnort und Arbeitsplatz in EWR [II.B]<br />
• Name und Kontaktdaten <strong>de</strong>n zuständigen<br />
Behör<strong>de</strong>n <strong>de</strong>r MS und EMA anzuzeigen [I.C.1.1]<br />
• Pflichten: in Job Description [I.C.1.1] beschreiben<br />
• Back up-Procedures (Stellvertreter) notwendig<br />
[I.C.1.3]<br />
• Zusätzlich national verantwortliche Personen<br />
möglich (wenn gesetzlich gefor<strong>de</strong>rt) [I.C.1.1]<br />
Stufenplanbeauftragter in Deutschland<br />
65<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Qualifikation <strong>de</strong>r QPPV<br />
GVP Modul I: Qualifikation <strong>de</strong>r QPPV [I.C.1.2.]<br />
Eine QPPV braucht<br />
• adäquates theoretisches und praktisches<br />
Wissen zur Durchführung von PV-Aktivitäten<br />
• Fähigkeiten zur Führung eines PV-Systems<br />
• Expertise in relevanten Bereichen (Medizin,<br />
Pharmazie, Epi<strong>de</strong>miologie und Biostatistik)<br />
• Zugang zu einer medizinisch ausgebil<strong>de</strong>ten<br />
Person, falls QPPV keine med. Ausbildung<br />
hat (“not completed basic medical training”)<br />
66<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Aufgaben <strong>de</strong>r QPPV [I.C.1.1] (1/4)<br />
• Überblick über<br />
• alle Arzneimittelsicherheitsprofile<br />
• aufkommen<strong>de</strong> Sicherheitsbe<strong>de</strong>nken<br />
• sicherheitsrelevante Verpflichtungen / Auflagen,<br />
die sich aus Zulassung o<strong>de</strong>r an<strong>de</strong>ren<br />
Verpflichtungen ergeben<br />
• Beteiligung an<br />
• Post-Authorisation Safety Studies (PASS)<br />
• Risikomanagement-Plänen (RMPs)<br />
• Risikominimierungsmaßnahmen<br />
67<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Aufgaben <strong>de</strong>r QPPV [I.C.1.1] (2/4)<br />
• Durchführung von PV-Aktivitäten<br />
• Zeitgerechte Einreichung korrekter und<br />
vollständiger Dokumente<br />
• Umgehen<strong>de</strong> Beantwortung aller Anfragen von<br />
nationalen Behör<strong>de</strong>n und EMA<br />
• Beteiligung bei Vorbereitung regulatorischer<br />
Aktivitäten<br />
• Kontinuierlich erreichbarer Ansprechparter<br />
für Behör<strong>de</strong>n (24/7)<br />
68<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Aufgaben <strong>de</strong>r QPPV [I.C.1.1] (3/4)<br />
Notwendig: Überblick über Funktionsfähigkeit<br />
<strong>de</strong>s gesamten PV-Systems inklusive QS<br />
• SOPs,<br />
• Verträge,<br />
• Datenbanken (inkl. Validierungsstatus, wichtige<br />
Än<strong>de</strong>rungen), insbeson<strong>de</strong>re bei UAW-DB<br />
• Compliance-Daten<br />
• Einzelfall- und periodische Berichte,<br />
• Auditberichte,<br />
• Training,...)<br />
• ...<br />
69<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Aufgaben <strong>de</strong>r QPPV [I.C.1.3] (4/4)<br />
The QPPV may <strong>de</strong>legate specific tasks, un<strong>de</strong>r<br />
supervision, to appropriately qualified and<br />
trained Individuals… provi<strong>de</strong>d that the QPPV<br />
maintains system oversight and overview of the<br />
safety profiles of all products.<br />
Such <strong>de</strong>legation should be documented.”<br />
70<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Innerbetriebliche<br />
Unterstützung von StB<br />
und QPPV<br />
Angaben im<br />
Zulassungsantrag<br />
71 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Angaben im Rahmen <strong>de</strong>r Zulassung<br />
16. AMG-Novelle: § 22 Abs. 2 Nr. 5 AMG<br />
(neu)<br />
Es sind ferner vorzulegen [...]<br />
„a) <strong>de</strong>n Nachweis, dass <strong>de</strong>r Antragsteller über eine<br />
qualifizierte Person nach § 63a verfügt und die<br />
Angabe <strong>de</strong>r MS, in <strong>de</strong>nen diese Person ansässig<br />
und tätig ist, […]<br />
c) Eine vom Antragsteller unterzeichnete Erklärung,<br />
dass er über die notwendigen Mittel verfügt, um<br />
<strong>de</strong>n im Zehnten Abschnitt aufgeführten Aufgaben<br />
und Pflichten [PV] nachzukommen.“<br />
72<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Angaben im Rahmen <strong>de</strong>r Zulassung<br />
16. AMG-Novelle: § 22 Abs. 2 Nr. 5 AMG<br />
(neu)<br />
16. AMG-Novelle (Amtl. Begründung):<br />
„Die Regelung stellt insbes. klar, dass die qualifizierte<br />
Person für <strong>Pharmakovigilanz</strong> nach<br />
Art. 104 Abs. 3 <strong>de</strong>r Stufenplanbeauftragte nach<br />
§ 63a ist...“<br />
73<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Ressourcen und Qualifikation<br />
§ 4 Abs. 1 AMWHV<br />
• Die Betriebe und Einrichtungen müssen über<br />
sachkundiges und angemessen qualifiziertes<br />
Personal in ausreichen<strong>de</strong>r Zahl verfügen.<br />
• Personal darf nur entsprechend seiner<br />
Ausbildung und Kenntnissen eingesetzt<br />
wer<strong>de</strong>n.<br />
74<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Innerbetriebliche Organisation<br />
§ 19 Abs. 8 AMWHV<br />
Pharm. Unternehmer hat dafür zu sorgen, dass<br />
alle im Betrieb eingehen<strong>de</strong>n<br />
• Meldungen über Arzneimittelrisiken und<br />
Beanstandungen sowie<br />
• Informationen für die Nutzen-Risiko-Bewertung<br />
eines Arzneimittels<br />
unverzüglich <strong>de</strong>m / <strong>de</strong>r Stufenplanbeauftragten<br />
[…] mitgeteilt wer<strong>de</strong>n.<br />
75<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Unterstützung <strong>de</strong>r QPPV durch MAH<br />
Unterstützung durch <strong>de</strong>n MAH [I.C.1.1]<br />
• Ausstattung <strong>de</strong>r QPPV mit ausreichen<strong>de</strong>r Authorität<br />
für Erfüllung bzw. Verän<strong>de</strong>rung <strong>de</strong>r PV-Aktivitäten<br />
und <strong>de</strong>s QS-Systems<br />
• Zugang und Anordnungsbefugnisse zum<br />
PSMF, RMPs, Information über alle Än<strong>de</strong>rungen<br />
• Zugang zu allen relevanten Informationen (z.B.<br />
zu klinischen Studien, aufkommen<strong>de</strong>n Sicherheitsbe<strong>de</strong>nken,<br />
allg. Informationen zum Nutzen-Risiko-<br />
Verhältnis)<br />
• Zugriff zur UAW-Datenbank<br />
76<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Unterstützung <strong>de</strong>r QPPV durch MAH<br />
Unterstützung [I.C.1.1] durch Information über<br />
• Ergebnisse von QS-Reviews zur PV und<br />
Maßnahmen und anstehen<strong>de</strong>n PV Audits<br />
QPPV soll auch Audits veranlassen können<br />
• Compliance und CAPAs nach Audits<br />
QPPV stellt Umsetzung <strong>de</strong>r CAPAs sicher<br />
• Käufe von Zulassungen o<strong>de</strong>r Unternehmen<br />
(frühzeitige Beteiligung am Due Diligence<br />
Prozess)<br />
77<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Outsourcing <strong>de</strong>r<br />
<strong>Pharmakovigilanz</strong><br />
78<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Rahmenbedingungen nach dt. Recht<br />
• AMG:<br />
§ 63b Abs. 7: Regelungen zur PhV bei pharm.<br />
Unternehmern, die nicht MAH sind (Mitvertreiber)<br />
• AMWHV*:<br />
Nur allgemeine Ausführungen zu Audits, Lieferantenqualifizierung<br />
etc.<br />
* AMWHV: Arzneimittel- und Wirkstoffherstellungs-Verordnung<br />
79<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Rahmenbedingungen nach dt. Recht<br />
•§ 9 AMWHV:<br />
„Für je<strong>de</strong> Tätigkeit im Auftrag, insbeson<strong>de</strong>re die<br />
Herstellung, Prüfung und das Inverkehrbringen<br />
o<strong>de</strong>r je<strong>de</strong>n damit verbun<strong>de</strong>nen Vorgang, <strong>de</strong>r im<br />
Auftrag ausgeführt wird, muss ein schriftlicher<br />
Vertrag zwischen Auftraggeber und Auftragnehmer<br />
bestehen. In <strong>de</strong>m Vertrag müssen die Verantwortlichkeiten<br />
je<strong>de</strong>r Seite klar festgelegt und insbeson<strong>de</strong>re<br />
die Einhaltung <strong>de</strong>r Guten Herstellungspraxis<br />
in <strong>de</strong>n Fällen <strong>de</strong>s § 3 Abs. 2 o<strong>de</strong>r <strong>de</strong>r Guten<br />
Fachlichen Praxis in <strong>de</strong>n Fällen <strong>de</strong>s § 3 Abs. 3<br />
geregelt sein.“<br />
80<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Rahmenbedingungen nach EU-Recht<br />
• Directive 2001/83, Regulation 726/2004: -<br />
• Modul I [C.1.5 “Quality System requirements for PV<br />
tasks subcontracted by the MAH”]<br />
“The MAH may subcontract certain activities of<br />
the PV system to third parties, i.e. to another<br />
organisation or person.<br />
This may inclu<strong>de</strong> the role of the QPPV.”<br />
81<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Rahmenbedingungen nach EU-Recht<br />
• Modul I [C.1.5 (“Quality System requirements for PV<br />
tasks subcontracted by the MAH”)]<br />
“The MAH shall nevertheless retain full<br />
responsibility for the completeness and<br />
accurance of the PSMF.<br />
The ultimate responsibility for the fulfilment<br />
of all PV tasks and responsibilities<br />
and the quality and integrity of the PV<br />
system always remains with the MAH.”<br />
82<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Rahmenbedingungen nach EU-Recht<br />
Regelungen bei Outsourcing <strong>de</strong>r PV<br />
• Sicherstellung eines effektiven QS-Systems<br />
• Detaillierter, aktueller und klarer Vertrag über<br />
Art und Umfang <strong>de</strong>r ausgelagerten PV-<br />
Aktivitäten und Verantwortlichkeiten <strong>de</strong>r<br />
Partner (Aufnahme in PSMF)<br />
• Regelmäßige Audits beim Dienstleister,<br />
Möglichkeiten zur Inspektion durch Behör<strong>de</strong>n<br />
83<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Konsequenz:<br />
Vertragliche Regelungen<br />
• Die Übertragung aller <strong>Pharmakovigilanz</strong>-Verpflichtungen<br />
auf Dritte kann vertraglich geregelt<br />
wer<strong>de</strong>n.<br />
Die Verantwortung bleibt trotz Outsour-<br />
cing beim MAH und <strong>de</strong>r QPPV<br />
84<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Vergleich von<br />
Stufenplanbeauftragten<br />
und QPPV<br />
85<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Vergleich von StB und QPPV<br />
StB<br />
QPPV<br />
Notwendigkeit <br />
Benennung bei<br />
Behör<strong>de</strong>n<br />
Ständige Erreichbarkeit <br />
Aufgaben Medizinische +<br />
pharmazeut. Mängel<br />
<br />
<br />
Nur medizinische<br />
Mängel<br />
Verantwortung / Haftung Persönliche Haftung Innerbetriebliche<br />
Haftung<br />
Sanktionen -<br />
86<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
EU-Pharma-Paket und 2.<br />
AMG-Än<strong>de</strong>rungsgesetz<br />
(“16. AMG-Novelle”)<br />
Än<strong>de</strong>rung <strong>de</strong>r <strong>Pharmakovigilanz</strong>-<br />
Gesetzgebung
88<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
89<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
90<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
91<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
92<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
93<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Allgemeiner Befund<br />
Zunehmen<strong>de</strong> Regelungsdichte in<br />
<strong>de</strong>r <strong>Pharmakovigilanz</strong> vs.<br />
Entbürokratisierung
“Entbürokratisierung”<br />
• Än<strong>de</strong>rung <strong>de</strong>r Richtlinie 2001/83/EG<br />
• früher: 8 Artikel zur PhV (Art. 101-108)<br />
• jetzt: 31 Artikel (Art. 101-104, 104a, 105, 106,<br />
106a, 107, 107a-r, 108, 108a, aa und b)<br />
• Good Pharmacovigilance Practise (anstelle<br />
Volume 9a)<br />
• „Delegated Act“ und „Implementing<br />
Regulation“<br />
• Heterogene nationale Regelungen (Gesetze,<br />
Verordnungen, Bekanntmachungen,...)<br />
* PhV: <strong>Pharmakovigilanz</strong><br />
95 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Commission Implementing<br />
Regulation<br />
(Durchführungsverordnung)
Implementing Regulation<br />
Befugnis für Kommission, zur Harmonisierung<br />
von Anfor<strong>de</strong>rungen verbindliche Regelungen zu<br />
erlassen (Art. 87a VO 726/2004, Art. 108 RL 2005/83)<br />
• Inhalt/Pflege <strong>de</strong>s PhV System Master File<br />
• Anfor<strong>de</strong>rungen an QS in <strong>de</strong>r PhV (MS, MAH)<br />
• Format/Inhalt <strong>de</strong>r elektronischen NW-Meldung<br />
• Format/Inhalt <strong>de</strong>r elektronischen PSURs und<br />
von Risikomanagement-Plänen<br />
• Format von Protokollen, Abstracts, Schlussberichten<br />
von Sicherheitsstudien nach<br />
Zulassung<br />
Etablierung zusätzlicher Anfor<strong>de</strong>rungen<br />
97 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Delegated Act<br />
Befugnis für Kommission, zur Harmonisierung<br />
von Anfor<strong>de</strong>rungen verbindliche Regelungen zu<br />
erlassen (Art. 87a VO 726/2004, Art. 108 RL 2005/83)<br />
• Format von Protokollen, Abstracts, Schlussberichten<br />
von Wirksamkeitsstudien nach<br />
Zulassung<br />
Noch nicht verabschie<strong>de</strong>t<br />
98 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Implementing Regulation<br />
99 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Implementing Regulation - Inhalte<br />
100 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Konkrete Auswirkungen<br />
auf das AMG
Neue Definitionen zur<br />
<strong>Pharmakovigilanz</strong><br />
(§ 4 AMG)
Neue Definitionen in § 4 Abs ...<br />
(34) Unbe<strong>de</strong>nklichkeitsstudie bei Human-AM<br />
(35) Unbe<strong>de</strong>nklichkeitsstudie bei Tier-AM<br />
(36) Risikomanagement-System<br />
(37) Risikomanagement-Plan “… ist eine <strong>de</strong>taillierte<br />
Beschreibung <strong>de</strong>s Risikomanagement-<br />
Systems“<br />
(38) <strong>Pharmakovigilanz</strong>-System<br />
(39) <strong>Pharmakovigilanz</strong>-Stammdokumentation<br />
Quelle: Richtlinie 2001/83, Art. 1 Nr. 15, 28b-e, 33<br />
103 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
<strong>Pharmakovigilanz</strong>-<br />
Stammdokumentation<br />
(§ 22 Abs. 5 AMG)
§ 63b: <strong>Pharmakovigilanz</strong>-System<br />
§ 63b AMG: Allgemeine <strong>Pharmakovigilanz</strong>-<br />
Pflichten <strong>de</strong>s Inhaber <strong>de</strong>r Zulassung<br />
„Der Inhaber <strong>de</strong>r Zulassung ist verpflichtet, bei AM,<br />
die zur Anwendung bei Menschen bestimmt sind,<br />
[…]<br />
eine <strong>Pharmakovigilanz</strong>-Stammdokumentation zu<br />
führen und diese auf Anfrage [lt. § 29 Abs. 1a AMG<br />
innerhalb von 7 Tagen] zur Verfügung zu stellen,<br />
[…]“<br />
105<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Zulassungsunterlagen in § 22 Abs. 2 Nr. 5 AMG<br />
<strong>Pharmakovigilanz</strong>-Stammdokumentation<br />
• konkrete Inhalte nicht im AMG geregelt<br />
in „Implementing Regulation“ <strong>de</strong>r EU festgelegt<br />
• ersetzt die bisherige „Detaillierte Beschreibung <strong>de</strong>s<br />
<strong>Pharmakovigilanz</strong>-Systems“ (DDPS)<br />
• beim MAH vorzuhalten (nicht routinemäßig einzureichen)<br />
• Nur „Kerninformationen“ mit Zulassungsantrag<br />
einzureichen (siehe § 22 Abs. 2 Nr. 5 AMG)<br />
106 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Zulassungsunterlagen in § 22 Abs. 2 Nr. 5 AMG<br />
„Es sind ferner vorzulegen: …<br />
bei AM, die zur Anwendung bei Menschen bestimmt sind,<br />
eine zusammenfassen<strong>de</strong> Beschreibung <strong>de</strong>s <strong>Pharmakovigilanz</strong>systems<br />
<strong>de</strong>s Antragstellers, die Folgen<strong>de</strong>s<br />
umfassen muss:<br />
a) Den Nachweis, dass <strong>de</strong>r Antragsteller über eine qualifizierte<br />
Person nach § 63a verfügt, und die Angabe <strong>de</strong>r<br />
Mitgliedstaaten, in <strong>de</strong>nen diese Person ansässig und<br />
tätig ist, sowie die Kontaktangaben zu dieser Person,<br />
b) die Angabe <strong>de</strong>s Ortes, an <strong>de</strong>m die <strong>Pharmakovigilanz</strong>-<br />
Stammdokumentation für das betreffen<strong>de</strong> AM geführt<br />
wird, und<br />
c) eine vom Antragsteller unterzeichnete Erklärung, dass er<br />
über die notwendigen Mittel verfügt, um <strong>de</strong>n im 10. Abschnitt<br />
aufgeführten Aufgaben und Pflichten nachzukommen.“<br />
107 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSMF: Implementing Regulation<br />
108<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSMF: Übergangsregelungen<br />
<strong>Pharmakovigilanz</strong>-Stammdokumentation<br />
• § 63b Abs. 2 Nr. 3 gilt für AM, die vor <strong>de</strong>m In-<br />
Kraft-Treten zugelassen wer<strong>de</strong>n,<br />
• ab <strong>de</strong>m 21. Juli 2015 o<strong>de</strong>r, falls früher<br />
• <strong>de</strong>m Datum <strong>de</strong>r Zulassungsverlängerung.<br />
• § 63b Abs. 2 Nr. 3 gilt für AM, die vor <strong>de</strong>m In-<br />
Kraft-Treten ein Zulassungsantrag gestellt<br />
wur<strong>de</strong>, ab <strong>de</strong>m 21. Juli 2015<br />
109 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Ordnungswidrig han<strong>de</strong>lt, wer vorsätzlich o<strong>de</strong>r<br />
fahrlässig entgegen …<br />
§ 63b Abs. 2 ...<br />
§ 97: Ordnungswidrigkeiten<br />
(40) Nr. 3 keine PV-Stammdokumentation führt /<br />
nicht rechtzeitig zur Verfügung stellt, …<br />
Bußgeld bis zu 25.000 € !<br />
110<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Good Vigilance Practice –<br />
das “Kleingedruckte” <strong>de</strong>r<br />
<strong>Pharmakovigilanz</strong>
GVP-Module<br />
112 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Good Vigilance Practice<br />
Modul II
GVP-Module<br />
114 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSMF: GVP-Modul II<br />
115 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
116 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Inhalte nach GVP - Module II (PSMF)<br />
1. QPPV<br />
Stammdokumentation - Inhalte<br />
2. Organisational structure of the MAH<br />
3. PSMF section on sources of safety data<br />
4. PSMF Section on Computerised Systems and<br />
Databases<br />
5. Pharmacovigilance Processes<br />
6. Pharmacovigilance System Performance<br />
7. PSMF section on quality system<br />
Annexe A – H<br />
Logbuch<br />
117 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stammdokumentation - Inhalte<br />
Detail-Inhalte (1/2)<br />
5. Pharmacovigilance Processes<br />
• QPPV<br />
• Overview of corporate pharmacovigilance units and<br />
organisations<br />
• Site(s) where the PV activities are un<strong>de</strong>rtaken<br />
• Description of <strong>de</strong>legated PV activities and/or services<br />
• Links with other organizations<br />
• <strong>Uni</strong>ts/sites for ICSR collection<br />
• Studies/programmes sponsored by the MAH<br />
• Flow diagram for ICSRs from different sources<br />
• Continuous monitoring of product risk benefit profile<br />
• Risk Management System(s)/Risk Management Plan<br />
• Collection, assessment and reporting of ICSRs<br />
118<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Stammdokumentation - Inhalte<br />
Detail-Inhalte (2/2)<br />
5. Pharmacovigilance Processes<br />
• PSUR (scheduling, production, submission)<br />
• Communication of safety concerns<br />
• Implementation of Safety Variations<br />
• Involvement of QPPV in routine PV Activities<br />
• Response to Competent Authority requests<br />
• Literature Search<br />
• Safety Database Change Control<br />
• Safety Data Exchange Agreements<br />
• Safety Data Archiving<br />
• Pharmacovigilance Auditing<br />
• Quality control<br />
• Training<br />
119 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Zulassungsunterlagen in § 22 Abs. 2 Nr. 5 AMG<br />
Wer muss PSMF erstellen ?<br />
• Alle Zulassungsinhaber<br />
• Inhaber einer trad. pflanzlichen Registrierung<br />
(§ 39a AMG)<br />
Nicht jedoch<br />
• Inhaber einer homöopathischen Registrierung<br />
(§ 38 AMG)<br />
Befreit von Vorlage von Unterlagen nach § 22<br />
Abs. 2 Nr. 5 AMG<br />
120 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Exkurs:<br />
BAH-Vorschlag<br />
zur <strong>Pharmakovigilanz</strong>-<br />
Stammdokumentation
PSMF: Vorschlag <strong>de</strong>s BAH<br />
122<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSMF-Template: Hinweis<br />
Die Arbeitsgruppe möchte mit ihren Empfehlungen<br />
Anregungen für die Ausgestaltung <strong>de</strong>r <strong>Pharmakovigilanz</strong>-<br />
Stammdokumentation geben. Die Arbeitsgruppe legt<br />
großen Wert darauf, hinzuweisen, dass die im Dokument<br />
enthaltenen Formulierungen keineswegs allgemeingültig<br />
sind, son<strong>de</strong>rn vielmehr an die individuelle Situation<br />
je<strong>de</strong>s Unternehmens angepasst wer<strong>de</strong>n müssen.<br />
Da zum Zeitpunkt <strong>de</strong>r Erstellung <strong>de</strong>s Dokuments die zu<br />
Grun<strong>de</strong> liegen<strong>de</strong>n Rechtsvorschriften erst wenige Wochen<br />
verfügbar waren, betrat die Arbeitsgruppe weitgehend<br />
Neuland. Für konstruktive Kritik und Anregungen zur<br />
Optimierung dieses Papiers ist die Arbeitsgruppe<br />
je<strong>de</strong>rzeit offen und dankbar.<br />
123<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSMF-Template: Autorengruppe<br />
124<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSMF: Template für Summary (1/2)<br />
125<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSMF: Template für Summary (2/2)<br />
126<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSMF: Template für Hauptdokument<br />
PSMF-Template<br />
<strong>de</strong>s BAH am 3.<br />
September 2012<br />
für Mitgliedsfirmen<br />
zum Download<br />
bereitgestellt.<br />
127 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSMF: Vorschlag <strong>de</strong>s BAH<br />
128<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Vorschlag <strong>de</strong>s BAH: Beispiel<br />
129<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Vorschlag <strong>de</strong>s BAH: Beispiel<br />
130<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Vorschlag <strong>de</strong>s BAH: Beispiel<br />
131<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
… zurück zum<br />
Arzneimittelgesetz …
Risikomanagement-<br />
Pläne<br />
(§ 22 Abs. 5a u. 6 AMG)
Zulassungsunterlagen (§ 22 Abs. 2 AMG)<br />
Risikomanagement bei Human-AM (§ 22<br />
Abs. 2 Nr. 5a AMG)<br />
• RM*-Plan mit Beschreibung <strong>de</strong>s RM-Systems,<br />
das Antragsteller für das betreffen<strong>de</strong> AM<br />
einführen wird, mit Zusammenfassung<br />
RM bei Tier-AM (§ 22 Abs. 2 Nr. 6 AMG):<br />
• entspricht bisherigem § 22 Abs. 2 Nr. 5 AMG<br />
* RM: Risikomanagement<br />
134 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Auflagenbefugnis zum<br />
Risikomanagement<br />
(§ 28 AMG)
Auflagen bei Zulassung (§ 28 Abs. 3a AMG)<br />
Auflagen bei Erteilung <strong>de</strong>r Zulassung durch<br />
BOB*:<br />
• bestimmte im Risikomanagement-System enthaltene<br />
Maßnahmen zur sicheren Anwendung <strong>de</strong>s AM<br />
• Durchführung von Unbe<strong>de</strong>nklichkeitsstudien<br />
• zusätzliche Verpflichtungen zur Erfassung und<br />
Meldung von Nebenwirkungen<br />
• sonst. Maßnahmen zur sicheren Anwendung <strong>de</strong>s AM<br />
• Einführung eines angemessenen PV-Systems<br />
wenn dies im Interesse <strong>de</strong>r Arzneimittelsicherheit<br />
erfor<strong>de</strong>rlich ist.<br />
* BOB: Bun<strong>de</strong>soberbehör<strong>de</strong><br />
136<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Auflagen bei Zulassung (§ 28 Abs. 3a AMG)<br />
Auflagen bei Erteilung <strong>de</strong>r Zulassung durch BOB*<br />
(im Interesse <strong>de</strong>r Arzneimittelsicherheit):<br />
• Wirksamkeitsstudien nach <strong>de</strong>r Zulassung (bei Be<strong>de</strong>nken<br />
bzgl. einzelner Aspekte <strong>de</strong>r Wirksamkeit, die<br />
erst nach Inverkehrbringen beseitigt wer<strong>de</strong>n können).<br />
* BOB: Bun<strong>de</strong>soberbehör<strong>de</strong><br />
137<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Auflagen nach Zulassung (§ 28 Abs. 3b AMG)<br />
Auflagen nach Erteilung <strong>de</strong>r Zulassung durch<br />
BOB:<br />
• Risikomanagement-System und -Plan einführen<br />
• Durchführung von Unbe<strong>de</strong>nklichkeitsstudien<br />
wenn dies im Interesse <strong>de</strong>r Arzneimittelsicherheit<br />
erfor<strong>de</strong>rlich ist.<br />
138 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Auflagen nach Zulassung (§ 28 Abs. 3b AMG)<br />
Auflagen nach Erteilung <strong>de</strong>r Zulassung durch<br />
BOB (im Interesse <strong>de</strong>r Arzneimittelsicherheit):<br />
• Durchführung von Wirksamkeitsstudien, wenn<br />
• Erkenntnisse über Krankheit o<strong>de</strong>r klinische Methodik<br />
darauf hin<strong>de</strong>uten, dass frühere Bewertungen <strong>de</strong>r<br />
Wirksamkeit erheblich korrigiert wer<strong>de</strong>n müssen.<br />
• Verpflichtung muss Vorgaben <strong>de</strong>s Art. 22a Abs. 1<br />
Buchstabe b Satz 2 <strong>de</strong>r RL 2001/83 entsprechen<br />
[Vorgaben <strong>de</strong>s „Delegated Act“ und wiss. Leitlinien]<br />
• Mehrere AM, die in mehreren MS zugelassen sind:<br />
Empfehlung <strong>de</strong>r BOB nach Abstimmung mit PRAC einer<br />
gemeinsamen Wirksamkeitsstudie nach Zulassung<br />
139 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Weitere Auflagen (§ 28 Abs. 3e und f AMG)<br />
§ 28 Abs. 3e (neu)<br />
Bei Auflagen nach Abs. 3, 3a und 3b kann BOB<br />
• Art, Umfang und Zeitrahmen <strong>de</strong>r Studien o<strong>de</strong>r<br />
Prüfungen sowie<br />
• Tätigkeiten, Maßnahmen und Bewertungen im PV-<br />
System bestimmen.<br />
Die Ergebnisse sind durch Unterlagen zu belegen (Art,<br />
Umfang, Zeitpunkt <strong>de</strong>r Studie/Prüfung).<br />
§ 28 Abs. 3f (neu)<br />
MAH hat alle Auflagen nach Abs. 3, 3a und 3b in<br />
sein Risikomanagement-System aufzunehmen.<br />
140 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Details:<br />
GVP Modul V
GVP-Modul V<br />
142 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
<strong>Pharmakovigilanz</strong>-<br />
System<br />
(§ 63b AMG)
§ 63b: <strong>Pharmakovigilanz</strong>-System (1/5)<br />
§ 63b AMG: Allgemeine <strong>Pharmakovigilanz</strong>-<br />
Pflichten <strong>de</strong>s Inhaber <strong>de</strong>r Zulassung<br />
• Einrichten/Betreiben eines PV-Systems<br />
• MAH ist verpflichtet, für Human-AM<br />
• Sämtliche Informationen wiss. zu bewerten<br />
• Möglichkeiten zu Risikominimierung und –<br />
vermeidung prüfen<br />
• ggf. Maßnahmen ergreifen (teilweise neu)<br />
144<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 63b: <strong>Pharmakovigilanz</strong>-System (2/5)<br />
• MAH ist verpflichtet, für Human-AM<br />
• PV-System regelmäßig zu auditieren, die wichtigsten<br />
Ergebnisse in <strong>de</strong>r PV-Stammdokumentation zu<br />
vermerken (neu)<br />
Problem: Was sind die „wichtigsten“ Ergebnisse?<br />
wichtig: critical und major (GVP-Modul)<br />
Regierungsentwurf ergänzt [RL 2001/83/EU, Art. 104]:<br />
„…; wenn die Maßnahmen zur Mängelbeseitigung<br />
vollständig durchgeführt sind, kann <strong>de</strong>r Vermerk<br />
gelöscht wer<strong>de</strong>n.“<br />
145<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 63b: <strong>Pharmakovigilanz</strong>-System (3/5)<br />
• MAH ist verpflichtet, für Human-AM<br />
• PV-Stammdokumentation führen, auf Anfrage<br />
vorzulegen (neu)<br />
• Wem vorlegen?<br />
RL 2001/83, Art. 23: „Die zuständige nationale Behör<strong>de</strong><br />
kann […] verlangen. Der Inhaber <strong>de</strong>r Genehmigung<br />
[…] muss diese Kopie spätestens sieben Tage nach<br />
Erhalt <strong>de</strong>r Auffor<strong>de</strong>rung vorlegen.“<br />
146<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 63b: <strong>Pharmakovigilanz</strong>-System (4/5)<br />
• MAH ist verpflichtet, für Human-AM …<br />
• Risikomanagement-System für je<strong>de</strong>s einzelne<br />
AM zu betreiben, das nach Inkrafttreten <strong>de</strong>r Novelle<br />
zugelassen wur<strong>de</strong> o<strong>de</strong>r entsprechen<strong>de</strong> Auflage hat<br />
(neu)<br />
147<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 63b: <strong>Pharmakovigilanz</strong>-System (5/5)<br />
• MAH ist verpflichtet, für Human-AM …<br />
• Ergebnisse von Risikominimierungs-Maßnahmen<br />
zu überwachen, die Teil eines RMP sind o<strong>de</strong>r<br />
auferlegt wur<strong>de</strong>n (neu)<br />
• Risikomanagement-System zu aktualisieren, PV-<br />
Daten überwachen (Ermittlung neuer Risiken o<strong>de</strong>r<br />
Än<strong>de</strong>rungen im Nutzen-Risiko-Verhältnis) (neu)<br />
• zusätzliche Anfor<strong>de</strong>rungen bei biologischen AM<br />
(Verschreibungszahlen, I<strong>de</strong>ntifikation von AM) (neu)<br />
• Keine Veröffentlichung von PV-Informationen<br />
ohne vorherige o<strong>de</strong>r gleichzeitige Information<br />
<strong>de</strong>r Behör<strong>de</strong>n (bisher § 63b Abs. 5b)<br />
148<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Details:<br />
GVP Modul I
GVP-Modul I<br />
150 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einzelfall-Anzeigepflichten<br />
(§ 63c AMG )
Neue Definitionen zur<br />
<strong>Pharmakovigilanz</strong><br />
(§ 4 AMG)
Neue Definitionen in § 4 Abs ...<br />
(13) Nebenwirkungen bei Human-AM*<br />
„… sind schädliche und unbeabsichtigte Reaktionen<br />
auf das AM.“<br />
Verzicht auf Verknüpfung mit „bestimmungsgemäßem<br />
Gebrauch“<br />
Konsequenz:<br />
• beträchtliche Erweiterung <strong>de</strong>r Mel<strong>de</strong>pflichten<br />
• Aufgabe <strong>de</strong>s internationalen Konsenses (ICH)<br />
Quelle: Richtlinie 2001/83, Art. 1 Nr. 11, 12<br />
* AM: Arzneimittel<br />
153 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einzelfall-Mel<strong>de</strong>pflichten nach § 63c AMG<br />
• Viel mehr Einzelfallberichte beschleunigt<br />
anzeigepflichtig<br />
• alle schwerwiegen<strong>de</strong>n UAW* aus D und aus<br />
Drittstaaten binnen 15 Tagen<br />
• alle nicht-schwerwiegen<strong>de</strong>n UAW aus D<br />
binnen 90 Tagen auf Auffor<strong>de</strong>rung<br />
• ausschließlich elektronische Meldung (neu)<br />
• Keine weitere Differenzierung für Reporting-<br />
Zwecke (Quelle, erwartet/unerwartet)<br />
• Keine Verknüpfung mit bestimmungsgemäßen<br />
Gebrauch<br />
* UAW: unerwünschte Arzneimittelwirkung<br />
154 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einzelfall-Mel<strong>de</strong>pflichten nach § 63c AMG<br />
• Verpflichtung <strong>de</strong>s MAH, UAW-Berichte an zentraler<br />
Stelle im Unternehmen verfügbar halten<br />
• Anzeigepflichten gelten entsprechend für...<br />
• Inhaber <strong>de</strong>r Registrierung nach § 39a [trad.<br />
pflanzliche AM] und entsprechen<strong>de</strong><br />
Mitvertreiber<br />
• Inhaber <strong>de</strong>r Registrierung nach § 38 [Homöopathika]<br />
und entsprechen<strong>de</strong> Mitvertreiber<br />
• über das En<strong>de</strong> <strong>de</strong>s Inverkehrbringens, <strong>de</strong>r Zulassung/Registrierung<br />
hinaus (wie bisher)<br />
• schriftlicher Vertrag zwischen MAH und Mitvertreiber<br />
zur Delegation <strong>de</strong>r Aufgaben auf MAH<br />
möglich (wie bisher)<br />
155 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einzelfall-Mel<strong>de</strong>pflichten: Bewertung<br />
Einerseits ...<br />
... viel mehr Einzelfallberichte beschleunigt<br />
anzeigepflichtig<br />
• alle schwerwiegen<strong>de</strong>n UAW*<br />
• (perspektivisch) alle nicht-schwerwiegen<strong>de</strong>n<br />
UAW aus <strong>de</strong>r EU<br />
• Keine Differenzierung erwartet/unerwartet für<br />
Reporting-Zwecke<br />
• Verzicht auf "bestimmungsgemäßen Gebrauch"<br />
in <strong>de</strong>r UAW-Definition<br />
* UAW: unerwünschte Arzneimittelwirkung<br />
156 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einzelfall-Mel<strong>de</strong>pflichten: Bewertung<br />
An<strong>de</strong>rerseits ...<br />
... Vereinfachung <strong>de</strong>r Mel<strong>de</strong>pflichten<br />
• ausschließlich elektronische Meldung<br />
• ausschließlich an EMA (EV*-Datenbank)<br />
• keine nationalen Son<strong>de</strong>rregelungen<br />
* EV: EudraVigilance<br />
157 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einzelfall-Mel<strong>de</strong>pflichten: Kompromiss<br />
Ausgangssituation<br />
• MS möchten Fälle direkt von MAH erhalten<br />
• EMA möchte alle Fälle in EudraVigilance (EV)<br />
haben<br />
Der „Deal“…<br />
• Alle Fälle gehen an EV<br />
• EV routet Fälle unverzüglich an MS weiter<br />
158 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einzelfall-Mel<strong>de</strong>pflichten: Kompromiss<br />
Der Haken daran…<br />
• Testat zur Funktionsfähigkeit von EV durch<br />
unabhängiges Audit erfor<strong>de</strong>rlich<br />
• Übergangsphase: weiterhin Meldung an MS<br />
• Bis dahin: erhöhtes Fallaufkommen an alle<br />
zuständigen MS / EMA !<br />
bis auf Weiteres keine Vereinfachung<br />
159 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einzelfallmeldungen: Übergangsregelungen<br />
Artikel 2 <strong>de</strong>s 2. AMG-Än<strong>de</strong>rungsgesetzes<br />
• „§ 63c Abs. 5 Satz 2 [wird] 6 Monate, nach<strong>de</strong>m<br />
die EMA bekannt gegeben hat, dass die<br />
Datenbank [EudraVigilance] über die erfor<strong>de</strong>rliche<br />
Funktion […] verfügt, wie folgt<br />
gefasst:<br />
„Für die AM gelten die Verpflichtungen <strong>de</strong>s<br />
pharmazeutischen Unternehmers nach <strong>de</strong>r<br />
Verordnung (EG) Nr. 726/2004 in <strong>de</strong>r jeweils<br />
gelten<strong>de</strong>n Fassung.“<br />
160 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Details:<br />
GVP Modul VI
GVP-Modul VI<br />
162 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Pharmapaket:<br />
Zentrale Literaturrecherche<br />
durch EMA
Literaturrecherche durch EMA<br />
• EMA soll Literaturrecherche übernehmen<br />
• für bestimmte Wirkstoffe<br />
• in bestimmten Publikationen/Zeitschriften<br />
Publikation jeweils einer Liste<br />
• <strong>de</strong>taillierte Regelungen in einem Gui<strong>de</strong><br />
• Entbindung <strong>de</strong>r MAH* vom Reporting<br />
auch von <strong>de</strong>r internen Bewertung (Nutzen-<br />
Risiko-Verhältnis, Labelling, ...) ???<br />
• MAH*: weiterhin Recherche für alle an<strong>de</strong>ren<br />
Wirkstoffe und Publikationen<br />
* MAH: Marketing Authorisation Hol<strong>de</strong>r = Zulassungsinhaber<br />
164 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Offene Fragen (u.a.)<br />
Literaturrecherche - Fazit<br />
• Wie umfangreich wird EMA-Portfolio ?<br />
• Wie wird bewertet ?<br />
• Was wird wie verfügbar gemacht ?<br />
• Weitere For<strong>de</strong>rungen <strong>de</strong>r Industrie<br />
• transparente Prozesse (SOPs,...)<br />
• Zugriff durch Industrie<br />
• rechtliche Klarstellung <strong>de</strong>r Pflichten <strong>de</strong>r MAHs<br />
(Akzeptanz <strong>de</strong>r zentralen Recherche in nat.<br />
Rechten, Umgang mit nationalen Journals,...)<br />
165 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Literaturrecherche: Übergangsregelungen<br />
Artikel 2 <strong>de</strong>s 2. AMG-Än<strong>de</strong>rungsgesetzes<br />
• Bei AM mit Wirkstoffen, auf die sich die Liste<br />
von Veröffentlichungen bezieht, die die EMA<br />
[…] auswertet, muss <strong>de</strong>r MAH die in <strong>de</strong>r angeführten<br />
med. Fachliteratur verzeichneten Verdachtsfälle<br />
von NW nicht an die EudraVigilance-Datenbank<br />
übermitteln;<br />
• Er muss aber die an<strong>de</strong>rweitige medizinische<br />
Fachliteratur auswerten und alle Verdachtsfälle<br />
über NW […] mel<strong>de</strong>n.<br />
166 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Periodic Safety Update<br />
Reports (PSURs)<br />
(§ 63d, h und i AMG)
Neuregelungen zu PSURs<br />
• Getrennte / unterschiedliche Regelungen<br />
• § 63d: PSURs für Human-AM (neu)<br />
• § 63h Abs. 5 zu Tier-AM (wie bisher)<br />
• § 63i Abs. 4 für Blut- u. Gewebezubereitungen<br />
(wie bisher)<br />
Nachfolgend Fokussierung auf Human-AM<br />
(§ 63d AMG)<br />
168<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSURs für Human-AM<br />
• Reduzierte Inhalte (§ 63d Abs. 1 AMG)<br />
• Zusammenfassung von Daten für die Beurteilung<br />
<strong>de</strong>r Nutzen-Risiko-Bilanz (einschließlich aller<br />
Studien mit Auswirkungen auf die Zulassung)<br />
• wiss. Bewertung <strong>de</strong>s Nutzen-Risiko-Verhältnisses<br />
(auch unter Berücksichtigung von Anwendungen<br />
außerhalb zugelassener Indikationen)<br />
• Daten zur Absatzmenge, Verschreibungsvolumen,<br />
Patientenexposition<br />
Keine umfangreichen Einzelfall-Listen mehr<br />
• § 63d Abs. 2: PSUR-Vorlage nur elektronisch<br />
169<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSURs für Human-AM<br />
•Vorlagefrequenz (§ 63d Abs. 3 AMG)<br />
• In <strong>de</strong>r Zulassung angegeben o<strong>de</strong>r<br />
• In <strong>de</strong>r EU festgelegt (Verweis auf Art. 107c Abs. 4<br />
RL 2001/83)<br />
• Möglichkeit <strong>de</strong>r Beantragung von Stichtagen/<br />
Frequenz <strong>de</strong>r Einreichung durch MAH<br />
• Bei vor <strong>de</strong>m In-Kraft-Treten <strong>de</strong>r Novelle o<strong>de</strong>r<br />
rein national zugelassenen AM: Beibehaltung<br />
<strong>de</strong>r bisherigen Frequenz (1/2 jährlich, jährlich,<br />
alle 3 Jahre)<br />
170<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSURs für Human-AM<br />
• Befreiung von PSURs (§ 63d Abs. 4 AMG)<br />
• AM nach § 22 Abs. 3 (well-established use)<br />
• AM nach § 24b Abs. 2 (Generika)<br />
• Registrierungen nach §§ 38 [Homöopathika]<br />
und 39a [trad. pflanzl. AM] + jew. Mitvertreiber<br />
• Nur ausnahmsweise PSURs, …<br />
• wenn dies per Auflage angeordnet<br />
• bei Be<strong>de</strong>nken hinsichtlich <strong>Pharmakovigilanz</strong><br />
o<strong>de</strong>r bei nicht ausreichend vorliegen<strong>de</strong>n PSURs<br />
• wenn Frequenz /Termine entsprechend URD-<br />
Liste in Zulassung festgelegt<br />
171<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Ausgangssituation<br />
• MS möchten PSURs direkt von MAH erhalten<br />
(Gebühren …)<br />
• EMA will PSURs direkt erhalten<br />
Der „Deal“…<br />
PSURs: Kompromiss<br />
• Alle PSURs gehen an EMA<br />
• EMA errichtet PSUR-Repository (Zugriff: MS)<br />
172 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Einzelfall-Mel<strong>de</strong>pflichten: Kompromiss<br />
PSUR-Befreiung ist sofort umsetzungspflichtig!<br />
die meisten Produkte sofort befreit<br />
Der (kleine) Haken für die an<strong>de</strong>ren …<br />
• Testat zur Funktionsfähigkeit <strong>de</strong>s Repository<br />
durch unabhängiges Audit erfor<strong>de</strong>rlich<br />
• Übergangsphase !<br />
173 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PSURs: Übergangsregelungen<br />
Artikel 2 <strong>de</strong>s 2. AMG-Än<strong>de</strong>rungsgesetzes<br />
• „§ 63d Abs. 2 [wird] 12 Monate nach Bekanntgabe<br />
durch die EMA, dass das<br />
Datenarchiv [PSUR-Repository] über seine<br />
Funktionsfähigkeit verfügt, wie folgt gefasst:<br />
„(2) Die Übermittlung <strong>de</strong>r regelmäßigen aktualisierten<br />
Unbe<strong>de</strong>nklichkeitsberichte hat elektronisch<br />
zu erfolgen.“<br />
174 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Details:<br />
GVP Modul VII
PSMF: GVP-Modul VII<br />
176 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 62 Abs. 6 AMG: PV-Inspektionen<br />
<strong>Pharmakovigilanz</strong>-<br />
Inspektionen<br />
177<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
<strong>Pharmakovigilanz</strong>-Inspektionen<br />
§ 62 Abs. 6 AMG:<br />
Die zuständige Bun<strong>de</strong>soberbehör<strong>de</strong> (BOB) kann in<br />
Betrieben …, die Arzneimittel herstellen o<strong>de</strong>r in <strong>de</strong>n<br />
Verkehr bringen …, die<br />
• Sammlung/Auswertung von AM-Risiken und<br />
• Koordinierung notwendiger Maßnahmen<br />
überprüfen.<br />
Zu diesem Zweck können Beauftragte <strong>de</strong>r zuständigen<br />
BOB im Benehmen mit <strong>de</strong>r zuständigen (Lan<strong>de</strong>s-)Behör<strong>de</strong><br />
Betriebs- und Geschäftsräume zu <strong>de</strong>n üblichen<br />
Geschäftszeiten betreten, Unterlagen einsehen<br />
sowie Auskünfte verlangen.<br />
178<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 63b Abs. 5a AMG: Inspektionen<br />
Erläuterung in Begründung zum AMG<br />
Prüfungen erstrecken sich insbeson<strong>de</strong>re auf:<br />
• Einzelfallmeldungen (Fristen, Bewertung,<br />
Nachverfolgung u.a.),<br />
• PSURs<br />
• Organisationsstruktur <strong>de</strong>s vorhan<strong>de</strong>nen<br />
<strong>Pharmakovigilanz</strong>systems<br />
179<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 63b Abs. 5a AMG: Inspektionen<br />
Konsequenzen für die Unternehmen:<br />
• Vorbereitungen treffen, u.a.<br />
• Erstellung einer <strong>Pharmakovigilanz</strong>-Stammdokumentation<br />
(PSMF)<br />
• Überprüfung <strong>de</strong>r innerbetrieblichen Arbeitsabläufe<br />
(SOPs, Compliance, Verankerung SB,...)<br />
• Überprüfung <strong>de</strong>r Ressourcen für <strong>Pharmakovigilanz</strong><br />
(Personal, Technik,...)<br />
• Überprüfung <strong>de</strong>r vertraglichen Regelungen mit<br />
Partnern (Co-Marketing, Lizenzpartner, Dienstleister,...)<br />
180<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
<strong>Pharmakovigilanz</strong>-Kommunikation<br />
§ 63b Abs. 3 AMG:<br />
Der Inhaber <strong>de</strong>r Zulassung darf im Zusammenhang mit<br />
<strong>de</strong>m zugelassenen AM keine<br />
die <strong>Pharmakovigilanz</strong> betreffen<strong>de</strong>n Informationen<br />
ohne<br />
vorherige o<strong>de</strong>r gleichzeitige Mitteilung an die<br />
zuständige BOB<br />
öffentlich bekannt machen.<br />
Er stellt sicher, dass solche Informationen in objektiver<br />
und nicht irreführen<strong>de</strong>r Weise dargelegt wer<strong>de</strong>n.<br />
181<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Internationale Zusammenarbeit<br />
§ 62 Abs. 3 AMG:<br />
Die zuständige BOB hat […]<br />
• je<strong>de</strong>n ihr gemel<strong>de</strong>ten und im Inland aufgetretenen<br />
Verdachtsfall einer schwerwiegen<strong>de</strong>n Nebenwirkung<br />
innerhalb von 15 Tagen<br />
• und im Inland aufgetretenen Verdachtsfall einer<br />
nicht-schwerwiegen<strong>de</strong>n Nebenwirkung innerhalb<br />
von 90 Tagen<br />
elektronisch an die Datenbank nach Art. 24 <strong>de</strong>r<br />
Verordnung 726/2004 (EudraVigilance-Datenbank)<br />
[…] zu übermitteln.<br />
Zentrale Sammlung in einer EU-weiten Datenbank<br />
182<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Weitere Verpflichtungen<br />
§ 63c Abs. 4 AMG: Verpflichtungen u.a. für<br />
Inhaber von Registrierungen und für<br />
Mitvertreiber<br />
Die Verpflichtungen nach § 63 Abs. 1-3 (Einzelfälle),<br />
§ 62 Abs. 6 (Inspektionen) und § 63b (PV-System)<br />
gelten für<br />
• Inhaber von Registrierungen nach § 39a (traditionelle<br />
pflanzliche AM)<br />
• Mitvertreiber.<br />
183<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Weitere Verpflichtungen<br />
§ 63c Abs. 4 AMG: Verpflichtungen u.a. für<br />
Inhaber von Registrierungen und für<br />
Mitvertreiber<br />
Die Verpflichtungen nach § 63 Abs. 1-3 (Einzelfälle)<br />
gelten für<br />
• Inhaber von Registrierungen nach § 38 (homöopathische<br />
Registrierungen)<br />
• Mitvertreiber solcher Registrierungen<br />
• Antragsteller vor Erteilung <strong>de</strong>r Zulassung.<br />
184<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Details:<br />
GVP Modul III
GVP-Modul III<br />
186 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Nichtinterventionelle<br />
Unbe<strong>de</strong>nklichkeitsprüfungen<br />
(NISS)
NISS nach § 63f AMG<br />
• § 63f: Allgemeine Voraussetzungen für NISS<br />
• § 63g: Beson<strong>de</strong>re Voraussetzungen für<br />
angeordnete NISS<br />
• NISS, die freiwillig vom MAH durchgeführt<br />
wer<strong>de</strong>n, sind <strong>de</strong>r BOB, KBV, SpiBU <strong>de</strong>r Krankenkassen<br />
und Verband <strong>de</strong>r PKV anzuzeigen.<br />
• Die BOB kann Protokoll und Berichte anfor<strong>de</strong>rn.<br />
• Innerhalb eines Jahres nach Abschluss <strong>de</strong>r Datenerfassung<br />
muss <strong>de</strong>r MAH <strong>de</strong>n Abschlussbericht<br />
übermitteln.<br />
188 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
NISS nach § 63f AMG<br />
• Für NISS, die nach § 28 Abs. 3, 3a o<strong>de</strong>r 3b<br />
aufgelegt wur<strong>de</strong>n, gilt Verfahren nach § 63g.<br />
• Durchführung von Unbe<strong>de</strong>nklichkeitsprüfungen ist<br />
nicht zulässig, wenn<br />
• durch sie <strong>de</strong>r Absatz geför<strong>de</strong>rt wer<strong>de</strong>n soll<br />
• unzulässig hohe Vergütungen (Zeitaufwand, Kosten)<br />
an Angehörige <strong>de</strong>r Gesundheitsberufe gezahlt<br />
wer<strong>de</strong>n<br />
• ein Anreiz für bevorzugte Verschreibung o<strong>de</strong>r<br />
Empfehlung bestimmter AM entsteht.<br />
• NISS sind <strong>de</strong>r KBV, SpiBu und Verband <strong>de</strong>r PKV<br />
unverzüglich anzuzeigen (Angabe von Ort, Zeit,<br />
Ziel, Protokoll, beteiligte Ärzte, Honorare).<br />
189 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
NISS nach § 63g AMG<br />
• MAH hat bei NISS, die nach § 28 Abs. 3, 3a<br />
o<strong>de</strong>r 3b aufgelegt wur<strong>de</strong>n<br />
• Entwurf <strong>de</strong>s Studienprotokolls vor Durchführung<br />
<strong>de</strong>r BOB (bei Studien im Inland) o<strong>de</strong>r <strong>de</strong>m PRAC<br />
(bei multinationalen Studien) vorzulegen<br />
• NISS darf nur nach Genehmigung <strong>de</strong>s Protokollentwurfs<br />
begonnen wer<strong>de</strong>n.<br />
• BOB hat dafür 60 Tage Zeit.<br />
• Genehmigung ist zu versagen, wenn dadurch<br />
• Anwendung <strong>de</strong>s AM geför<strong>de</strong>rt wer<strong>de</strong>n soll<br />
• Ziele nicht erreicht wer<strong>de</strong>n können<br />
• es sich um klinische Prüfung han<strong>de</strong>lt.<br />
190 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
NISS nach § 63g AMG<br />
• Nach Beginn sind wesentliche Än<strong>de</strong>rungen<br />
<strong>de</strong>s Protokolls vor <strong>de</strong>ren Umsetzung<br />
• von BOB (bei Studien im Inland) o<strong>de</strong>r PRAC (bei<br />
multinationalen Studien) zu genehmigen.<br />
• Nach Abschluss einer Studie ist <strong>de</strong>r<br />
abschließen<strong>de</strong> Studienbericht und<br />
Kurzdarstellung <strong>de</strong>r Studienergebnisse<br />
• <strong>de</strong>r BOB (bei Studien im Inland) o<strong>de</strong>r PRAC (bei<br />
multinationalen Studien)<br />
• innerhalb von 12 Monaten nach Abschluss <strong>de</strong>r<br />
Datenerfassung vorzulegen.<br />
• Ausnahme: wenn Behör<strong>de</strong> darauf verzichten<br />
191 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Details:<br />
GVP Modul VIII
GVP-Modul VIII<br />
193 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Sonstige Anzeige-<br />
und<br />
Mitteilungspflichten<br />
194<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Spezifische Anzeige- und Mitteilungspflichten<br />
§ 29 AMG (1/5)<br />
(1) Der Antragsteller hat <strong>de</strong>r zuständigen BOB* …<br />
unverzüglich Anzeige zu erstatten, wenn sich<br />
Än<strong>de</strong>rungen in <strong>de</strong>n Angaben … nach <strong>de</strong>n §§ 22<br />
bis 24a und 25b [Zulassungsunterlagen] ergeben.<br />
Diese Verpflichtung … hat nach Erteilung <strong>de</strong>r<br />
Zulassung <strong>de</strong>r Inhaber <strong>de</strong>r Zulassung.<br />
Beispiel:<br />
• Wirkungsverlust eines Antibiotikums durch<br />
Ausbreitung von Resistenzen<br />
* BOB = Bun<strong>de</strong>soberbehör<strong>de</strong> (BfArM, PEI, BVL<br />
195<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Spezifische Anzeige- und Mitteilungspflichten<br />
§ 29 AMG (2/5)<br />
(1a) Der Inhaber <strong>de</strong>r Zulassung hat <strong>de</strong>r zuständigen<br />
BOB unverzüglich<br />
• alle Verbote o<strong>de</strong>r Beschränkungen durch die<br />
zuständigen Behör<strong>de</strong>n je<strong>de</strong>s Lan<strong>de</strong>s, in <strong>de</strong>m das<br />
betreffen<strong>de</strong> AM in Verkehr gebracht wird, sowie<br />
alle an<strong>de</strong>ren neuen Informationen mitzuteilen, die<br />
die Beurteilung <strong>de</strong>s Nutzens und <strong>de</strong>r Risiken<br />
<strong>de</strong>s betreffen<strong>de</strong>n AM beeinflussen könnten.<br />
• Auch positive und negative Ergebnisse von<br />
(klinischen) Studien in allen zugelassenen und<br />
nicht zugelassenen Indikationen.<br />
196<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Spezifische Anzeige- und Mitteilungspflichten<br />
§ 29 AMG (2/5)<br />
(1a) Der Inhaber <strong>de</strong>r Zulassung hat <strong>de</strong>r zuständigen<br />
BOB unverzüglich …<br />
• auf Verlangen <strong>de</strong>r zuständigen BOB auch alle<br />
Angaben und Unterlagen vorzulegen, die<br />
belegen, dass das Nutzen-Risiko-Verhältnis<br />
weiterhin günstig zu bewerten ist.<br />
• Die zuständige BOB kann je<strong>de</strong>rzeit die Vorlage<br />
einer Kopie <strong>de</strong>r PV-Stammdokumentation<br />
verlangen (innerhalb von 7 Tagen vorzulegen)<br />
197<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Spezifische Anzeige- und Mitteilungspflichten<br />
§ 29 AMG (4/5)<br />
(1c) Der Inhaber <strong>de</strong>r Zulassung hat <strong>de</strong>r zuständigen<br />
BOB … mitzuteilen, wenn das Inverkehrbringen<br />
<strong>de</strong>s AM vorübergehend o<strong>de</strong>r endgültig<br />
eingestellt wird. […]<br />
(1d) Der Inhaber <strong>de</strong>r Zulassung hat alle Daten im<br />
Zusammenhang mit <strong>de</strong>r Absatzmenge <strong>de</strong>s AM<br />
sowie alle ihm vorliegen<strong>de</strong>n Daten im Zusammenhang<br />
mit <strong>de</strong>m Verschreibungsvolumen<br />
mitzuteilen, sofern die zuständige BOB dies<br />
aus Grün<strong>de</strong>n <strong>de</strong>r Arzneimittelsicherheit<br />
for<strong>de</strong>rt.<br />
198<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Spezifische Anzeige- und Mitteilungspflichten<br />
§ 29 AMG (5/5)<br />
(1e) Der Inhaber <strong>de</strong>r Zulassung hat <strong>de</strong>r zuständigen<br />
BOB Än<strong>de</strong>rung <strong>de</strong>r PSUR-Stichtage o<strong>de</strong>r<br />
Intervalle anzuzeigen; bei Anpassung an EU-<br />
Stichtage innerhalb von 6 Monaten nach <strong>de</strong>ren<br />
Veröffentlichung.<br />
(1f) Der Inhaber <strong>de</strong>r Zulassung ist verpflichtet, die<br />
zuständige BOB und die EMA zu informieren,<br />
falls neue o<strong>de</strong>r verän<strong>de</strong>rte Risiken bestehen<br />
o<strong>de</strong>r sich das Nutzen-Risiko-Verhältnis von<br />
AM geän<strong>de</strong>rt hat.<br />
199<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 95 bis 97 AMG: Sanktionen<br />
Sanktionsmöglichkeiten<br />
200<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 95: Strafvorschriften<br />
Straftatbestän<strong>de</strong><br />
201<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 95: Straftatbestand<br />
Mit Freiheitsstrafe bis zu drei Jahren o<strong>de</strong>r mit<br />
Geldstrafe wird bestraft, wer …<br />
• § 95 Abs. 1 AMG<br />
• entgegen § 5 Abs. 1 [be<strong>de</strong>nkliche Arzneimittel]<br />
ein Arzneimittel in <strong>de</strong>n Verkehr bringt<br />
o<strong>de</strong>r bei an<strong>de</strong>ren anwen<strong>de</strong>t,…<br />
Adressat: Zulassungsinhaber<br />
202<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 97: Ordnungswidrigkeiten<br />
Ordnungs-<br />
Widrigkeiten<br />
(Auswahl)<br />
jeweils Geldbuße bis 25.000 €<br />
203<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Ordnungswidrig han<strong>de</strong>lt, wer vorsätzlich o<strong>de</strong>r<br />
fahrlässig...<br />
§ 97 Abs. 2 Nr. 8 AMG [bisher Nr. 7]<br />
• entgegen § 29 Abs. 1 (Än<strong>de</strong>rung <strong>de</strong>r Zulassungsunterlagen),<br />
1a (Beschränkung Inverkehrbringen),<br />
1c Satz 1 (Einstellung <strong>de</strong>s Vertriebs), 1e (PSUR-<br />
Stichtage) o<strong>de</strong>r f (neue Risiken, Än<strong>de</strong>rungen im<br />
Nutzen-Risiko-Verhältnis) […],<br />
• entgegen § 63c Abs. 2 (Einzelfälle bei Human-AM),<br />
jeweils auch i.V.m. § 63a Abs. 1 S. 3 (Aufgaben <strong>de</strong>s<br />
StB*) o<strong>de</strong>r § 63c Abs. 4 S. 1 o<strong>de</strong>r S. 2 (Registrierungen<br />
nach § 39a),<br />
* StB: Stufenplanbeauftragter<br />
§ 97: Ordnungswidrigkeiten<br />
204<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 97: Ordnungswidrigkeiten<br />
Ordnungswidrig han<strong>de</strong>lt, wer vorsätzlich o<strong>de</strong>r<br />
fahrlässig...<br />
…<br />
• [entgegen] § 63f Abs. 1 S.1 (NIS-Studien),<br />
• § 63h Abs. 2, 3 o<strong>de</strong>r 4 (Anzeigepflichten bei<br />
Tier-AM), jeweils auch i.V.m. § 63a Abs. 2 S.1<br />
(Personalunion <strong>de</strong>s StB*)<br />
eine Mitteilung nicht, nicht vollständig o<strong>de</strong>r<br />
nicht rechtzeitig erstattet.<br />
205<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Ordnungswidrig han<strong>de</strong>lt, wer vorsätzlich o<strong>de</strong>r<br />
fahrlässig entgegen …<br />
§ 63b Abs. 2 ...<br />
§ 97: Ordnungswidrigkeiten<br />
(38) Nr. 1 nicht/nicht rechtzeitig geeignete (risikomin<strong>de</strong>rn<strong>de</strong>)<br />
Maßnahmen ergreift<br />
(39) Nr. 2 sein PV-System keinen regelmäßigen<br />
Audits unterzieht o<strong>de</strong>r nicht rechtzeitig<br />
geeignete Maßnahmen ergreift<br />
(40) Nr. 3 keine PV-Stammdokumentation führt /<br />
nicht rechtzeitig zur Verfügung stellt, …<br />
206<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Ordnungswidrig han<strong>de</strong>lt, wer vorsätzlich o<strong>de</strong>r<br />
fahrlässig entgegen<br />
§ 63b Abs. 2 ...<br />
§ 97: Ordnungswidrigkeiten<br />
(41) Nr. 4 Risikomanagement-System für je<strong>de</strong>s<br />
einzelne AM betreibt,<br />
(42) Nr. 5 Ergebnisse von Risikominimierungsmaßnahmen<br />
nicht überwacht,<br />
(43) Nr. 6 Risikomanagement-System nicht<br />
aktualisiert / PV-Daten nicht überwacht,<br />
(44) Nr. 7 biologische Human-AM nicht i<strong>de</strong>ntifiziert,<br />
207<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 97: Ordnungswidrigkeiten<br />
Ordnungswidrig han<strong>de</strong>lt, wer vorsätzlich o<strong>de</strong>r<br />
fahrlässig entgegen …<br />
(45) § 63d PSURs nicht / nicht rechtzeitig vorlegt,<br />
(46) § 63f Abs. 1 S. 2 <strong>de</strong>n Abschlussbericht nicht<br />
o<strong>de</strong>r nicht rechtzeitig vorlegt,<br />
(47)§ 63g Abs. 1 (angeordnete NISS) <strong>de</strong>n Entwurf<br />
<strong>de</strong>s Studienprotokolls nicht rechtzeitig vorlegt,<br />
(48) § 63g Abs. 2 vor <strong>de</strong>r Genehmigung <strong>de</strong>s<br />
Studienprotokolls (o<strong>de</strong>r vor <strong>de</strong>ssen Übermittlung)<br />
mit <strong>de</strong>r Studie beginnt,<br />
208<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
§ 97: Ordnungswidrigkeiten<br />
Ordnungswidrig han<strong>de</strong>lt, wer vorsätzlich o<strong>de</strong>r<br />
fahrlässig entgegen …<br />
(49) § 63g Abs. 4 (angeordnete NISS) <strong>de</strong>n<br />
Studienbericht und Kurzdarstellung <strong>de</strong>r<br />
Ergebnisse nicht o<strong>de</strong>r nicht rechtzeitig vorlegt,<br />
(50) § 63h Abs. 5 <strong>de</strong>n PSUR (für Tier-AM) nicht<br />
o<strong>de</strong>r nicht rechtzeitig vorlegt,<br />
(51) § 63i Abs. 3 S. 1 (Blut- / Gewebeprodukte)<br />
eine Meldung nicht o. nicht rechtzeitig macht,<br />
(52) § 63i Abs. 4 einen Bericht (PSUR) nicht o<strong>de</strong>r<br />
nicht rechtzeitig vorlegt.<br />
209<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Haftung
Haftung <strong>de</strong>s pU<br />
• Wortlaut <strong>de</strong>r Kennzeichnung und Fach- und<br />
Gebrauchsinformation durch Zulassungsbescheid<br />
festgelegt, aber…<br />
Eigenverantwortung (§ 25 Abs. 10 AMG)<br />
• Ausstattungsmaterialien enthalten wesentliche<br />
Charakteristika <strong>de</strong>s Arzneimittels<br />
• Irreführungsverbot nach § 8 Abs. 1 Nr. 2<br />
AMG knüpft an Aussagen in <strong>de</strong>n Ausstattungsmaterialien<br />
an<br />
211<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Pharmahaftpflicht nach §§ 84 ff. AMG<br />
• Scha<strong>de</strong>nsersatzpflicht bei Körperverletzung o<strong>de</strong>r<br />
Tötung eines Menschen aufgrund <strong>de</strong>r Anwendung<br />
eines zulassungspflichtigen AM, das in D. in<br />
<strong>de</strong>n Verkehr gebracht wur<strong>de</strong>, wenn<br />
• Arzneimittel schädliche Wirkungen hat, die über<br />
ein wissenschaftlich vertretbares Maß<br />
hinausgehen (§ 84 S. 2 Nr. 1) o<strong>de</strong>r<br />
• Scha<strong>de</strong>n infolge einer nicht <strong>de</strong>n wiss. Erkenntnissen<br />
entsprechen<strong>de</strong>n Kennzeichnung, Fach- o<strong>de</strong>r Gebrauchsinformation<br />
eingetreten ist (Satz 2 Nr. 2)<br />
Verantwortung: pU bzw. Zulassungsinhaber (§<br />
25 Abs. 10 AMG)<br />
212<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Pharmahaftpflicht nach §§ 84 ff. AMG<br />
• Beweislast für Fehlerhaftigkeit: Geschädigter<br />
• 2. Scha<strong>de</strong>nsrechtän<strong>de</strong>rungsgesetz (Juli 2002)<br />
• Kausalitätsvermutung<br />
• Auskunftsanspruch <strong>de</strong>s Geschädigten (§<br />
84 Abs. 2, § 84a AMG)<br />
213<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Umfang <strong>de</strong>r Ersatzpflicht<br />
• Mitverschul<strong>de</strong>n <strong>de</strong>s Geschädigten (§ 85)<br />
• Bei Tötung (§ 86): Ersatz <strong>de</strong>r Kosten für Behandlung<br />
und Erwerbsunfähigkeit<br />
• Höchstbetrag (§ 88): 120 Mio. €<br />
• Bei Körperverletzung (§ 87): Ersatz Kosten für<br />
Heilung und Erwerbsunfähigkeit<br />
• Höchstbetrag (§ 88): jährlicher Rentenbetrag<br />
von 7,2 Mio. €<br />
• Bei mehreren Ersatzpflichtigen gesamtschuldnerische<br />
Haftung (§ 93)<br />
214<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Deckungsvorsorge nach § 94 AMG<br />
• zur Erfüllung von Scha<strong>de</strong>nsersatzansprüchen<br />
• Schä<strong>de</strong>n bis zu 5 Mio. € versichern einzelne<br />
Versicherer<br />
• Prämien frei verhan<strong>de</strong>lbar<br />
• Schä<strong>de</strong>n zwischen 5-120 Mio. € wer<strong>de</strong>n vom<br />
Pharma-Pool rückversichert<br />
• Festlegung <strong>de</strong>r Prämien vom Pool, Höhe u.a. in<br />
Abhängigkeit vom Vertriebsstatus <strong>de</strong>s AM<br />
215<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
2. Teil:<br />
Europäische<br />
Arzneimittelsicherheit<br />
(<strong>Pharmakovigilanz</strong>)
Europäische Schiedsverfahren<br />
(Referrals)
Referral-Verfahren - Einleitung (1/2)<br />
Eingangskriterien (RL 2001/83/EG)<br />
analog bei zentral zugelassenen AM*<br />
• Art. 29:<br />
unterschiedliche Positionen von MS** im<br />
Zulassungsverfahren<br />
• Art. 30:<br />
unterschiedliche Zulassungsentscheidungen<br />
in MS<br />
• Art. 31:<br />
beson<strong>de</strong>re Fälle von <strong>Uni</strong>onsinteresse,<br />
insbeson<strong>de</strong>re <strong>Pharmakovigilanz</strong><br />
* AM = Arzneimittel, ** MS = Mitgliedstaaten <strong>de</strong>r EU<br />
218<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Referral-Verfahren - Einleitung (2/2)<br />
Eingangskriterien (RL 2001/83/EG)<br />
• Art. 36:<br />
Schutz <strong>de</strong>r öffentlichen Gesundheit (Eingriffsmöglichkeit<br />
für MS)<br />
• Art. 37:<br />
erneute Regulierung von AM, die zuvor ein<br />
Konzertierungsverfahren durchlaufen haben<br />
• Art. 107i:<br />
Verfahren zur Än<strong>de</strong>rung <strong>de</strong>r Zulassung<br />
aufgrund <strong>Pharmakovigilanz</strong>daten (u.a. NW*)<br />
* NW = Nebenwirkungen<br />
219 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Referrals nach Art. 30<br />
Art. 30-Verfahren: Regelungsbereich<br />
• Harmonisierung unterschiedlicher Zulassungen<br />
in <strong>de</strong>r EU<br />
• nicht primär zur Lösung aktueller Safety Issues<br />
gedacht/geeignet (Art. 31 o<strong>de</strong>r 36)<br />
Anwendung jedoch auch zur Harmonisierung<br />
Safety-relevanter Passagen <strong>de</strong>r SPC<br />
möglich (Isotretinoin)<br />
220<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Referrals<br />
nach Art. 30:<br />
Beispiel<br />
Ciprofloxacin<br />
221<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Ablauf von Referral – Verfahren nach Art. 32ff<br />
Ablauf <strong>de</strong>s Verfahrens<br />
nach Artikel 32f<br />
- die Realität -<br />
222 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Referral SSRIs/SNRIs (best case)<br />
20.01.2005 Eröffnung <strong>de</strong>s Artikel 31- Verfahren<br />
22.02.2005 Stellungnahme <strong>de</strong>r MAH<br />
24.03.2005 BfArM-Stufenplanverfahren<br />
21.04.2005 Draft Opinion <strong>de</strong>s CHMP<br />
26.05.2005 Final Opinion <strong>de</strong>s CHMP (da kein Appeal)<br />
27.06.2005 Draft Commission Decision, Start <strong>de</strong>s<br />
Standing Committe-Verfahren<br />
27.07.2005 Abschluss SC-Verfahren<br />
19.08.2005 Commission Decision<br />
08.09.2005 BfArM-Bescheid<br />
223 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Referral Paroxetin (worst case)<br />
26.06.2003 Eröffnung <strong>de</strong>s Artikel 31- Verfahren<br />
10.07.2003 BfArM-Stufenplanverfahren<br />
20.11.2003 2. List of Questions<br />
12/2003 1. Assessment Report<br />
03/2004 2. Assessment Report<br />
04.05.2004 CHMP-Opinion / draft SPC<br />
08.09.2004 Draft Commission Decision, Start <strong>de</strong>s<br />
Standing Committe-Verfahren<br />
11/2004 SC: zurück an CHMP<br />
08.12.2004 CHMP bestätigt Opinion<br />
29.03.2005 Commission Decision (für alte MS, neue<br />
Beratung für neue MS)<br />
26.04.2005 BfArM-Bescheid<br />
224 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Das neue<br />
Dringlichkeitsverfahren<br />
(„Urgent <strong>Uni</strong>on Procedure“)<br />
nach Artikel 107i
Das neue Art. 107i-Verfahren<br />
Das neue Art. 107i-Verfahren<br />
• Antragsrecht: Mitgliedstaat, EU-Kommission<br />
• betroffen:<br />
• einzelne AM, therapeutischer Bereich o<strong>de</strong>r<br />
Substanzklasse („Prüfung“ durch EMA)<br />
• alle Formen von Zulassungen<br />
• EMA o<strong>de</strong>r MS: Information <strong>de</strong>r MAH<br />
226 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Das neue Art. 107i-Verfahren - Transparenz<br />
Veröffentlichung auf Webseite(n) <strong>de</strong>r EMA (und<br />
ggf. <strong>de</strong>r MS):<br />
• Einleitung <strong>de</strong>s Verfahrens mit Begründung<br />
• Betroffene Wirkstoffe und Produkte<br />
• Hinweis: Recht <strong>de</strong>r MAH, Heilberufe und Öffentlichkeit<br />
zur Übermittlung von Informationen zur<br />
EMA<br />
• MAH: kann schriftl. Stellungnahme einreichen<br />
• Öffentliche Anhörungen (falls nicht dringlich)<br />
227 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Das neue Art. 107i-Verfahren - Kriterien<br />
Einleitung eines Verfahrens, wenn erwogen wird,<br />
• eine Genehmigung auszusetzen / zu wi<strong>de</strong>rrufen<br />
• die Abgabe eines AM zu untersagen<br />
• die Verlängerung einer Genehmigung zu<br />
verweigern<br />
• eine neue Gegenanzeige aufzunehmen, die empfohlene<br />
Dosis zu verringern o<strong>de</strong>r die Indikationen<br />
einzuschränken<br />
o<strong>de</strong>r<br />
• <strong>de</strong>r MAH wegen Sicherheitsbe<strong>de</strong>nken das Inverkehrbringen<br />
unterbrochen hat o<strong>de</strong>r Zulassung<br />
zurückgenommen hat bzw. dieses beabsichtigt.<br />
228 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Das neue Art. 107i-Verfahren - Bearbeitung<br />
Bearbeitung <strong>de</strong>s Verfahrens:<br />
• Eingang <strong>de</strong>s Antrags<br />
• Beurteilung durch PRAC<br />
• Einsetzung eines Berichterstatters (Rapporteur)<br />
• Enge Zusammenarbeit mit CHMP und RMS<br />
• Durchführung öffentlicher Anhörungen<br />
• „gebühren<strong>de</strong>“ Beachtung <strong>de</strong>r therapeutischen<br />
Wirkung <strong>de</strong>r betroffenen AM, auch bei Anhörung<br />
• Auf Antrag auch nicht-öffentliche Anhörung<br />
• Begrün<strong>de</strong>te „Empfehlung“ binnen 60 Tagen (ggf.<br />
verkürzbar), Min<strong>de</strong>rheitsvoten wer<strong>de</strong>n publiziert<br />
229 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Das (alte) „<strong>Uni</strong>on<br />
Interest“-Verfahren<br />
nach Artikel 31
Ablauf von Referral-Verfahren<br />
Beson<strong>de</strong>re Fälle von <strong>Uni</strong>onsinteresse<br />
(„<strong>Uni</strong>on Interest")<br />
• gut begrün<strong>de</strong>ter Verdacht auf schwerwiegen<strong>de</strong>s<br />
neues Risiko<br />
• vorauss. größere Än<strong>de</strong>rung <strong>de</strong>r Zulassung<br />
(ggf. Wi<strong>de</strong>rruf o<strong>de</strong>r Rücknahme <strong>de</strong>r Zulassung)<br />
• betroffene Arzneimittel/Substanzen in<br />
mehreren MS in Verkehr<br />
231 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Referral-Verfahren - Entscheidung<br />
Entscheidung / nationale Umsetzung<br />
• RL 2001/83/EG, Art. 33 und Art. 121 (Ständiger<br />
Ausschuss) i.V.m. VO 1662/95, Art. 3<br />
• bin<strong>de</strong>n<strong>de</strong> Kommissions- o<strong>de</strong>r Ratsentscheidung<br />
• i.d.R. Einzelsubstanzen-spezifisch<br />
• i.d.R. Harmonisierung <strong>de</strong>r gesamten SPC*<br />
<br />
nach Umsetzung <strong>de</strong>zentral zugelassenen<br />
AM gleichgestellt<br />
* SPC = Summary of Product Characterics<br />
232 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Ablauf <strong>de</strong>s Verfahrens<br />
nach Artikel 31 und 107i<br />
233 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Das neue<br />
<strong>Pharmakovigilanz</strong>-<br />
Komitee<br />
(VO 726/2004)
PRAC<br />
Pharmacovigilance Risk Assessment<br />
Committee (PRAC)<br />
• neu eingerichtet bei <strong>de</strong>r EMA (Juli 2012)<br />
• übliche Zusammensetzung aus Vertretern<br />
<strong>de</strong>r Mitgliedstaaten und einigen Experten<br />
• Umfangreiche Kompetenzen zur Bewertung<br />
von <strong>Pharmakovigilanz</strong>-Sachverhalten<br />
• (formelle) Entscheidung durch CMD(h) o<strong>de</strong>r<br />
CHMP<br />
• i.d.R. keine bin<strong>de</strong>n<strong>de</strong> Entscheidung <strong>de</strong>r EU-<br />
Kommission<br />
235 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PRAC<br />
PRAC (1/2)<br />
• Beratung <strong>de</strong>r CMD* bei (u.a.):<br />
• Vorschläge für PSUR-Stichtage / Intervalle (107c)<br />
• Bestellung Rapporteur (CAPs**), Koordination<br />
<strong>de</strong>s PSUR-Assessments, Bericht an CMD (107e-g)<br />
• allg. Bewertung von Nutzen-Risiko-Verhältnis<br />
• Durchführung von Referrals (Art. 107i)<br />
• Prüfung von Unterlagen<br />
• Anhörungen<br />
• Erarbeitung von Empfehlungen für CMD<br />
* CMD(h) = Coordination Group for mutal recognition and <strong>de</strong>centralised procedure - human<br />
** CAP = centrally authorised products<br />
236 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PRAC<br />
PRAC (2/2)<br />
• Beratung <strong>de</strong>r CMD bei (u.a.):<br />
• Bewertung von Studienprotokollen, Amendments,<br />
Abschlussberichte, Abstracts etc. (107i)<br />
• Erarbeitung von Empfehlungen, u.a. für SmPC*,<br />
Veröffentlichung im Webportal (Art. 107r)<br />
• Beratung bei Kommunikation zu <strong>Pharmakovigilanz</strong>-Sachverhalten<br />
(via EMA-Webportal)<br />
* SmPC = Summary of product characteristics<br />
237 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Nationale Behör<strong>de</strong>n<br />
Stellenwert <strong>de</strong>r nationalen Behör<strong>de</strong>n ?<br />
• Betreiben nationale Web-Portale (Art. 106)<br />
• Unterstützen EMA, CMD, PRAC (mit Experten)<br />
• Nehmen (ggf.) PSURs bei "Alt-Zulassungen"<br />
entgegen und bewerten diese (Art. 107c, d)<br />
bei generischen Produkten im Auftrag <strong>de</strong>r CMD<br />
• Entschei<strong>de</strong>n, wenn kein "Single Assessment"<br />
• Setzen "Empfehlungen" <strong>de</strong>r CMD um<br />
• Können Referrals beantragen (Art. 107i)<br />
238 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
239 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
PRAC: "Empfehlung"<br />
(ggf. mit Min<strong>de</strong>rheitsvoten)<br />
zentrale Zulassungen betroffen: Nein<br />
zentrale Zulassungen betroffen: Ja<br />
30 Tage<br />
CMDh: Beratung<br />
CHMP: Erstellung<br />
eines Gutachtens<br />
30 Tage<br />
CMDh: Standpunkt<br />
im Konsens<br />
CMDh: Standpunkt<br />
ohne Konsens<br />
Mitgliedstaaten:<br />
Umsetzung<br />
MAH:<br />
Än<strong>de</strong>rungsanzeige<br />
EU-Kommission: Abschließen<strong>de</strong>r<br />
Entscheidungsprozess<br />
240 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Art. 121<br />
Beschluss 1999/468/EG<br />
EU-Kommission: Abschließen<strong>de</strong>r Entscheidungsprozess<br />
Ständiger Ausschuss für Humanarzneimittel<br />
Zustimmung zum<br />
Kommissionsvorschlag<br />
Ablehnung <strong>de</strong>s<br />
Kommissionsvorschlages<br />
o<strong>de</strong>r keine Entscheidung<br />
Rückweisung an CHMP<br />
EU-Kommission: Vorlage beim Rat<br />
Rat <strong>de</strong>r Europäischen <strong>Uni</strong>on (Gesundheitsminister)<br />
3 Monate<br />
keine Entscheidung<br />
Zustimmung zum<br />
Kommissionsvorschlag<br />
Ablehnung <strong>de</strong>s<br />
Kommissionsvorschlag<br />
EU-Kommission: Binding Commission Decision<br />
Bindung Council Decision<br />
Mitgliedstaaten: Nationale Umsetzung<br />
241 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Das neue Art. 107i-Verfahren - Maßnahmen<br />
Maßnahmenvorschläge (Art. 107j Abs. 3)<br />
• keine weitere Bewertung / Maßnahmen notwendig<br />
• MAH sollte Daten weitergehend bewerten<br />
• MAH sollte eine PAS-Studie durchführen und die<br />
Ergebnisse hinsichtlich Maßnahmen bewerten<br />
• MS o<strong>de</strong>r MAH sollten Maßnahmen zur Risikominimierung<br />
treffen<br />
• Zulassung sollte ausgesetzt, wi<strong>de</strong>rrufen o<strong>de</strong>r<br />
nicht verlängert wer<strong>de</strong>n<br />
• Zulassung sollte geän<strong>de</strong>rt wer<strong>de</strong>n (Vorschlag für<br />
geän<strong>de</strong>rte SPC, Packungsbeilage, Etikettierung).<br />
242 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Art. 107i-Verfahren - Sofortmaßnahmen<br />
Maßnahmen bei dringen<strong>de</strong>m Handlungsbedarf<br />
(Art. 107i Abs. 2 und 3)<br />
• MS kann zum Schutz <strong>de</strong>r öffentlichen Gesundheit,<br />
wenn Sofortmaßnahmen erfor<strong>de</strong>rlich sind,<br />
• vorläufig (bis zur Entscheidung)<br />
• Inverkehrbringen aussetzen (Zulassung bleibt<br />
unberührt)<br />
• MS muss Kommission, EMA und an<strong>de</strong>re MS<br />
spätestens am nächsten Arbeitstag informieren<br />
• Kommission kann MS (je<strong>de</strong>rzeit) auffor<strong>de</strong>rn,<br />
sofort vorläufige Maßnahmen zu treffen<br />
243 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Referral-Verfahren - Umsetzung<br />
1. Umsetzung von CMD-„Standpunkten“<br />
• Keine bin<strong>de</strong>n<strong>de</strong> Rechtsgrundlage, Umsetzung<br />
durch Behör<strong>de</strong>n <strong>de</strong>r Mitgliedstaaten<br />
• „Empfehlung“: „freiwillige“ Übernahme <strong>de</strong>r<br />
Vorschläge durch MAH, Anzeige per Variation<br />
auch Anpassung <strong>de</strong>r Kennzeichnung<br />
2. Umsetzung von Entscheidungen <strong>de</strong>r EU-<br />
Kommission bzw. <strong>de</strong>s Rates<br />
• bin<strong>de</strong>n<strong>de</strong> Rechtsgrundlage, Umsetzung<br />
durch Beschei<strong>de</strong> <strong>de</strong>r Behör<strong>de</strong>n <strong>de</strong>r MS<br />
244 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Referral-Verfahren - Umsetzung<br />
Umsetzung von Entscheidungen<br />
• Entscheidungen enthalten Wortlaut <strong>de</strong>r SPC<br />
(in allen Amtssprachen <strong>de</strong>r EU)<br />
auch Wortlaut <strong>de</strong>r Gebrauchsinformation<br />
• Umsetzungsfrist nur 30 Tage<br />
• aus Zulassungsverfahren abgeleitet<br />
• dito bei Wi<strong>de</strong>rruf <strong>de</strong>r Zulassung<br />
• bei Än<strong>de</strong>rung <strong>de</strong>r Zulassung Umsetzung<br />
nicht ohne Gefährdung <strong>de</strong>r Versorgung<br />
245 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Referrals<br />
Praktische<br />
Beispiele<br />
246<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Ablauf von Referral-<br />
Verfahren<br />
am Beispiel <strong>de</strong>r Verfahren zu<br />
Paroxetin und SSRIs /SNRIs<br />
247 Forum-Seminar Referrals, 23. 3. November 2010 2009 in in Bonn
Eröffnung <strong>de</strong>s Referral-<br />
Verfahrens zu<br />
Paroxetin<br />
26.06.2003<br />
248 Forum-Seminar Referrals, 23. November 2010 in Bonn
249 Forum-Seminar Referrals, 23. November 2010 in Bonn
Eröffnung <strong>de</strong>s Verfahrens<br />
250 Forum-Seminar Referrals, 23. November 2010 in Bonn
List of Outstanding<br />
Issues<br />
251 Forum-Seminar Referrals, 23. November 2010 in Bonn
252 Forum-Seminar Referrals, 23. November 2010 in Bonn
253 Forum-Seminar Referrals, 23. November 2010 in Bonn
Entwurf <strong>de</strong>r Kommissionsentscheidung<br />
254 Forum-Seminar Referrals, 23. November 2010 in Bonn
Standing Committee-Verfahren<br />
Plenary Meeting <strong>de</strong>s SC<br />
255 Forum-Seminar Referrals, 23. November 2010 in Bonn
Opinion <strong>de</strong>s CHMP<br />
256 Forum-Seminar Referrals, 23. November 2010 in Bonn
BfArM-Bescheid<br />
zur Umsetzung<br />
257 Forum-Seminar Referrals, 23. November 2010 in Bonn
258 Forum-Seminar Referrals, 23. November 2010 in Bonn
259 Forum-Seminar Referrals, 23. November 2010 in Bonn
260 Forum-Seminar Referrals, 23. November 2010 in Bonn
261 Forum-Seminar Referrals, 23. November 2010 in Bonn
Beispiele<br />
für Än<strong>de</strong>rungen<br />
von Fach- und<br />
Gebrauchsinformationen<br />
262 Forum-Seminar Referrals, 23. November 2010 in Bonn
263 Forum-Seminar Referrals, 23. November 2010 in Bonn
264 Forum-Seminar Referrals, 23. November 2010 in Bonn
Neuere Entwicklungen in<br />
Referral-Verfahren<br />
- Risikokommunikation -
Details:<br />
GVP Modul XV
GVP-Modul XV<br />
267 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Neuere Entwicklungen in<br />
Referral-Verfahren<br />
- Risikokommunikation am<br />
Beispiel Piroxicam -
269 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
270 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Risikokommunikation –<br />
Norfloxacin
272 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
273 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Risikokommunikation –<br />
Tolperison
275<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
276 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Neuere Entwicklungen in<br />
Referral-Verfahren<br />
- Valproat und RMP -
Beispiel: Referral-Verfahren Valproat<br />
278 Einführung Forum-Seminar das Referrals, Arzneimittelrecht 3. November - <strong>Pharmakovigilanz</strong> 2009 in Bonn (2013)
Beispiel: Referral-Verfahren Valproat<br />
279 Einführung Forum-Seminar das Referrals, Arzneimittelrecht 3. November - <strong>Pharmakovigilanz</strong> 2009 in Bonn (2013)
Beispiel: Referral-Verfahren Valproat<br />
280 Einführung Forum-Seminar das Referrals, Arzneimittelrecht 3. November - <strong>Pharmakovigilanz</strong> 2009 in Bonn (2013)
Beispiel: Referral-Verfahren Valproat<br />
281 Einführung Forum-Seminar das Referrals, Arzneimittelrecht 3. November - <strong>Pharmakovigilanz</strong> 2009 in Bonn (2013)
Neuere Entwicklungen in<br />
Referral-Verfahren<br />
- Gadolinium und RMP -
Beispiel: Referral-Verfahren Gadolinium<br />
283 Einführung Forum-Seminar das Referrals, Arzneimittelrecht 3. November - <strong>Pharmakovigilanz</strong> 2009 in Bonn (2013)
Annex 4: Condition of the MA
Beispiel: Referral-Verfahren Gadolinium<br />
285 Einführung Forum-Seminar das Referrals, Arzneimittelrecht 3. November - <strong>Pharmakovigilanz</strong> 2009 in Bonn (2013)
Neuere Entwicklungen in<br />
Referral-Verfahren<br />
- Modafinil und RMP -
Beispiel: Referral-Verfahren Modafinil<br />
287 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Beispiel: Referral-Verfahren Modafinil<br />
288 Einführung Forum-Seminar das Referrals, Arzneimittelrecht 3. November - <strong>Pharmakovigilanz</strong> 2009 in Bonn (2013)
Beispiel: Referral-Verfahren Modafinil<br />
289 Einführung Forum-Seminar das Referrals, Arzneimittelrecht 3. November - <strong>Pharmakovigilanz</strong> 2009 in Bonn (2013)
Beispiel: Referral-Verfahren Modafinil<br />
290 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Beispiel: Referral-Verfahren Modafinil<br />
291 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Neuere Entwicklungen in<br />
Referral-Verfahren<br />
- Erste PRAC-Referrals-
Erstes PRAC-Referral: Co<strong>de</strong>in<br />
293 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Zweites PRAC-Referral: Diclofenac<br />
294 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Allgemeine<br />
Informationen über<br />
Referrals
Referrals allgemein<br />
• Informationen zu Referrals (EMA Q&A-<br />
Papier)<br />
• CHMP Press Release und im CHMP Monthly<br />
Report (EMA Webseite):<br />
• Mitteilung über Start/ Annahme <strong>de</strong>s Referrals<br />
• Ergebnis eines Referrals<br />
jeweils unter Angabe <strong>de</strong>r Grün<strong>de</strong> und <strong>de</strong>r betroffenen<br />
Substanz<br />
• ggf. Public Statements und weitere Presseerklärungen<br />
<strong>de</strong>s CHMP (EMA Webseite)<br />
• nach Kommissionsentscheidung Veröffentlichung<br />
<strong>de</strong>r Opinion (inkl. Annexe) sowie ggf.<br />
weiterer Dokumente auf <strong>de</strong>r Referral-Webseite<br />
296<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
EMA<br />
Referral-<br />
Seite
298<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
299<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
300<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Übersicht über alle Art. 29-Verfahren<br />
301<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Referrals nach Art. 30 : Probleme<br />
Problem 3: Information<br />
• früher völlig intransparent (nicht involvierte MAH)<br />
• nun Information auf EMEA-Homepage<br />
Vorbereitung auf Umsetzung jetzt möglich<br />
302<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Liste <strong>de</strong>r Artikel<br />
30-Verfahren<br />
303<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Fazit
Fazit<br />
• Umsetzung <strong>de</strong>s EU-Pharmapaketes wird<br />
vieles verän<strong>de</strong>rn!<br />
• Bisherige Herausfor<strong>de</strong>rungen bleiben<br />
(überwiegend) erhalten<br />
• Neue kommen hinzu!<br />
• Ansatzpunkt für Bewältigung: Kooperationen<br />
• Hierfür erfor<strong>de</strong>rlich:<br />
• Bereitschaft zur firmenübergreifen<strong>de</strong>n<br />
Zusammenarbeit<br />
• Plattformen für die Koordination (Dienstleister)<br />
• Erweiterung von Organisationsstrukturen<br />
305 Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)
Vielen Dank für Ihre<br />
Aufmerksamkeit<br />
Fragen ?<br />
kroth@bah-bonn.<strong>de</strong><br />
306<br />
Einführung in das Arzneimittelrecht - <strong>Pharmakovigilanz</strong> (2013)