Tetraether Lipide thermophiler Archaebakterien
Tetraether Lipide thermophiler Archaebakterien
Tetraether Lipide thermophiler Archaebakterien
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Tetraether</strong> <strong>Lipide</strong> <strong>thermophiler</strong><br />
<strong>Archaebakterien</strong><br />
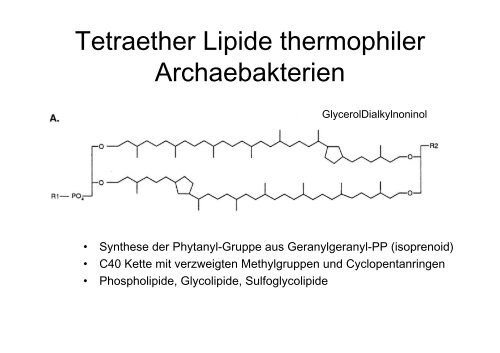
GlycerolDialkylnoninol<br />
• Synthese der Phytanyl-Gruppe aus Geranylgeranyl-PP (isoprenoid)<br />
• C40 Kette mit verzweigten Methylgruppen und Cyclopentanringen<br />
• Phospholipide, Glycolipide, Sulfoglycolipide
Bipolare Etherlipide bilden ‚Monolayer‘<br />
Membranen aus<br />
Extrem thermophile<br />
Archea (>50 o C)
GlycerolDialkylnoninol + 4 Cyclopentanringe<br />
GlycerolDialkylnoninolTetraehter
Funktion von <strong>Lipide</strong>n<br />
-Membrankomponenten<br />
-Energiespeicher -<br />
-Übersicht:<br />
Synthese von Triacylglycerol<br />
Ölkörper<br />
-Fettsäurezusammensetzung in Speicherlipiden<br />
Oxylipine in Ölsamen<br />
Synthese ungewöhnlicher Fettsäuren<br />
Industrielle Nutzung und<br />
biotechnologische Ansätze<br />
-Strukturelle <strong>Lipide</strong><br />
-Cuticula<br />
Oxylipine in strukturellen <strong>Lipide</strong>n: Cutinaufbau<br />
und -synthese<br />
-sek. Zellwände<br />
Suberin<br />
-Signal- und Abwehrstoffe<br />
-IEP<br />
-Oxylipin Jasmonat<br />
Abwehr<br />
Wundheilung: Wachstumshormon<br />
reproduktive Entwicklung
Speicherstoffe<br />
Energiespeicher
Energiespeicher<br />
Triacylglycerol<br />
Synthese<br />
in Arabidopsis<br />
Samen
Aufbau der Triacylglycerol-haltigen<br />
Ölkörper (oleosom)<br />
Energiespeicher<br />
Oleosine stabilisieren Ölkörper
Energiespeicher<br />
Ölsamen<br />
• Ungewöhnliche<br />
Fettsäuren<br />
• Industrielle Nutzung<br />
Ricinus Samen
Biosynthese von Ricinolinsäure<br />
(12-Hydroxyölsäure)<br />
Energiespeicher
Energiespeicher<br />
Bifunctionale<br />
Desaturase/Hydroxylase<br />
Science 1998<br />
7 Aminosäuren verwandeln<br />
Hydroxylase in<br />
Desaturase und vv<br />
• FAD2 Desaturase aus<br />
Arabidopsis<br />
• m7FAD2 Desaturase aus<br />
Arabidopsis mit 7 Resten<br />
der Hydroxylase<br />
• LFAH12 Hydroxylase aus<br />
Lesquerella<br />
• m7LFAH12 Hydroxylase<br />
aus Lesquerella mit 7<br />
Resten der Desaturase
Katalytischer Mechanismus der FAD<br />
5. Abspaltung des H<br />
Es entsteht ein Radical der Fettsäure<br />
4. Spaltung des O 2, Oxidation zum<br />
aktivierten<br />
diferryl Fe (FeIV) Intermediate<br />
3. Bindung von O 2 führt<br />
zum peroxo Intermediate<br />
(FeIII)<br />
6. Abspaltung des benachbarten<br />
H, Doppelbindung<br />
Anlagerung des Substrats 18:0<br />
Acyl~ACP<br />
2. Reduktion zum<br />
Diferrous Fe (FeII)<br />
1. Ruhezustand:<br />
Diferric Fe (FeIII), µ-oxo
Energiespeicher
Desaturase Hydroxylase Acetylase Epoxidase<br />
Energiespeicher
Energiespeicher<br />
Desaturasen ähnliche Enzyme modifizieren<br />
Fettsäuren
Biotechnologische Ansätze:<br />
Optimierung der Nutzung von<br />
Pflanzenölen<br />
Energiespeicher<br />
• Ertragssteigerung<br />
durch<br />
Gentechnologie<br />
• Was determiniert<br />
Produktionslevel von<br />
Speicherlipiden?<br />
• Mehr als 30<br />
Reaktionen<br />
notwendig um<br />
Acetyl-CoA in<br />
Triacylglycerol zu<br />
verwandeln<br />
• Erfolgreich:<br />
1.Expression<br />
cytosolischer CCA in<br />
Plastiden;
• Speicherlipide TAG:<br />
• Synthese im ER, AcylCoA Pool, Fettsäuren<br />
werden durch Desaturasen -gebunden an<br />
Phosphatidylcholine- desaturiert, unmittelbare<br />
Vorstufe für TAG Synthese ist DAG<br />
• Speicherung in Oleosomen<br />
• Ungewöhnliche Fettsäuren: langkettig (C22:1)<br />
oder Hydroxy-, Epoxy-, Acetylenderivate,<br />
Synthese anhand von ‚mutierten‘ Desaturasen<br />
• Industrielle Nutzung, Biotechnologische Ansätze
Oxylipinsynthese als Antwort auf biologische<br />
Aggression<br />
Cutin<br />
Jasmonat
Strukturelle <strong>Lipide</strong><br />
Strukturell <strong>Lipide</strong>:<br />
Aufbau der pflanzlichen Zellwände: Cuticula<br />
und sek. verkorkte Zellwand
Synthese von Cutin Bausteinen:<br />
Lipoxygenase/Peroxygenase<br />
Strukturelle <strong>Lipide</strong><br />
• Wichtigsten<br />
Monomere:<br />
• C16: 16-<br />
Hydroxypalmitinsäure;<br />
16, x-<br />
Dihydroxypalmitinsäure<br />
• C18: 18-<br />
Hydroxyölsäure,<br />
9,10-Epoxi 18-<br />
Hydroxystearinsäure;<br />
9,10,18,<br />
Trihydroxystearinsäure
Hydroperoxid
Strukturelle <strong>Lipide</strong><br />
Cutinschicht
Strukturelle <strong>Lipide</strong><br />
Suberin: Verkorkte Zellwände<br />
Fettsäuremetabolismusderivate<br />
Phenolderivat
Oxylipine<br />
Botenstoffe
Botenstoffe
Botenstoffe<br />
Vorstufe:Fettsäuren<br />
Jasmonat: Signalstoff, Abwehrstoff
Jasmonat wehrt Insektenbefall ab<br />
Botenstoffe
Zusammenfassung: Oxylipine<br />
• Mit O 2 angereicherte Fettsäuren<br />
• Vorkommen:<br />
- Speicherlipiden: ungewöhnliche Fettsäuren<br />
- Strukturellen <strong>Lipide</strong>n: z.B. Cutin<br />
- Regulation von Abwehr und<br />
Entwicklungsprozessen: Jasmonat<br />
• Biosynthesewege:<br />
1. Lipoxygenase Weg: Hydroperoxid als<br />
Vorstufe für Cutin (Peroxygenase Weg),<br />
Jasmonat (Allen Oxid Synthese) Synthese<br />
2. ‚Modifizierte Desaturase‘ Weg: Hydroxy-,<br />
Epoxy- Fettsäuren in Triglyceriden
Vorstufe:<br />
Carotenoide: Energietransduktion, Photoprotektion
Vorstufe Membranlipid<br />
Botenstoffe<br />
Botenstoffe<br />
Inositolphosphat ‚Secondary‘ messengers
Bio-technische Minderung des<br />
Erucasäuregehalts in Raps
Energiespeicher