Frankfurt Institute for Molecular Life Sciences (FMLS) - CEF-MC
Frankfurt Institute for Molecular Life Sciences (FMLS) - CEF-MC
Frankfurt Institute for Molecular Life Sciences (FMLS) - CEF-MC
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
70 PrinCiPal inveStigatorS<br />
PrinCiPal inveStigatorS<br />
71<br />
HeInZ osIeWaCZ<br />
Heinz D. Osiewacz, geboren 1956 im<br />
niedersächsischen Stöcken, studierte<br />
Biologie an der Ruhr-Universität Bochum,<br />
wo er auch promovierte. Von 1984<br />
bis 1985 folgte ein Forschungsaufenthalt<br />
an der Michigan State University, East<br />
Lansing, USA. Von 1985 bis 1990 war<br />
Osiewacz Hochschulassistent an der<br />
Ruhr-Universität Bochum und von 1990<br />
bis 1993 leitete er die Abteilung »Molekularbiologie<br />
der Alterungsprozesse«<br />
am Deutschen Krebs<strong>for</strong>schungszentrum.<br />
Er habilitierte sich 1993 an der Ruhr-<br />
Universität Bochum im Fach Botanik<br />
und ist seit 1994 Universitätsprofessor<br />
im Fachbereich Biowissenschaften an<br />
der Goethe-Universität. Osiewacz ist<br />
begeisterter Freund klassischer Musik.<br />
Zu seinen Lieblingswerken gehören die<br />
Suiten für Solo-Cello von J.S. Bach und<br />
Beethovens einzige Oper Fidelio.<br />
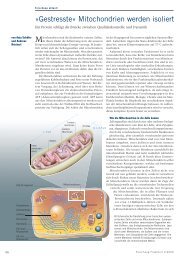
gefärbte Mitochondrien des juvenilen<br />
und gealterten, seneszenten wildstamms<br />
von Podospora anserina mit<br />
einer mittleren lebensspanne von<br />
24 tagen. Die tubulären Mitochondrien<br />
in juvenilen Zellen sind durch teilung<br />
in runde und ovale kleinere einheiten<br />
übergegangen. Hierbei handelt es sich<br />
um ein zelluläres ›rettungsprogramm‹<br />
von geschädigten Mitochondrien. Die<br />
Mitochondrien juveniler Kulturen eines<br />
genetisch hergestellten Stammes, dem<br />
das Mitochondrien-teilungsgen PaDnm1<br />
fehlt, sind länger und stärker vernetzt<br />
als die des wildstammes. Dieser Stamm<br />
lebt im Mittel 244 tage.<br />
mItoCHonDrIale GrunDlaGen BIoloGIsCHen alterns<br />
Zelluläre QualitätSKontrolle<br />
alle biologischen systeme altern. Die<br />
zugrunde liegenden mechanismen<br />
dieses komplexen prozesses führen zu zeitabhängigen,<br />
irreversiblen Veränderungen<br />
physiologischer funktionen und dadurch<br />
zu Beeinträchtigungen und erkrankungen.<br />
um nachhaltige strategien gegen solche Degenerationen<br />
entwickeln zu können, ist ein<br />
Verständnis der zugrunde liegenden molekularen<br />
Grundlagen notwendig. Das Ziel ist<br />
eine Verbesserung der Qualität des lebens<br />
auch in <strong>for</strong>tgeschrittenem alter.<br />
Wir beschäftigen uns mit der er<strong>for</strong>schung<br />
molekularer mechanismen des alterns und<br />
nutzen dazu den pilz Podospora anserina als<br />
modell. Im Vordergrund stehen untersuchungen<br />
zur Bedeutung der mitochondrien.<br />
Diese »Kraftwerke« der Zelle produzieren<br />
neben dem für alle lebensprozesse unentbehrlichen<br />
energielieferanten adenosintriphosphat<br />
(atp) auch giftige nebenprodukte,<br />
so genannte reaktive sauerstoffspezies<br />
(ros). ros verursachen molekulare schä-<br />
den der Zelle, die sich während des alterns<br />
anhäufen und schließlich zum tod der Zelle<br />
und des organismus führen. allerdings<br />
verfügen biologische systeme auch über<br />
abwehr- und reparatursysteme sowie über<br />
systeme, die geschädigte moleküle abbauen.<br />
Die untersuchung und genetische manipulation<br />
dieser Qualitätskontrollsysteme<br />
stehen im mittelpunkt unserer untersuchungen.<br />
Wir konnten kürzlich zeigen,<br />
dass die genetisch herbeigeführte Überexpression<br />
eines Gens mit der Bezeichnung<br />
Lon, dessen produkt am abbau geschädigter<br />
proteine beteiligt ist, zu einer Verlängerung<br />
der gesunden lebensspanne um 67 prozent<br />
führt, im Vergleich zum nicht manipulierten<br />
Wildstamm. Ähnliches gelang durch die<br />
entfernung eines Gens aus dem Genom, das<br />
die teilung von mitochondrien kontrolliert.<br />
Derartige Befunde belegen, dass verschiedene<br />
molekulare mechanismen an der Kontrolle<br />
der alterung beteiligt sind.<br />
wildstamm (juvenil) wildstamm (seneszent) PaDnm1<br />
Deletionsstamm (juvenil)<br />
struKtur unD funKtIon paramaGnetIsCHer Zentren In enZymen<br />
ungePaarte eleKtronen iM viSier<br />
In der arbeitsgruppe untersuchen wir paramagnetische<br />
Zentren in biologischen<br />
makromolekülen mit methoden der elektronenspin-resonanzspektroskopie<br />
(epr),<br />
die die analyse von atomen oder molekülen<br />
mit ungepaartem elektronenspin erlaubt. Im<br />
Gegensatz zur nmr-spektroskopie ist diese<br />
methode einerseits wesentlich empfindlicher,<br />
stellt aber andererseits deutlich höhere<br />
technische an<strong>for</strong>derungen in Bezug auf<br />
anregungsfrequenz und Zeitskala. Deshalb<br />
laufen bei uns die biophysikalischen untersuchungen<br />
zu spezifischen fragestellungen<br />
an proteinen und oligonukleotiden Hand in<br />
Hand mit methodischen und technischen<br />
Weiterentwicklungen.<br />
Die Hochfeld-epr-spektroskopie (Hfepr)<br />
liefert eine gesteigerte spektrale<br />
auflösung, was besonders in biologischen<br />
systemen mit mehreren beteiligten<br />
paramag netischen Zentren von essentieller<br />
Bedeutung ist. Zusätzlich wird die empfindlichkeit<br />
des spektrometers um mehrere<br />
Größenordnungen gesteigert, was zu deutlich<br />
verringerten probenmengen führt. Wir<br />
haben ein spektrometer entwickelt, das um<br />
den faktor 20 empfindlicher ist als die üblichen<br />
kommerziellen Geräte.<br />
mit der Hyperfeinspektroskopie untersuchen<br />
wir die Wechselwirkung des ungepaarten<br />
elektronenspins mit den Kernspins<br />
der nahen umgebung. Dadurch können die<br />
lokale struktur des paramagnetischen Zentrums<br />
und seine Änderungen mit hoher<br />
Genauigkeit bestimmt werden. Genauso<br />
können wir die Wechselwirkung zwischen<br />
zwei ungepaarten paramagnetischen Zentren<br />
in großen makromolekülen detektieren.<br />
so können wir die relative lage von<br />
untereinheiten in großen proteinkomplexen<br />
oder große strukturelle Änderungen<br />
in makromolekülen bei chemischen reaktionen<br />
oder substratbindung messen. Wir<br />
setzen die epr-spektroskopie auch ein, um<br />
strukturelle und funktionelle aspekte von<br />
proteinkomplexen der mitochondrialen atmungskette<br />
und von ribozymen und rnaligand-Komplexen<br />
zu untersuchen.<br />
PelDor-Spektren an spingelabelten<br />
ionenkanälen Kcsa (oben) und Doppelstrang-Dna-Molekülen<br />
(unten), die eine<br />
direkte bestimmung des abstandes der<br />
Spinlabels und damit der biomakromolekülstruktur<br />
erlauben.<br />
tHomas prIsner<br />
Thomas F. Prisner, geboren 1957, studierte<br />
Physik an der Universität Heidelberg.<br />
1988 wurde er an der Universität<br />
Dortmund promoviert. Danach ging er<br />
als Postdoc an das Massachusetts <strong>Institute</strong><br />
of Technology in Cambridge, USA.<br />
1991 wechselte er zur Freien Universität<br />
Berlin, wo er sich 1996 habilitierte. Seit<br />
1997 ist Thomas Prisner C4-Professor<br />
für Elektronenspin-Resonanzspektroskopie<br />
am Institut für Physikalische und<br />
Theoretische Chemie an der Goethe-<br />
Universität <strong>Frankfurt</strong>. Er ist verheiratet<br />
und hat zwei Kinder. Zu seinen Hobbies,<br />
für die leider wenig Zeit bleibt, gehören<br />
Zeichnen, Musizieren und Radfahren.