Lösung hier - PatrickReinke.de
Lösung hier - PatrickReinke.de
Lösung hier - PatrickReinke.de
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
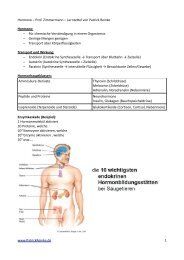
Anorganische Chemie Tutorium Übung 7: RedOx-Chemie 2<br />
Ausschnitt <strong>de</strong>r Spannungsreihe:<br />
Redoxpaar Spannung (E 0 )<br />
Li / Li +<br />
Mg / Mg 2+<br />
Al / Al 3+<br />
Ti / Ti 2+<br />
Cr / Cr 2+<br />
Zn / Zn 2+<br />
Fe / Fe 2+<br />
Ni / Ni 2+<br />
Sn / Sn 2+<br />
Pb / Pb 2+<br />
- 3,01 V<br />
- 2,38 V<br />
- 1,66 V<br />
- 1,63 V<br />
- 0,91 V<br />
- 0,76 V<br />
- 0,44 V<br />
- 0,23 V<br />
- 0,14 V<br />
- 0,13 V<br />
H 2 / 2 H + 0,00 V ← Bezugspotential<br />
Cu / Cu 2+<br />
Ag / Ag +<br />
Au / Au 3+<br />
+ 0,34 V<br />
+ 0,80 V<br />
+ 1,42 V<br />
Bezugshalbzelle: Ein galvanisches Element mit einer sauren Lösung und Wasserstoffgas, welches an<br />
einem Platingitter entlang läuft, ist das Bezugselement von galvanischen Zellen.<br />
b) Sage die Spannungen von folgen<strong>de</strong>n galvanischen Elementen voraus:<br />
Zn / Zn 2+ // Au / Au 3+<br />
Li / Li + // H 2 / 2 H +<br />
Cr / Cr 3+ // Ag / Ag +<br />
Spannungen von folgen<strong>de</strong>n Halbzellen:<br />
- 3,04 V Li / Li +<br />
- 0,76 V Zn / Zn 2+<br />
- 0,74 V Cr / Cr 3+<br />
0,00 V H 2 / 2 H +<br />
+ 0,80 V Ag / Ag +<br />
+ 1,50 V Au / Au 3+<br />
Nach <strong>de</strong>r folgen<strong>de</strong>n Formel:<br />
Spannung <strong>de</strong>r Galvanischen Zelle = - (Potential Oxidation) + (Potential Reduktion)<br />
Zink-Gold-Halbzellen: Im ersten Beispiel oxidiert Zink (niedrigeres Potential) und die Goldionen<br />
wer<strong>de</strong>n reduziert (höheres Potential).<br />
Spannung <strong>de</strong>r Galvansichen Zelle = - ( - 0,76 V ) + ( + 1,50 V )<br />
= + 2,26 Volt<br />
Lithium-Wasserstoff-Halbzellen: Hier oxidiert Lithium (niedrigeres Potential) und die Hydronium-<br />
Ionen wer<strong>de</strong>n reduziert (höheres Potential).<br />
Spannung <strong>de</strong>r Galvansichen Zelle = - ( - 3,04 V ) + ( 0 V )<br />
= + 3,04 Volt<br />
www.<strong>PatrickReinke</strong>.<strong>de</strong> 2 / 4