REDOXREAKTIONEN GF
REDOXREAKTIONEN GF
REDOXREAKTIONEN GF
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
KSO<br />
<strong>REDOXREAKTIONEN</strong> <strong>GF</strong><br />
Skript Redoxreaktionen <strong>GF</strong> V1.0 12/12 | © MMo, edited by Bor
1<br />
INHALTSVERZEICHNIS<br />
"<strong>REDOXREAKTIONEN</strong>"<br />
1. Einleitung….................................................................................................... 02<br />
2. Elektronenübertragungen.............................................................................. 02<br />
2.1 Die Oxidation....................................................................................... 02<br />
2.2 Die Reduktion...................................................................................... 03<br />
2.3 Die Redoxreaktion................................................................................ 03<br />
2.4 Die Oxidationszahlen............................................................................ 04<br />
3. Die Redoxreihe der Metalle............................................................................06<br />
3.1 Elektronendonatoren & -akzeptoren....................................................... 06<br />
3.2 Korrespondierende Redoxpaare............................................................. 06<br />
3.3 Die Stärke von Oxidations- & Reduktionsmittel; die Redoxreihe................ 06<br />
3.4 Edle und unedle Metalle........................................................................ 08<br />
3.5 Aufstellen von Redoxgleichungen........................................................... 08<br />
4. Nutzung von Redoxreaktionen; die Galvanische Zelle..................................... 10<br />
4.1 Das Daniell-Element.............................................................................. 11<br />
4.2 Die Spannung bei Redoxreaktionen; das Redoxpotential........................... 11<br />
5. Redoxreaktionen in Molekülen...................................................................... 13<br />
5.1 Oxidationszahlen in Molekülen.............................................................. 13<br />
6. Anwendungen von Redoxreaktionen............................................................. 15<br />
6.1 Die Batterie......................................................................................... 15<br />
6.2 In der Industrie..................................................................................... 15<br />
6.3 Bei der Energieerzeugung...................................................................... 15<br />
6.4 Sprengstoffe........................................................................................ 16<br />
6.5 In der Lebensmittelindustrie.................................................................. 16<br />
7. Exkurs: Der Hochofenprozess......................................................................... 16<br />
8. Zusammenfassung......................................................................................... 17<br />
9. Übungen........................................................................................................ 17
2<br />
1. Einleitung<br />
Bild: cache.eb.com<br />
Der irische Naturforscher Robert Boyle (1627 – 1691) erklärte die<br />
Klärung des Phänomens „Verbrennung“ zu einem der Hauptprobleme<br />
der Chemie. Georg Ernst Stahl (1660 –<br />
1734), deutscher Chemiker, Mediziner und Metallurge,<br />
nahm 1722 an, dass jeder brennbare<br />
Stoffe einen „Feuerstoff“, das so genannte<br />
Phlogiston, enthalte, welcher bei der Verbrennung<br />
entweiche. Gegen Ende des 18. Jahrhunderts<br />
gelang es dem französischen Chemiker<br />
Antoine Laurent de Lavoisier (1743 – 1794), den<br />
Verbrennungsvorgang als eine Reaktion eines Stoffes mit Sauerstoff<br />
aufzuklären. Er führte auch den Begriff Oxidation ein, der in der Folgezeit<br />
für alle Vorgänge benutzt wurde, bei denen sich Substanzen mit<br />
Sauerstoff verbinden. Der Begriff Reduktion wurde für die Gewinnung<br />
Bild: upload.wikimedia.org<br />
Bild: usuarios.lycos.es<br />
eines Metalls aus seinem Metalloxid verwendet und erlangte gegenteilige Bedeutung zum<br />
Begriff Oxidation.<br />
Viele Reaktionen, an denen überhaupt kein Sauerstoff beteiligt ist, unterscheiden sich aber<br />
äusserlich überhaupt nicht von den eigentlichen Verbrennungen, bei denen der Sauerstoff<br />
an der Reaktion teilnimmt. Aus diesem Grund müssen die Begriffe Oxidation und Reduktion<br />
etwas anders definiert werden.<br />
2. Elektronenübertragungen<br />
Werden ganz allgemein Reaktionen zwischen Metallen und Nichtmetallen betrachtet, so fällt<br />
eine Gemeinsamkeit auf, Metalle und Nichtmetalle reagieren zu Salzen. Für Salze ist die Ionenbindung<br />
charakteristisch.<br />
Ionen zeichnen sich allgemein durch eine positive oder negative elektrische Ladung aus. Die<br />
Ionen können sich aus Atomen bilden, wenn letztere Elektronen abgeben oder aufnehmen.<br />
2.1 Die Oxidation<br />
Bei der Bildung von Salzen aus Metallen und Nichtmetallen geben immer die Metallatome<br />
Elektronen ab.
3<br />
Mg Mg 2+ + 2 e -<br />
Dabei gilt jede Abgabe von Elektronen als Oxidation. Auch ein Anion kann eine Oxidation<br />
erfahren.<br />
F - F + e -<br />
Auch Kationen können unter Umständen weitere Elektronen abgeben.<br />
Fe 2+ Fe 3+ + e -<br />
Oxidationen können ausschliesslich stattfinden, wenn ein anderes Atom, Ion oder Molekül<br />
das abgegebene Elektron wieder aufnehmen kann.<br />
<br />
Die Abgabe von Elektronen wird als Oxidation bezeichnet.<br />
2.2 Die Reduktion<br />
Die Nichtmetallatome nehmen bei der Bildung von Salzen die von den Metallen abgegebenen<br />
Elektronen auf.<br />
O + 2 e - O 2-<br />
Jede Aufnahme von Elektronen wird als Reduktion bezeichnet. Auch ein Kation kann eine<br />
Reduktion erfahren.<br />
Mg 2+ + 2 e - Mg<br />
Anionen, welche weitere Elektronen aufnehmen, sind nicht bekannt.<br />
Reduktionen können ausschliesslich stattfinden, wenn ein anderes Atom, Ion oder Molekül<br />
auch ein Elektron zur Aufnahme zur Verfügung stellt.<br />
<br />
Die Aufnahme von Elektronen wird als Reduktion bezeichnet.<br />
2.3 Die Redoxreaktion<br />
Eine Reduktion kann ohne eine gleichzeitig ablaufende Oxidation nicht stattfinden, et vice<br />
versa. Ein Beispiel soll Licht ins Dunkel bringen. Magnesium reagiert mit Schwefel zu Magnesiumsulfid.<br />
1. Teilreaktion: Oxidation: Mg Mg 2+ + 2 e -<br />
2. Teilreaktion: Reduktion: S + 2 e - S 2-<br />
Magnesium gibt bei der Bildung eines Salzes Elektronen ab. Die Elektronen werden vom<br />
Schwefel aufgenommen.
4<br />
Redoxreaktion: Mg + S MgS<br />
<br />
Eine Reaktion, bestehend aus einer Reduktion und einer Oxidation, wird als Redoxreaktion<br />
bezeichnet. Sie wird gekennzeichnet durch eine Verschiebung von Elektronen.<br />
Aufgabe I<br />
Geben Sie bei den folgenden Reaktionen jeweils die beiden Teilreaktionen, die Oxidation<br />
und die Reduktion, und die daraus entstehende Redoxreaktion an. Achten Sie darauf, dass<br />
immer gleich viele Elektronen abgegeben wie aufgenommen werden.<br />
a.)<br />
b.)<br />
c.)<br />
Natrium und Chlor reagieren zu Natriumchlorid.<br />
Lithium reagiert mit Sauerstoff zu Lithiumoxid.<br />
Eisen und Sauerstoff reagieren zu Eisen(III)-oxid.<br />
Aufgabe II (Zusatz)<br />
Suchen Sie weitere Redoxreaktionen, verfassen Sie diese Reaktionen in kurze Sätze, wie dies<br />
bei der obenstehenden Aufgabe I der Fall ist, und schreiben Sie diese auf den Hellraumprojektor,<br />
so dass alle diese Aufgaben lösen können.<br />
2.4 Die Oxidationszahlen<br />
Von jedem Ion, aber auch von Atomen, können die so genannten Oxidationszahlen angegeben<br />
werden. Sie entsprechen bei Atomen und einfachen Ionen der Ladung derselben. So hat<br />
ein Aluminiumatom die Oxidationszahl 0, ein Aluminiumion die Oxidationszahl +3 und das<br />
Sauerstoffanion die Oxidationszahl -2. Sie wird in römischen Ziffern über das Atomsymbol<br />
geschrieben.<br />
Aufgabe III<br />
Studieren Sie die Regeln zur Bestimmung von Oxidationszahlen im ausgeteilten Blatt und<br />
lösen Sie die Aufgaben auf der Rückseite.
5<br />
Aufgabe IV<br />
Die Oxidationszahlen in Aluminiumoxid werden wie folgt angegeben. Al 2 O 3<br />
Geben Sie die Oxidationszahlen in folgenden Stoffen an.<br />
III -II<br />
a.)<br />
b.)<br />
c.)<br />
d.)<br />
e.)<br />
f.)<br />
g.)<br />
Natriumfluorid<br />
Eisen(III)-bromid<br />
Kohlenstoff<br />
Silber(I)-oxid<br />
Magnesiumhydrid<br />
Natriumnitrid<br />
Kaliumiodid<br />
Aufgabe V<br />
Stellen Sie 2-3 weitere Stoffe zusammen, bei welchen die Oxidationszahlen bestimmt werden<br />
können. Schreiben Sie diese an die Tafel, so dass alle diese Aufgaben lösen können.
6<br />
3. Die Redoxreihe der Metalle<br />
3.1 Elektronendonatoren & -akzeptoren<br />
Immer wenn eine Teilchensorte Elektronen abgibt, muss eine andere Teilchensorte zugegen<br />
sein, die diese Elektronen aufnimmt. Die Oxidation und die Reduktion sind also gekoppelte<br />
Reaktionen. Die Teilchensorte, welche Elektronen zur Verfügung stellt, wird als Elektronendonator<br />
(lat. donare: spenden) bezeichnet, die Teilchensorte, welche Elektronen aufnimmt,<br />
als Elektronenakzeptor (lat. accipere: aufnehmen).<br />
3.2 Korrespondierende Redoxpaare<br />
Ein so genanntes Reduktionsmittel kann andere Stoffe reduzieren, wird dabei selber oxidiert<br />
und zu einem korrespondierenden (dazugehörenden) Oxidationsmittel.<br />
Red Ox + z e -<br />
Beispiel: K K + + e -<br />
Ein so genanntes Oxidationsmittel kann andere Stoffe oxidieren, wird dabei selber reduziert<br />
und zu einem korrespondierenden Reduktionsmittel.<br />
Ox + z e -<br />
Red<br />
Beispiel: Na + + e - Na<br />
Reduktions- und Oxidationsmittel einer Redoxreaktion bilden je ein korrespondierendes Redoxpaar.<br />
korrespondierend<br />
Red 1 + Ox 2 Ox 1 + Red 2<br />
korrespondierend<br />
3.3 Die Stärke von Oxidations- & Reduktionsmitteln; die Redoxreihe<br />
Aufgabe VI<br />
Skizzieren Sie das vorgezeigte Experiment und übernehmen Sie die Tabelle.<br />
Aufgabe VII<br />
Bei obenstehendem Experiment haben einige Redoxreaktionen stattgefunden. Formulieren<br />
Sie diese und kennzeichnen Sie die entsprechenden korrespondierenden Redoxpaare.
7<br />
Offensichtlich sind einige Metalle stärkere Reduktionsmittel als andere. Wird dieses Experiment<br />
mit weiteren Metallen durchgeführt, erhält man eine Reihe, die so genannte Redoxreihe.<br />
Tabelle I<br />
Die Redoxreihe (Spannungsreihe); die Spalte mit dem Standardpotential E° muss Sie (noch)<br />
nicht kümmern.<br />
reduzierende Wirkung nimmt ab; oxidierende Wirkung nimmt zu<br />
Reduktor (Reduzierte Form) Oxidator (Oxidierte Form) E° [V]<br />
Li (s) Li + (aq) + e - -3.03<br />
K (s) K + (aq) + e - -2.92<br />
Ba (s) Ba 2+ (aq) + 2e - -2.92<br />
Sr (s) Sr 2+ (aq) + 2e - -2.89<br />
Ca (s) Ca 2+ (aq) + 2e - -2.76<br />
Na (s) Na + (aq) + e - -2.71<br />
Mg (s) Mg 2+ (aq) + 2e - -2.40<br />
Al (s) Al 3+ (aq) + 3e - -1.69<br />
Zn (s) Zn 2+ (aq) + 2e - -0.76<br />
Fe (s) Fe 2+ (aq) + 2e - -0.44<br />
Pb (s) Pb 2+ (aq) + 2e - -0.13<br />
H 2 (aq) 2 H + (aq) + 2e - 0.00<br />
Cu (s) Cu 2+ (aq) + 2e - +0.35<br />
2 I - (aq) I 2 (aq) + 2e - +0.58<br />
Fe 2+ (aq) Fe 3+ (aq) + e - +0.75<br />
Ag (s) Ag + (aq) + e - +0.81<br />
Hg (s) Hg 2+ (aq) + 2e - +0.86<br />
2 Br - (aq) Br 2 (aq) + 2e - +1.09<br />
2 Cl - (aq) Cl 2 (aq) + 2e - +1.36<br />
Au (s) Au 3+ (aq) + 3e - +1.38<br />
2 F - (aq) F 2 (aq) + 2e - +2.85<br />
Quelle: Günter Baars, Hans-Rudolf Christen;<br />
Chemie; hep-Verlag<br />
Die Standardpotentiale der Redoxpaare wurden gemessen bei 25 °C und 1013 mbar, wobei alle Reaktanden<br />
in der Konzentration 1 mol/L vorlagen.<br />
reduzierende Wirkung nimmt zu; oxidierende Wirkung nimmt ab
8<br />
Aufgabe VIII<br />
Schauen Sie den Klett-Kurzfilm zum Thema „Spannungsreihe“ und notieren Sie die wichtigsten<br />
Informationen, welche neu für Sie sind.<br />
3.4 Edle und unedle Metalle<br />
Nur wenige Metalle kommen in der Natur gediegen, also nicht in einer<br />
Verbindung, sondern als reines Metall vor. Zu ihnen zählen Gold oder<br />
Silber. Diese Metalle zeichnen sich durch ihre Beständigkeit gegenüber<br />
Oxidationsprozessen aus und wurden schon seit Jahrhunderten als<br />
Schmuck verarbeitet oder galten als wertbeständiges Zahlungsmittel.<br />
Bild: www.ctt-reisen.de<br />
Sie werden als Edelmetalle bezeichnet und von den weniger beständigen unedlen Metallen<br />
abgegrenzt. Je weiter unten in der Redoxreihe ein Metall steht, umso edler ist es.<br />
Zu den Edelmetallen werden allerdings erst die Metalle ab Silber gezählt. Sie behalten ihren<br />
Glanz auch an feuchter Luft. Kupfer reagiert dagegen nach einiger Zeit bereits mit Sauerstoff,<br />
Wasser und Kohlenstoffdioxid zu Malachit (Kupferhydroxidcarbonat), das sich durch eine<br />
schöne grüne Farbe auszeichnet. Man deckt deshalb häufig die Dächer von Kirchen und<br />
grossen Bauwerken mit Kupfer. Kupfer gilt als Halbedelmetall.<br />
3.5 Aufstellen von Redoxgleichungen<br />
Beim Aufstellen von Reaktionsgleichungen von Redoxreaktionen sind prinzipiell zwei Punkte<br />
zu beachten. Erstens ist es wichtig, dass immer gleich viele Elektronen bei der Oxidation abgegeben<br />
werden wie bei der Reduktion aufgenommen werden. Ein Beispiel<br />
hierzu:<br />
Na Na + + 1 e - | *4<br />
O 2 + 4 e - 2 O 2-<br />
In dieser Reaktion müssen also pro Sauerstoffatom immer zwei Natriumatome<br />
reagieren.<br />
4 Na + O 2 2 Na 2 O<br />
Weiter wurde in den obenstehenden Kapitel darauf hingewiesen, dass<br />
Metalle unterschiedlich starke Reduktionsmittel sind, bzw. deren Kationen<br />
unterschiedlich starke Oxidationsmittel. Es ist daher wichtig, abschätzen<br />
zu können, welche Metalle mit welchen Metallkationen reagie-<br />
Red<br />
Red 1<br />
Red 2<br />
Red 3<br />
Ox<br />
Ox 1<br />
Ox 2<br />
Ox 3
9<br />
ren können. Eine Hilfestellung bietet das nebenstehende Schema. Ein Reduktionsmittel Red 2<br />
wird nur mit einem Oxidationsmittel Ox reagieren, wenn letzteres in der Redoxreihe weiter<br />
unten steht (Ox 3 ), da das entsprechende Reduktionsmittel Red 3 ein geringeres Verlangen als<br />
Red 2 hat, Elektronen abzugeben und somit Ox 3 ein grösseres Verlangen hat als Ox 2 , Elektronen<br />
aufzunehmen<br />
In chemischen Verbindungen kommen Ionen niemals alleine vor, da ansonsten der ganze<br />
Stoff eine elektrische Ladung tragen würde. Aus diesem Grund wurden bei der folgenden<br />
Übung Anionen zu den Kationen hinzugefügt. Die Anionen sind in diesem Fall einzig für den<br />
Ladungsausgleich verantwortlich.<br />
Aufgabe IX<br />
Ergänzen Sie die Reaktionen, geben Sie die Oxidations-, die Reduktions- und die daraus resultierende<br />
Redoxreaktion an. Markieren Sie die korrespondierenden Redoxpaare. Entscheiden<br />
Sie mit Hilfe der Tabelle I, ob eine Reaktion stattfindet oder nicht.<br />
a.) CuO + Fe FeO + Cu<br />
b.) FeO + Al<br />
c.) MgO + Ca<br />
d.) ZnO + Li<br />
e.) SrCl 2 + Mg<br />
Aufgabe X<br />
Viele Baumaterialien bestehen aus Metallen, da diese eine hohe Festigkeit besitzen, aber<br />
dennoch bei Druck nicht sofort auseinander brechen. Besteht eine Brücke aus Eisen, so stellt<br />
das Rosten der Eisenkonstruktion eine Gefahr für die Stabilität der Eisenbrücke dar. Erklären<br />
Sie ausführlich warum.
10<br />
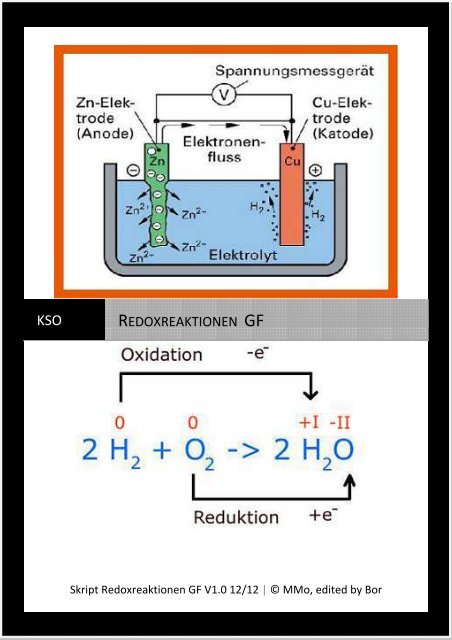
4. Nutzung von Redoxreaktionen; die galvanische Zelle<br />
In Abschnitt 3.3 wurden Systeme aus einem Metall und einer Salzlösung vorgestellt. Werden<br />
Metalle in Salzlösungen eines edleren Metalls getaucht, finden Elektronenübergänge<br />
statt. Ionen des edleren Metalls werden reduziert, die Atome des<br />
unedleren Metalls oxidiert. Die Elektronenübergänge verlaufen spontan, das<br />
System nimmt mit Beginn der Reaktion einen energetisch günstigeren Zustand<br />
ein.<br />
Dieser Prozess wird in Batterien genutzt. Indem die Elektronenabgabe und die<br />
Aufnahme von Elektronen räumlich getrennt werden, gelingt es, die chemische<br />
Energie der Redoxreaktion in elektrische Energie umzusetzen. Eine Versuchsanordnung,<br />
die Elektronenabgabe und -aufnahme räumlich voneinander<br />
Bild: de.wikipedia.org<br />
trennt, heisst galvanische Zelle, benannt nach dem italienischen<br />
Arzt, Anatom und Biophysiker Luigi Galvani (1737 –<br />
1798).<br />
In galvanischen Zellen müssen auf Grund der räumlichen<br />
Trennung der Oxidation und der Reduktion die Elektronen,<br />
welche übertragen werden, „aussen herum“, d.h. über<br />
einen die Zellen verbindenden Metalldraht laufen. Und wie<br />
allgemein bekannt, werden sich bewegende Ladungsträger<br />
als elektrischen Strom bezeichnet.<br />
Bild: Duden, Chemie, Lehrbuch SII<br />
Aufgabe XI<br />
a.)<br />
b.)<br />
Beschriften Sie die oben stehende Zeichnung (wird vorgegeben).<br />
Übernehmen Sie die Skizze von der Wandtafel.
11<br />
4.1 Das Daniell-Element<br />
Der englische Chemiker John Frederic Daniell (1790 – 1845) entwickelte 1836<br />
die ersten Batterien, welche in Telegrafenanlagen eingebaut wurden. Das Daniell-Element<br />
war aus einer Halbzelle mit dem Redoxpaar Zn/Zn 2+ und einer<br />
Halbzelle mit dem Redoxpaar Cu/Cu 2+ aufgebaut.<br />
Bild: de.wikipedia.org<br />
Aufgabe XII<br />
Skizzieren Sie das vorgezeigte Experiment. Formulieren Sie die Oxidations-, die Reduktions-<br />
und die daraus entstehende Redoxreaktion.<br />
4.2 Die Spannung bei Redoxreaktionen; das Redoxpotential<br />
Beim Daniell-Element wurde beobachtet, dass elektrischer Strom fliesst. Elektronen werden<br />
also von einer Halbzelle zur anderen verschoben. Die einzelnen Redoxpaare haben ein unterschiedliches<br />
Bestreben, Elektronen abzugeben bzw. aufzunehmen. Dadurch entsteht auf<br />
beiden Seiten ein Elektronendruck. Die Elektronen fliessen dabei immer von der Halbzelle<br />
mit einem grösseren Elektronendruck zur Halbzelle mit einem kleineren Elektronendruck.<br />
Dieser Elektronendruck ist ein quantitatives Mass für die Stärke des Elektronendonators<br />
(Reduktor) bzw. des Elektronenakzeptors (Oxidator). Dieses Mass wird als Redoxpotential<br />
bezeichnet.<br />
Das Redoxpotential zwischen zwei Halbzellen kann gemessen werden. Die Spannung, welche<br />
zwischen zwei Halbzellen entsteht, entspricht dabei immer der Differenz der beiden Standardpotentiale<br />
E°.<br />
U = ∆E° = E° 1 – E° 2<br />
Aufgabe XIII<br />
Formulieren Sie die Oxidation, die Reduktion und die Redoxreaktion für folgende Batterien<br />
und berechnen Sie deren Spannung.<br />
a.)<br />
b.)<br />
c.)<br />
d.)<br />
Eine Zink-Kupfer-Batterie<br />
Eine Lithium-Silber-Batterie<br />
Eine Quecksilberoxid-Zink-Batterie<br />
Eine Silberoxid-Zink-Batterie
12<br />
Aufgabe XIV (Zusatz)<br />
Erfinden Sie zu zweit weitere mögliche Batterien und berechnen Sie deren Spannung.<br />
Aufgabe XV<br />
Schauen Sie den Kurzfilm zur Zink-Kohle-Batterie und „Dry Cell“ und notieren Sie sich das<br />
Wichtigste. Wie sieht eine Batterie von Innen aus? Wie funktioniert sie?
13<br />
5. Redoxreaktionen in Molekülen<br />
Oft gibt eine Reaktionsgleichung nicht ausreichend Auskunft darüber, ob bei einer Reaktion<br />
Elektronenübergänge stattgefunden haben oder welche Teilchensorte als Elektronendonator<br />
oder -akzeptor wirkt. Diese Schwierigkeiten treten besonders dann auf, wenn an der Reaktion<br />
Stoffe beteiligt sind, deren Teilchen nicht durch Ionenbindung sondern durch Elektronenpaarbindung<br />
miteinander verbunden sind. Ein Beispiel hierfür ist die Reaktion von Eisen(II)-<br />
oxid mit Kohlenstoff zu Eisen und Kohlenstoffdioxid.<br />
Aufgabe XVI<br />
Formulieren Sie die oben genannte Reaktion und bestimmen Sie, dort wo Sie es bereits können,<br />
die Oxidationszahlen.<br />
Das Eisen(II)-ion wurde zu einem Eisenatom reduziert. Gleichzeitig muss auch eine Oxidation<br />
stattgefunden haben. Wenn die Definition von de Lavoisier zu Hilfe genommen wird, wird<br />
klar, dass die Reaktion von Kohlenstoffmonoxid mit dem Sauerstoff des Eisen(II)-oxids der<br />
Oxidationsvorgang sein muss. Wie ist es aber möglich, bei Molekülen Oxidationszahlen anzugeben?<br />
5.1 Oxidationszahlen in Molekülen<br />
Die Oxidationszahlen entsprechen bei Ionen deren Ladung. Bei der Ausbildung chemischer<br />
Bindungen findet allerdings ein vollständiger Elektronenübergang nur bei Ionenverbindungen<br />
statt. Bei kovalenten Verbindungen werden dagegen gemeinsame Elektronenpaare gebildet,<br />
die stärker vom elektronegativeren Bindungspartner angezogen werden. Um den<br />
Elektronenübergang bei Redoxreaktionen dennoch beschreiben zu können, benutzt man das<br />
Modell der Oxidationszahlen.<br />
Dazu geht man formal davon aus, dass alle Stoffe, also auch Moleküle, aus Ionen aufgebaut<br />
sind. Man stellt die Lewis-Formel des Moleküls auf und ordnet in Gedanken die bindenden<br />
Elektronenpaare einer polaren Atombindung dem elektronegativeren Bindungspartner zu.<br />
Gleiche Bindungspartner teilen sich die bindenden Elektronenpaare. An den Bindungen nicht<br />
beteiligte Elektronenpaare, die nicht bindenden Elektronenpaare, verbleiben beim dazugehörigen<br />
Atom.
14<br />
Die Oxidationszahl (OZ) eines Atoms in einer Verbindung ist die Differenz aus der Valenzelektronenzahl<br />
(VEZ) des neutralen Atoms und der Elektronenzahl des formal geladenen<br />
Atoms (EZA).<br />
3,5 2,5 3,5<br />
O C O<br />
OZ = VEZ – EZA<br />
2,2<br />
2,5 2,5 2,2<br />
H C C H<br />
C: 4 – 0 = IV C: 4 – 5 = -I<br />
O: 6 – 8 = -II H: 1 – 0 = I<br />
-II IV -II<br />
O C O<br />
I<br />
-I -I I<br />
H C C H<br />
Aufgabe XVII<br />
Bestimmen Sie die Oxidationszahlen der einzelnen Atome in folgenden Verbindungen.<br />
a.) HF b.) O 2 c.) CF 4 d.) CH 4<br />
e.) H 2 O 2 f.) NaOH g.) H 3 CCHO h.) CHCl 3<br />
i.)<br />
H 2 CO 3 (Kohlensäure; keine Bindung zwischen zwei Sauerstoffatomen!)<br />
Aufgabe XVIII<br />
Zeigen Sie auf, dass folgende Reaktionen Redoxreaktionen sind, indem Sie die Oxidationszahlen<br />
der Atome bestimmen und die Oxidation und die Reduktion kennzeichnen.<br />
a.)<br />
b.)<br />
Der Raketentreibstoff Hydrazin (N 2 H 4 ) verbrennt zu Stickstoff und Wasser.<br />
Kohlenstoff reagiert mit Sauerstoff zu Kohlenstoffdioxid.
15<br />
6. Anwendungen von Redoxreaktionen<br />
Ohne Redoxreaktionen könnte kein Leben auf unserer Erde existieren. Tiere könnten ohne<br />
Atmung ihre benötigte Energie nicht gewinnen, Pflanzen ohne Assimilation, den Umbau von<br />
körperfremden Stoffen in körpereigene Verbindungen, keine Kohlenhydrate aufbauen und<br />
somit nicht wachsen. Redoxreaktionen sind seit jeher in der Natur wichtige Reaktionen, aber<br />
auch aus unserem Alltag sind sie nicht mehr wegzudenken.<br />
6.1 Die Batterie<br />
Die Batterie ist das Paradebeispiel für Redoxreaktionen. Deren Funktionsweise wurde bereits<br />
in Kapitel 4 erläutert.<br />
6.2 In der Industrie<br />
Praktisch alle stickstoffhaltigen Verbindungen, wie Düngemittel, Farbstoffe, Sprengstoffe<br />
oder Polyamide, werden aus Ammoniak erzeugt. Die Herstellung von Ammoniak aus den<br />
Elementen haben wir bereits im Skript „Kinetik & chemisches Gleichgewicht“ kennengelernt.<br />
Aufgabe XIX<br />
Zeigen Sie auf, dass die Herstellung von Ammoniak aus den Elementen eine Redoxreaktion<br />
ist.<br />
Auch die Synthesen organischer Stoffe, wie Alkohole, Aldehyde, Ketone oder Carbonsäuren,<br />
und die bedeutsamen Elektrolyseverfahren, wie die Chloralkali-Elektrolyse, basieren auf Redoxreaktionen.<br />
Aufgabe XX<br />
Schauen Sie den Klett-Kurzfilm zur Elektrolyse und notieren Sie das Wichtigste.<br />
6.3 Bei der Energieerzeugung<br />
Bei der Verbrennung von fossilen Energieträgern, wie Kohle, Erdöl oder Erdgas wird viel<br />
Energie in Form von Wärme frei. Unter anderem wird diese Energie in Kraftwerken in elektrische<br />
Energie umgewandelt.
16<br />
Das Verbrennen von Benzin, Diesel oder Kerosin wird zum Betreiben von Kraftfahrzeugen,<br />
Flugzeugen und Schiffen genutzt.<br />
Aufgabe XXI<br />
Zeigen Sie jeweils auf, dass die nachfolgenden Reaktionen Redoxreaktionen sind.<br />
a.)<br />
b.)<br />
Aceton wird verbrannt.<br />
Erdgas (hauptsächlich bestehend aus Methan, CH 4 ) wird verbrannt.<br />
6.4 Sprengstoffe<br />
Explosive Stoffe können schlagartig in exothermen Redoxreaktionen Gase freisetzen, die sich<br />
auf Grund der hohen Temperatur extrem ausdehnen und damit die Sprengkraft bewirken.<br />
Aufgabe XXII<br />
Ein Beispiel für einen Sprengstoff ist das Salz Ammoniumnitrat NH 4 NO 3 . Es zerfällt zu Stickstoff,<br />
Sauerstoff und Wasser. Zeigen Sie auch hier auf, dass dies eine Redoxreaktion ist.<br />
H<br />
H<br />
+<br />
N<br />
H<br />
H<br />
O<br />
O<br />
N+<br />
O<br />
6.5 In der Lebensmittelindustrie<br />
Länger haltbar gemachte Lebensmittel enthalten Konservierungsmittel, wie Antioxidantien.<br />
Diese Antioxidantien verhindern, wie der Name schon sagt, die Oxidation des Produktes,<br />
also dessen Reaktion mit dem Sauerstoff der Luft. Das Produkt beginnt erst später zu faulen,<br />
zu verderben oder ranzig zu werden.<br />
7. Exkurs: Der Hochofenprozess<br />
Aufgabe XXIII – Zeitbudget: 3 Lektionen<br />
Bearbeiten Sie die von der Lehrperson ausgeteilten Blätter zum Hochofenprozess. Als Hilfe<br />
dient Ihnen das Buch „Elemente“, worin sich auch einige der erwähnten Aufgaben befinden.
17<br />
8. Zusammenfassung<br />
Eine Oxidation ist ein Prozess, bei dem ein Atom, Molekül oder Ion tatsächlich oder formal<br />
Elektronen abgibt. Seine Oxidationszahl nimmt dabei zu.<br />
Eine Reduktion ist ein Prozess, bei dem ein Atom, Molekül oder Ion tatsächlich oder formal<br />
Elektronen aufnimmt. Seine Oxidationszahl nimmt dabei ab.<br />
9. Übungen<br />
Aufgabe XXIV<br />
Bestimmen Sie die Oxidationszahlen aller Atome in folgenden Verbindungen.<br />
a.) Br 2 b.) Fe c.) FeBr 3 d.) S 8<br />
e.) H 2 S f.) H 2 O 2 g.) SrO h.) CH 2 Cl 2<br />
i.) HCHO j.) C 3 H 8 k.) Na + l.)<br />
-<br />
MnO 4<br />
m.) KOH n.) AgO o.) C 2 H 4 p.) Ag 2 O<br />
Aufgabe XXV<br />
Formulieren Sie die korrekten Reaktionsgleichungen und kennzeichnen Sie den Oxidationsund<br />
Reduktionsprozess.<br />
a.) Wasser wird in die Elemente gespalten.<br />
b.) Zink reagiert mit Wasser und Sauerstoff zu Zink(II)-hydroxid.<br />
c.) Brom reagiert mit Ethen (C 2 H 4 ) zu 1,2-Dibromethan (C 2 H 4 Br 2 ).<br />
d.) Natrium reagiert mit Wasser zu Natronlauge (NaOH) und Wasserstoff.<br />
Berechnen Sie nachstehend zusätzlich noch die Spannung und geben Sie an, ob diese<br />
Reaktion wirklich abläuft.<br />
e.)<br />
f.)<br />
g.)<br />
Natriumbromid reagiert mit Chlor zu Natriumchlorid und Brom.<br />
Eisen(III)-iodid reagiert zu Eisen(II)-iodid. Dabei entsteht elementares Iod.<br />
Calciumfluorid reagiert mit elementarem Chlor zu Calciumchlorid und Fluor.<br />
Aufgabe XXVI<br />
Erfinden Sie zu zweit (zu dritt) weitere Beispiele.