REDOXREAKTIONEN SF
REDOXREAKTIONEN SF
REDOXREAKTIONEN SF
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
KSO<br />
<strong>REDOXREAKTIONEN</strong> <strong>SF</strong><br />
Skript Redoxreaktionen <strong>SF</strong> V1.0 12/13 | ©MMo, edited by Bor
2<br />
INHALTSVERZEICHNIS<br />
"<strong>REDOXREAKTIONEN</strong>"<br />
1. Einleitung……………………………......................................................................... 04<br />
1.1 Vergleich Säure-Base-Reaktionen mit Redoxreaktionen............................ 04<br />
1.2 Definitionen......................................................................................... 04<br />
1.2.1 Die Redoxreaktion...................................................................... 04<br />
1.2.2 Die Oxidationszahl...................................................................... 04<br />
1.3 Repetition............................................................................................05<br />
1.3.1 Einfache Beispiele....................................................................... 05<br />
1.3.2 Anspruchsvollere Beispiele........................................................... 05<br />
1.3.3 Redoxreaktionen........................................................................ 06<br />
2. Elektrischer Strom durch chemische Reaktionen............................................ 08<br />
2.1 Die Elektronenübertragungsreaktion...................................................... 08<br />
2.2 Die räumlich getrennte Elektronenübertragungsreaktion.......................... 08<br />
2.3 Gleichgewichte an den Oberflächen der Elektroden.................................. 08<br />
2.4 Die Potentialdifferenz........................................................................... 09<br />
2.5 Die Standardwasserstoffelektrode..........................................................10<br />
2.6 Die Nernst'sche Gleichung..................................................................... 11<br />
2.7 Konzentrationsabhängigkeit des Redoxpotentials.................................... 12<br />
3. Primärbatterien............................................................................................. 15<br />
3.1 Das Leclanché-Element..........................................................................15<br />
3.2 Alkali-Mangan-Batterie......................................................................... 17<br />
3.3 Lithium-Batterien................................................................................. 18<br />
4. Sekundärbatterien; Akkumulatoren............................................................... 21<br />
4.1 Der Blei-Akkumulator........................................................................... 21<br />
4.2 Der Nickel-Cadmium-Akkumulator......................................................... 22<br />
4.2.1 Toxizität................................................................................... 22<br />
4.3 Der Nickel-Metallhydrid-Akkumulator.................................................... 23<br />
5. Brennstoffzellen............................................................................................. 25<br />
5.1 Energieumwandlung im Vergleich.......................................................... 25<br />
5.2 Die Knallgaszelle................................................................................... 25
3<br />
5.3 Die Methanolzelle................................................................................ 27<br />
6. Korrosion....................................................................................................... 28<br />
6.1 Ursachen der Korrosion......................................................................... 28<br />
6.2 Spezialfall Eisen.................................................................................... 29<br />
6.2.1 Rosten im neutralen bis alkalischen Bereich..................................... 30<br />
6.2.1 Rosten im sauren Bereich............................................................. 30<br />
6.3 Korrosionsschutz.................................................................................. 30<br />
7. Redoxtabelle.................................................................................................. 32
4<br />
1. Einleitung<br />
In diesem Skript soll das im Grundlagenfach erworbene Wissen über Redoxreaktionen erweitert<br />
werden.<br />
1.1 Vergleich Säure-Base-Reaktionen mit Redoxreaktionen<br />
Protonenabgabe<br />
Elektronenabgabe<br />
HCl Cl - + H + Na Na + + e -<br />
Protonenaufnahme<br />
Elektronenaufnahme<br />
NH 4<br />
+<br />
Protonenabgabe<br />
Elektronenabgabe<br />
NH 3 + H + 2 Cl - Cl 2 + 2e -<br />
Protonenaufnahme<br />
Elektronenaufnahme<br />
Bei der Säure-Base-Reaktion werden Protonen übertragen, bei der Redoxreaktion sind es<br />
Elektronen.<br />
1.2 Definitionen<br />
1.2.1 Die Redoxreaktion<br />
Die Aufnahme von Elektronen wird als Reduktion bezeichnet, die Abgabe als Oxidation. Die<br />
beiden Reaktionen laufen zwangsläufig immer gemeinsam ab, dies wird aus diesem Grund<br />
als Redoxreaktion bezeichnet.<br />
1.2.2 Die Oxidationszahl<br />
Zum Erkennen der Oxidation und der Reduktion werden die Oxidationszahlen als Hilfsmittel<br />
eingesetzt. Bei einer Oxidation steigt die Oxidationszahl, sie wird positiver; et vice versa. Die<br />
Oxidationszahlen werden mit römischen Ziffern geschrieben.<br />
Elemente: Elementen wird die Oxidationszahl Null zugeordnet.<br />
Ionenverbindungen: Die Oxidationszahl von einatomigen Ionen ist identisch mit der elektrischen<br />
Ladung dieser Ionen. Bei den Hauptgruppenelementen ist diese<br />
direkt aus der Hauptgruppe ableitbar.<br />
Die Summe aller Oxidationszahlen eines mehratomigen Ions ist identisch<br />
mit der elektrischen Ladung des Ions.
5<br />
Die Summe aller Oxidationszahlen der Atome einer Verbindung ist<br />
Null.<br />
Moleküle:<br />
In einem Molekül entspricht die Oxidationszahl der Ladung, die jedes<br />
Atom erhält, wenn die bindenden Elektronenpaare vollständig dem<br />
elektronegativeren Atom zugeteilt werden. Bei gleicher Elektronegativität<br />
teilen sich die beiden an der Bindung beteiligten Atome die entsprechenden<br />
Elektronen.<br />
In Verbindungen besitzen Wasserstoff-Atome praktisch immer die Oxidationszahl<br />
+I (Ausnahmen: H 2 & Hydride).<br />
In Verbindungen besitzen Sauerstoff-Atome praktisch immer die Oxidationszahl<br />
–II (Ausnahmen: O 2 & Peroxide).<br />
1.3 Repetition<br />
1.3.1 Einfache Beispiele<br />
Aufgabe I:<br />
Bestimmen Sie die Oxidationszahlen in folgenden Verbindungen und benennen Sie diese.<br />
a.) Na b.) CH 4 c.) BaCl 2 d.) Al 2 O 3<br />
e.) C 3 H 8 f.) S 8 g.) FeCl 2 h.) I 2<br />
i.) Ca 2 C j.) CH 2 Cl 2 k.) Li 2 O l.) AgCl 2<br />
m.) NaCl n.) FeCl 3 o.) H 2 O p.) AgCl<br />
q.) Mg 3 N 2 r.) Ho 2 O 3 s.) H 3 CCHO t.) H 3 CCOOH<br />
1.3.2 Anspruchsvollere Beispiele<br />
Bei Komplex-Ionen wird die Bestimmung der Oxidationszahlen wortwörtlich etwas komplexer.<br />
Hier gibt es zwei Möglichkeiten zu deren Bestimmung. Dies soll anhand des Schwefelsäure-Moleküls<br />
aufgezeigt werden.<br />
Erstens, durch Aufzeichnen der Lewis-Formel.<br />
O Wasserstoff erhält somit Oxidationszahl 1: H I<br />
H O S O H Sauerstoff erhält die Oxidationszahl -2:<br />
O Schwefel erhält die Oxidationszahl 6:<br />
O -II<br />
S VI
6<br />
Hinweis:<br />
Die Oktettregel gilt nur für die zweite Periode streng. Das Schwefel-Atom<br />
kann auf Grund des grossen Radius und der kleinen Energiedifferenz zwischen<br />
den 3s-, 3p- und 3d-Orbitalen Hybridorbitale ausbilden, die dazu führen, dass<br />
Schwefel auch sechs Bindungen eingehen kann. Bei sechsbindigem Schwefel<br />
ist dies ein sp 3 d 2 -Hybridorbital.<br />
Zweitens, aus den bekannten Oxidationszahlen bildet man die algebraische Summe und ergänzt<br />
mit dem fraglichen Atom auf null.<br />
H 2 SO 4 H I ; O -II ergo: S VI<br />
Aufgabe II:<br />
Bestimmen Sie die Oxidationszahlen in folgenden Verbindungen.<br />
a.) CaCO 3 b.) H 3 PO 4 c.) K 2 Cr 2 O 7<br />
d.) KClO 3 e.) NaMnO 4 f.) HClO 4<br />
1.3.3 Redoxreaktionen<br />
Die in den obenstehenden Beispielen geübte Bestimmung der Oxidationszahlen kann gebraucht<br />
werden, um Oxidationen und Reduktionen in einer Reaktion zu bestimmen und diese<br />
somit als Redoxreaktion zu definieren.<br />
Aufgabe III:<br />
Bestimmen Sie die Oxidationszahlen der Atome in den Verbindungen bei den folgenden Reaktionen<br />
und kennzeichnen Sie die Oxidation(en) und die Reduktion(en).<br />
a.)<br />
b.)<br />
c.)<br />
Wird festes Blei(II)-nitrat erhitzt, entsteht Blei(II)-oxid, Stickstoffdioxid und Sauerstoff.<br />
Wird elementares Kupfer in eine Salpetersäure-Lösung getaucht, bildet sich gelöstes<br />
Kupfer(II)-nitrat (welches an der blauen Farbe zu erkennen ist), braunes Stickstoffdioxidgas<br />
und Wasser.<br />
Das zum Stickstoff-Molekül isoelektronische (siehe unten) Kohlenstoffmonoxid kann<br />
Eisen(III)-oxid zu Eisen reduzieren.
7<br />
Einschub:<br />
Als isoelektronisch bezeichnet man Atome, Moleküle oder Ionen, welche eine<br />
sehr ähnliche Elektronenkonfiguration besitzen, und damit oftmals die gleichen<br />
Bindungsverhältnisse aufweisen, aber aus anderen Elementen bestehen<br />
bzw. zusammengesetzt sind.
8<br />
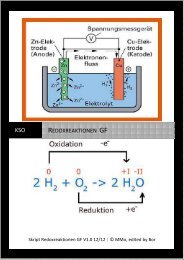
2. Elektrischer Strom durch chemische Reaktionen<br />
2.1 Die Elektronenübertragungsreaktion<br />
Schüttelt man im Reagenzglas Eisenpulver in einer Kupfer(II)-salz-Lösung, so lässt sich eine<br />
deutliche Erwärmung feststellen. Die Reaktion ist also exotherm und exergon.<br />
Aufgabe IV:<br />
Was heisst exotherm und exergon?<br />
Während dieses Vorgangs müssen jeweils zwei Elektronen von den Eisen-Atomen auf die<br />
Kupfer-Ionen übertragen worden sein. Eine solche Verschiebung von elektrischer Ladung<br />
kann als elektrischer Strom aufgefasst werden. Der elektrische Strom ist allerdings nicht<br />
nachweisbar, weil die Elektronenübertragung in atomaren Dimensionen erfolgt. Dies wird<br />
hingegen möglich, wenn die beiden Teilvorgänge der Redoxreaktion räumlich voneinander<br />
getrennt werden.<br />
Die in der oben gesehenen Reaktion frei werdende Energie kann dann in Form von elektrischer<br />
Energie genutzt werden.<br />
2.2 Die räumlich getrennte Elektronenübertragungsreaktion<br />
Aufgabe V:<br />
Zeichnen Sie eine Apparatur, bei welcher die beiden Teilvorgänge der Redoxreaktion räumlich<br />
voneinander getrennt sind.<br />
Die während der Gesamtreaktion frei werdende Energie lässt sich mit dieser Versuchsanordnung<br />
als elektrische Arbeit erhalten. Je nach Wahl der Komponenten lässt sich eine ganz<br />
bestimmte Spannung, hervorgerufen durch die Potentialdifferenz, messen.<br />
Die Vorgänge an den Elektroden sollen nachstehend etwas genauer betrachtet werden.<br />
2.3 Gleichgewichte an den Oberflächen der Elektroden<br />
Wird eine Elektrode in eine wässrige Lösung getaucht, in welcher Ionen desselben Metalls<br />
gelöst sind, so laufen, unter der Annahme, dass die Anionen nicht beteiligt sind, die folgenden<br />
Oberflächenvorgänge an der Elektrode ab:
9<br />
1. Infolge Hydratation und Wärmebewegung können Atomrümpfe des Metalls, also die<br />
Kationen, in Lösung gehen. Durch diese Reaktion ergibt sich eine negative Überschussladung<br />
an der Elektrode, weil die Elektronen auf dem Metall zurückbleiben.<br />
2. Infolge der Wärmebewegung prallen gelöste Metall-Ionen auf die Elektrodenoberfläche,<br />
wo sie z. T. ins Metallgitter eingelagert werden. Durch diese Reaktion ergibt sich<br />
eine positive Überschussladung an der Elektrode.<br />
Die Reaktionsgeschwindigkeit der 1. Reaktion hängt von der Art des Metalls (Gitterenergie,<br />
Ionisierungsenergie, Hydratationsenergie) und von der Ladung der Metallelektrode ab. Je<br />
höher die negative Überschussladung ist, desto geringer ist die Reaktionsgeschwindigkeit<br />
des Austritts positiv geladener Ionen.<br />
Die Reaktionsgeschwindigkeit der 2. Reaktion ist neben der Art des Metalls auch von der<br />
Konzentration der gelösten Kationen und der Ladung der Metallelektrode abhängig. Je höher<br />
die positive Überschussladung wird, desto geringer ist die Reaktionsgeschwindigkeit des Eintritts<br />
positiv geladener Ionen.<br />
Aufgabe VI:<br />
Erklären Sie Sich zu zweit die Begriffe Gitterenergie, Ionisierungsenergie und Hydratationsenergie.<br />
Die Oxidation von Zink in wässriger Lösung kann in folgende Teilschritte zerlegt werden:<br />
1. Ablösung der Zink-Atome aus dem Metallgitter<br />
2. Ionisierung der abgelösten Metall-Atome<br />
3. Bildung des Zink-Aquokomplexes (Hydratation)<br />
Aufgabe VII:<br />
Verlaufen diese Teilvorgänge exotherm oder endotherm? Ist die ganze Reaktion exo- oder<br />
endotherm?<br />
2.4 Die Potentialdifferenz<br />
Bei der Kombination zweier Halbzellen aus einem Metall und seinen Ionen lässt sich das Zustandekommen<br />
der Potentialdifferenz besonders anschaulich verstehen, wenn man wiederum<br />
die Grenzflächen der Elektroden betrachtet. Stellt man ein Eisenblech in eine Eisen(II)-
10<br />
salz-Lösung, so können einige Ionen an der Oberfläche das Metall verlassen. Zurück auf dem<br />
Eisenblech bleiben die Elektronen und verhindern somit durch die elektrische Anziehung,<br />
dass sich die Eisen-Ionen aus der Nachbarschaft der Oberfläche entfernen können. Es ist eine<br />
Doppelschicht aus Ionen und Elektronen entstanden. Es bildet sich also ein dynamisches<br />
Gleichgewicht aus.<br />
Aufgabe VIII:<br />
Übernehmen Sie die Zeichnung und deren Beschriftung von der Wandtafel.<br />
Aus dem edleren Kupferblech werden weit weniger Ionen aus dem Metall in die Lösung<br />
übergehen. Im Kupferblech werden weniger Elektronen zurückbleiben als beim Eisenblech,<br />
der Elektronendruck auf dem Eisenblech ist somit höher. Da die beiden Elektroden miteinander<br />
über einen Leiter verbunden sind, werden Elektronen vom Ort mit dem höheren<br />
Elektronendruck zum Ort mit dem niedrigeren Elektronendruck verschoben. An der Oberfläche<br />
des Kupferblechs wird es also mehr Elektronen haben und die sich an der Oberfläche<br />
befindenden Kupfer-Ionen werden je zwei Elektronen aufnehmen und sich ins Metallgitter<br />
einlagern.<br />
Die Potentialdifferenz zwischen den beiden Metallen lässt sich als sehr anschaulich mit der<br />
Differenz des Drucks zwischen zwei Gasbehältern vergleichen.<br />
Starke Reduktoren (Elektronendonatoren) stehen gewissermassen unter hohem, starke Oxidatoren<br />
(Elektronenakzeptoren) unter niedrigem Elektronendruck.<br />
2.5 Die Standardwasserstoffelektrode<br />
Da es nicht möglich ist, Einzelpotentiale zu bestimmen, sondern lediglich Spannungen d.h.<br />
Potentialdifferenzen zu messen, muss man für die Potentialskala einen willkürlichen Nullpunkt<br />
festlegen. Es wurde dafür das Potential einer Wasserstoffelektrode gewählt. Sie besteht<br />
aus einer Elektrode aus Platin, welche von Wasserstoff in einer Lösung mit einem pH-<br />
Wert von 0 umspült wird. Dieses Redoxpotential wird gleich null gesetzt.<br />
Aufgabe IX:<br />
Wieso hat die Lösung einen pH-Wert von 0?
11<br />
Aufgabe X:<br />
Es soll eine Wasserstoffelektrode mit einer Kupferelektrode kombiniert werden. Welches ist<br />
die Kathode, welches die Anode? Welche Reaktionen laufen an den Elektroden ab? Wie lautet<br />
die Redoxreaktion? Welche Spannung wird generiert?<br />
2.6 Die Nernst‘sche Gleichung<br />
Es soll noch einmal die oben stehende Versuchsanordnung mit der Wasserstoff- und der<br />
Kupferelektrode betrachtet werden.<br />
Mit einer solchen Versuchsanordnung ist es möglich, die maximale Arbeit W max , die eine<br />
chemische Reaktion zu leisten imstande und gleich ∆G r ist, als elektrische Arbeit zu gewinnen.<br />
Die Arbeit setzt sich zusammen aus der Stromstärke, der Zeit und der Spannung. Ist die<br />
Reaktion bei der Kombination der beiden Halbzellen zum Stillstand gekommen, ist eine gewisse<br />
Anzahl an Elektronen geflossen; diese sei n. Die Ladung Q eines Elektrons ist gleich der<br />
Elementarladung e und beträgt<br />
e = Q = -1.602176 · 10 -19 C = -1.602176 · 10 -19 As<br />
In der Regel werden nicht einzelne Elektronen verschoben bzw. gemessen, sondern eine<br />
sehr grosse Anzahl. Aus diesem Grund ist es sinnvoll, die Ladung pro Stoffmenge anzugeben.<br />
Aufgabe XI:<br />
Berechnen Sie die Ladung pro Stoffmenge in Mol.<br />
Diese Beziehung zwischen Ladung und Stoffmenge wurde erstmals vom englischen<br />
Physiker und Chemiker Michael Faraday (1791 – 1867) geprägt. Deswegen<br />
wird diese Konstante als Faraday-Konstante F 1 bezeichnet.<br />
Wie oben bereits erwähnt, setzt sich die Arbeit zusammen aus der Stromstärke,<br />
der Zeit und der Spannung. Die maximale Arbeit, die eine chemische Reaktion<br />
zu leisten imstande ist, entspricht<br />
∆G r = - n · F · ∆E<br />
Bild: www.cksinfo.com<br />
1<br />
Nicht zu verwechseln mit der Kraft F.
12<br />
bzw. ∆G r 0 = - n · F · ∆E 0<br />
Dabei entspricht ∆E dem Potential und ∆E 0 dem Standardpotential der Zelle.<br />
Eine andere in diesem Zusammenhang wichtige Beziehung gelang dem amerikanischen<br />
Physiker Josiah Willard Gibbs (1839 – 1903). Er schrieb zwischen<br />
1876 und 1878 den Zusammenhang zwischen der freien Enthalpie zu einem<br />
bestimmten Zeitpunkt der Reaktion ∆G r und der (Gibbsschen) freien Standardenthalpie<br />
∆G 0 r in Abhängigkeit der Gleichgewichtskonstanten K einer chemischen<br />
Reaktion.<br />
Bild: www.uned.es<br />
∆G r = ∆G r 0 + R · T · ln(K)<br />
R ist die molare Gaskonstante und entspricht 8.314472 J/(mol·K).<br />
Werden die freie Standardenthalpie und die freie Enthalpie in diese Gleichung<br />
eingesetzt und nach dem Potential aufgelöst, so erhält man die Nernst‘sche Gleichung,<br />
benannt nach dem deutschen Physiker und Chemiker Walther Nernst<br />
(1864 – 1941).<br />
Bild: de.wikipedia.org<br />
Aufgabe XII:<br />
Leiten Sie die Nernst‘sche Gleichung her.<br />
Die Standardpotentiale gelten nur bei 25 °C und einer Konzentration der Reaktanden von 1<br />
mol/L, wie dies bei der Redoxtabelle bereits erwähnt ist. Werden andere Konzentrationen<br />
verwendet oder bei einer anderen Temperatur gearbeitet, so kann mit Hilfe der<br />
Nernst‘schen Gleichung das Potential ausgerechnet werden.<br />
n entspricht der Anzahl an übertragenen Elektronen.<br />
2.7 Konzentrationsabhängigkeit des Redoxpotentials<br />
Wiederum soll die Zelle mit einer Wasserstoff- und einer Kupferelektrode betrachtet werden.<br />
Das Potential der Wasserstoffelektrode ist definitionsgemäss null, so dass die Spannung<br />
hier dem Redoxpotential der Kupferelektrode entspricht. Liegt die Konzentration der gelös-
13<br />
ten Kupfer-Ionen in einer Konzentration von einem Mol pro Liter vor, so ist das Potential<br />
gleich dem Standardpotential E 0 .<br />
Aufgabe XIII:<br />
Stellen Sie die Nernst‘sche Gleichung für die oben stehende Zelle auf. Formulieren Sie dabei<br />
die Gleichgewichtskonstante K aus.<br />
Es gilt deshalb allgemein für ein beliebiges Redoxpaar<br />
Red Ox + n e -<br />
bzw.<br />
M M n+ + n e -<br />
die Gleichung<br />
E = E 0 + R · T / (n · F) · ln([Ox]/[Red])<br />
Bei einer Metallelektrode ist die Konzentration des Metalls konstant. Dort vereinfacht sich<br />
die Gleichung auf<br />
E = E 0 + R · T / (n · F) · ln([M n+ ])<br />
Aufgabe XIV:<br />
Berechnen Sie das Redoxpotential für das Redoxpaar Al/Al 3+ bei 20 °C und einer Konzentration<br />
an gelösten Ionen von 0.1 M.<br />
Aufgabe XV:<br />
Berechnen Sie die Potentialdifferenz bzw. Spannung für die Konzentrationszelle Ag/Ag +<br />
(c = 0.25 M) // Ag/Ag + (c = 0.002 M) bei einer Temperatur von 25 °C.<br />
Aufgabe XVI:<br />
Übernehmen Sie das vorgezeigte Experiment<br />
Aus den unterschiedlichen Konzentrationen in den beiden Halbzellen resultiert eine Spannung.<br />
Eine Spannung kann also auch aus den unterschiedlichen Konzentrationen der gelösten<br />
Ionen erzeugt werden.
14<br />
Aufgabe XVII:<br />
Berechnen Sie die Spannung, die mit einem Daniell-Element bei 10 °C erzeugt werden kann,<br />
welches den folgenden Aufbau aufweist: Zn/Zn 2+ (c = 0.2 M) // Cu/Cu 2+ (c = 0.01 M).<br />
Aufgabe XVIII:<br />
In einer Zelle liegen bei 25 °C folgende Stoffe in entsprechender Konzentration vor: Fe 2+ (c =<br />
0.5 M)/Fe 3+ (c = 1 M) // H/H + (c = 10 -7 M). (Hinweis: In beiden Halbzellen kommen Platinelektroden<br />
zum Einsatz)<br />
a.)<br />
b.)<br />
c.)<br />
Welche Reaktion läuft ab?<br />
Welche Spannung kann damit generiert werden?<br />
Was ist zu beobachten, wenn konzentrierte Salzsäure-Lösung in die Wasserstoff-<br />
Halbzelle gegeben wird?
15<br />
3. Primärbatterien<br />
3.1 Das Leclanché-Element<br />
Bild: de.wikipedia.org<br />
Das Leclanché-Element wurde vom französischen Chemiker Georges Leclanché<br />
(1839 – 1882) entwickelt. In der ursprünglichen Form enthielt diese Batterie<br />
einen flüssigen Elektrolyten, welcher aber heutzutage nicht mehr verwendet<br />
wird. Diese Batterie<br />
war historisch eine der<br />
ersten Batterien. Der flüssige<br />
Elektrolyt wurde aber<br />
später durch eine feuchte Paste ausgetauscht<br />
und wird heutzutage umgangssprachlich<br />
als Zink-Kohle-Batterie bezeichnet.<br />
Der Name dieser Batterie zielt auf die<br />
beiden Elektroden ab, obwohl der Graphit-Stift<br />
nur als elektrischer Leiter fungiert. Wissenschaftlich korrekt wird diese Batterie<br />
Zink-Braunstein-Zelle genannt und zielt auf die beiden Redoxpaare, Zn/Zn 2+ // Mn 3+ /Mn 4+ ,<br />
ab.<br />
Bild:<br />
www.batteryfacts.co.uk<br />
Aufgabe XIX:<br />
Wie ist diese Zelle aufgebaut? Wieso muss die<br />
Zelle luftdicht abgeschlossen sein? Diskutieren<br />
Sie mit dem/der PultnachbarIn.<br />
Bild: www.diracdelta.co.uk<br />
Aufgabe XX:<br />
Wie lauten die Reduktion, die Oxidation und Redoxreaktion?
16<br />
Werden alle an der Reaktion beteiligten Stoffe betrachtet, entstehen die Stoffgleichungen:<br />
Aufgabe XXI:<br />
Stellen Sie die Stoffgleichungen für die Reaktionen an der Anode und an der Kathode auf und<br />
schliessen sie daraus auf die Redoxreaktion mit allen beteiligten Stoffkomponenten.<br />
An dieser Stelle erscheint es unumgänglich festzuhalten, dass die Anode nicht als Pluspol<br />
und die Kathode nicht als Minuspol definiert sind! Die korrekten Definitionen lauten wie<br />
folgt:<br />
Die Anode (griech. anodos: Weg nach oben) ist die Elektrode, die Elektronen aufnimmt,<br />
an welcher also die Oxidation stattfindet. Aus diesem Grund kann die Anode<br />
eine positive Ladung aufweisen, wie bei einem elektrischen Verbraucher, oder eine<br />
negative Ladung haben, wie bei einer Spannungsquelle.<br />
Die Kathode (griech. kathodos: Weg nach unten) ist die Elektrode, die Elektronen<br />
abgibt, an welcher also die Reduktion stattfindet. Aus diesem Grund kann die Kathode<br />
eine negative Ladung aufweisen, wie bei einem elektrischen Verbraucher, oder<br />
eine positive Ladung haben, wie bei einer Spannungsquelle.<br />
An den Elektroden entstehen so Zink(II)- und Hydroxid-<br />
Ionen. Dies wiederum sollte zu einem erheblichen Abfall<br />
der Zellspannung führen, da sich ein Gleichgewicht<br />
einstellt. Durch den Entzug der Produkte sollte die Reaktion<br />
wieder ablaufen. Dies geschieht durch die Reaktion<br />
der Zink(II)- und der Hydroxid-Ionen mit Ammoniumchlorid.<br />
An der Kathode entsteht dabei Ammoniak.<br />
Bild: www.chempage.de<br />
2 NH 4 + (aq) + 2 OH - (aq) 2 NH 3 (aq) + 2 H 2 O (l)<br />
Der entstehende Ammoniak diffundiert durch die feuchte Paste. An der Anode bildet sich<br />
Diamminzink(II)-chlorid.
17<br />
Zn 2+ (aq) + 2 NH 3 (aq) + 2 Cl - [Zn(NH 3 ) 2 ]Cl 2 (s)<br />
Leclanché-Zellen können nicht beliebig lange aufbewahrt werden. Bei einem geringen Wasserverlust<br />
können Salze auskristallisieren. Zudem nimmt die Spannung bei tieferen Temperaturen<br />
stark ab, da sich die Ionen weniger gut bewegen können.<br />
Leclanché-Zellen<br />
Minus-Pol (Anode, Oxidation): Zinkblech (Zn)<br />
Plus-Pol (Kathode, Reduktion): Mangan(IV)-oxid (Mangandioxid; MnO 2 )<br />
Elektrolyt:<br />
Feuchte Paste aus Ammoniumchlorid, Kleister<br />
oder Sägemehl und Russ<br />
Spannung:<br />
1.5 Volt<br />
Reaktionsgleichungen:<br />
Zn (s) + 2 MnO 2 (s) + 2 H 2 O (l)<br />
Zn 2+ (aq) + 2 MnOOH (s) + 2 OH - (aq)<br />
2 NH + 4 (aq) + 2 OH - (aq) 2 NH 3 (aq) + 2 H 2 O (l)<br />
Zn 2+ (aq) + 2 NH 3 (aq) + 2 Cl - (aq) [Zn(NH 3 ) 2 ]Cl 2 (s)<br />
3.2 Alkali-Mangan-Batterie<br />
Die Alkali-Mangan-Batterie ist eine Weiterentwicklung des Leclanché-Elements. Der treffendere<br />
Name würde auch Zink-Mangandioxid-Zelle lauten. Der prinzipielle Unterschied zum<br />
Leclanché-Element liegt im alkalischen Elektrolyten. Dieser bewirkt auch, dass an der Kathode<br />
Mangan(IV)-Ionen zu Mangan(II)-Ionen reduziert werden.<br />
Aufgabe XXII:<br />
Formulieren Sie die Oxidation, die Reduktion und die Redoxreaktion.<br />
Die an der Anode gebildeten Zink(II)-Ionen verbinden sich mit den Hydroxid-Ionen zu Zink(II)-<br />
hydroxid. An der Kathode reagiert Braunstein mit zwei Wasser-Molekülen zu Mangan(II)-<br />
hydroxid und zwei Hydroxid-Ionen.
18<br />
Aufgabe XXIII:<br />
Formulieren Sie die Reaktion an der Anode sowie die Reaktion an der Kathode und schliessen<br />
Sie daraus auf die Gesamtreaktion.<br />
Diese Redoxreaktion ist eine<br />
Gleichgewichtsreaktion. Wenn sich<br />
dieses Gleichgewicht einstellen<br />
würde, käme es zu einem Spannungsabfall<br />
und die Batterie würde<br />
nicht lange halten. Dies wird<br />
verhindert durch den Entzug eines<br />
Produkts. Das Zink(II)-hydroxid<br />
reagiert mit zwei Hydroxid-Ionen<br />
weiter zum Zink(II)-tetrahydroxokomplex.<br />
Bild: www.doitpoms.ac.uk<br />
Zn(OH) 2 (s) + 2 OH - (aq) [Zn(OH) 4 ] 2- (aq)<br />
Alkali-Mangan-Zelle (Alkaline-Batterie)<br />
Minus-Pol (Anode, Oxidation): ultrareines, eisenfreies Zinkpulver (Zn)<br />
Plus-Pol (Kathode, Reduktion): Mangan(IV)-oxid (Mangandioxid; MnO 2 )<br />
Elektrolyt:<br />
Spannung:<br />
Reaktionsgleichungen:<br />
Zn (s) + MnO 2 (s) + 2 H 2 O (l)<br />
Zn(OH) 2 (s) + 2 OH - (aq)<br />
Kalilauge [KOH (aq)]<br />
1.5 Volt<br />
Zn(OH) 2 (s) + Mn(OH) 2 (aq)<br />
[Zn(OH) 4 ] 2- (aq)
19<br />
3.3 Lithium-Batterien<br />
Lithium ist ein sehr starkes Reduktionsmittel. Aus diesem Grund<br />
lassen sich mit Lithium die höchsten Zellspannungen erzielen.<br />
Lithium bereitet aber Schwierigkeiten; da es eine sehr hohe<br />
Reaktionsfähigkeit besitzt, muss es vor Luftfeuchtigkeit, Sauerstoff<br />
und sogar Stickstoff geschützt werden. Ausserdem kann es<br />
mit einigen Elektrolyten reagieren.<br />
In Lithium-Batterien besteht eine Elektrode aus Lithium-Metall<br />
Bild: upload.wikimedia.org<br />
oder einer Lithium-Legierung. Als Gegenelektrode fungiert oftmals Mangan(IV)-oxid<br />
(Mn 4+ /Mn 2+ ) (Braunstein), da dieser sehr billig ist. Als Elektrolyten fungieren die stark ätzenden<br />
Flüssigkeiten Thionylchlorid (SOCl 2 ) oder Sulfurylchlorid (SO 2 Cl 2 ).<br />
Lithium-Zellen kommen vor allem in Kameras, Taschenrechnern u. ä. vor.<br />
Aufgabe XXIV:<br />
Formulieren Sie die Oxidation und die Reduktion und schliessen Sie daraus auf die Gesamtreaktion.<br />
Bild:<br />
www.charite.de<br />
Auch in Herzschrittmachern werden<br />
Lithium-Batterien aufgrund<br />
ihrer langen Lebenszeit von bis zu<br />
10 Jahren eingesetzt. Dort wird<br />
aber ein leitfähiger Kunststoff als<br />
Elektrolyt verwendet und die Gegenelektrode<br />
besteht aus einem<br />
Gemisch des Kunststoffs mit elementarem<br />
Iod.<br />
Bild: www.cardio-biel.ch<br />
Aufgabe XXV:<br />
Formulieren Sie die Reaktion an der Anode sowie die Reaktion an der Kathode und schliessen<br />
Sie daraus auf die Gesamtreaktion.<br />
Aufgabe XXVI:<br />
Füllen Sie den Kasten über Lithium-Batterien aus.
20<br />
Lithium-Batterien<br />
Minus-Pol (Anode, Oxidation): Lithium (Li)<br />
Plus-Pol (Kathode, Reduktion): Mangan(IV)-oxid (Mangandioxid; MnO 2 );<br />
Iod (Herzschrittmacher)<br />
Elektrolyt:<br />
Thionylchlorid (SOCl 2 ) oder Sulfurylchlorid<br />
(SO 2 Cl 2 );<br />
leitfähiger Kunststoff (Herzschrittmacher)<br />
Spannung:<br />
3 Volt<br />
Reaktionsgleichungen:
21<br />
4. Sekundärbatterien; Akkumulatoren<br />
Sekundärbatterien können im Gegensatz zu Primärbatterien, welche nur einmal gebraucht<br />
werden können, wieder aufgeladen werden. Die beim Gebrauch des Akkumulators (lat. accumulator:<br />
Aufhäufer) ablaufenden Vorgänge können durch Umkehrung der Stromrichtung<br />
also wieder rückgängig gemacht werden; dies entspricht dem Aufladen der Batterie. Es ist<br />
aus diesem Grund sehr wichtig, dass keine Durchmischung der Reaktanden stattfindet und<br />
sich die Elektroden bei den Lade- und Entladevorgängen nicht verändern.<br />
4.1 Der Blei-Akkumulator<br />
Die wichtigste Sekundärbatterie ist der Blei-Akku. Er wird vor allem in Fahrzeugen verwendet<br />
und liefert dort 12 Volt bzw. 24 Volt. Beim Starten des Motors muss der Blei-Akku für kurze<br />
Zeit eine sehr hohe Stromstärke von 400 bis 450 Ampere liefern. Aus diesem Grund sind die<br />
Oberflächen der Elektroden sehr gross.<br />
Aufgabe XXVII:<br />
Informieren Sie Sich auf www.chemgapedia.de ( Chemie Physikalische Chemie <br />
Elektrochemie) über den Blei-Akku und halten Sie die wichtigsten Erkenntnisse nachstehend<br />
fest, so dass Sie zum Schluss den Kasten über den Akku eigenständig ausfüllen können.<br />
Blei-Akkumulator<br />
Minus-Pol (Anode, Oxidation):<br />
Plus-Pol (Kathode, Reduktion):<br />
Elektrolyt:<br />
Spannung:<br />
Reaktionsgleichung:
22<br />
4.2 Der Nickel-Cadmium-Akkumulator<br />
Nickel-Cadmium-Akkumulatoren, kurz Ni-Cd-Akkus, haben den entscheidenden<br />
Vorteil, dass sie gasdicht gebaut werden können und<br />
gegenüber dem Blei-Akku ein geringeres Gewicht aufweisen.<br />
Er eignet sich als Starterbatterie in Luftfahrzeugen (Quelle:<br />
de.wikipedia.org), für Rechner, Radioapparate, Lampen usw.<br />
Bild:<br />
www.elektrofachmarktonline.de<br />
Bei diesem Akku bildet ein mit Nickel(III)-oxidhydroxid überzogenes<br />
Nickelblech die eine Elektrode und Cadmium die<br />
andere.<br />
Bild: www.handwerkerversand.de<br />
Aufgabe XXVIII:<br />
Stellen Sie für den Entladevorgang die Oxidation, die Reduktion und die Redoxreaktion auf.<br />
Aufgabe XXIX:<br />
Formulieren Sie die Reaktion an der Anode sowie die Reaktion an der Kathode und schliessen<br />
Sie daraus auf die Gesamtreaktion.<br />
Der Nickel-Cadmium-Akkumulator zeigt den so genannten Memory-Effekt. Wird der Akku<br />
nicht vollständig entladen, bevor er wieder aufgeladen wird, bilden sich Cadmiumkristalle<br />
auf der Cadmium-Elektrode. Die Kapazität wird durch diese Verkleinerung der Oberfläche<br />
verringert, woran sich der Akku beim nächsten Entladen erinnert.<br />
4.2.1 Toxizität<br />
Bilder: de.wikipedia.org<br />
Cadmium ist sehr giftig, leichtentzündlich und umweltgefährdend.<br />
Übermässige Aufnahme von Cadmium kann zu Nierenschäden, Schäden<br />
am Zentralnervensystem und am Immunsystem, Unfruchtbarkeit,<br />
psychischen Störungen, DNA-Schäden und sogar zu Krebs führen.<br />
Aus diesem Grund findet Cadmium allgemein immer wie weniger Verwendung im Alltag.<br />
Auch die Cadmium enthaltenden Akkumulatoren werden bei adäquatem Ersatz immer wie<br />
mehr verschwinden.
23<br />
Aufgabe XXX:<br />
Füllen Sie den Kasten über den Nickel-Cadmium-Akkumulator aus.<br />
Nickel-Cadmium-Akkumulator<br />
Minus-Pol (Anode, Oxidation):<br />
Plus-Pol (Kathode, Reduktion):<br />
Elektrolyt:<br />
Spannung:<br />
Reaktionsgleichung:<br />
4.3 Der Nickel-Metallhydrid-Akkumulator<br />
Eine Alternative zum Nickel-Cadmium-Akkumulator bietet der Nickel-<br />
Metallhydrid-Akkumulator, kurz Ni-MH-Akku, da er viel umweltverträglicher<br />
ist.<br />
Der Unterschied zum Ni-Cd-Akku liegt nur in einer Elektrode. Anstelle<br />
von Cadmium wird eine Legierung aus Nickel/Lanthan oder Titan/Zirkonium<br />
verwendet. Diese können bei Raumtemperatur reversi-<br />
Bild: ecx.images-amazon.com<br />
bel elementaren Wasserstoff in ihren Metallgittern speichern, kurz MH.<br />
Aufgabe XXXI:<br />
Stellen Sie für den Entladevorgang die Oxidation, die Reduktion und die Redoxreaktion auf.<br />
Aufgabe XXXII:<br />
Formulieren Sie die Reaktion an der Anode sowie die Reaktion an der Kathode und schliessen<br />
Sie daraus auf die Gesamtreaktion.<br />
Wie die anderen beiden Akkumulatoren entlädt sich der Ni-MH-Akku durch die Zersetzung<br />
von NiOOH zu Ni(OH) 2 allmählich von selbst.
24<br />
Aufgabe XXXIII:<br />
Füllen Sie den Kasten über den Nickel-Metallhydrid-Akkumulator aus.<br />
Nickel-Metallhydrid-Akkumulator<br />
Minus-Pol (Anode, Oxidation):<br />
Plus-Pol (Kathode, Reduktion):<br />
Elektrolyt:<br />
Spannung:<br />
Reaktionsgleichung:
25<br />
5. Brennstoffzellen<br />
Eine galvanische Zelle produziert elektrische Energie mit einem hohen Wirkungsgrad von 70<br />
bis 90 %. Der Wirkungsgrad von Wärmekraftmaschinen ist aus prinzipiellen Gründen auf<br />
etwa 40 % beschränkt. Aus diesem Grund wäre es sehr sinn- und wertvoll, wenn sich die zur<br />
Energiegewinnung in Wärmekraftmaschinen verwendeten chemischen Prozesse, wie das<br />
Verbrennen von Erdgas, Öl, Benzin oder Kohle oder auch die Knallgas-Reaktion, elektrochemisch<br />
durchführen liessen.<br />
Trotz jahrzehntelanger Forschung sind bis heute nur wenige praktisch verwendbare Zellen,<br />
so genannte Brennstoffzellen, entwickelt worden. Die Hauptschwierigkeiten beim Bau einer<br />
Brennstoffzelle liegen in den hohen Aktivierungsenergien, welche für die Verbrennung erforderlich<br />
sind.<br />
5.1 Energieumwandlung im Vergleich<br />
Wärmekraftmaschinen<br />
Brennstoff Wärmeenergie mechanische Energie elektrische Energie<br />
Brennstoffzellen<br />
Brennstoff<br />
elektrische Energie<br />
Aufgabe XXXIV:<br />
Aus welchem Grund ist der Energieausbeute bei Wärmekraftmaschinen prinzipiell schlechter<br />
als bei einer Brennstoffzelle?<br />
5.2 Die Knallgaszelle<br />
Die einfachste Brennstoffzelle ist die Wasserstoff-Sauerstoff-Zelle. Die beiden Elektroden<br />
bestehen aus Netzen aus Nickeldraht, welche oberflächlich mit katalytisch wirkendem Palladium<br />
überzogen sind. Die beiden Elektroden werden von Wasserstoff bzw. Sauerstoff umströmt.<br />
Dabei werden verschiedene Elektrolyten verwendet, oftmals eine Kaliumhydroxidoder<br />
eine Phosphorsäure-Lösung.<br />
Aufgabe XXXV:<br />
Füllen Sie den Kasten über die Knallgaszelle aus. Annahme: [H 3 O + ] = 10 -7 M.
26<br />
Die Knallgaszelle<br />
Minus-Pol (Anode, Oxidation):<br />
Plus-Pol (Kathode, Reduktion):<br />
Elektrolyt:<br />
Spannung:<br />
Reaktionsgleichung:<br />
Aufgabe XXXVI:<br />
Welches sind die an der Anode und an der Kathode ablaufenden Reaktionen bei einem sauren<br />
bzw. einem basischen Elektrolyten?<br />
Aufgabe XXXVII:<br />
Übernehmen Sie das vorgezeigte Experiment.<br />
Diese Zelle ist aber technisch so nicht einsetzbar, da weder der Sauerstoff noch der Wasserstoff<br />
ganz verbraucht werden und so unerwünschten Nebenreaktionen führen könnten. Aus<br />
diesem Grund sollte wenn möglich alle Edukte aufgebraucht werden. Dies kann durch eine<br />
Vergrösserung der Reaktionsoberfläche und durch den direkten Kontakt des Katalysators mit<br />
der Membran erreicht werden.<br />
Aufgabe XXXVIII:<br />
Übernehmen Sie das vorgezeigte Experiment.
27<br />
Aufgabe XXXIX:<br />
Welche Vor- bzw. Nachteile hat eine<br />
Brennstoffzelle im Vergleich mit<br />
konventionellen Verbrennungsvorgängen?<br />
5.3 Die Methanolzelle<br />
Anstelle des explosionsgefährlichen Wasserstoffs<br />
kann auch die weniger gefährlich<br />
Flüssigkeit Methanol als Brennstoff benützt<br />
werden. Man spricht dann von einer<br />
Methanol-Brennstoffzelle. Dabei kommt<br />
Bild: www.uni-marburg.de<br />
ein Gemisch aus Wasser und Methanol zum Einsatz.<br />
An der Anode reagieren dabei je ein Molekül Methanol und Wasser zusammen zu Kohlenstoffdioxid<br />
und Protonen. Letztere wandern wiederum durch die Membran und reagieren an<br />
der Kathode mit dem (Luft-)Sauerstoff.<br />
Aufgabe XL:<br />
Welches sind bei der Methanol-Brennstoffzelle die Reaktionen an den beiden Elektroden<br />
und die Gesamtreaktion?
28<br />
6. Korrosion<br />
Unter Korrosion (lat. corrodere: zernagen, zerfressen) versteht man die Zerstörung von<br />
Werkstoffen durch chemische Reaktionen; insbesondere Metalle sind davon betroffen.<br />
Aufgabe XLI:<br />
Diskutieren Sie mit dem Nachbarn/der Nachbarin. Halten Sie Sich die wichtigsten Punkte<br />
fest.<br />
- Was wissen Sie über die Korrosion?<br />
- Wo ist sie anzutreffen?<br />
- Welche Auswirkungen hat sie?<br />
- Wie schützt man die Werkstoffe vor Korrosion?<br />
Bei der Korrosion wird das Metall stets zu<br />
Metall-Ionen oxidiert, letztere können<br />
anschliessend in verschiedenster Weise zu<br />
einer Vielzahl von Korrosionsprodukten<br />
weiterreagieren.<br />
Bild: www.der-andreas.de<br />
6.1 Ursachen der Korrosion<br />
Die Ursachen von Korrosion können verschiedener<br />
Art sein:<br />
- Aggressive Gase wie Chlor, Chlorwasserstoff<br />
oder Sauerstoff können zu<br />
einer Korrosion führen.<br />
- Durch elektrochemische Reaktionen kann es auch zur Zerstörung von Metallen kommen.<br />
- In der Nähe von Hochspannungsleitungen oder Bahnanlagen kann es zu so genannten<br />
vagabundierenden Strömen in der Erde kommen. Diese können bewirken, dass ein Metall<br />
Elektronen abgeben kann und sich somit auflöst. Tankanlagen und Rohrleitungen,<br />
welche in die Erde verlegt werden, sind somit besonders gefährdet.
29<br />
Sehr oft finden Korrosionen durch die Bildung von so genannten Lokalelementen statt. Berühren<br />
sich zwei verschieden edle Metalle und taucht zudem die Berührungsstelle der beiden<br />
Metalle in eine Elektrolyt-Lösung, so bildet sich eine kurzgeschlossene galvanische Zelle,<br />
ein Lokalelement.<br />
(wässriger) Elektrolyt<br />
unedleres Metall<br />
edleres Metall<br />
Aufgabe XLII:<br />
Diskutieren Sie mit dem Nachbarn/der Nachbarin, was wo und warum dies passiert. Halten<br />
Sie die Erkenntnisse fest.<br />
Die Hydroxid-Ionen bilden zusammen mit den Metall-Ionen oftmals schwerlösliche Salze.<br />
Diese Salze schützen aber nicht vor weiterer Korrosion, da sie meist lockere Strukturen bilden.<br />
Stark salzhaltige Elektrolyten, wie Meerwasser oder das Salz auf den Strassen im Winter,<br />
fördern die Korrosion. Insbesondere Chlorid-Ionen tragen u. a. durch ihre katalytische Wirkung<br />
zur Korrosion bei.<br />
6.2 Spezialfall Eisen<br />
Das Rosten von Eisen ist wirtschaftlich von besonderer Bedeutung. Bei der Oxidation von<br />
Eisen, und somit der Bildung von Eisensalzen, verliert der Werkstoff Eisen an Flexibilität und<br />
an Stabilität. Die Oxidation kann bereits durch Verunreinigungen im Metall selber gefördert<br />
werden, da sich ein Lokalelement ausbildet.<br />
Die beim Rosten, der Oxidation von Eisen, ablaufenden chemischen Reaktionen verlaufen<br />
unterschiedlich, je nach pH-Wert des umgebenden Wassers. Im neutralen bis alkalischen<br />
Bereich erfolgt das Rosten durch den Luftsauerstoff; man spricht von einer Sauerstoffkorrosion.
30<br />
6.2.1 Rosten im neutralen bis alkalischen Bereich<br />
Aufgabe XLIII:<br />
Geben Sie die Reaktionsgleichungen für die Oxidation, die Reduktion und die Redoxreaktion<br />
für das Rosten im neutralen bis alkalischen Bereich an.<br />
Die Oxidation und die Reduktion sind örtlich getrennt. Durch Diffusion entsteht aber in der<br />
Folge ein Salz. Dieses wird wiederum durch den Luftsauerstoff angegriffen, das Metall oxidiert<br />
weiter. In einem dritten Schritt bildet sich das schwerlösliche Salz Eisen(III)-oxidhydroxid,<br />
indem ein Wasser-Molekül zu einem Molekül Kristallwasser umgelagert wird.<br />
Aufgabe XLIV:<br />
Stellen Sie die drei Reaktionsgleichungen auf.<br />
Aufgabe XLV:<br />
Wie lautet die Gesamtgleichung für das Rosten im neutralen bis alkalischen Bereich?<br />
6.2.2 Rosten im sauren Bereich<br />
Aufgabe XLVI:<br />
Geben Sie die Reaktionsgleichungen für die Oxidation, die Reduktion und die Redoxreaktion<br />
für das Rosten im sauren Bereich an.<br />
Der Ladungsausgleich wird durch ein Anion bewirkt, welches je nach Säure variiert.<br />
6.3 Korrosionsschutz<br />
Um eine Korrosion von Metallen zu verhindern, bedient man sich, je nach Möglichkeit, verschiedenster<br />
Verfahren.<br />
Aufgabe XLVII:<br />
Diskutieren Sie zu zweit, welche Schutzmassnahmen getroffen werden könnten, um eine<br />
Korrosion zu verhindern. Die Bilder können Ihnen dabei hilfreich sein.
31<br />
Bild: www.vdi.de<br />
Bild: www.bs-wiki.de<br />
Bild:<br />
www.offshoreanodes.com
32<br />
reduzierende Wirkung nimmt ab; oxidierende Wirkung nimmt zu<br />
7. Redoxtabelle<br />
Reduktor (Reduzierte Form) Oxidator (Oxidierte Form) E°[V]<br />
Li (s) Li + (aq) + e - -3.03<br />
K (s) K + (aq) + e - -2.92<br />
Ba (s) Ba 2+ (aq) + 2e - -2.92<br />
Sr (s) Sr 2+ (aq) + 2e - -2.89<br />
Ca (s) Ca 2+ (aq) + 2e - -2.76<br />
Na (s) Na + (aq) + e - -2.71<br />
Mg (s) Mg 2+ (aq) + 2e - -2.40<br />
Al (s) Al 3+ (aq) + 3e - -1.69<br />
Cd(s) + 2 OH - Cd(OH) 2 (s) + 2e - -0.81<br />
Zn (s) Zn 2+ (aq) + 2e - -0.76<br />
Fe (s) Fe 2+ (aq) + 2e - -0.44<br />
H 2 (g) + 2 OH - (aq) 2 H 2 O (l) + 2e - (bei pH 7) -0.42<br />
Pb (s) Pb 2+ (aq) + 2e - -0.13<br />
H 2 (g) + 2 H 2 O (l) 2 H 3 O + (aq) + 2e - (bei pH 0) 0.00<br />
Cu (s) Cu 2+ (aq) + 2e - +0.35<br />
4 OH - (aq) O 2 (aq) + 2 H 2 O (l) + 4e - +0.40<br />
Ni(OH) 2 (s) + OH - (aq) NiOOH (s) + H 2 O + e - +0.49<br />
2 I - (aq) I 2 (aq) + 2e - +0.58<br />
MnOOH (s) + 2 OH - (aq) MnO 2 (s) + 2 H 2 O (l) + 2e - +0.74<br />
Fe 2+ (aq) Fe 3+ (aq) + e - +0.75<br />
Ag (s) Ag + (aq) + e - +0.81<br />
6 H 2 O (l) O 2 (g) + 4 H 3 O + + 4e - (bei pH 7) +0.82<br />
Hg (s) Hg 2+ (aq) + 2e - +0.86<br />
Au (s) + 4 Cl - (aq) [AuCl 4 ] - (aq) + 3e - +1.00<br />
2 Br - (aq) Br 2 (aq) + 2e - +1.09<br />
reduzierende Wirkung nimmt zu; oxidierende Wirkung nimmt ab<br />
Mn 2+ (aq) + 6 H 2 O (l) MnO 2 (s) + 4 H 3 O + (aq) + 2e - +1.22<br />
2 Cr 3+ (aq) + 21 H 2 O (l) Cr 2 O 2- 7 (aq) + 14 H 3 O + (aq) + 6e - +1.36<br />
2 Cl - (aq) Cl 2 (aq) + 2e - +1.36<br />
Au (s) Au 3+ (aq) + 3e - +1.38<br />
12 H 2 O (l) + Mn 2+ (aq) MnO - 4 (aq) + 8 H 3 O + (aq) + 5e - +1.50<br />
6 H 2 O (l) + PbSO 4 (s) PbO 2 (s) +SO 2- 4 (aq) +4H 3 O + (aq) + 2e - +1.68<br />
2 F - (aq) F 2 (aq) + 2e - +2.85<br />
Die Standardpotentiale der Redoxpaare wurden gemessen bei 25 °C und 1013 mbar, wobei alle Reaktanden in der<br />
Konzentration 1 mol/L vorlagen.<br />
Quelle: Günter Baars, Hans-Rudolf Christen;<br />
Chemie; hep-Verlag