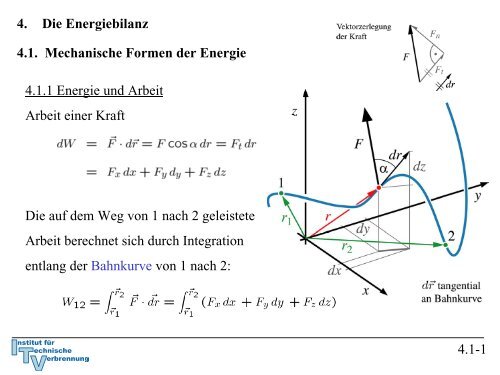
4.1.1 Energie und Arbeit Arbeit einer Kraft Die auf dem Weg von 1 ...
4.1.1 Energie und Arbeit Arbeit einer Kraft Die auf dem Weg von 1 ...
4.1.1 Energie und Arbeit Arbeit einer Kraft Die auf dem Weg von 1 ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
4. <strong>Die</strong> <strong>Energie</strong>bilanz<br />
4.1. Mechanische Formen der <strong>Energie</strong><br />
<strong>4.1.1</strong> <strong>Energie</strong> <strong>und</strong> <strong>Arbeit</strong><br />
<strong>Arbeit</strong> <strong>einer</strong> <strong>Kraft</strong><br />
<strong>Die</strong> <strong>auf</strong> <strong>dem</strong> <strong>Weg</strong> <strong>von</strong> 1 nach 2 geleistete<br />
<strong>Arbeit</strong> berechnet sich durch Integration<br />
entlang der Bahnkurve <strong>von</strong> 1 nach 2:<br />
4.1-1
Wenn das angegebene Koordinatensystem ein Inertialsystem ist, sind nach Newton<br />
Beschleunigung <strong>und</strong> <strong>Kraft</strong> verknüpft:<br />
Definition Geschwindigkeit:<br />
Definition Beschleunigung:<br />
Es gilt mit der Kettenregel:<br />
<strong>Arbeit</strong> der <strong>Kraft</strong>:<br />
<strong>Die</strong>s ist der <strong>Arbeit</strong>ssatz oder <strong>Energie</strong>satz der Mechanik.<br />
4.1-2
Definition kinetische <strong>Energie</strong>:<br />
Damit ist nach <strong>dem</strong> <strong>Arbeit</strong>ssatz der Mechanik die <strong>Arbeit</strong> der <strong>Kraft</strong> mit der Änderung<br />
der kinetischen <strong>Energie</strong> des Massenpunktes verknüpft:<br />
4.1-3
Beispiel: Bremsweg eines PKW bei konstanter Bremskraft<br />
(68iger Modell, Bremsen vorne kaputt)<br />
<strong>Die</strong> <strong>Arbeit</strong> der Bremskraft erwirkt eine Änderung der kinetischen <strong>Energie</strong><br />
Bremsweg<br />
Befreiung des Systems PKW<br />
4.1-4
Spezialfall:<br />
<strong>Arbeit</strong> der Gewichtskraft eines Massenpunktes bei<br />
Lageveränderung im Schwerefeld der Erde<br />
Falls z 2 > z 1 ist die vom System (Masse m)<br />
geleistete <strong>Arbeit</strong> negativ:<br />
<strong>Die</strong>s entspricht der auch in der Thermodynamik üblichen Vorzeichenkonvention, dass einem<br />
System zugeführte <strong>Arbeit</strong>en positiv, abgegebene <strong>Arbeit</strong>en dagegen negativ bewertet werden.<br />
4.1-5
Definition:<br />
Potentielle <strong>Energie</strong><br />
(<strong>Energie</strong> der Lage, die im System gespeichert)<br />
Wir erhalten damit:<br />
Falls z 2 > z 1 hat das System (Masse m) <strong>Arbeit</strong> gegen die Gewichtskraft geleistet, also<br />
<strong>Arbeit</strong> abgegeben. Nach <strong>dem</strong> <strong>Arbeit</strong>ssatz muss dies <strong>einer</strong> Abnahme der kinetischen<br />
<strong>Energie</strong> des Systems entsprechen:<br />
4.1-6
<strong>Die</strong> in einem einfachen mechanischen System insgesamt gespeicherten <strong>Energie</strong><br />
setzt sich nach den getroffenen Definitionen aus der potentiellen <strong>und</strong> der<br />
kinetischen <strong>Energie</strong> zusammen:<br />
Offensichtlich bleibt ohne die <strong>Arbeit</strong> weiterer äußerer Kräfte die gesamte<br />
mechanische <strong>Energie</strong> aus kinetischer <strong>und</strong> potentieller <strong>Energie</strong> konstant.<br />
<strong>Die</strong>s ist die Aussage des <strong>Energie</strong>erhaltungssatzes.<br />
4.1-7
Beispiel: Pendelversuch <strong>von</strong> Galilei<br />
Zustand 0:<br />
Zustand 1:<br />
Fadenkraft leistet keine <strong>Arbeit</strong> am System, da<br />
sie stets senkrecht <strong>auf</strong> der Bahnkurve steht<br />
⇒ <strong>Energie</strong>erhaltung:<br />
Zustand 2:<br />
Freischnitt des Systems<br />
in allgem<strong>einer</strong> Lage<br />
Eine Kenntnis der Zwischenzustände ist nicht nötig!<br />
4.1-8
Der <strong>Arbeit</strong>ssatz der Mechanik kann auch für ein thermodynamisches System<br />
angewandt werden.<br />
Wir müssen dazu jedoch voraussetzen, dass keine anderen inneren <strong>Energie</strong>n des<br />
Systems in kinetische <strong>und</strong> potentielle <strong>Energie</strong> umgesetzt werden.<br />
Am System sollen neben der Gewichtskraft<br />
andere äußere Kräfte angreifen.<br />
Der <strong>Arbeit</strong>ssatz liefert:<br />
4.1-9
Reibung<br />
Makroskopische Bewegungen sind immer mit Reibungsverlusten verb<strong>und</strong>en. <strong>Die</strong><br />
Reibungsarbeit wird in Wärme umgewandelt. <strong>Die</strong> Wärme steht dann nicht mehr<br />
unmittelbar als mechanische <strong>Energie</strong> zur Verfügung.<br />
Siehe Folie 4.1-9 mit der Reibkraft als äußerer <strong>Kraft</strong>:<br />
Da die Reibkraft der Bewegung immer entgegen gerichtet ist, ergibt das Integral<br />
einen negativen Wert<br />
oder<br />
4.1-10
Potentielle <strong>Energie</strong> <strong>und</strong> mechanisches Gleichgewicht<br />
Ein Körper ist im Gleichgewicht, wenn er seinen Bewegungszustand nicht mehr ändert.<br />
Alle an ihm angreifenden Kräfte <strong>und</strong> Momente müssen dann in der Summe<br />
verschwinden.<br />
Aus der Erfahrung:<br />
<strong>Die</strong> Kugel kann an der Position 1 nicht<br />
in Ruhe verharren, wohl aber in Position<br />
2 → stabiler Gleichgewichtszustand.<br />
Da die Bahnkurve auch gleichzeitig den<br />
Verl<strong>auf</strong> der potentiellen <strong>Energie</strong> darstellt,<br />
kann das Auftreten eines lokalen<br />
Minimums der potentiellen <strong>Energie</strong> als<br />
Bedingung für das stabile Gleichgewicht abgelesen werden.<br />
Darüberhinaus unterscheidet man noch labiles (3) <strong>und</strong> indifferentes<br />
Gleichgewicht (4). In je<strong>dem</strong> Fall verschwindet die Ableitung:<br />
4.1-11
Dem stabilen Gleichgewicht (1) kommt gegenüber den anderen Gleichgewichtslagen<br />
eine Sonderstellung zu:<br />
Wird das System in den Position 3 gestört, so gelangt es in instabile Zustände <strong>und</strong> die<br />
Störung wird verstärkt → labiles Gleichgewicht.<br />
Nach der Störung sich selbst überlassen, wird der Körper freiwillig in eine stabile<br />
Lage übergehen.<br />
In Position 4 wird die Störung, wenn <strong>von</strong> Reibung abgesehen wird, nicht gedämpft<br />
oder verstärkt → indifferentes Gleichgewicht.<br />
Es ist nun die wesentliche Aufgabe der Thermodynamik, Gleichgewichte <strong>und</strong><br />
Stabilitätsaussagen wie dE pot /dx = 0 abzuleiten, bei denen nicht nur mechanische<br />
<strong>Energie</strong>formen <strong>und</strong> einfache Körper sondern alle <strong>Energie</strong>formen <strong>und</strong> ganze Systeme<br />
betrachtet werden (vergl. Kapitel 8).<br />
4.1-12
Wir haben die <strong>Arbeit</strong> äußerer Kräfte<br />
bereits <strong>auf</strong> ein thermodynamisches System statt <strong>auf</strong> einen einfachen Massenpunkt<br />
angewandt.<br />
Wir konnten die <strong>Arbeit</strong> äußerer Kräfte für die Änderung <strong>von</strong> kinetischer <strong>und</strong><br />
potentieller <strong>Energie</strong> des Systems verantwortlich machen, die deshalb auch als<br />
äußere <strong>Energie</strong>n bezeichnet werden.<br />
Der Zusammenhang ist korrekt, solange die Kräfte nicht auch Änderungen des<br />
inneren Zustands des Systems bewirken oder sich der innere Zustand des Systems<br />
selbst ändert .<br />
<strong>Die</strong>s ist bei thermodynamischen Systemen jedoch typischerweise der Fall <strong>und</strong><br />
erfordert eine Verallgem<strong>einer</strong>ung des <strong>Energie</strong>satzes der Mechanik.<br />
4.1-13
Schon etwas komplexere mechanische Systeme können solche inneren<br />
Zustandsänderungen <strong>auf</strong>weisen.<br />
Ein Beispiel:<br />
Mechanisches System aus Rad, Wagenkasten<br />
<strong>und</strong> vorgespannter Feder.<br />
Start (Zustand 1) aus der Ruhe <strong>auf</strong><br />
horizontalem Untergr<strong>und</strong>.<br />
<strong>Arbeit</strong>ssatz:<br />
4.1-14
Festlegung des Systems <strong>und</strong> Freischnitt<br />
<strong>Arbeit</strong>en äußerer Kräfte beim<br />
verlustlosen Rollen der Räder:<br />
<strong>Energie</strong>n zu den verschiedenen Zeitpunkten:<br />
Kinetische <strong>Energie</strong> zum Zeitpunkt 2 durch<br />
Entspannen der Feder:<br />
Bem.: <strong>Die</strong>se kinetische <strong>Energie</strong> setzt sich zusammen aus der Rotationsenergie der Räder <strong>und</strong> der Translationsenergie<br />
<strong>von</strong> Rädern <strong>und</strong> Wagenkasten.<br />
4.1-15
Wir werden im Abschnitt 4.2 sehen, dass äußere Kräfte auch den inneren Zustand eines<br />
Systems verändern können, nämlich schon dann, wenn die Abmessungen des Systems<br />
durch diese Kräfte verändert werden.<br />
Das wird im Abschnitt 4.2 mit der Volumenänderungsarbeit (vergl. 4.2-9) eingeführt.<br />
Umgekehrt kann die Änderung des inneren Zustands des Systems auch <strong>auf</strong> die<br />
Änderung äußerer <strong>Energie</strong>n des Systems Einfluss nehmen. <strong>Die</strong>s geschieht zum Beispiel<br />
bei Fahrzeugen. Hier wird durch Verbrennung <strong>von</strong> <strong>Kraft</strong>stoff oder Umwandlung<br />
gespeicherter elektrischer <strong>Energie</strong> ein Teil der im System gespeicherten <strong>Energie</strong> in<br />
Bewegungsenergie <strong>und</strong> <strong>Energie</strong> der Lage umgewandelt.<br />
<strong>Die</strong> Einbeziehung aller möglicher <strong>Energie</strong>formen <strong>und</strong> -wandlungen in den<br />
<strong>Energie</strong>erhaltungssatz wird durch den 1. Hauptsatz der Thermodynamik geleistet.<br />
4.1-16
4.2 Erster Hauptsatz der Thermodynamik<br />
„<strong>Die</strong> Gesamtenergie E eines Systems ändert sich durch Zu- <strong>und</strong> Abfuhr <strong>von</strong><br />
<strong>Energie</strong> über die Systemgrenzen.“<br />
Im Folgenden: Spezifizierung der verschiedenen <strong>Energie</strong>ströme.<br />
Dabei werden wir uns <strong>auf</strong> die wichtigsten <strong>Energie</strong>formen beschränken. * )<br />
*)<br />
Vorzeichenregelung: zugeführte <strong>Energie</strong>n werden positiv bewertet<br />
4.2-1
4.2.1 Gesamtenergie oder <strong>Energie</strong>inhalt eines Systems<br />
<strong>Die</strong> Gesamtenergie E eines thermodynamischen Systems setzt sich zusammen aus den<br />
äußeren <strong>Energie</strong>n E a bestehend aus<br />
kinetischer <strong>Energie</strong> des Systems E kin<br />
<strong>und</strong> potentieller <strong>Energie</strong> des Systems E pot<br />
<strong>und</strong> der im System gespeicherten <strong>Energie</strong> U, der inneren <strong>Energie</strong><br />
Es lassen sich wieder molare <strong>und</strong> spezifische Größen formulieren:<br />
Gesamtenergie:<br />
Innere <strong>Energie</strong>:<br />
4.2-2
<strong>Die</strong> innere <strong>Energie</strong> U<br />
Wie der Druck, das Volumen <strong>und</strong> die Temperatur ist auch die innere <strong>Energie</strong><br />
eine Zustandsgröße. Es besteht deshalb z. B. der funktionale Zusammenhang<br />
Eine solche Beziehung heißt kalorische Zustandsgleichung. <strong>Die</strong> innere <strong>Energie</strong><br />
ist eine Zustandsgröße.<br />
Über die thermische Zustandsgleichung<br />
sind Volumen, Druck <strong>und</strong><br />
Temperatur <strong>von</strong>einander abhängig, so dass die innere <strong>Energie</strong> auch wahlweise<br />
als Funktion der anderen Zustandsgrößen geschrieben werden kann.<br />
4.2-3
Da die innere <strong>Energie</strong> eine Zustandsfunktion ist, besitzt sie ein vollständiges<br />
Differential.<br />
Falls die innere <strong>Energie</strong> als Funktion der<br />
Temperatur <strong>und</strong> des spezifischen<br />
Volumens gegeben ist<br />
lautet das vollständige Differential:<br />
oder:<br />
4.2-4
Spezialfall: <strong>Die</strong> kalorische Zustandsgleichung des idealen Gases<br />
Beim idealen Gas beschreibt die innere <strong>Energie</strong> die thermische <strong>Energie</strong><br />
des Systems <strong>auf</strong> Gr<strong>und</strong> der Bewegung <strong>von</strong> Molekülen (Billardkugelmodell).<br />
Innere <strong>Energie</strong><br />
Molare innere <strong>Energie</strong> .<br />
Für ein einatomiges, ideales Gas hatten wir<br />
gef<strong>und</strong>en:<br />
Es folgt für die molare innere <strong>Energie</strong><br />
<strong>und</strong> für die spezifische innere <strong>Energie</strong>:<br />
Für ein ideales Gas ist daher die innere <strong>Energie</strong> nur eine Funktion der Temperatur.<br />
4.2-5
<strong>Die</strong> äußeren <strong>Energie</strong>n E a<br />
<strong>Die</strong> kinetischen <strong>und</strong> potentiellen <strong>Energie</strong>n beziehen sich <strong>auf</strong> die Bewegung des<br />
Systems als Ganzes relativ zu einem festen Bezugssystem (vergl. 4.1-5).<br />
Sie spielen bei geschlossenen Systemen, da diese meist ortsfest sind, oft keine Rolle.<br />
Zu<strong>dem</strong> können vielfach alleine die <strong>Arbeit</strong>en äußerer Kräfte, für deren Änderung<br />
verantwortlich gemacht werden.<br />
<strong>Die</strong> Bilanz<br />
kann deshalb oft <strong>von</strong> der <strong>Energie</strong>bilanz für das System abgespalten werden (vergl. die<br />
Bemerkung <strong>auf</strong> Folien 4.1-11 <strong>und</strong> 4.1-12).<br />
<strong>Die</strong>se Möglichkeit besteht jedoch nicht immer, so dass eine genaue Betrachtung im<br />
Einzelfall notwendig ist.<br />
4.2-6
4.2.2 Verschiedene <strong>Arbeit</strong>sformen<br />
Exemplarisch ohne Anspruch <strong>auf</strong> Vollständigkeit seien <strong>auf</strong>gezählt:<br />
- <strong>Arbeit</strong> äußerer Kräfte bei festen Systemgrenzen<br />
Wir können uns hier <strong>auf</strong> die Vorüberlegungen zu den mechanische <strong>Energie</strong>formen<br />
beziehen (vergl. 4.1-5).<br />
Alle Kräfte, die <strong>von</strong> außen <strong>auf</strong> das System einwirken, wollen wir<br />
als äußere Kräfte bezeichnen.<br />
Durch diese Kräfte ändern sich kinetische <strong>und</strong> potentielle<br />
<strong>Energie</strong>n des Systems als Ganzes.<br />
<strong>Die</strong> <strong>Arbeit</strong> der Gewichtskraft ist für die Änderung der potentiellen <strong>Energie</strong> maßgeblich:<br />
4.2-7
- elektrische <strong>Arbeit</strong><br />
Zum Beispiel durch Zufuhr elektrischer <strong>Energie</strong> an Motor M aus der Umgebung<br />
W el > 0 oder Abgabe an ein Leitungsnetz außerhalb des Systems erzeugt durch<br />
einen Generator G innerhalb des Systems W el < 0.<br />
4.2-8
- Wellenarbeit<br />
Übertragen durch eine über die Systemgrenze ragende Welle<br />
Eine Welle, angetrieben <strong>von</strong> einem außerhalb des Systems stehenden Motor M, wird<br />
<strong>Arbeit</strong> ins System einspeisen W > 0.<br />
Eine Welle, die einen Generator G außerhalb des Systems antreibt, entzieht <strong>dem</strong><br />
System <strong>Arbeit</strong> W < 0.<br />
Durch die Welle eines Rührwerks wird <strong>von</strong> außen <strong>Arbeit</strong> in das System Welle<br />
übertragen W > 0.<br />
Bei den bisherigen Beispielen sind feste Systemgrenzen angenommen worden.<br />
Im Folgenden: Geschlossene Systemen mit bewegten Systemgrenzen<br />
4.2-9
Volumenänderungsarbeit (Verschiebearbeit) <strong>und</strong> Nutzarbeit<br />
Betrachtet wird exemplarisch ein System aus<br />
Zylinder <strong>und</strong> Kolben. <strong>Die</strong> <strong>Kraft</strong> an der Kolbenstange<br />
leistet die <strong>Arbeit</strong><br />
Bei quasistatischer, reversibler Zustandsänderung<br />
durchläuft das System eine Reihe <strong>von</strong> Gleichgewichtszuständen.<br />
<strong>Die</strong> träge Masse des Kolbens spielt dann keine Rolle.<br />
Eine Kräftebilanz am Kolben liefert deshalb<br />
für die <strong>Kraft</strong>:<br />
4.2-10
Nutzarbeit <strong>und</strong> Volumenänderungsarbeit<br />
<strong>Die</strong> an die Kolbenstange abgeführte <strong>Arbeit</strong>, die<br />
Nutzarbeit, bei quasistatischer, reversibler<br />
Zustandsänderung ist daher:<br />
Der erste Term ist die Volumenänderungsarbeit des im<br />
Zylinder eingeschlossenen Gases:<br />
oder da m=const:<br />
<strong>Die</strong> Volumenänderungsarbeit des eingeschlossenen Gases wird bei Volumenvergrößerung<br />
<strong>von</strong> diesem an die Umgebung abgegeben:<br />
4.2-11
Verschiebearbeit<br />
Der zweite Term ist die <strong>von</strong> der Umgebung<br />
<strong>auf</strong>genommene Verschiebearbeit<br />
Sie entspricht der Volumenänderungsarbeit der<br />
Umgebung, wenn, wie in der Skizze angedeutet, die<br />
Umgebung als Bilanzsystems herangezogen wird.<br />
<strong>Die</strong> Verschiebearbeit ist also die Volumenänderungsarbeit gegen einen konstanten<br />
Druck. Der Begriff tritt bei vom Fluid durchströmten Systemen, also offenen Systemen,<br />
nochmals in Erscheinung (vgl. 4.2-14).<br />
<strong>Die</strong> Nutzarbeit ist nur ein Teil der vom System abgegebenen <strong>Arbeit</strong>.<br />
Ein Anteil der vom Gas abgegebenenVolumenänderungsarbeit wird als<br />
Verschiebearbeit an die Umgebung übergeben <strong>und</strong> kann nicht genutzt werden.<br />
4.2-12
Volumenänderungsarbeit als reversible <strong>Arbeit</strong><br />
<strong>Die</strong> gegebene Definition zur Volumenänderungsarbeit zeigt, dass sich die<br />
Volumenänderungsarbeit durch Umkehrung der Kolbenbewegung vollständig<br />
zurückgewinnen lässt.<br />
Solche Vorgänge werden als verlustlos oder reversibel bezeichnet.<br />
<strong>Die</strong> Volumenänderungsarbeit ist also eine reversible <strong>Arbeit</strong>.<br />
<strong>Die</strong> Umkehrbarkeit des Kompressionsprozesses für das System „Gas“ setzt voraus,<br />
dass keine Verwirbelung durch innere Reibung im Gas <strong>auf</strong>tritt.<br />
<strong>Die</strong> Kolbenbewegung muss dazu sehr langsam, eigentlich unendlich langsam<br />
erfolgen. Es besteht zu je<strong>dem</strong> Zeitpunkt mechanisches Gleichgewicht.<br />
Bemerkung: Der Verluste durch Reibung zwischen Kolben <strong>und</strong> Wand spielt für das System „Gas“<br />
keine Rolle. Der Kolben gehört ja gar nicht zum System! Erst bei der Betrachtung der Nutzarbeit am<br />
System „Kolben“ macht diese Reibung ihren Einfluss geltend <strong>und</strong> verringert die erzielbare Nutzarbeit.<br />
Der Terminus „reibungsfreier Kolben“ meint oft lax die Vernachlässigung aller Verluste.<br />
4.2-13
Volumenänderungsarbeit pro Zeiteinheit beim Ein- <strong>und</strong> Ausschieben <strong>einer</strong> Masse<br />
Geschlossenes System mit mitbewegten Grenzen wird zu zwei Zeitpunkten 1 <strong>und</strong> 2<br />
im Abstand dt (gedachte Kolben am Ein <strong>und</strong> Austritt) betrachtet.<br />
Volumenänderungsarbeit während des Zeitintervalls dt im Eintritt,<br />
<strong>Kraft</strong> F 1 = p 1 A , <strong>Weg</strong>änderung dx = c dt :<br />
Volumenänderungsarbeit pro Zeiteinheit im Eintritt:<br />
4.2-14
<strong>Die</strong> im geschlossenen System enthaltene Masse bleibt konstant.<br />
Deshalb sind die Massenströme am Ein- <strong>und</strong> Austritt gleich <strong>und</strong> die<br />
Massenstromdichten ρ c gekoppelt:<br />
Volumenänderungsarbeit oder Verschiebearbeiten pro Zeiteinheit im Eintritt:<br />
<strong>und</strong> am Austritt:<br />
Summe der Verschiebearbeiten pro Zeiteinheit zwischen Ein- <strong>und</strong> Austritt:<br />
4.2-15
Übergang vom geschlossenen System zum offenen Kontrollraum<br />
<strong>Die</strong> am geschlossenen System abgeleiteten Verschiebearbeiten pro Zeiteinheit<br />
können als <strong>Arbeit</strong>sströme gedeutet werden, die zu je<strong>dem</strong> Zeitpunkt einem System<br />
mit durchströmter Bilanzhülle (Kontrollraum), <strong>dem</strong> offenen System , zu- bzw.<br />
abgeführt werden.<br />
<strong>Die</strong>se <strong>Arbeit</strong>sströme sind an die Massenströme, welche die Kontrollgrenzen<br />
überschreiten, gekoppelt.<br />
<strong>Die</strong> spezifischeVerschiebearbeit ist durch gegeben.<br />
4.2-16
Ergebnis:<br />
<strong>Die</strong> ein- <strong>und</strong> austretenden Massenströme<br />
führen mit:<br />
- Kinetische <strong>und</strong> potentielle <strong>Energie</strong>n,<br />
- Innere <strong>Energie</strong>n,<br />
- Verschiebearbeiten<br />
<strong>Die</strong> eintretenden <strong>Energie</strong>ströme liefern an das System<br />
die <strong>Energie</strong><br />
die austretenden Ströme entfernen den <strong>Energie</strong>strom<br />
4.2-17
<strong>Die</strong> Enthalpie H<br />
Wir definieren die Summe aus innerer <strong>Energie</strong> U <strong>und</strong> Verschiebearbeit pV als neue<br />
Größe:<br />
<strong>Die</strong> molaren <strong>und</strong> spezifischen Größen lauten:<br />
Wie die innere <strong>Energie</strong> ist auch die Enthalpie eine Zustandsgröße:<br />
Sie besitzt deshalb wie diese ein vollständiges Differential (vergl. 4.2-4):<br />
4.2-18
Spezialfall: ideales Gas (vergl. 4.2-5)<br />
Aus<br />
folgt mit der thermischen Zustandsgleichung des idealen Gases<br />
<strong>und</strong> der inneren <strong>Energie</strong><br />
sofort, dass auch die Enthalpie beim idealen Gas nur eine Funktion der Temperatur<br />
ist:<br />
Entsprechend gilt für die spezifischen Größen:<br />
4.2-19
Totalenthalpie<br />
Als Summe aus Enthalpie <strong>und</strong> kinetischer <strong>und</strong> potentieller <strong>Energie</strong> wird auch<br />
die Totalenthalpie eingeführt:<br />
Für die molaren <strong>und</strong> spezifischen Größen gilt:<br />
Entsprechend wird die <strong>Energie</strong>bilanz am<br />
Kontrollvolumen noch kompakter<br />
darstellbar:<br />
4.2-20
4.2.3 Wärmeströme<br />
Physikalische Deutung des Wärmestroms über Wände ins Bilanzsystem<br />
Wärmestrom<br />
J/s , 1 J = 1 Nm<br />
Wärmeleitung (Fouriersches Gesetz) ,<br />
z. B. in der ebenen Wand<br />
Wärmeleitfähigkeit: λ [λ] = J/(msK)<br />
4.2-21
Wärmestrom bei Konvektion<br />
Wärmeübertragung<br />
Wärmeübergangskoeffizient α [α] = J/(m 2 sK)<br />
Temperaturprofil T(r) wird durch die mittlere Temperatur T m ersetzt,<br />
α wird empirisch für verschiedene Strömungen bestimmt.<br />
4.2-22
Wärmetransport <strong>und</strong> Irreversibilität<br />
<strong>Die</strong> vorgenannten Prozesse der Wärmeübertragung haben, wie die Erfahrung lehrt,<br />
eine eindeutige, vorgegebene Richtung.<br />
Wärme fließt stets vom heißeren zum kälteren Körper. Zwischen <strong>dem</strong> thermodynamischen<br />
System <strong>und</strong> der Umgebung wird es zu einem Temperaturausgleich kommen.<br />
<strong>Die</strong> dargestellten Prozesse der Wärmeleitung <strong>und</strong> Konvektion sind also nicht<br />
umkehrbar oder irreversibel.<br />
4.2-23
Reversibler Wärmetransport<br />
<strong>Die</strong>ser Begriff erscheint nach der vorstehenden Bemerkung sinnlos. Wir werden aber<br />
sehen, dass er für theoretische Konzepte eine wichtige Rolle spielt.<br />
Reversibler Wärmetransport erfordert eine verschwindende Temperaturdifferenz ΔT<br />
zwischen System <strong>und</strong> Umgebung. Der Wärmestrom tendiert mit ΔT → 0 selbst gegen<br />
Null. Damit geht aber ein unendlich langsamer Temperaturausgleich einher.<br />
Sind praktisch keine Temperaturunterschiede vorhanden, ist der Wärmefluss im<br />
Prinzip umkehrbar.<br />
System <strong>und</strong> Umgebung sind bei der reversiblen Wärmezufuhr zu je<strong>dem</strong> Zeitpunkt im<br />
thermischen Gleichgewicht.<br />
(Vergl. auch die Bemerkung zur reversiblen <strong>Arbeit</strong> Folie 4.2-11)<br />
Wir werden bei der späteren Quantifizierung <strong>von</strong> Irreversibilitäten dar<strong>auf</strong> geführt, dass<br />
das Maß für die Irreversibilitäten proportional zu ΔT 2 ist <strong>und</strong> damit <strong>von</strong> höherer<br />
Ordnung gegen Null tendiert als der Wärmestrom (Abschnitt 5).<br />
4.2-24
Erster Hauptsatz der Thermodynamik<br />
Damit können wir die <strong>Energie</strong>bilanz endgültig formulieren:<br />
„<strong>Die</strong> Gesamtenergie eines Systems ändert sich durch die mit den<br />
Massenströmen über die Systemgrenzen transportierte Totalenthalpien <strong>und</strong><br />
durch <strong>Arbeit</strong>s- <strong>und</strong> Wärmeströme über die Systemgrenzen.“<br />
4.2-25
4.3 Verschiedene Formen des 1. Hauptsatzes<br />
4.3.1 Geschlossenes System ohne Änderung äußerer <strong>Energie</strong>n<br />
Keine Massenflüsse über Systemgrenze, m = const,<br />
Keine Änderung <strong>von</strong> kinetischen <strong>und</strong> potentiellen <strong>Energie</strong>n des Systems<br />
⇒ <strong>Die</strong> Änderung der inneren <strong>Energie</strong> wird betrachtet: e = u.<br />
Abstraktion <strong>und</strong> Freischnitt:<br />
4.3-1
Erster Hauptsatz:<br />
mit<br />
Volumenänderungsarbeit: (reversibel)<br />
Reibungsarbeit: (irreversibel)<br />
4.3-2
Der während eines Zeitintervalls 1-2 zugeführte spezifische Wärmestrom wird als<br />
bezeichnet<br />
(analog für die Volumenänderungsarbeit <strong>und</strong> die Reibungsarbeit)<br />
Da die innere <strong>Energie</strong> eine Zustandsfunktion ist, braucht nur die Änderung der inneren<br />
<strong>Energie</strong> zwischen den Zeitpunkten<br />
betrachtet zu werden.<br />
1. Hauptsatz für geschlossene Systeme in differentieller <strong>und</strong> integraler Form<br />
<strong>Die</strong> Änderung der inneren <strong>Energie</strong> eines geschlossenen Systems ist gleich der<br />
Summe aus Wärme, die über die Systemgrenze zugeführt wird, der<br />
Volumenänderungsarbeit des Systems <strong>und</strong> aller irreversibel zugeführten <strong>Arbeit</strong>en.<br />
4.3-3
Im Allgemeinen können sich auch die äußeren <strong>Energie</strong>n des Systems ändern<br />
<strong>und</strong> äußere Kräfte<br />
<strong>Arbeit</strong> leisten.<br />
Sind diese <strong>Energie</strong>formen zu berücksichtigen lautet der 1. Hauptsatz in differentieller<br />
Form<br />
<strong>und</strong> in integraler Form<br />
4.3-4
Spezialfall:<br />
1. Hauptsatz für geschlossene Systeme bei reversibler Prozessführung<br />
keine mechanischen Verluste <strong>und</strong> Wärmezufuhr reversibel<br />
(vergl. die Bemerkungen <strong>auf</strong> Seite 4.2-13 <strong>und</strong> 4.2-22)<br />
4.3-5
Beispiel: Kolben-Zylindersystem im Schwerefeld der Erde<br />
Ein Kolben mit Masse m K<br />
schließt einen mit Gas,<br />
Masse m G<br />
, gefüllten Zylinder nach oben ab.<br />
Der Kolben werde ein kleines Stück dz langsam nach oben<br />
bewegt, so dass das Gas im Inneren stets im Gleichgewicht<br />
sei. Der Kolben gleite ferner reibungsfrei.<br />
Formulieren Sie die differenzielle <strong>Energie</strong>bilanz für diesen<br />
Prozess!<br />
Der 1. Hauptsatz für ein geschlossenes System mit Änderung<br />
äußerer <strong>Energie</strong>n lautet:<br />
4.3-6
Nebenstehend sind zwei mögliche Systemabgrenzungen<br />
skizziert.<br />
Für beide Systeme sollen die Bilanzen formuliert werden.<br />
Da beide Systeme bei <strong>dem</strong> als langsam angenommenen<br />
Vorgang stets im Gleichgewicht stehen <strong>und</strong> auch der<br />
Kolben reibungsfrei gleitet, kann die Reibarbeit δw R in<br />
beiden Fällen vernachlässigt werden.<br />
<strong>Die</strong> Systeme besitzt ebenfalls keine kinetische <strong>Energie</strong>.<br />
4.3-7
<strong>Die</strong> Bilanz lautet unter diesen Voraussetzungen für beide Systeme:<br />
System 1:<br />
Bei Verschiebung der oberen Grenze gewinnt das Gas die<br />
potentielle <strong>Energie</strong>:<br />
<strong>Die</strong> Volumenänderungsarbeit ist:<br />
<strong>Die</strong> <strong>Arbeit</strong> der äußeren Kräfte verschwindet, da die Differenz der<br />
Druckkräfte der Gewichtskraft des Gases das Gleichgewicht hält<br />
(Hydrostatik).<br />
<strong>Die</strong> resultierende äußere <strong>Kraft</strong> also verschwindet:<br />
<strong>Die</strong> Bilanz für System 1 lautet also:<br />
4.3-8
System 2:<br />
Bei Verschiebung der oberen Grenze gewinnen das Gas <strong>und</strong> der<br />
Kolben die potentielle <strong>Energie</strong>:<br />
<strong>Die</strong> Volumenänderungsarbeit ist Verschiebearbeit gegen die<br />
Umgebung:<br />
<strong>Die</strong> resultierende äußere <strong>Kraft</strong><br />
leistet die <strong>Arbeit</strong>:<br />
<strong>Die</strong> Bilanz für System 2 lautet also:<br />
<strong>Weg</strong>en der hydrostatischen Aussage<br />
folgt wieder wie für System 1:<br />
4.3-9
4.3.2 Stationärer Fließprozess in offenen Systemen<br />
Annahmen:<br />
1. Stationär → Masse im System konstant:<br />
2. <strong>Arbeit</strong> ist die <strong>dem</strong> System durch Wellen übertragene <strong>Arbeit</strong>:<br />
4.3-10
Bilanz am stationären offenen System:<br />
Zugeführter Wärmestrom:<br />
Zugeführte Leistung:<br />
4.3-11
Mit der Enthalpie<br />
folgt der 1. Hauptsatz für stationären Fließprozess<br />
<strong>Die</strong> Summe aus zugeführter Wärme <strong>und</strong> zugeführter technischer <strong>Arbeit</strong> ist<br />
gleich der Änderung der Enthalpie, der kinetischen <strong>und</strong> der potentiellen<br />
<strong>Energie</strong> des Mediums, das in einem stationären Fließprozess durch einen<br />
Kontrollraum strömt.<br />
4.3-12
Vergleich mit 1. Hauptsatz für geschlossene Systeme<br />
<strong>Die</strong> Bilanz am offenen System lautet:<br />
Für das mitschwimmende Massenelement (grün), das<br />
bei 1 ein- <strong>und</strong> bei 2 austritt, liefert der 1. Hauptsatz für<br />
das geschlossene System<br />
mit<br />
<strong>Die</strong> Differenz der beiden Formulierungen ergibt für die<br />
technische <strong>Arbeit</strong>:<br />
4.3-13
<strong>Die</strong> Differenz ergibt für die technische <strong>Arbeit</strong>:<br />
Mit der Produktregel der Differentiation lassen sich die ersten beiden Terme <strong>auf</strong><br />
der rechten Seite zusammenfassen.<br />
4.3-14
<strong>Die</strong> technische <strong>Arbeit</strong><br />
besitzt <strong>dem</strong>nach zwei Anteile<br />
reversibler Anteil<br />
irreversibler Anteil<br />
Bem.: Der reversible Anteil beinhaltet die kinetischen <strong>und</strong> potentiellen <strong>Energie</strong>n der Massenströme.<br />
<strong>Die</strong> gespeicherte potentielle <strong>Energie</strong> in einem hochgelegen Reservoir wird zum Beispiel als<br />
technische <strong>Arbeit</strong> bei Wasserkraftanlagen in <strong>einer</strong> Turbine umgesetzt.<br />
4.3-15
Spezialfall:<br />
1. Hauptsatz für stationären Fließprozess bei reversibler Prozessführung<br />
keine mechanischen Verluste <strong>und</strong> Wärmezufuhr reversibel<br />
(vergl. die Bemerkungen <strong>auf</strong> Seite 4.2-13)<br />
4.3-16
Spezialfall:<br />
Adiabater Strömungsprozess (q 12 = 0)<br />
ohne technische <strong>Arbeit</strong> (w t 12 = 0),<br />
Bei einem solchen Prozess bleibt die Totalenthalpie konstant.<br />
Das heißt, die Summe der austretenden Totalenthalpieströme ist gleich der Summe<br />
der eintretenden Totalenthalpieströme.<br />
4.3-17
4.4 <strong>Die</strong> spezifischen Wärmekapazitäten<br />
4.4.1 Änderung der inneren <strong>Energie</strong> <strong>auf</strong> Gr<strong>und</strong> <strong>von</strong> Temperaturänderung<br />
<strong>Weg</strong>en des 1. Hauptsatz<br />
ist es zweckmäßig isochore Prozesse zu<br />
betrachten, da dann die Volumenänderungsarbeit verschwindet (vgl. 4.7-2):<br />
Bei reversibler Prozessführung ist dann die Änderung der inneren <strong>Energie</strong> allein<br />
durch die Wärmezufuhr bestimmt:<br />
Wir betrachten<br />
<strong>und</strong> definieren wegen (*):<br />
spezifische <strong>und</strong> molare Wärmekapazität bei konstantem Volumen<br />
4.4-1
Bei konstantem Volumen gilt:<br />
Bemerkung:<br />
Wir haben die Änderung der inneren <strong>Energie</strong> mit der zugeführten Wärme<br />
gekoppelt, in<strong>dem</strong> wir einen isochoren Prozess betrachtet haben:<br />
Für ideale Gase ist die Einschränkung <strong>auf</strong> einen isochoren Prozess aber nicht<br />
notwendig, da hier wegen<br />
gilt <strong>und</strong> damit immer:<br />
Der 1. Hauptsatz liefert für ideale Gase:<br />
4.4-2
4.4.2 Änderung der Enthalpie <strong>auf</strong> Gr<strong>und</strong> <strong>von</strong> Temperaturänderung<br />
Änderung der Enthalpie <strong>auf</strong> Gr<strong>und</strong> <strong>von</strong> Temperaturänderungen bei konstantem<br />
Druck, isobare Prozesse (vgl. 4.7-3):<br />
Wir definieren wegen (*):<br />
spezifische <strong>und</strong> molare Wärmekapazität bei konstantem Druck<br />
Bei konstantem Druck gilt:<br />
4.4-3
Eine Sonderrolle kommt wieder <strong>dem</strong> idealen Gas zu:<br />
Wir haben die Änderung der Enthalpie mit der zugeführten Wärme gekoppelt,<br />
in<strong>dem</strong> wir einen isobaren Prozess betrachtet haben:<br />
Für ideale Gase ist die Einschränkung <strong>auf</strong> einen isobaren Prozess aber nicht<br />
notwendig, da hier wegen<br />
gilt <strong>und</strong> damit immer:<br />
Der 1. Hauptsatz liefert für ideale Gase:<br />
4.4-4
4.4.3 Spezifische Wärmekapazitäten idealer Gase<br />
Bei idealen Gasen sind die innere <strong>Energie</strong> <strong>und</strong> die Enthalpie ausschließlich<br />
Funktionen der Temperatur.<br />
Daher müssen auch die molaren <strong>und</strong> spezifischen Wärmekapazitäten reine<br />
Temperaturfunktionen sein:<br />
Es gilt ferner:<br />
4.4-5
Ableitung<br />
Ebenso<br />
Verhältnis der spezifischen Wärmen: κ ∗)<br />
Es ergibt sich:<br />
Das Billardkugelmodell des idealen Gases beschreibt im angegebenen Temperatur-<br />
bereich den Wert für einatomige Gase richtig (vergl. 4.2-19):<br />
*)<br />
Das Verhältnis der spezifischen Wärmen κ spielt eine besondere Rolle. Wir werden sehen, dass für die<br />
idealen Gase κ gleich <strong>dem</strong> Isentropenxponenten k ist (vergl. 4.7-6)<br />
4.4-6
Das Verhältnis der spezifischen oder der molaren Wärmen<br />
nimmt bei Umgebungstemperatur näherungsweise folgende Zahlenwerte an:<br />
Einatomige Gase: κ = 5/3 = 1,66<br />
Zweiatomige Gase: κ = 7/5 = 1,4<br />
4.4-7
Für mehratomige Gase zeigen Messungen, dass die spezifischen Wärmekapazitäten<br />
deutlich größer <strong>und</strong> deutlich temperaturabhängig sind:<br />
Für zweiatomige Gase bei Raumtemperatur liest man im vorstehenden Diagramm<br />
folgenden Wert ab:<br />
Zweiatomige Gase können bei diesen Temperaturen noch als starres Hantelmodell<br />
dargestellt werden. Da die innere <strong>Energie</strong> als die Summe der <strong>Energie</strong>n der frei<br />
betrachteten Moleküle dargestellt werden kann, kommt bei zweiatomigen Gasen zu<br />
den drei <strong>Energie</strong>anteilen der Translation des Billardkugelmodell noch die<br />
Rotationsenergie um zwei Achsen hinzu.<br />
Nach <strong>dem</strong> Gleichverteilungssatz erhält im statistischen Mittel jeder Freiheitsgrad<br />
die gleiche innere <strong>Energie</strong>. Daher ist:<br />
Noch höhere Temperaturen regen Molekülschwingungen <strong>und</strong> bisher eingefrorene<br />
Freiheitsgrade an, so dass die Wärmekapazitäten mit der Temperatur weiter ansteigen.<br />
4.4-8
Translatorische <strong>und</strong> rotatorische Freiheitsgrade<br />
Einatomige Gase (Beispiel Edelgase wie He, Ar etc)<br />
Freiheitsgrade der Translation: 3<br />
Freiheitsgrade der Rotation: alle eingefroren* )<br />
Zweiatomige Gase (Beispiel Gase wie N 2<br />
, O 2<br />
etc)<br />
Freiheitsgrade der Translation: 3<br />
Freiheitsgrade der Rotation: 2 (<strong>einer</strong> eingefroren* ) )<br />
Dreiatomige Gase mit gewinkelter Struktur<br />
(Beispiel Gase wie H 2<br />
O, SO 2<br />
etc)<br />
Freiheitsgrade der Translation: 3<br />
Freiheitsgrade der Rotation: 3<br />
Aus den Messwerten lässt sich deshalb folgern, dass CO 2<br />
keine<br />
gewinkelte Struktur wie H 2<br />
O oder SO 2<br />
hat!<br />
*) <strong>Die</strong> Tatsache, dass einige rotatorische Freiheitsgrade eingefroren sind, ist ein quantenmechanischer Effekt <strong>und</strong> lässt sich<br />
mit der klassischen Physik nicht erklären. <strong>Die</strong> Quantisierung des Drehimpulses erfordert bei kleinem Trägheitsmoment eine<br />
ausreichend hohe Temperatur, um die Rotation um die entsprechende Achse anzuregen. Alle klassischen Erklärungen<br />
widersprechen <strong>dem</strong> Gleichverteilungssatz, nach<strong>dem</strong> jeder Freiheitsgrad die gleiche <strong>Energie</strong> <strong>auf</strong>nimmt.<br />
4.4-9
4.4.2 Spezifische Wärmekapazitäten idealer Flüssigkeiten<br />
Annahme: inkompressibel, d. h. konstantes Volumen: dv = 0<br />
1. Hauptsatz liefert mit pdv = 0:<br />
<strong>Die</strong> innere <strong>Energie</strong> für ideale Flüssigkeiten ist also nur<br />
<strong>von</strong> der Temperatur abhängig.<br />
4.4-10
Folgerung für die Enthalpie idealer Flüssigkeiten <strong>und</strong> c p<br />
Definition der Enthalpie:<br />
Vollständiges Differential:<br />
Vergleich:<br />
⇒ Wärmekapazitäten c p <strong>und</strong> c v sind gleich für ideale Flüssigkeiten.<br />
<strong>Die</strong> Enthalpie für ideale Flüssigkeiten ist also <strong>von</strong> der Temperatur <strong>und</strong><br />
vom Druck abhängig:<br />
4.4-11