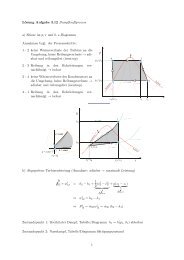
Lösung Aufgabe 4.8 ”Exergie und Anergie der Wärme bei isobare ...
Lösung Aufgabe 4.8 ”Exergie und Anergie der Wärme bei isobare ...
Lösung Aufgabe 4.8 ”Exergie und Anergie der Wärme bei isobare ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Lösung</strong> <strong>Aufgabe</strong> <strong>4.8</strong> <strong>”Exergie</strong> <strong>und</strong> <strong>Anergie</strong> <strong>der</strong> <strong>Wärme</strong> <strong>bei</strong> <strong>isobare</strong> Erwärmung”<br />
Wie<strong>der</strong>holung theoretischer Gr<strong>und</strong>lagen<br />
b q<br />
q zu<br />
e q<br />
Definition 1: Die Exergie ist die aus <strong>der</strong> <strong>Wärme</strong><br />
maximal gewinnbare Nutzar<strong>bei</strong>t: E Q .<br />
Bei reversiblem Prozessverlauf, ideale Maschine,<br />
wird gerade dieser Anteil <strong>der</strong> <strong>Wärme</strong> in Ar<strong>bei</strong>t<br />
umgewandelt.<br />
w = e q<br />
Definition 2: Der nicht verwertbare, nicht in<br />
Ar<strong>bei</strong>t umwandelbare Anteil <strong>der</strong> <strong>Wärme</strong> ist die<br />
<strong>Anergie</strong> <strong>der</strong> <strong>Wärme</strong>: B Q .<br />
Die <strong>Wärme</strong> lässt sich also aufteilen: Q = E Q +B Q .<br />
q ab<br />
Definition 3: Exergetischer Wirkungsgrad ζ = W E Q<br />
.<br />
Aus <strong>der</strong> Definition <strong>der</strong> Exergie folgt: Ar<strong>bei</strong>t ist reine Exergie W = E Q .<br />
Die reversible Maschine ar<strong>bei</strong>tet mit dem Carnotschen Wirkungsgrad<br />
(Aussage des 2. Hauptsatzes)<br />
Es folgt daher für die Exergie <strong>der</strong> <strong>Wärme</strong>:<br />
η C (T u , T ) = 1 − T u<br />
T = W Q = E Q<br />
Q<br />
<strong>Aufgabe</strong>nstellung:<br />
⇒ E Q = η C (T u , T ) Q = (1 − T u<br />
T )Q<br />
a) Exergie <strong>und</strong> <strong>Anergie</strong> <strong>der</strong> <strong>Wärme</strong> <strong>bei</strong> <strong>isobare</strong>m Prozessverlauf<br />
Da <strong>bei</strong>m isobren Erwärmen die Temperatur T variabel ist, stellen wir uns den Prozess<br />
als eine Serie von Teilprozessen vor, <strong>bei</strong> denen jeweils eine differentielle Menge <strong>Wärme</strong><br />
δQ zugeführt wird.<br />
⇒ δQ = δE Q + δB Q<br />
δE Q = (1 − T u<br />
T ) δQ<br />
} {{ }<br />
η C (T u ,T )
Integration (Summation über alle Teilprozesse) für spezifische Größen:<br />
e q12 =<br />
∫ 2<br />
1<br />
(1 − T ∫ 2<br />
u<br />
T ) δq = q 12 −<br />
1<br />
T u<br />
T δq<br />
Da e q12 + b q12 = q 12 folgt<br />
1. Hauptsatz<br />
b q12 =<br />
∫2<br />
1<br />
T u<br />
T δq<br />
für den <strong>isobare</strong>n Prozess<br />
q 12 + w t 12 = h 2 − h 1 = c p (ϑ 2 − ϑ 1 )<br />
o<strong>der</strong> differentiell:<br />
δq + v <br />
✒ 0<br />
dp = dh = c p dϑ = c p dT<br />
b q12 =<br />
∫2<br />
1<br />
∫2<br />
= T u c p<br />
∫2<br />
T u<br />
T δq n =<br />
1<br />
1<br />
T u<br />
T c p dT<br />
dT<br />
T = T u c p ln( T 2<br />
T 1<br />
)<br />
(<br />
⇒ e q12 = c p (T 2 − T 1 ) − T u ln( T )<br />
2<br />
)<br />
T 1<br />
Zahlenwerte:<br />
q 12 = c p (T 2 − T 1 ) = 5, 1393 kJ<br />
kJ<br />
· 550 K = 2856<br />
kgK kg<br />
b q12 = 298, 15 K · 5, 1393 kJ<br />
kgK<br />
e q12 = q 12 − b q12 = 1814 kJ<br />
kg<br />
15 kJ<br />
ln(1123, ) = 1042<br />
573, 15 kg
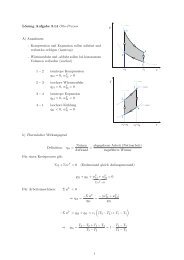
) Exergieverlust<br />
Die Exergie <strong>der</strong> <strong>Wärme</strong> e q12<br />
Prozess<br />
ist die maximal gewinnbare Nutzar<strong>bei</strong>t <strong>bei</strong>m reversiblen<br />
Der vorliegenden Prozess soll einen Wirkungsgrad η th haben.<br />
Es gilt immer : η th ≤ η C (2. Hauptsatz)<br />
q zu<br />
b q<br />
e q<br />
η th = wt<br />
q , η C = wt rev<br />
q<br />
⇒ w t < wrev<br />
t<br />
e V = w t rev − w t<br />
e V = e q12 − η th q 12<br />
Der Exergieverlust e V ist <strong>der</strong> ”echte”<br />
Verlust. Die eintretende <strong>Anergie</strong> ist nicht<br />
verwertbar.<br />
Zahlenwerte:<br />
e V12 = e q12 − η th q 12<br />
e V<br />
q ab = b q + e V<br />
w = e q - e V<br />
Exergetischer Wirkungsgrad:<br />
c) Abwärme<br />
Bilanz, 1. Hauptsatz:<br />
= 1814 kJ<br />
kJ<br />
− 0, 33 · 2856<br />
kg kg<br />
ζ = wt<br />
e q12<br />
= 0, 52<br />
= 871, 52<br />
kJ<br />
kg<br />
e V = w t rev − w t = e q12 − ζ e q12 = e q12 (1 − ζ)<br />
q ab = q zu − w t = b q + e V<br />
Zahlenwerte:<br />
q ab = 1913 kJ<br />
kg<br />
Die Abwärme enthält den unvermeidbaren Anteil b q , <strong>der</strong> schon <strong>bei</strong>m reversiblen Prozess<br />
auftritt. Dieser stellt sicher, dass <strong>der</strong> mit <strong>der</strong> <strong>Wärme</strong> zugefḧrte Entropiestromauch<br />
abgeführt wird.