h - Institut für Technische Verbrennung
h - Institut für Technische Verbrennung
h - Institut für Technische Verbrennung
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
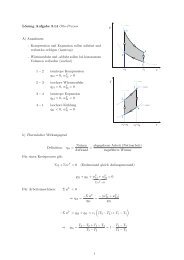
2.11 Innere Energie und Enthalpie <strong>für</strong> Gasgemische<br />
Komponenten:<br />
Partielle spezifische und partielle molare innere Energie der Komponente: u i , u i,m<br />
Partielle spezifische und partielle molare innere Enthalpie der Komponente: h i , h i,m<br />
Zusammenhang:<br />
Gemisch:<br />
Spezifische und partielle molare innere Energie des Gemisches:<br />
2.11-1
Temperaturabhängigkeit<br />
Bei idealen Gasen hängen innere Energie und Enthalpie nur von der Temperatur<br />
ab, dies gilt auch <strong>für</strong> die partielle innere Energie und die partielle Enthalpie:<br />
Die Temperaturabhängigkeit wird erfasst durch:<br />
Der Index ‘ref’ bezeichnet einen Referenzzustand, insbesondere die<br />
Referenztemperatur, die üblicherweise zu 25 o C = 298,15 K festgesetzt ist.<br />
Die hochgestellte ‘0’ bezeichnet den Referenzdruck von 1 atm.<br />
2.11-2
Die Temperaturabhängigkeit ist umso größer, je größer das Molekül ist, da es dann<br />
auch mehr innere Freiheitsgrade besitzt wie Rotation, Schwingung, Elektronenanregung,<br />
die mit wachsender Temperatur angeregt werden.<br />
Jedem Freiheitsgrad wird im statistischen Mittel die gleiche Energie zugeordnet<br />
→ Gleichverteilungssatz, so dass Moleküle mit einer großen Zahl von Freiheitsgraden<br />
mehr Energie speichern können.<br />
2.11-3
Spezifische und molare Wärmekapazitäten<br />
Allgemein gilt:<br />
Verknüpfung:<br />
Bei idealen Gasen keine Druckabhängigkeit:<br />
Mittlere spezifische und molare Wärmekapazitäten:<br />
2.11-4
Da sich bei <strong>Verbrennung</strong>sprozessen die Temperatur in weiten Grenzen ändert,<br />
werden statt mittlerer Wärmekapazitäten Polynomansätze <strong>für</strong> die<br />
Temperaturabhängigkeit der Wärmekapazitäten sowie <strong>für</strong> die Enthalpien und die<br />
Entropien genutzt, zum Beispiel in den NASA Polynomen.<br />
Die Koeffizienten der Ansätze sind in den NASA Polynomen in Abhängigkeit<br />
von Temperatur und Druck tabelliert.<br />
2.11-5
Die Bildungsenthalpie als Referenzenthalpie<br />
Enthalpie eines Gemisches idealer Gase<br />
Spezifische Enthalpie<br />
Molare Enthalpie<br />
Die einzelnen chemischen Komponenten besitzen unterschiedliche<br />
Referenzenthalpien bzw. , die bei definiert sind,<br />
so dass<br />
Wärmekapazität bei konstantem Druck:<br />
2.11-6
Reaktionsenthalpie<br />
Die Größe mit bezeichnet die bei einer<br />
Reaktion umgesetzte Enthalpie.<br />
Dieser Zusammenhang gilt <strong>für</strong> beliebige Temperaturen.<br />
Beispiel: Bruttoreaktion<br />
2.11-7
Die Referenzenthalpien von H 2 (gasförmig), O 2 (gasförmig) und C (fest)<br />
werden zu Null festgesetzt. Die chemisch gebundene molare Enthalpie von<br />
gasförmigem Methan würde aus dem (fiktiven) Umsatz<br />
bei der Temperatur folgen.<br />
Somit stellt die Referenzenthalpie die im Methan gebundene chemische<br />
Energie dar. Sie wird auch als Bildungsenthalpie bezeichnet.<br />
2.11-8
In ähnlicher Weise gilt <strong>für</strong> CO 2<br />
und H 2 O<br />
Somit wird bei der Reaktion<br />
bei konstanter Temperatur<br />
die molare Reaktionsenthalpie<br />
frei.<br />
2.11-9
Stoffgrößen <strong>für</strong> Gase bei<br />
M i<br />
[kg/kmol]<br />
h i,m,ref<br />
[kJ/mol]<br />
1 H 2<br />
2,016 0.000<br />
2 H 2<br />
O 18,016 -241,826<br />
3 H 2<br />
O 2<br />
34,016 -136,105<br />
4 NO 30,008 90,290<br />
5 NO 2<br />
46,008 33,095<br />
6 N 2<br />
28,016 0,000<br />
7 N 2<br />
O 44,016 82,048<br />
8 O 16,000 249,194<br />
9 O 2<br />
32,000 0,000<br />
10 O 3<br />
48,000 142,674<br />
M i<br />
[kg/kmol]<br />
h i,m,ref<br />
[kJ/mol]<br />
11 CH 2<br />
O 30,027 -115,896<br />
12 CH 2<br />
OH 31,035 -58,576<br />
13 CH 4<br />
16,043 -74,873<br />
14 CH 3<br />
OH 32,043 -200,581<br />
15 CO 28,011 -110,529<br />
16 CO 2<br />
44,011 -393,522<br />
17 C 2<br />
H 6<br />
30,070 -84,667<br />
18 C 2<br />
H 4<br />
28,054 52,283<br />
19 C 3<br />
H 8<br />
44,097 -103,847<br />
Tabelle Referenzenthalpien<br />
2.11-10
Die Enthalpiedifferenz bei einer Temperatur<br />
enthält den chemisch gebundenen und den thermischen Anteil der<br />
Enthalpiedifferenz.<br />
2.11-11
2.12 Reaktionsenthalpie und Heizwert<br />
Molare Reaktionsenthalpie: Δ h m<br />
Diejenige chemisch gebundene Wärme, die bei konstanter Temperatur beim Umsatz<br />
von einem Mol Brennstoff frei wird.<br />
Aus einer Globalreaktionsgleichung ergibt sich bei Umsetzung von einem Mol<br />
Brennstoff:<br />
Entsprechend bei einem System von r Reaktionsgleichungen:<br />
Exotherme Reaktionen: Δ h m , Δ h k,m < 0<br />
Endotherme Reaktionen: Δ h m , Δ h k,m > 0<br />
2.12-1
Definition: Heizwert<br />
Die Definition des Heizwertes nimmt Bezug auf die Reaktionsenthalpie.<br />
Der spezifische untere Heizwert h u bezeichnet die Wärme, die frei wird, wenn ein<br />
Kilogramm eines Brennstoffes umgesetzt wird, und das entstehende Wasser gasförmig<br />
vorliegt.<br />
Der spezifische obere Heizwert h o berücksichtigt ferner die Wärme, wenn das<br />
Wasser bei derselben Temperatur zusätzlich kondensiert → Kondensationswärme.<br />
Für eine Globalreaktion besteht zwischen Reaktionsenthalpie und unterem Heizwert<br />
der Zusammenhang:<br />
Mit der spezifischen Verdampfungsenthalpie r = 2442 kJ/kg von Wasser bei 25 o C<br />
ergibt sich <strong>für</strong> den oberen Heizwert:<br />
2.12 -2
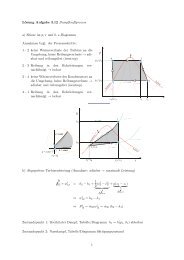
Definition: Adiabate Flammentemperatur<br />
Die adiabate Flammentemperatur ist diejenige Temperatur, die sich einstellt,<br />
wenn ein Ausgangsgemisch adiabat bei konstantem Druck ohne Zufuhr von<br />
technischer Arbeit verbrannt wird.<br />
Daraus folgt nach dem ersten Hauptsatz, dass der Prozess bei konstanter<br />
Enthalpie, also isenthalp, abläuft:<br />
Rechnet man mit mittleren Wärmekapazitäten<br />
erhält man mit der Definition der Enthalpie:<br />
2.12 -3
Verschiedene Formulierungen zur Berechnung<br />
der adiabaten Flammentemperatur<br />
Hier: System ohne Wärmeaustausch und ohne Austausch technischer Arbeit<br />
a) massenbasiert<br />
Bezogen auf die Gesamtmasse m (siehe 2.13-1):<br />
b) mengenbasiert<br />
(ein Bezug auf die Gesamtmolzahl macht keinen Sinn, da diese im<br />
Allgemeinen nicht erhalten bleibt:<br />
2.12 -4
Reaktionsgleichung bei magerer <strong>Verbrennung</strong> in Luft ( λ > 1 )<br />
mit<br />
Im Unverbrannten (siehe auch 2.1-30)<br />
Im Verbrannten (siehe auch 2.9-2, 2.9-3)<br />
2.12 -5
Die Enthalpiebilanz liefert<br />
Darin sind die Enthalpien h i,m (T) aus Tabellen einzusetzen.<br />
2.12-6
Wesentliche Vereinfachung bei der <strong>Verbrennung</strong> von Luft:<br />
Da Stickstoff mit nahezu 80% den wesentlichen Anteil der Luft sowohl vor als<br />
auch nach der <strong>Verbrennung</strong> darstellt, kann <strong>für</strong> eine Überschlagsrechnung gesetzt<br />
werden:<br />
c p,b = c p,u = c p = 1,4 kJ/kg<br />
Sonderfall vollständige <strong>Verbrennung</strong> eines gasförmigen Brennstoffes<br />
Mit und<br />
Folgt der Zusammenhang:<br />
Bei konstantem c p ergibt sich die adiabate Flammentemperatur zu:<br />
2.13 -1
2.14 Die Entropie und das chemische Potential<br />
Die Entropie eines n-Komponenten-Gemisches lautet:<br />
Für ein ideales Gas lauten die partiellen molaren Entropien:<br />
Anders als die Enthalpie ist demnach die Entropie auch bei idealen Gasen<br />
druckabhängig, angezeigt durch die hochgestellte Null bei den<br />
Referenzwerten.<br />
Beim Referenzdruck p=1 atm gilt<br />
und daher:<br />
2.14-1
Definition: freie Enthalpie und molare freie Enthalpie<br />
Es gilt <strong>für</strong> die freie Enthalpie oder Gibbssche Enthalpie:<br />
Darin ist <strong>für</strong> ein Gemisch:<br />
Die partielle molare freie Enthalpie g i,m lässt sich darstellen als:<br />
Die partielle molare freie Enthalpie wird auch als chemisches Potential bezeichnet:<br />
2.14-2
Das chemische Potential ist die grundlegende Größe zur Bestimmung des<br />
Gleichgewichts von Mehrkomponentensystemen mit und ohne chemische<br />
Reaktionen.<br />
Es kann in einen temperaturabhängigen und einen druckabhängigen Anteil<br />
aufgespalten werden:<br />
2.14-3
2.15 Bedingungen <strong>für</strong> das chemische Gleichgewicht und<br />
das Massenwirkungsgesetz<br />
Abgeschlossene thermodynamische Systeme laufen spontan in einen<br />
Gleichgewichtszustand, der zumindest nach unendlich langer Zeit erreicht wird<br />
und ohne äußere Einwirkung auf das System nicht mehr verlassen wird.<br />
Dies ist die Aussage des 2. Hauptsatzes der Thermodynamik.<br />
Für die freie Enthalpie eine Einkomponenten-Systems bedeutet dies:<br />
Aus der Definition der Entropie<br />
folgt mit dem 1. Hauptsatz die Gibbssche Fundamentalgleichung:<br />
2.15-1
Interpretation des chemischen Potentials<br />
Das vollständige Differential der Gibbsschen Enthalpie lässt sich daher auch<br />
schreiben:<br />
In einem Mehrkomponentensystem ist zusätzlich zur Abhängigkeit von Druck<br />
und Temperatur, die Abhängigkeit von der Teilchenzahl zu berücksichtigen.<br />
Differenziert man den Zusammenhang partiell nach der<br />
Teilchenzahl, so folgt:<br />
2.15-2
Bedingung <strong>für</strong> Gleichgewicht<br />
Die Proportionalitätskonstante ist also gerade das chemische Potential.<br />
Daher lautet das vollständige Differential der Gibbsschen Enthalpie <strong>für</strong> ein<br />
Mehrkomonentensystem:<br />
Dies ist die Gibbssche Fundamentalgleichung bei Änderung von Druck,<br />
Temperatur und Teilchenzahl.<br />
Im chemischen Gleichgewicht erreicht neben der Entropie auch die freie<br />
Enthalpie ein Extremum und zwar (anders als die Entropie) ein Minimum:<br />
2.15-3
Aus der Gleichgewichtsbedingung folgt <strong>für</strong> konstanten Druck und Temperatur,<br />
dass <strong>für</strong> das chemische Gleichgewicht gelten muss:<br />
Die Änderung der Massenanteile wird durch die stöchiometrische<br />
Umsatzgleichung festgelegt<br />
und da dn 1 beliebig ist muss im Gleichgewicht gelten:<br />
2.15-4
Erweitert auf mehrere Reaktionen muss dies <strong>für</strong> jede Reaktion gelten:<br />
Mit der Definition <strong>für</strong> das chemische Potential<br />
ergibt sich:<br />
Die linke Seite wird auch mit abgekürzt. Der Ausdruck<br />
stellt die Gibbssche Reaktionsenthalpie dar.<br />
Dann folgt:<br />
2.15-5
Gleichgewichtskonstante und Massenwirkungsgesetz<br />
In der Gleichung<br />
wird die Exponentialfunktion durch die Setzung<br />
eliminiert.<br />
Darin wird die Temperaturfunktion K pk (T) Gleichgewichtskonstante genannt.<br />
Für die Gleichgewichtskonstante gilt dann:<br />
Dieser Zusammenhang wird Massenwirkungsgesetz genannt.<br />
2.15-6
Das Van´t-Hoffsche Gesetz<br />
Differenziert man die Beziehung<br />
nach der Temperatur erhält man zunächst:<br />
mit<br />
Wegen<br />
gilt:<br />
2.15-7
Ersetzt man hierin die Reaktionsenthalpie ein, erhält man das Van´t-Hoffsche Gesetz<br />
oder<br />
Da die Reaktionsenthalpie nahezu<br />
temperaturabhängig ist, ergibt nach<br />
dem Van´t-Hoffschen Gesetz die<br />
Auftragung des Logarithmus der<br />
Gleichgewichtskonstanten über dem<br />
Kehrwert der Temperatur eine<br />
Gerade.<br />
2.15-8
Ein Näherungsansatz <strong>für</strong> die Gleichgewichtskonstanten<br />
Die Gleichgewichtskonstanten können als Funktion der Temperatur aus den<br />
chemischen Potentialen der chemischen Komponenten berechnet werden.<br />
Dazu müssen nur die Bildungsenthalpien und die Bildungsentropien sowie die<br />
Wärmekapazitäten der Komponenten bekannt sein. Insbesondere die<br />
Einbeziehung der Temperaturabhängigkeit der Wärmekapazitäten ist unhandlich<br />
Als praktische Näherung soll eine Approximation gegeben werden, die<br />
unabhängig von der Darstellung der Wärmekapazitäten ist.<br />
2.15-9
Durch Abspaltung der Bildungsenthalpien kann geschrieben werden:<br />
Mit<br />
folgt <strong>für</strong> die neue Temperaturfunktion:<br />
Bei konstanter Wärmekapazität würde der zweite Term einer logarithmischen<br />
Temperaturabhängigkeit folgen, während der erste und der letzte Term bei<br />
großen Temperaturen nahezu konstant ist.<br />
2.15-10
Es bietet sich deshalb der Ansatz an:<br />
Die beiden Konstanten π ia und π ib lassen sich bestimmen, wenn der Wert der<br />
Funktion π i <strong>für</strong> zwei Temperaturen, zum Beispiel 1200 K und 3000 K, aus den<br />
Janaf Thermochemical Tables bestimmt wird.<br />
Mit diesem Ansatz ergibt sich <strong>für</strong> die Gleichgewichtskonstante<br />
Oder verglichen mit dem Arrhenius-Ansatz<br />
2.15-11
Aus dem Vergleich<br />
folgt <strong>für</strong> die Konstanten:<br />
2.15-12
Stoffgrößen <strong>für</strong> Gase bei T ref = 298,15 K<br />
M i<br />
[kg/kmol]<br />
h i,m,ref<br />
[kJ/mol]<br />
s i,m,ref<br />
[kJ/mol K]<br />
1 H 1,008 217,986 114,470 -1,2261 1,9977<br />
2 HNO 31,016 99,579 220,438 -1,0110 4,3160<br />
3 OH 17,008 39,463 183,367 3,3965 2,9596<br />
4 HO 2<br />
33,008 20,920 227,358 -,1510 4,3160<br />
5 H 2<br />
2,016 0,000 130,423 -2,4889 2,8856<br />
6 H 2<br />
O 18,016 -241,826 188,493 -1,6437 3,8228<br />
7 H 2<br />
O 2<br />
34,016 -136,105 233,178 -8,4782 5,7218<br />
8 N 14,008 472,645 153,054 5,8661 1,9977<br />
9 NO 30,008 90,290 210,442 5,3476 3,1569<br />
10 NO 2<br />
46,008 33,095 239,785 -1,1988 4,7106<br />
11 N 2<br />
28,016 0,000 191,300 3,6670 3,0582<br />
12 N 2<br />
O 44,016 82,048 219,777 -5,3523 4,9819<br />
π A,i<br />
π B,i<br />
2.15-13
M i<br />
[kg/kmol]<br />
h i,m,ref<br />
[kJ/mol]<br />
s i,m,ref<br />
[kJ/mol K]<br />
13 O 16,000 249,194 160,728 6,85561 1,9977<br />
14 O 2<br />
32,000 0,000 204,848 4,1730 3,2309<br />
15 O 3<br />
48,000 142,674 238,216 -3,3620 5,0313<br />
16 NH 15,016 331,372 180,949 3,0865 2,9596<br />
17 NH 2<br />
16,024 168,615 188,522 -1,9835 3,8721<br />
18 NH 3<br />
17,032 -46,191 192,137 -8,2828 4,8833<br />
19 N 2<br />
H 2<br />
30,032 212,965 218,362 -8,9795 5,4752<br />
20 N 2<br />
H 3<br />
31,040 153,971 228,513 -17,5062 6,9796<br />
21 N 2<br />
H 4<br />
32,048 95,186 236,651 -25,3185 8,3608<br />
22 C 12,011 715,003 157,853 6,4461 1,9977<br />
23 CH 13,019 594,128 182,723 2,4421 3,,0829<br />
24 HCN 27,027 130,540 201,631 -5,3642 4,6367<br />
π A,i<br />
π B,i<br />
2.15-14
M i<br />
[kg/kmol]<br />
h i,m,ref<br />
[kJ/mol]<br />
s i,m,ref<br />
[kJ/mol K]<br />
25 HCNO 43,027 -116,733 238,048 -10,1563 6,0671<br />
26 HCO 29,019 -12,133 224,421 -,2313 4,2667<br />
27 CH 2<br />
14,027 385,220 180,882 -5,6013 4,2667<br />
28 CH 2<br />
O 30,027 -115,896 218,496 -8,5350 5,4012<br />
29 CH 3<br />
15,035 145,686 193,899 -10,7155 5,3026<br />
30 CH 2<br />
OH 31,035 -58,576 227,426 -15,3630 6,6590<br />
31 CH 4<br />
16,043 -74,873 185,987 -17,6257 6,1658<br />
32 CH 3<br />
OH 32,043 -200,581 240,212 -18,7088 7,3989<br />
33 CO 28,011 -110,529 197,343 4,0573 3,1075<br />
34 CO 2<br />
44,011 -393,522 213,317 -5,2380 4,8586<br />
35 CN 26,019 456,056 202,334 4,6673 3,1075<br />
36 C 2<br />
24,022 832,616 198,978 1,9146 3,5268<br />
π A,i<br />
π B,i<br />
2.15-15
M i<br />
[kg/kmol]<br />
h i,m,ref<br />
[kJ/mol]<br />
s i,m,ref<br />
[kJ/mol K]<br />
37 C 2<br />
H 25,030 476,976 207,238 -4,6242 4,6367<br />
38 C 2<br />
H 2<br />
26,038 226,731 200,849 -15,3457 6,1658<br />
39 C 2<br />
H 3<br />
27,046 279,910 227,861 -17,0316 6,9056<br />
40 CH 3<br />
CO 43,046 -25,104 259,165 -24,2225 8,5334<br />
41 C 2<br />
H 4<br />
28,054 52,283 219.,468 -26,1999 8,1141<br />
42 CH 3<br />
COH 44,054 -165,979 264.061 -30,7962 9,6679<br />
43 C 2<br />
H 5<br />
29,062 110,299 228,183 -32,6833 9,2980<br />
44 C 2<br />
H 6<br />
30,070 -84,667 228,781 -40,4718 10,4571<br />
45 C 3<br />
H 8<br />
44,097 -103,847 269,529 -63,8077 14,7978<br />
46 C 4<br />
H 2<br />
50,060 465,679 250,437 -34,0792 10,0379<br />
47 C 4<br />
H 3<br />
51,068 455,847 273,424 -36,6848 10,8271<br />
48 C 4<br />
H 8<br />
56,108 16,903 295,298 -72,9970 16,7215<br />
π A,i<br />
π B,i<br />
2.15-16
M i<br />
[kg/kmol]<br />
h i,m,ref<br />
[kJ/mol]<br />
s i,m,ref<br />
[kJ/mol K]<br />
49 C 4<br />
H 10<br />
58,124 -134,516 304,850 -86,8641 19,0399<br />
50 C 5<br />
H 10<br />
70,135 -35,941 325,281 -96,9383 20,9882<br />
51 C 5<br />
H 12<br />
72,151 -160,247 332,858 -110,2702 23,3312<br />
52 C 6<br />
H 12<br />
84,152 -59,622 350,087 -123,2381 25,5016<br />
53 C 6<br />
H 14<br />
86,178 -185,560 380,497 -137,3228 28,2638<br />
54 C 7<br />
H 14<br />
98,189 -72,132 389,217 -147,4583 29,6956<br />
55 C 7<br />
H 16<br />
100,205 -197,652 404,773 -162,6188 32,6045<br />
56 C 8<br />
H 16<br />
112,216 -135,821 418,705 -173,7077 34,5776<br />
57 C 8<br />
H 18<br />
114,232 -223,676 430,826 -191,8158 37,6111<br />
58 C 2<br />
H 4<br />
O 44,054 -51,003 243,044 -34,3705<br />
59 HNO 3<br />
63,016 -134,306 266,425 -19,5553<br />
60 He 4,003 0,000 125,800<br />
π A,i<br />
π B,i<br />
2.15-17
Beispiel: Berechnen Sie die Gleichgewichtskonzentration in ppm von NO in Luft<br />
bei Temperaturen bis zu 1500 K und p = p 0<br />
= 1 atm.<br />
Bruttoreaktion<br />
π iA<br />
π iB<br />
N 2<br />
3,6670 3,0582<br />
O 2<br />
4,1730 3,2309<br />
NO 5,3476 3,1569<br />
2.15-18
2.15-19
Annahme: der Luft bleiben unverändert<br />
2.15-20
T [K] X NO<br />
ppv<br />
300 3,52 . 10 -16 3,52 . 10 -10<br />
600 2,55 . 10 -8 2,55 . 10 -2<br />
1000 3,57 . 10 -5 35,7<br />
1500 1,22 . 10 -3 1220<br />
parts per million (Volumenanteile)<br />
parts per million (Massenanteile)<br />
2.15-21
Für den Molenbruch von NO im Gleichgewicht gilt daher:<br />
Diese Beziehung liefert nebenstehende Darstellung im Arrhenius-Diagramm.<br />
Die Gleichgewichtswerte <strong>für</strong> die<br />
beiden Temperaturen von 2000 K<br />
und 400 K unterscheiden sich um<br />
fast 10 Zehnerpotenzen.<br />
Die bei der <strong>Verbrennung</strong> durch die<br />
hohen Temperaturen erzeugte hohe<br />
NO-Konzentration bleibt beim<br />
schnellen Abkühlen des Gases<br />
weitgehend erhalten. Der<br />
chemische Zustand ist zwar instabil,<br />
jedoch regelrecht eingefroren.<br />
Die Aktivierungsbarriere könnte<br />
durch eine katalytisch angeregte<br />
(Die Einheit ppm bedeutet: parts per million)<br />
Reaktion umgangen werden, die es<br />
erlaubt, sehr rasch in den Gleichgewichtszustand bei der tiefen Temperatur zurückzukehren.<br />
2.15-22
Beispiel: Chemisches Gleichgewicht eines Wasserstoff-Sauerstoff-Gemisches<br />
Werden keine Zwischenprodukte berücksichtigt, kann die Globalreaktion<br />
zugrunde gelegt werden.<br />
Es soll die Gemischzusammensetzung bei gegebener Temperatur betrachtet werden.<br />
Die Beziehung <strong>für</strong> die Gleichgewichtskonstante lautet:<br />
Zur Abkürzung der Schreibweise soll eingeführt werden<br />
Damit gilt <strong>für</strong> die Partialdrücke:<br />
2.15-23
Mit<br />
gilt <strong>für</strong> das unverbrannte Gemisch bei stöchiometrischer <strong>Verbrennung</strong> von Wasser mit<br />
Sauerstoff:<br />
und<br />
Daraus ergeben sich die Massenbrüche:<br />
Die Massenbrüche der Elemente Z H<br />
und Z O<br />
sind durch das Ausgangsgemisch<br />
vorgegeben:<br />
2.15-24
Bei gegebener Temperatur und Druck ist das Gleichungsystem<br />
zu lösen.<br />
Berechnet werden soll die Gleichgewichtszusammensetzung von H 2<br />
, O 2<br />
und H 2<br />
O im<br />
verbrannten Gemisch bei Temperaturen von 2000 K, 3000 K und 4000 K und bei<br />
Drücken von 5 bar und 10 bar.<br />
2.15-25
Lösung:<br />
Die Gleichgewichtskonstante kann mit der Näherung<br />
berechnet werden, wenn die Konstanten einer Tabelle entnommen werden.<br />
Verwendet man den Massenbruch von Wasser als unabhängige Variable, so ist sein Wert<br />
durch das Polynom 3. Grades gegeben<br />
mit<br />
2.15-26
Mit Hilfe der cardanischen Formel kann ein geschlossener Ausdruck <strong>für</strong> Y H2O<br />
gefunden<br />
werden.<br />
Von den drei Nullstellen ist nur jeweils eine physikalisch sinnvoll.<br />
Tabelliert lauten die Ergebnisse:<br />
Man sieht, dass die Wasserkonzentration mit steigender Temperatur zugunsten von<br />
Wasserstoff und Sauerstoff abnimmt. Es findet also eine Dissoziation von Wasser statt.<br />
Die Dissoziation wird mit höherem Druck geringer. Dies entspricht dem Prinzip des<br />
geringsten Zwanges nach Le Chatelier, nachdem die Reaktion bei höherem Druck nach der<br />
Seite tendiert, auf der die geringere Teilchenzahl angetroffen wird.<br />
2.15-27
Das heterogene Gleichgewicht<br />
Heterogene Reaktionen sind solche, die an Phasengrenzen, zum Beispiel festflüssig<br />
oder flüssig-gasförmig, ablaufen.<br />
Sind solche Reaktionen im Gleichgewicht bezeichnet man dies das heterogene<br />
Gleichgewicht.<br />
Auch hier gilt die Gleichgewichtsbedingung:<br />
Das chemische Potential einer kondensierten Phase ist jedoch unabhängig vom<br />
Druck:<br />
2.15-28
Im Massenwirkungsgesetz treten <strong>für</strong> heterogene Reaktionen nur die<br />
Partialdrücke der gasförmigen Komponenten auf.<br />
Zum Beispiel <strong>für</strong> die Bildung von Kohlendioxid aus festem Kohlenstoff und<br />
Sauerstoff nach der Reaktion C f + O 2 = CO 2<br />
treten nur die Partialdrücke von O 2 und CO 2 auf:<br />
2.15-29
Partielle Gleichgewichte<br />
Vollständiges chemisches Gleichgewicht <strong>für</strong> alle denkbaren Komponenten führt<br />
bei <strong>Verbrennung</strong>sprozessen meist zu physikalischen unrealistischen Ergebnissen.<br />
Bestimmte chemische Reaktionen, insbesondere bei niedrigen Temperaturen und<br />
hoher Aktivierungsenergie, laufen nur sehr langsam ab.<br />
Für das Einstellen des Gleichgewichts bietet der schnelle <strong>Verbrennung</strong>sprozess<br />
dann nicht genügend Zeit → eingefrorener Zustand.<br />
Darüberhinaus können um Reaktionspartner konkurrierende Reaktionen dazu<br />
führen, dass die Reaktionspartner vollständig verbraucht sind und damit<br />
bestimmte Reaktionswege blockiert sind.<br />
2.15-30
Diese eingefrorenen Zustände können in einer Gleichgewichtsrechnung dadurch<br />
berücksichtigt werden, dass man gewisse chemische Komponenten nicht zulässt.<br />
Ein Beispiel sind Stickoxide wie NO und NO 2 , deren Bildung aus N 2 und O 2<br />
relativ langsam erfolgt, da die Reaktionsgeschwindigkeit sehr stark<br />
temperaturabhängig ist (Stabilität der irdischen Atmosphäre).<br />
Hier kann es sinnvoll sein, <strong>für</strong> die <strong>Verbrennung</strong>sreaktionen chemisches<br />
Gleichgewicht anzusetzen, während die NO x -Bildung kinetisch bestimmt ist.<br />
2.15-31
In einem kinetischen Mechanismus kann demgegenüber angenommen werden,<br />
dass bestimmte Reaktionen wesentlich schneller ablaufen als andere.<br />
Dadurch sind die beteiligten Spezies im Gleichgewicht.<br />
Ein Beispiel <strong>für</strong> eine sehr schnelle Reaktion ist die Elementarreaktion<br />
aus dem Elementarmechanismus von H 2 und O 2 .<br />
Bei gegebenen Konzentrationen von H 2 und H 2 O beschreibt die<br />
Gleichgewichtsbeziehung<br />
dann das Verhältnis der Konzentration von H und OH.<br />
2.15-32