Partielle molare Zustandsgrößen
Partielle molare Zustandsgrößen
Partielle molare Zustandsgrößen
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
8. Mehrkomponentensysteme<br />
8.1 <strong>Partielle</strong> <strong>molare</strong> Größen<br />
Experiment 1 unter Umgebungsdruck p:<br />
Fügen wir einer Menge Wasser n mit Volumen V (<strong>molare</strong>s Volumen v m =V/n) bei<br />
einer bestimmten Temperatur T eine Menge Δn Wasser gleicher Temperatur mit<br />
einem Volumen ΔV (<strong>molare</strong>s Volumen v m =ΔV/Δn=V/n) hinzu, so vergrößert sich das<br />
Volumen der Wassermenge genau um das Volumen ΔV. Die Temperatur T ändert sich<br />
beim Zusammenschütten nicht.<br />
Es gilt:<br />
8.1-1
Experiment 2 unter Umgebungsdruck p:<br />
Fügen wir einer Menge Wasser n mit Volumen V (<strong>molare</strong>s Volumen v m,w =V/n) bei<br />
einer bestimmten Temperatur T eine Menge Δn Alkohol gleicher Temperatur mit<br />
einem Volumen ΔV (<strong>molare</strong>s Volumen v m,A =ΔV/Δn) hinzu, so ergibt sich ein<br />
Gesamtvolumen V ges das kleiner ist als die Summe der Teilvolumina<br />
V ges < V w + ΔV<br />
Außerdem ändert sich die Temperatur.<br />
Es ergibt sich:<br />
Pech!<br />
Bem.: Mit Index * sollen i. F. die Stoffgrößen reiner Komponenten bezeichnet werden.<br />
8.1-2
Anschauliche Erklärung:<br />
Das negative Exzessvolumen V ex kann man sich dadurch erklären, dass die kleineren<br />
Wassermoleküle Zwischenräume zwischen den größeren Alkoholmolekülen<br />
ausnutzen können. Die Mischung wird so kompakter.<br />
Diese rein geometrische Erklärung ist allerdings nicht vollständig, da auch Kräfte<br />
zwischen den Molekülen Einfluss haben. Eventuelle Abstoßung zwischen den<br />
Molekülen weist in Richtung Volumenvergrößerung.<br />
Verallgemeinerung:<br />
Wir folgern für das Volumen V eines beliebigen Gemisches, dass es nicht nur von der<br />
Temperatur T und dem Druck p, sondern auch von der Zusammensetzung abhängt!<br />
Bei k Komponenten und den Molmengen n 1 , n 2 ,…n k imGemischergibtsichder<br />
funktionale Zusammenhang<br />
8.1-3
Von der Funktion<br />
bilden wir das vollständige Differential<br />
Wenn wir die Mischung bei konstanter Temperatur und konstantem Druck<br />
durchführen, ergibt sich bei Veränderung der Mischung eine Volumenänderung<br />
Wir definieren die partiellen <strong>molare</strong>n Volumen einer Komponente i<br />
8.1-4
Anschauliche Deutung:<br />
Das partielle <strong>molare</strong> Volumen der Komponente i<br />
gibt an, wie sich das Volumen V ändert (→ dV ),<br />
wenn eine infinitesimale Menge der Komponente i<br />
zu einem Gemisch gegebener Zusammensetzung<br />
hinzugefügt wird, während wir dafür sorgen, dass<br />
Temperatur und Druck konstant bleiben.<br />
8.1-5
Bemerkung:<br />
Eine Mischung kann statt durch Angabe der Molzahlen der Komponenten auch durch<br />
die Angabe der Molenbrüche X i vollständig charakterisiert werden.<br />
Wir schreiben deshalb auch statt<br />
üblicherweise für die partielle <strong>molare</strong>n Volumina auch die Funktion<br />
Auf, wobei noch zusätzlich<br />
gilt<br />
8.1-6
Bedeutung der partiellen <strong>molare</strong>n Volumina<br />
Das Volumen V einer Mischung bei bekannter Temperatur T und bekanntem Druck p<br />
kann aus der Kenntnis aller partiellen <strong>molare</strong>n Volumina v i,m der Komponenten der<br />
Mischung durch<br />
oder kurz<br />
berechnet werden.<br />
8.1-7
Um die Gültigkeit von<br />
zu zeigen, wollen wir zwei Mischungen genau gleicher Zusammensetzung<br />
zusammenbringen.<br />
Es gilt dabei folgender Zusammenhang (V ist homogen vom Grade 1):<br />
Wir untersuchen die Variation von λ durch Ableitung der Identität nach λ:<br />
Dies gilt für alle λ, also auch für λ = 1:<br />
8.1-8
Berechnung von Exzessvolumina<br />
Bringen wir zwei verschiedene Reinstoffe oder zwei Mischungen unterschiedlicher<br />
Zusammensetzung bei konstanter Temperatur und konstantem Druck zusammen, so gilt<br />
für das Gesamtvolumen, wenn keine chemischen Reaktionen stattfinden:<br />
mit<br />
Die Abweichung V ex wird Exzessvolumen genannt.<br />
Sie ist mit den partiellen <strong>molare</strong>n Volumina der Mischungen a,b und c gegeben durch:<br />
8.1-9
Ein Exzessvolumen nach Formel<br />
tritt insbesondere dann nicht auf, wenn sich die partiellen <strong>molare</strong>n Volumina nicht von<br />
den <strong>molare</strong>n Volumina der reinen Komponenten unterscheiden:<br />
Reine Komponenten sollen wegen der besseren Lesbarkeit stets durch einen Index *<br />
hervorgehoben werden.<br />
Man kann sich denken, dass dies zum Beispiel für ideale Gase, bei denen die Moleküle<br />
keine Ausdehnung und keine Interaktion untereinander besitzen, der Fall ist.<br />
Die theoretische Bestimmung der partiellen <strong>molare</strong>n Größen realer Gemische ist eine<br />
schwierige Aufgabe. In der Vergangenheit wurden diese im Allg. durch Experimente<br />
ermittelt (siehe nachfolgendes Beispiel).<br />
8.1-10
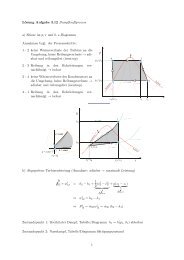
Beispiel Wasser-Ethanol-Gemisch<br />
Bei Umgebungstemperatur und -druck werden 0,3 Liter Ethanol und 0,7 Liter Wasser<br />
miteinander gemischt. Welches Gesamtvolumen hat die Mischung?<br />
Das Diagramm experimentell ermittelter partieller <strong>molare</strong>r Volumina für das Wasser-Ethanol-<br />
Gemisch sei gegeben.<br />
Lösung:<br />
Wir bestimmen die Molmengen von Wasser<br />
und Ethanol:<br />
8.1-11
Aus dem Diagram werden die partiellen <strong>molare</strong>n Volumina abgelesen.<br />
Um also tatsächlich ein Liter Schnapps<br />
mit 30 Vol % zu erhalten, müsste man eine<br />
größere Menge Alkohol und Wasser<br />
zusammenschütten.<br />
8.1-12
Führt man die Auswertung für viele Mengenverhältnisse durch oder misst man das<br />
Exzessvolumen erhält man folgendes Diagramm.<br />
8.1-13
Es sei speziell darauf hingewiesen, dass das berechnete Exzessvolumen V ex nicht mit<br />
dem Volumen δV der Folie 8.1-2 identisch ist.<br />
Der Vorgang dort wurde zwar bei konstantem Druck aber nicht bei konstanter<br />
Temperatur durchgeführt: keine Wärmebad → Wärmetönung (vergl. Folie 8.1-5)!<br />
Wegen der Wärmetönung bei der Vermischung verschiedener Substanzen muss im<br />
Allgemeinen gekühlt oder erwärmt werden.<br />
Solche Exzessgrößen treten also nicht nicht nur für das Volumen, sondern auch für<br />
energetische und entropische Größen wie innere Energie, Enthalpie und Entropie auf.<br />
Die Wärmetönung ist wegen des konstanten Druckes eine Folge des Exzesses der<br />
Freien Enthalpie.<br />
Analog zum Volumen müssen wir passende partielle <strong>molare</strong> Größen definieren, um<br />
solche Zusammenhänge rechnerisch erfassen zu können.<br />
8.1-14
<strong>Partielle</strong> <strong>molare</strong> <strong>Zustandsgrößen</strong><br />
Bei einem Mehrkomponentengemisch hängen alle <strong>Zustandsgrößen</strong> Z von der<br />
Zusammensetzung des Gemisches ab.<br />
Es gilt also stets<br />
Mit dem vollständiges Differential nach:<br />
Darin ist die partielle <strong>molare</strong> Zustandsgröße definiert durch:<br />
8.1-15
Die Interpretation der partiellen Ableitung<br />
folgt derjenigen der partiellen <strong>molare</strong>n Volumina.<br />
Die partielle Ableitung gibt wieder an, wie sich die<br />
Zustandsgröße des Gemisches bei konstanter Temperatur und konstantem Druck<br />
durch Hinzufügen einer infinitesimalen Menge einer Komponente i ändert.<br />
Ebenso gilt wieder bei konstanter Temperatur und konstantem Druck<br />
und beim Zusammenfügen verschiedener Mischung werden Exzessgrößen<br />
beobachtet:<br />
8.1-16
Beispiel: Die partielle <strong>molare</strong> Freie Enthalpie<br />
Besonders wichtig ist die partielle <strong>molare</strong> Freie Enthalpie G, da deren natürliche<br />
Variablen die thermischen variablen T und p sind, die in Experimenten leicht<br />
kontrolliert werden können oder als Betriebsbedingungen eines Reaktors<br />
vorgegeben werden.<br />
Definition der Freien Enthalpie:<br />
Bei einem Mehrkomponentengemisch hängt die Freie Enthalpie von der<br />
Zusammensetzung des Gemisches ab:<br />
Ihr vollständiges Differential lautet:<br />
8.1-17
Die partielle Ableitung<br />
gibt wieder an, wie sich die Zustandsgröße des<br />
Gemisches bei konstanter Temperatur und konstantem<br />
konstantem Druck durch Hinzufügen einer infinitesimalen Menge einer Komponente i<br />
ändert. Die partielle <strong>molare</strong> Freie Enthalpie wir Chemisches Potential μ i =g i,m genannt.<br />
Ebenso gilt wieder bei konstanter Temperatur und konstantem Druck<br />
und beim Zusammenfügen verschiedener Mischung wird ein Freie Mischungsenthalpie<br />
beobachtet :<br />
8.1-18
Die Freie Mischungsentalpie ΔG M enthält zwei Anteile, nämlich die Mischungsenthalpie<br />
der idealen Mischung, Index id , und<br />
eine Exzessenthalpie als Abweichung zur<br />
idealen Mischung, Index ex :<br />
Erstere ergibt sich aus der Mischungsentropie<br />
der idealen Mischung (siehe Abb.)<br />
Die treibende Kraft für die (ideale) Mischung ist<br />
die Entropiezunahme bei diesem Vorgang.<br />
Reale Mischungen besitzen eine zusätzliche Freie Mischungsenthalpie G ex , die<br />
Exzessenthalpie.<br />
Diese kann negativ, aber auch positiv sein (siehe 8.2, Mischungslücke).<br />
8.1-20
Die allgemeine Definition von Exzessgrößen lautet:<br />
Analog gilt für <strong>molare</strong> Exzessgrößen:<br />
Beispiel <strong>molare</strong>s Exzessvolumen:<br />
Ähnlich verhalten sich <strong>molare</strong> Innere Energie und <strong>molare</strong> Enthalpie:<br />
Wegen der Mischungsentropie idealer Mischungen gilt dagegen<br />
Dies wirkt sich auf <strong>molare</strong> Freie <strong>Zustandsgrößen</strong> wie Freie Energie und Freie Enthalpie<br />
aus:<br />
8.1-21
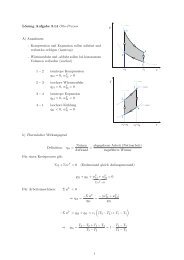
Bestimmung von partiellen <strong>molare</strong>n Größen<br />
<strong>Partielle</strong> <strong>molare</strong> Größen in einem Gemisch sind nicht unabhängig voneinander.<br />
Ausgangspunkt:<br />
Vergleich der vollständigen Differentiale → Gibbs-Duhem-Gleichung<br />
8.1-22
Unter isothermen und isobaren Bedingungen gilt für die Verknüpfung der partiellen<br />
<strong>molare</strong>n Größen untereinander<br />
bzw. mit den Molenbrüchen X i :<br />
Gemessene Daten lassen sich damit auf ihre thermodynamische Konsistenz überprüfen!<br />
Für ein binäres Gemisch ergibt sich zum Beispiel<br />
8.1-23
Wegen<br />
sind die Steigungen der partiellen <strong>molare</strong>n <strong>Zustandsgrößen</strong> miteinander verknüpft<br />
- Vorzeichenwechsel der Steigungen<br />
- waagerechte Tangenten an gleicher<br />
Stelle X<br />
- waagerechte Tangenten bei<br />
8.1-24
Achsenabschnittsmethode<br />
Die partiellen <strong>molare</strong>n Größen können aus der einfacher durchzuführenden Messung<br />
der <strong>Zustandsgrößen</strong> der Mischung bestimmt werden.<br />
Für binäre Mischungen X 1 +X 2 =1 führt dies auf die Achsenabschniuttsmethode.<br />
Wegen Gibbs-Duhem<br />
folgt<br />
8.1-25
In<br />
können wir mit<br />
z 2,m elimieren<br />
und erhalten:<br />
bzw. analog<br />
Messung des Verlaufes von z m und Bestimmung der lokalen Steigung liefert die<br />
partiellen <strong>molare</strong>n <strong>Zustandsgrößen</strong> auf den Achsabschnitten.<br />
8.1-26
GrafischeVeranschaulichung der Beziehungen<br />
Mit dem Index ∞ sind zusätzlich<br />
die partiellen <strong>molare</strong>n <strong>Zustandsgrößen</strong><br />
der Komponenten bei unendlicher<br />
Verdünnung eingetragen.<br />
8.1-27
Zusammenfassung<br />
<strong>Partielle</strong> <strong>molare</strong> Größen sind stets bei konstantem Druck und konstanter Temperatur durch<br />
die partielle Ableitung<br />
definiert.<br />
Der Wert der extensiven Zustandsgröße Z in einer Mischung errechnet sich aus:<br />
<strong>Partielle</strong> <strong>molare</strong> <strong>Zustandsgrößen</strong> unterscheiden sich im Allgemeinen von den <strong>molare</strong>n<br />
<strong>Zustandsgrößen</strong> reiner Komponenten:<br />
Um die funktionale Abhängigkeit nicht ausschreiben zu müssen sollen im Folgenden die<br />
<strong>molare</strong>n Größen reiner Komponenten mit einem Index * gekennzeichnet werden:<br />
8.1-28
Zusammenfassung (Fortsetzung)<br />
Verknüpfung zwischen den partiellen <strong>molare</strong>n <strong>Zustandsgrößen</strong> (Gibbs-Duhem):<br />
Definition von Exzessgrößen:<br />
Speziell gilt für die <strong>molare</strong> Entropie:<br />
8.1-29