Lehramt - Institut für Physikalische Chemie
Lehramt - Institut für Physikalische Chemie
Lehramt - Institut für Physikalische Chemie
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
UV-VIS<br />
der Fluoreszenz, die Absorption ist hingegen blauverschoben. Beide Effekte kompensieren<br />
sich teilweise und die Einflussnahme des Lösungsmittels auf die Lage einer Fluoreszenzbande<br />
bleibt damit gering.<br />
in polarem<br />
Lösungsmittel<br />
S' A<br />
in freiem<br />
Zustand<br />
} S' F<br />
A<br />
00<br />
F<br />
F<br />
A<br />
S A<br />
{<br />
{ } S F<br />
in polarem<br />
Lösungsmittel<br />
A<br />
F<br />
e > <br />
g<br />
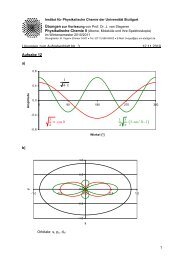
Abb. 2.9.: Einfluss der Lösungsmittelpolarität auf die Lagen der Absorptionsbanden<br />
(ν A ) und die Fluoreszenzbanden (ν F ). S A = mittlere thermische Energie des<br />
Grundzustands, S A ′ = beim elektronischen Übergang erzeugte Schwingungsenergie,<br />
S F ′ = thermische Energie des angeregten Zustands, S F = Schwingungsenergie,<br />
die beim Fluoreszenzübergang frei wurde. Im freien Zustand<br />
sind die Energien der 0-0-Übergange von Fluoreszenz und Absorption noch<br />
gleich. Im polaren Lösungsmittel hingegen ist aufgrund der Lösungsmittelrelaxation<br />
der 0-0-Übergang der Fluoreszenz gegenüber dem der Absorption<br />
rotverschoben.<br />
Eine quantitativen Behandlung des Einflusses von Lösungsmitteln auf Elektronenspektren ist<br />
sehr aufwändig, denn Molekül und Lösungsmittel müssen als ein Gesamtsystem betrachtet<br />
werden. Wir wollen uns daher auf ein stark vereinfachtes Modell beschränken, in dem:<br />
1. das gelöste Molekül als eine Kugel mit dem Radius a angesehen wird, in deren Zentrum<br />
sich ein punktförmiger Dipol µ befindet.<br />
2. das dielektrische Verhalten des umgebenden Lösungsmittels nur durch dessen Dielektrizitätskonstante<br />
ε r und dessen Brechungsindex n D beschrieben wird.<br />
Für die Wechselwirkungsenergie E w zwischen dem Dipolmoment µ des gelösten Moleküls und<br />
dem umgebenden Dielektrikum [18] erhält man<br />
E w = 2µ2<br />
a · ε r −1<br />
3 2ε r +1 . (2.21)<br />
Damit kann für die lösungsmittelbedingte Wellenzahldifferenz ∆˜ν 0−0 der 0-0-Übergänge von<br />
34