Lehramt - Institut für Physikalische Chemie
Lehramt - Institut für Physikalische Chemie
Lehramt - Institut für Physikalische Chemie
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
UV-VIS<br />
Aufgabe 4:<br />
Werten Sie die Fluoreszenz- und Absorptionsspektren wie in Abschnitt 2.2.1.4 gezeigt aus,<br />
undberechnen SiemitHilfevonGleichung (2.20)anschließend pK-pK ∗ .Vergleichen Siedieses<br />
Resultat mit denErgebnissen der vorherigen Aufgabenund diskutieren Sie dieAbweichungen.<br />
Diskutieren Sie auch die Werte k ∗ d , k∗ a, K und pK ∗ . Was sagen sie aus?<br />
2.3. Dipolmoment angeregter Moleküle<br />
Werden Absorptionsspektren von Farbstoffen in Lösungsmitteln unterschiedlicher Polarität<br />
aufgenommen,sokanninAbhängigkeitvonderStärkederLösungsmittelpolaritäteineVeränderung<br />
der Lage der Absorptionsbande und der Fluoreszenzbande beobachtet werden. Dieser<br />
Effekt kann dazu verwendet werden, bei bekanntem Dipolmoment des Grundzustands, das<br />
Dipolmoment des angeregten Zustands zu berechnen.<br />
2.3.1. Theoretischer Teil<br />
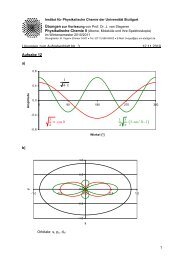
Abb. 2.7.: Einfluss der Lösungsmittelpolarität auf die Lage der Energieniveaus des<br />
Grundzustands (g) und des angeregten Zustands (e)<br />
Löst man einen Farbstoff wie z.B. 1,3,4-trimethylphenazin-2-ol, erscheint er in Eisessig dunkelrot,<br />
in Alkohol rot und in Benzol gelb. Jod löst sich je nach Lösungsmittel mit roter,<br />
brauner oder violetter Farbe. Dieser Effekt ist unter der Bezeichung Solvatochromie bekannt.<br />
Zunächst ist die Energie eines elektronischen Übergangs nur durch die Energiedifferenz zwischen<br />
Grund- und angeregtem Zustand bestimmt (Abb. 2.7, b)). Befindet sich das Molekül<br />
aber in einem polaren Lösungsmittel und besitzt es ein eigenes Dipolmoment, findet aufgrund<br />
dipolarer Wechselwirkungen eine Absenkung der Energieniveaus statt (siehe Abb. 2.7, a),c)).<br />
Diese ist umso stärker, je größer das Dipolmoment (µ) des betreffenden Zustands ist. Im Falle<br />
32