Lehramt - Institut für Physikalische Chemie
Lehramt - Institut für Physikalische Chemie
Lehramt - Institut für Physikalische Chemie
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
UV-VIS<br />
Durch Stöße mit Nachbarmolekülen gibt das angeregte Molekül seine Schwingungsenergie<br />
wieder ab, bis es den Schwingungsgrundzustand erreicht hat. Von hier aus kann nun ein<br />
strahlender Übergang in den elektronischen Grundzustand stattfinden, der aber gemäß dem<br />
Franck-Condon-Prinzip wieder vorwiegend zu angeregten Schwingungsniveaus führt. Der 0-<br />
0-Übergang besitzt nun die größte Energie. Dieser Mechanismus erklärt, warum Fluoreszenzspektren<br />
bei kleineren Frequenzen (bzw. Wellenzahlen) auftreten als Absorptionsspektren<br />
(Abb. 2.6). Dieser Effekt ist auch unter dem Begriff Stokesregel oder Stokes’sche Rotverschiebung<br />
bekannt.<br />
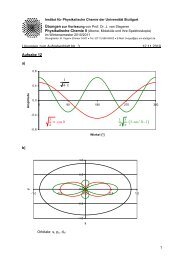
Abb. 2.6.: Fluoreszenz undAbsorptionbeibestimmtem pH-Wert. DieFluoreszenzsbande<br />
erscheint als Spiegelbild der Absorptionsbande, ist aber zu kleineren Wellenzahlen<br />
verschoben. Nur die 0-0-Übergänge fallen zusammen.<br />
Absorptions- und Fluoreszenzbande beinhalten beide den 0-0-Übergang, durch den auch die<br />
Übergangsenergie E (bzw. E ′ ) charakterisiert ist. Die Wellenzahl dieses Übergangs kann herausgefunden<br />
werden, indem eine geeignete Absorptionsbande und die zugehörige Fluoreszenzbande<br />
in die selbe Grafik kopiert und beide Banden auf die gleiche Größe skaliert werden,<br />
so wie in Abb. 2.6 gezeigt. Die beiden Kurven schneiden sich im 0-0-Übergang. Auf diese<br />
Weise lassen sich die gesuchten Wellenzahlen ˜ν ROH und ˜ν RO − herausfinden und folglich auch<br />
pK −pK ∗ berechnen.<br />
30