Versuch 1.2.4
Versuch 1.2.4 Versuch 1.2.4
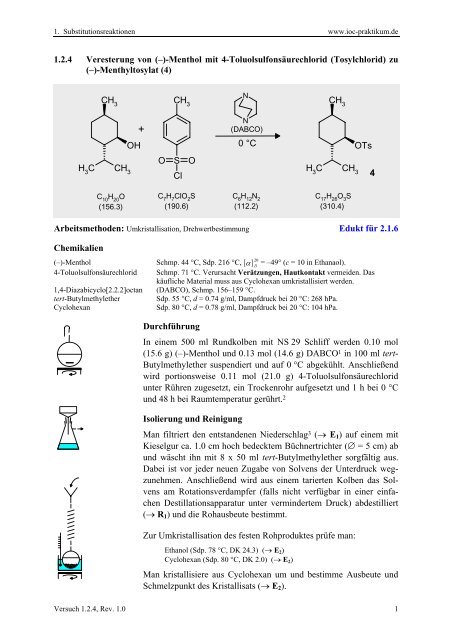
1. Substitutionsreaktionen www.ioc-praktikum.de 1.2.4 Veresterung von (–)-Menthol mit 4-Toluolsulfonsäurechlorid (Tosylchlorid) zu (–)-Menthyltosylat (4) CH 3 CH 3 N + N (DABCO) CH 3 OH 0 °C OTs O S O H 3 C CH 3 H 3 C CH 3 Cl 4 C 10 H 20 O (156.3) C 7 H 7 ClO 2 S (190.6) C 6 H 12 N 2 (112.2) C 17 H 26 O 3 S (310.4) Arbeitsmethoden: Umkristallisation, Drehwertbestimmung Edukt für 2.1.6 Chemikalien (–)-Menthol 20 Schmp. 44 °C, Sdp. 216 °C, [ α ] D = –49° (c = 10 in Ethanaol). 4-Toluolsulfonsäurechlorid Schmp. 71 °C. Verursacht Verätzungen, Hautkontakt vermeiden. Das käufliche Material muss aus Cyclohexan umkristallisiert werden. 1,4-Diazabicyclo[2.2.2]octan (DABCO), Schmp. 156–159 °C. tert-Butylmethylether Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa. Cyclohexan Sdp. 80 °C, d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa. Durchführung In einem 500 ml Rundkolben mit NS 29 Schliff werden 0.10 mol (15.6 g) (–)-Menthol und 0.13 mol (14.6 g) DABCO 1 in 100 ml tert- Butylmethylether suspendiert und auf 0 °C abgekühlt. Anschließend wird portionsweise 0.11 mol (21.0 g) 4-Toluolsulfonsäurechlorid unter Rühren zugesetzt, ein Trockenrohr aufgesetzt und 1 h bei 0 °C und 48 h bei Raumtemperatur gerührt. 2 Isolierung und Reinigung Man filtriert den entstandenen Niederschlag 3 (→ E 1 ) auf einem mit Kieselgur ca. 1.0 cm hoch bedecktem Büchnertrichter (∅ = 5 cm) ab und wäscht ihn mit 8 x 50 ml tert-Butylmethylether sorgfältig aus. Dabei ist vor jeder neuen Zugabe von Solvens der Unterdruck wegzunehmen. Anschließend wird aus einem tarierten Kolben das Solvens am Rotationsverdampfer (falls nicht verfügbar in einer einfachen Destillationsapparatur unter vermindertem Druck) abdestilliert (→ R 1 ) und die Rohausbeute bestimmt. Zur Umkristallisation des festen Rohproduktes prüfe man: Ethanol (Sdp. 78 °C, DK 24.3) (→ E 2 ) Cyclohexan (Sdp. 80 °C, DK 2.0) (→ E 2 ) Man kristallisiere aus Cyclohexan um und bestimme Ausbeute und Schmelzpunkt des Kristallisats (→ E 2 ). Versuch 1.2.4, Rev. 1.0 1
- Seite 2 und 3: 1. Substitutionsreaktionen www.ioc-
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
<strong>1.2.4</strong> Veresterung von (–)-Menthol mit 4-Toluolsulfonsäurechlorid (Tosylchlorid) zu<br />
(–)-Menthyltosylat (4)<br />
CH 3<br />
CH 3<br />
N<br />
+<br />
N<br />
(DABCO)<br />
CH 3<br />
OH<br />
0 °C<br />
OTs<br />
O S O<br />
H 3<br />
C CH 3<br />
H 3<br />
C CH 3<br />
Cl<br />
4<br />
C 10<br />
H 20<br />
O<br />
(156.3)<br />
C 7<br />
H 7<br />
ClO 2<br />
S<br />
(190.6)<br />
C 6<br />
H 12<br />
N 2<br />
(112.2)<br />
C 17<br />
H 26<br />
O 3<br />
S<br />
(310.4)<br />
Arbeitsmethoden: Umkristallisation, Drehwertbestimmung Edukt für 2.1.6<br />
Chemikalien<br />
(–)-Menthol<br />
20<br />
Schmp. 44 °C, Sdp. 216 °C, [ α ] D<br />
= –49° (c = 10 in Ethanaol).<br />
4-Toluolsulfonsäurechlorid Schmp. 71 °C. Verursacht Verätzungen, Hautkontakt vermeiden. Das<br />
käufliche Material muss aus Cyclohexan umkristallisiert werden.<br />
1,4-Diazabicyclo[2.2.2]octan (DABCO), Schmp. 156–159 °C.<br />
tert-Butylmethylether Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa.<br />
Cyclohexan<br />
Sdp. 80 °C, d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa.<br />
Durchführung<br />
In einem 500 ml Rundkolben mit NS 29 Schliff werden 0.10 mol<br />
(15.6 g) (–)-Menthol und 0.13 mol (14.6 g) DABCO 1 in 100 ml tert-<br />
Butylmethylether suspendiert und auf 0 °C abgekühlt. Anschließend<br />
wird portionsweise 0.11 mol (21.0 g) 4-Toluolsulfonsäurechlorid<br />
unter Rühren zugesetzt, ein Trockenrohr aufgesetzt und 1 h bei 0 °C<br />
und 48 h bei Raumtemperatur gerührt. 2<br />
Isolierung und Reinigung<br />
Man filtriert den entstandenen Niederschlag 3 (→ E 1 ) auf einem mit<br />
Kieselgur ca. 1.0 cm hoch bedecktem Büchnertrichter (∅ = 5 cm) ab<br />
und wäscht ihn mit 8 x 50 ml tert-Butylmethylether sorgfältig aus.<br />
Dabei ist vor jeder neuen Zugabe von Solvens der Unterdruck wegzunehmen.<br />
Anschließend wird aus einem tarierten Kolben das Solvens<br />
am Rotationsverdampfer (falls nicht verfügbar in einer einfachen<br />
Destillationsapparatur unter vermindertem Druck) abdestilliert<br />
(→ R 1 ) und die Rohausbeute bestimmt.<br />
Zur Umkristallisation des festen Rohproduktes prüfe man:<br />
Ethanol (Sdp. 78 °C, DK 24.3) (→ E 2 )<br />
Cyclohexan (Sdp. 80 °C, DK 2.0) (→ E 2 )<br />
Man kristallisiere aus Cyclohexan um und bestimme Ausbeute und<br />
Schmelzpunkt des Kristallisats (→ E 2 ).<br />
<strong>Versuch</strong> <strong>1.2.4</strong>, Rev. 1.0 1
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
Ausbeute an 4: 65–75%, Schmp. 93 °C. Das (–)-Menthyltosylat 4<br />
wird in <strong>Versuch</strong> 2.1.6 weiter umgesetzt.<br />
1 Welche Funktion hat die Substanz? Welches Reagens wirkt ähnlich?<br />
2 Weshalb benötigt die Reaktion so lange Zeit?<br />
3 Um welchen Feststoff handelt es sich?<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
E 1 :<br />
E 2 :<br />
R 1 :<br />
Filter und Rückstand → Entsorgung (Org. Feststoffe).<br />
Mutterlaugen → Entsorgung (RH).<br />
Abdestilliertes Lösungsmittel → Recycling (tert-Butylmethylether).<br />
Auswertung des <strong>Versuch</strong>s<br />
1 H-NMR-Spektrum von 4 (300 MHz, CDCl 3 ): δ = 0.52 (3 H), 0.82 (3 H), 0.87 (3 H), 0.73–1.05 (2 H), 1.16 (1<br />
H), 1.30–1.49 (2 H), 1.57–1.69 (2 H), 1.89 (1 H), 2.13 (1 H), 2.43 (3 H), 4.39 (1 H), 7.31 (2 H), 7.89 (2 H).<br />
4.4<br />
2.0<br />
1.5<br />
1.0<br />
8.0 6.0 4.0 2.0 [ppm] 0.0<br />
13 C-NMR-Spektrum (75.5 MHz, CDCl 3 ) von 4: δ = 15.3 (CH 3 ), 20.9 (CH 3 ), 21.6 (CH 3 ), 21.9 (CH 3 ), 23.0<br />
(CH 2 ), 25.5 (CH), 31.7 (CH), 33.8 (CH 2 ), 42.0 (CH 2 ), 47.6 (CH), 83.7 (CH), 127.7 (CH), 129.7 (CH), 134.9 (C),<br />
144.3 (C).<br />
LM<br />
160 140<br />
120<br />
100 80<br />
60 40 20 [ppm] 0<br />
<strong>Versuch</strong> <strong>1.2.4</strong>, Rev. 1.0 2
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
IR-Spektrum von 4 (KBr):<br />
100<br />
T [%]<br />
50<br />
3055<br />
2865<br />
1450<br />
2960 2930<br />
1357<br />
1178<br />
0<br />
4000 3000 2000 1500 1000 ν ~ [cm -1 ]<br />
1597<br />
* Bestimmen Sie den Drehwert von 4 (Lit.: [ α ]<br />
20 D<br />
= −70° (c = 15 in CHCl 3 ) [2] ).<br />
* Formulieren Sie den zu 4 führenden Reaktionsmechanismus.<br />
Weitere denkbare Reaktionsprodukte:<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
OTos<br />
H 3<br />
C<br />
H 3<br />
C<br />
H 3<br />
C<br />
A B C<br />
* Mit welchen spektroskopischen Daten und einfachen <strong>Versuch</strong>en lassen sich A–C ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen.<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Nach dieser Arbeitsvorschrift lassen sich primäre und sekundäre Alkohole umsetzen. Beim Umsatz kurzkettiger<br />
Alkohole entsteht in der Regel kein festes Produkt. In diesen Fällen müssen die ölig anfallenden Produkte im<br />
Ölpumpenvakuum aus einer Feststoffdestillationsapparatur destilliert werden.<br />
DABCO ersetzt das toxische Pyridin, das bisher bei diesen Reaktionen eingesetzt wurde. [1]<br />
[1] S. Hünig, J. Hartung, R. Kreuer, M. Schwarz, H. Wenner, Synthesis 1997, 1433–1438.<br />
[2] W. Hückel, C.-M. Jennewein, Liebigs. Ann. Chem. 1965, 683, 100–117.<br />
<strong>Versuch</strong> <strong>1.2.4</strong>, Rev. 1.0 3