6.2.1.1: 4-Ethylbenzoesäure
6.2.1.1: 4-Ethylbenzoesäure
6.2.1.1: 4-Ethylbenzoesäure
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
6. Oxidations-, Reduktions-Reaktionen www.ioc-praktikum.de<br />
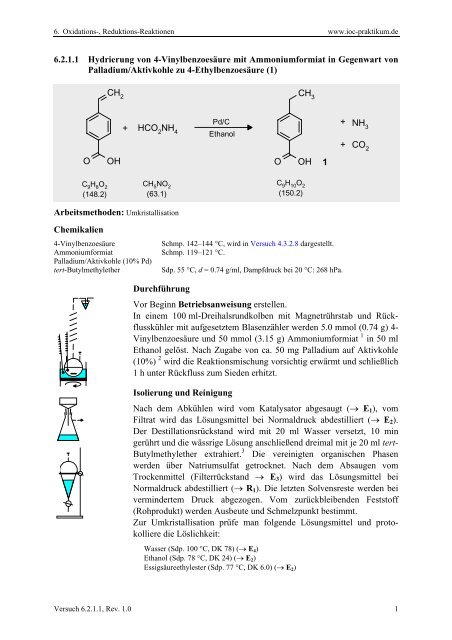
<strong>6.2.1.1</strong> Hydrierung von 4-Vinylbenzoesäure mit Ammoniumformiat in Gegenwart von<br />
Palladium/Aktivkohle zu 4-Ethylbenzoesäure (1)<br />
CH 3<br />
O<br />
O OH<br />
+ HCO 2<br />
NH 4<br />
Pd/C<br />
+<br />
Ethanol<br />
+<br />
OH<br />
1<br />
CH 2<br />
NH 3<br />
CO 2<br />
C 9<br />
H 8<br />
O 2<br />
(148.2)<br />
CH 5<br />
NO 2<br />
(63.1)<br />
C 9<br />
H 10<br />
O 2<br />
(150.2)<br />
Arbeitsmethoden: Umkristallisation<br />
Chemikalien<br />
4-Vinylbenzoesäure<br />
Ammoniumformiat<br />
Palladium/Aktivkohle (10% Pd)<br />
tert-Butylmethylether<br />
Schmp. 142–144 °C, wird in Versuch 4.3.2.8 dargestellt.<br />
Schmp. 119–121 °C.<br />
Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 100 ml-Dreihalsrundkolben mit Magnetrührstab und Rückflusskühler<br />
mit aufgesetztem Blasenzähler werden 5.0 mmol (0.74 g) 4-<br />
Vinylbenzoesäure und 50 mmol (3.15 g) Ammoniumformiat 1 in 50 ml<br />
Ethanol gelöst. Nach Zugabe von ca. 50 mg Palladium auf Aktivkohle<br />
(10%) 2 wird die Reaktionsmischung vorsichtig erwärmt und schließlich<br />
1 h unter Rückfluss zum Sieden erhitzt.<br />
Isolierung und Reinigung<br />
Nach dem Abkühlen wird vom Katalysator abgesaugt (→ E 1 ), vom<br />
Filtrat wird das Lösungsmittel bei Normaldruck abdestilliert (→ E 2 ).<br />
Der Destillationsrückstand wird mit 20 ml Wasser versetzt, 10 min<br />
gerührt und die wässrige Lösung anschließend dreimal mit je 20 ml tert-<br />
Butylmethylether extrahiert. 3 Die vereinigten organischen Phasen<br />
werden über Natriumsulfat getrocknet. Nach dem Absaugen vom<br />
Trockenmittel (Filterrückstand → E 3 ) wird das Lösungsmittel bei<br />
Normaldruck abdestilliert (→ R 1 ). Die letzten Solvensreste werden bei<br />
vermindertem Druck abgezogen. Vom zurückbleibenden Feststoff<br />
(Rohprodukt) werden Ausbeute und Schmelzpunkt bestimmt.<br />
Zur Umkristallisation prüfe man folgende Lösungsmittel und protokolliere<br />
die Löslichkeit:<br />
Wasser (Sdp. 100 °C, DK 78) (→ E 4 )<br />
Ethanol (Sdp. 78 °C, DK 24) (→ E 2 )<br />
Essigsäureethylester (Sdp. 77 °C, DK 6.0) (→ E 2 )<br />
Versuch <strong>6.2.1.1</strong>, Rev. 1.0 1
6. Oxidations-, Reduktions-Reaktionen www.ioc-praktikum.de<br />
Das Rohprodukt wird aus 50proz. Ethanol umkristallisiert, Kristallisation<br />
im Eisbad (Mutterlauge → E 4 ). Nach dem Trocknen im Exsikkator<br />
über Kieselgel bestimme man Ausbeute und Schmelzpunkt des<br />
umkristallisierten Reinprodukts. Ausbeute an 1: 45–55%, Schmp. 112–<br />
113 °C.<br />
1 Welche Rolle spielt das Ammoniumformiat? Stöchiometrie?<br />
2 Was ist zu beobachten?<br />
3 Erläutern Sie die Aufarbeitungsschritte.<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
E 1 : Pd/C-Katalysator → Sammeln für die Wiederverwendung des Katalysators.<br />
E 2 : Abdestilliertes Lösungsmittel und wasserfreie Mutterlaugen → Entsorgung (RH).<br />
E 3 : Trockenmittel → Entsorgung (Anorg. Feststoffe).<br />
E 4 : Wässrige Mutterlaugen → Entsorgung (H 2 O mit RH).<br />
R 1 : Abdestilliertes Lösungsmittel → Recycling (tert-Butylmethylether).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 1 (300 MHz, DMSO-d 6 ): δ = 1.17 (3 H), 2.64 (2 H), 7.30 (2 H), 7.86 (2 H), 12.70 (1<br />
H).<br />
805.1 Hz<br />
797.5 Hz<br />
790.0 Hz<br />
782.4 Hz<br />
359.2 Hz<br />
351.7 Hz<br />
344.1 Hz<br />
a) b)<br />
b)<br />
Amplitude x 5<br />
a)<br />
14.0 13.0 12.0 11.0 10.0 9.0 8.0 7.0 6.0 5.0 4.0 3.0 2.0 [ppm] 0.0<br />
13 C-NMR Spektrum von 1 (75.5 MHz, DMSO-d 6 ): δ = 15.07 (CH 3 ), 28.04 (CH 2 ), 127.80 (CH), 128.19 (C),<br />
129.31 (CH), 167.22 (C).<br />
LM<br />
180<br />
160<br />
140<br />
120<br />
100 80<br />
60 40 20 [ppm] 0<br />
Versuch <strong>6.2.1.1</strong>, Rev. 1.0 2
6. Oxidations-, Reduktions-Reaktionen www.ioc-praktikum.de<br />
IR-Spektrum von 1 (KBr):<br />
100<br />
T [%]<br />
50<br />
2975<br />
1780<br />
0<br />
4000 3000 2000 1500 1000 ν ~ [cm -1 ]<br />
* Formulieren Sie den zu 1 führenden Reaktionsmechanismus. Welche Schlüsse lassen sich aus der Bildung<br />
von CO 2 ziehen?<br />
Weitere denkbare Reaktionsprodukte:<br />
1610<br />
O<br />
H<br />
CH 2<br />
O H<br />
CH 2<br />
CH 3<br />
CH 3<br />
OH<br />
OH<br />
A B C D<br />
* Mit welchen spektroskopischen Daten und einfachen Versuchen lassen sich A–D ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen. In welchem Zusammenhang stehen A/B und C/D?<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
α,β-Ungesättigte Carbonsäureester, Amide, Nitrile und Ketone werden mit 10% Pd/C / HCO 2 NH 4 in 5–20 min<br />
bei 110 °C in 63–93proz. Ausbeuten hydriert. [1]<br />
[1] S. Ram, L.D. Spicer, Synthetic Communications 1992, 22, 2683–2690. Siehe auch Einführung 6.2.1.<br />
Versuch <strong>6.2.1.1</strong>, Rev. 1.0 3