Hier steht der Titel der Power Point Präsentation.
Hier steht der Titel der Power Point Präsentation.
Hier steht der Titel der Power Point Präsentation.
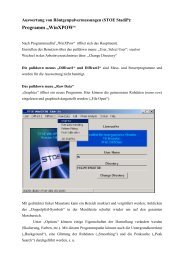
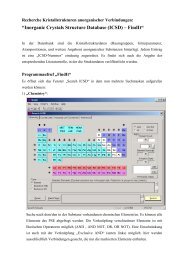
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Chemische Reaktionen<br />
Die elektrochemische Spannungsreihe<br />
... ist eine Ordnung <strong>der</strong> Redoxsysteme nach <strong>der</strong> Größe ihrer Standardpotentiale.<br />
Redoxsystem<br />
reduzierte Form → oxidierte Form +e -<br />
E° in V pH-Wert<br />
Mn 2+ + 12H 2 O → MnO 4- + 8H 3 O + + 5e -<br />
+1,51<br />
Mn → Mn 2+ + 2e - -1,19<br />
Au → Au 3+ + 3e -<br />
+1,50<br />
6H 2 O → O 2(g) + 4H 3 O + + 4e -<br />
+1,23<br />
6H 2 O → O 2(g) + 4H 3 O + + 4e -<br />
+0,81<br />
Ag → Ag + + e -<br />
+0,80<br />
Fe 2+ → Fe 3+ + e -<br />
+0,77<br />
4OH - → O 2(g) + 2H 2 O + 4e -<br />
+0,40<br />
Cu → Cu 2+ + 2e -<br />
+0,34<br />
H 2 + 2H 2 O → 2H 3 O + + 2e -<br />
0<br />
Pb → Pb 2+ + 2e -<br />
-0,13<br />
Sn → Sn 2+ + 2e -<br />
-0,14<br />
H 2(g) + 2OH - → 2H 2 O (l) + 2e -<br />
-0,42<br />
Fe → Fe 2+ + 2e -<br />
-0,44<br />
Cr → Cr 3+ + 3e -<br />
-0,74<br />
Zn → Zn 2+ + 2e -<br />
-0,76<br />
H 2(g) + 2OH - → 2H 2 O (l) + 2e -<br />
-0,83<br />
0<br />
7<br />
14<br />
0<br />
7<br />
14