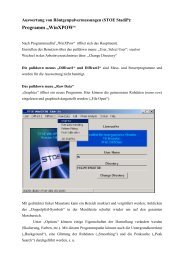
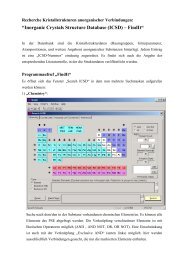
Praktikum - Fachrichtung Chemie und Lebensmittelchemie
Praktikum - Fachrichtung Chemie und Lebensmittelchemie
Praktikum - Fachrichtung Chemie und Lebensmittelchemie
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Synthese <strong>und</strong> Charakterisierung anorganischer Stoffe<br />
_________________________________<br />
Anorganisches Vertiefungspraktikum für Lehramtskandidaten<br />
a)<br />
b) c) d)<br />
e)<br />
TU – Dresden<br />
Fakultät Mathematik <strong>und</strong> Naturwissenschaften<br />
<strong>Fachrichtung</strong> <strong>Chemie</strong> <strong>und</strong> <strong>Lebensmittelchemie</strong><br />
Professur für Anorganische <strong>Chemie</strong> I
Einleitung<br />
„Ohne <strong>Chemie</strong>“ ... ein Werbeslogan, den man immer häufiger liest. Offensichtlich<br />
ist „<strong>Chemie</strong>“ heutzutage ein Synonym für Stoffe, die für Mensch <strong>und</strong> Umwelt<br />
schädlich sind. Jedoch selbst die einfachsten, alltäglich gegenwärtigen Dinge wie<br />
Computer, Handy oder Auto basieren auf chemisch hochentwickelten Produkten <strong>und</strong><br />
Prozessen (Halbleiter, Lithiumbatterie, Verbrennung).<br />
Im Rahmen des <strong>Praktikum</strong>s werden stoffchemische Gr<strong>und</strong>kenntnisse aus dem<br />
Gr<strong>und</strong>studium vertieft <strong>und</strong> ein Einblick in die praxisnahe Forschung an neuen<br />
Produkten <strong>und</strong> Technologien gegeben.<br />
Das <strong>Praktikum</strong> findet über einen Zeitraum von fünf Wochen <strong>und</strong> in der Regel an<br />
jeweils einem Tag pro Woche statt. Es dient der Vertiefung bzw. Erweiterung der im<br />
Gr<strong>und</strong>studium erworbenen Kenntnisse <strong>und</strong> Fähigkeiten beim präparativen <strong>und</strong><br />
analytischen Arbeiten. Es werden Versuche zur Darstellung <strong>und</strong> zur<br />
Charakterisierung anorganischer Substanzen durchgeführt. Beim Versuch „<strong>Chemie</strong><br />
des Kupfers“ wird in der letzten Präparatestufe der Ausgangsstoff wieder<br />
zurückgewonnen (Stoffkreisläufe). Auf diesem Wege lernen die Studenten<br />
unterschiedliche Reaktionstypen <strong>und</strong> Verbindungsklassen kennen. Das Prinzip der<br />
Synthese in geschlossenen Kreisläufen soll u. a. Anregungen für die spätere<br />
selbständige Planung von Schulversuchen unter Berücksichtigung von Aspekten des<br />
Umweltschutzes <strong>und</strong> des sparsamen Umgangs mit Chemikalien vermitteln. Die<br />
Konzeption der Stoffkreisläufe zur <strong>Chemie</strong> des Kupfers erfolgte in Anlehnung an eine<br />
Publikation von V. Wiskamp et al. in <strong>Chemie</strong> in unserer Zeit 27(1993)48.<br />
Die Synthesebeispiele zu lumineszierenden Nanopartikeln <strong>und</strong> leitfähigen<br />
Dünnschichten ermöglichen den Studenten einen Blick in Wirkungsfelder<br />
anorganischer Materialien, die bereits ihren Weg in den Alltag der heutigen Zeit<br />
gef<strong>und</strong>en haben.<br />
Poröse Substanzen, wie Metal-Organic Frameworks (MOFs), weisen sehr große<br />
Oberflächen auf <strong>und</strong> stoßen seit einigen Jahren auf ein enormes Interesse seitens<br />
der <strong>Chemie</strong>, der Physik <strong>und</strong> der Materialwissenschaften. Die Synthese <strong>und</strong><br />
Charakterisierung soll im Rahmen dieses <strong>Praktikum</strong>s die Gr<strong>und</strong>lagen synthetischer<br />
2
Arbeiten zur Herstellung <strong>und</strong> Anwendung poröser Materialien sowie deren<br />
analytische Untersuchungen einführend dargelegt werden.<br />
Die zum Einsatz gelangenden physikalisch-chemischen Untersuchungsmethoden<br />
sind nur eine kleine Auswahl der Vielzahl von zur Charakterisierung von<br />
anorganischen Festkörpern <strong>und</strong> Nanomaterialien verwendeten Methoden.<br />
Kenntnisse über weitere Methoden sind im Selbststudium <strong>und</strong> durch gegenseitige<br />
Information zu erwerben. Vor Beginn der praktischen Arbeiten findet eine<br />
<strong>Praktikum</strong>seinführung <strong>und</strong> Sicherheitsunterweisung statt. Informieren Sie sich bitte<br />
unabhängig davon über einige gr<strong>und</strong>sätzliche Inhalte des Chemikaliengesetzes, der<br />
Gefahrstoffverordnung <strong>und</strong> der Technischen Regeln für Gefahrstoffe sowie über<br />
allgemeine Richtlinien für die Arbeit im Labor (Jander, Blasius: Lehrbuch der<br />
analytischen <strong>und</strong> präparativen anorganischen <strong>Chemie</strong>, Auflage 1995, S.141-161). Zur<br />
Vorbereitung auf die jeweiligen <strong>Praktikum</strong>saufgaben gehört neben den Informationen<br />
über zu verwendende Synthese- <strong>und</strong> Charakterisierungsmethoden auch das<br />
Vertrautmachen mit den Eigenschaften der verwendeten Substanzen einschließlich<br />
ihrer H- <strong>und</strong> P-Sätze.<br />
<strong>Praktikum</strong>sbegleitend finden in enger Anlehnung an die <strong>Praktikum</strong>saufgaben fünf<br />
Seminare statt:<br />
1. Eigenschaften, Synthese <strong>und</strong> Charakterisierung von Nanopartikeln (2 Seminare)<br />
2. Komplexverbindungen - Bindung, Struktur <strong>und</strong> Eigenschaften<br />
3. Strukturuntersuchung mit Röntgenstrahlung<br />
4. Thermische Analyse<br />
allgemeine Literatur:<br />
G. Brauer, Handbuch der präparativen anorganischen <strong>Chemie</strong>, Emke Verlag,<br />
Stuttgart 1975<br />
G. Jander, E. Blasius, Einführung in das anorganisch-chemische <strong>Praktikum</strong>, S.Hirzel<br />
Verlag, Stuttgart 1990<br />
G. Jander, E. Blasius, Lehrbuch der analytischen <strong>und</strong> präparativen anorganischen<br />
<strong>Chemie</strong>, S. Hirzel Verlag, Stuttgart 1995<br />
3
D. F. Shriver, P. W. Atkins, C. H. Langford, Anorganische <strong>Chemie</strong> – ein weiterführendes<br />
Lehrbuch, VCH, 1992<br />
A.R. West, Gr<strong>und</strong>lagen der Festkörperchemie, VCH, 1992<br />
4
Seminare<br />
1. Seminar: Nanomaterialien I<br />
<br />
<br />
<br />
<br />
<br />
Wirkungsfelder von Nanomaterialien<br />
Eigenschaften von Nanomaterialien<br />
Syntheseprinzipien<br />
Charakterisierungsmethoden, Dynamische Lichtstreuung<br />
ZnO <strong>und</strong> ZnO:Al: lumineszierende Nanopartikel <strong>und</strong> transparent leitfähige<br />
Oxide<br />
Literatur: Lagaly, Schulz, Zimehl: Dispersionen <strong>und</strong> Emulsionen<br />
2. Seminar: Nanomaterialien II<br />
<br />
<br />
Charakterisierungsmethoden von Nanomaterialien<br />
Dynamische Lichtstreuung, Methoden <strong>und</strong> Auswertung<br />
Literatur: Dörfler: Grenzflächen <strong>und</strong> kolloiddisperse Systeme<br />
3. Seminar: Komplexverbindungen - Bindung, Struktur <strong>und</strong><br />
Eigenschaften<br />
<br />
<br />
<br />
<br />
<br />
Gr<strong>und</strong>züge der Ligandenfeldtheorie<br />
Magnetische Eigenschaften von Komplexverbindungen<br />
Optische Eigenschaften <strong>und</strong> spektrochemische Reihe<br />
Koordinationszahl <strong>und</strong> Symmetrie<br />
Thermodynamische <strong>und</strong> kinetische Stabilität von Komplexverbindungen<br />
Literatur: Kapitel „Übergangsmetallkomplexe“ im Lehrbuch Anorganische <strong>Chemie</strong><br />
von Shriver, Atkins <strong>und</strong> Langford, WILEY-VCH<br />
5
4. Seminar: Strukturuntersuchung mit Röntgenstrahlung<br />
<br />
<br />
<br />
<br />
<br />
Kristallsysteme <strong>und</strong> Bravaisgitter<br />
Wiederholung ausgewählter Kristallstrukturen<br />
Röntgenbeugungs-Techniken<br />
Pulverdiffraktometrie<br />
Auswertung von Röntgenpulverdiffraktogrammen<br />
Literatur: West: Festkörperchemie<br />
zur Ergänzung: Atkins u. a.: Anorganische <strong>Chemie</strong>, Kap. 4, Kap. 18.<br />
5. Seminar: Thermische Analyse<br />
<br />
<br />
<br />
Thermodynamische Gr<strong>und</strong>lagen<br />
Methoden (DSC, DTA, TG, DTG)<br />
Auswertung von Ergebnissen thermischer Analysen (insbesondere selbst<br />
synthetisierte Proben)<br />
Literatur: Autorenkollektiv: Analytikum , Herausgeber: Klaus Doerffel, Rudolf Geyer,<br />
Helmut Müller, 9. Auflage 1994, Kap. 7: Thermische Analyse<br />
M. Otto: Analytische <strong>Chemie</strong><br />
West: Festkörperchemie<br />
6
„<strong>Chemie</strong> des Kupfers“<br />
Kupfer gehört zu den technisch bedeutendsten Metallen, es ist als relativ weiches<br />
Metall gut formbar <strong>und</strong> zeigt eine interessante <strong>Chemie</strong>, die in einem anorganischen<br />
<strong>Praktikum</strong> nicht fehlen sollte.<br />
http://www.planeterde.de/Members/ http://www.seilnacht.com/Lexikon/komplex.html http://de.academic.ru/dic.nsf/dewiki/806129<br />
holgerkroker/0811/kupfersulfat/view<br />
Mit diesem <strong>Praktikum</strong>sversuch soll einerseits die <strong>Chemie</strong> des Kupfers über mehrere<br />
Reaktionsschritte erk<strong>und</strong>et werden als auch ein Bewusstsein für die dringende<br />
Notwendigkeit des Umweltschutzes geschaffen werden. Vermittelt werden sollen<br />
anhand dieses geschlossenen Stoffkreislaufes wichtige Prinzipien der Synthese <strong>und</strong><br />
Komplexchemie sowie die Stoffkenntnisse des Elements Kupfer <strong>und</strong> seiner<br />
Verbindungen.<br />
A1: Darstellung von [Cu(NH 3 ) 4 ]SO 4 * H 2 O<br />
5 g CuSO 4 ⋅ 5H 2 O werden unter Erwärmen in 10 ml H 2 O gelöst <strong>und</strong> mit 20 ml konz.<br />
Ammoniaklösung versetzt. (Ein intermediär gebildeter Niederschlag von Cu(OH) 2<br />
geht wieder in Lösung.) Die klare, tiefblaue Lösung wird langsam unter Rühren in 30<br />
ml Ethanol eingetragen. Dabei fällt der Cu-Amminkomplex in Form blauer Kristalle<br />
aus. Er wird abgesaugt <strong>und</strong> dreimal mit jeweils 4 ml Ethanol ausgewaschen. Man<br />
saugt 5 bis 10 Minuten Luft durch den Filterkuchen. Danach ist der Filterkuchen<br />
ausreichend trocken. Der isolierte Komplex wird in Versuch A2 weiterverarbeitet.<br />
7
Auswertung zu A1:<br />
Welcher Komplex wird gebildet (in Wasser <strong>und</strong> wasserfrei)? Geben Sie dazu<br />
auch jeweils die Reaktionsgleichungen mit an!<br />
Begründen Sie die Farbänderung der Lösung bei der Bildung des<br />
Amminkomplexes (Ligandenfeldtheorie, spektrochemische Reihe)!<br />
Warum wird die Löslichkeit des Komplexes durch Zusatz von Ethanol<br />
herabgesetzt?<br />
A2: Rückgewinnung von CuSO 4<br />
Das gesamte Produkt aus Versuch A2 wird in ca. 15 mL Wasser gelöst <strong>und</strong><br />
anschließend wird die Lösung in 2 Bechergläser verteilt.<br />
In die eine Hälfte tropft man so lange verd. Schwefelsäure, bis die tiefblaue Farbe<br />
gerade verschw<strong>und</strong>en ist <strong>und</strong> gibt weitere 5 ml Säure hinzu. Dann trägt man<br />
Eisenpulver in kleinen Portionen ein, um elementares Kupfer auszuflocken<br />
(Berechnen Sie die benötigte Menge Eisenpulver für die eingesetzte Menge<br />
[Cu(NH 3 ) 4 ]SO 4 * H 2 O mit einem Überschuss von 20%). Nach 10 min Rühren wird die<br />
überstehende Lösung abgesaugt. Der Kupferschlamm wird mit 20 ml verd. HCl unter<br />
dem Abzug aufgekocht, um anhaftendes Eisen oxidativ abzulösen. Die wässrige,<br />
überstehende Lösung wird abdekantiert <strong>und</strong> verworfen. Dieser Vorgang wird<br />
solange wiederholt, bis keine Gasentwicklung mehr zu beobachten ist, mindestens<br />
jedoch zweimal. Dann wird das Kupfer mehrfach mit Wasser gewaschen, auf<br />
Filterpapier gegeben <strong>und</strong> zum Trocknen an der Luft liegengelassen. Eine kleine<br />
Probenmenge wird für die Aufnahme eines Röntgendiffraktogramms entnommen.<br />
Später wird es in 20 ml verd. Schwefelsäure suspendiert. Beim Zutropfen von 20 ml<br />
3 % H 2 O 2 <strong>und</strong> unter ständigem Rühren mit einem Glasstab geht es unter Bildung<br />
von CuSO 4 in Lösung, aus der es nach dem Eindampfen kristallisiert <strong>und</strong> gewogen<br />
wird.<br />
Auswertung zu A2:<br />
Sie erhalten das Röntgenpulverdiffraktogramm des elementaren Kupfer.<br />
Werten Sie dieses unter folgenden Gesichtspunkten aus:<br />
8
- Reinheit des Produktes<br />
- Zuordnung der Röntgenreflexe (rechnergestützte Phasenanalyse)<br />
Weshalb kann anhaftendes Eisen in HCl aufgelöst werden <strong>und</strong> Cu nicht? Auf<br />
welcher Reaktion beruht die Gasentwicklung? Begründen Sie den Sachverhalt<br />
eindeutig!<br />
A3: Rückgewinnung von CuSO 4<br />
Die andere Hälfte der blauen Kupferlösung wird im Abzug mit 20 ml verd. NaOH versetzt<br />
<strong>und</strong> langsam aufgekocht. Zunächst bildet sich ein gelartiger, blaugrüner Niederschlag<br />
(Zusammensetzung?), der nach etwa 10 min Rühren in der Siedehitze in<br />
schwarzes CuO übergeht (Gelegentlich wird etwas Wasser nachdosiert, um die<br />
beim Sieden auftretenden Verdampfungsverluste zu kompensieren). Dieses wird<br />
heiß abfiltriert. Der Filterkuchen wird mehrfach mit kleinen Portionen Wasser<br />
gewaschen. Das ablaufende Waschwasser wird verworfen. Das CuO wird direkt<br />
durch Auftropfen von etwa 15 ml verd. Schwefelsäure als CuSO 4 vom Filterpapier<br />
abgelöst <strong>und</strong> dieses mit etwas Wasser nachgespült. Aus dem klaren Filtrat werden<br />
durch Eindampfen Kupfersulfatkristalle gewonnen <strong>und</strong> gewogen.<br />
Allgemeine Auswertung zum Versuch „<strong>Chemie</strong> des Kupfers“<br />
Skizzieren Sie die ablaufenden Reaktionen des Kupferkreislaufes in Form<br />
eines Doppelkreislaufes! Geben Sie die Art der Reaktionen an<br />
(Komplex/Redox/Pyrolyse u.ä.)! Schreiben Sie alle Reaktionsgleichungen auf!<br />
Berechnen Sie die Ausbeute des zurück gewonnenen Kupfersulfates.<br />
Empfohlene Literatur:<br />
Wiskamp et al., <strong>Chemie</strong> in unserer Zeit 1993, 27, 48.<br />
Kapitel „Übergangsmetallkomplexe“ im Lehrbuch Anorganische <strong>Chemie</strong> von<br />
Shriver, Atkins <strong>und</strong> Langford, WILEY-VCH<br />
9
„Lumineszierende Nanopartikel <strong>und</strong> leitfähige<br />
Dünnschichten“<br />
(2 <strong>Praktikum</strong>stage)<br />
Durch die Entdeckung des Größenquantisierungseffektes ist den lumineszierenden<br />
Halbleiternanopartikeln in den letzten Jahren eine besondere Aufmerksamkeit zu teil<br />
geworden. Durch Verkleinerung der Partikelgröße kommt es solchen Nanopartikeln<br />
zu einer Aufweitung der Bandlücke. Dieser Effekt beruht auf der Tatsache, dass<br />
durch die endliche Anzahl von Atomen in Halbleiternanopartikeln die Energieniveaus<br />
nicht mehr mit Bändern beschrieben werden <strong>und</strong> eine Diskretisierung der<br />
energetischen Zustände resultiert.<br />
Abb.:1 links: Diskretisierung der Energieniveaus, daraus folgt die Aufweitung der Bandlücke<br />
(Größenquantisierungseffekt). Es wird höherenergetische Strahlung zur Anregung eines Elektrons<br />
benötigt. rechts: Bandlücken verschiedener Verbindungen in Abhängigkeit vom Partikeldurchmesser.<br />
Zinkoxid ist ein Halbleiter, der in der Wurtzitstruktur<br />
kristallisiert. Mit einer weiten Bandlücke von 3,37 eV ist<br />
ZnO farblos <strong>und</strong> wird aufgr<strong>und</strong> der UV-Absorption unterhalb<br />
von 380 nm Wellenlänge in vielen Anwendungen als UV-<br />
Absorber genutzt. Die Bandlückenenergie <strong>und</strong> damit die<br />
10
UV-Absorptionsbande verschieben sich für ZnO-Nanopartikel aufgr<strong>und</strong> des<br />
Größenquantisierungseffektes.<br />
Informieren Sie sich im Vorfeld dieses Versuchs anhand der angegebenen<br />
Literaturstellen bzw. einschlägiger Fachbücher über folgende Versuchsinhalte:<br />
Lumineszierende Nanopartikel; u.a. was besagt der<br />
Größenquantisierungseffekt<br />
Transparent leitfähige Oxide, Anwendungsmöglichkeiten<br />
Möglichkeiten zur Synthese von Nanopartikeln (Mikroemulsionen,<br />
Phasentransfer, kontrollierter Fällung)<br />
Untersuchung von Nanopartikeln mit der Röntgenpulverdiffraktometrie:<br />
Warum kann diese Methode angewendet werden <strong>und</strong> welche Informationen<br />
sind ableitbar (Kristallinität); woran können nanoskalige Phasen erkannt<br />
werden; Kristallitgrößenbestimmung nach Scherrer!<br />
weitere Charakterisierung von Nanopartikeln <strong>und</strong> -kompositen mit Hilfe von<br />
UV/VIS-Spektroskopie <strong>und</strong> Dynamischer Lichtstreuung sowie mikroskopischen<br />
(Rasterelektronenmikroskopie, Rasterkraftmikroskopie) Methoden<br />
Machen Sie sich mit den Reaktionen/Strukturen sowie Gefahrenpotentialen<br />
<strong>und</strong> den daraus resultierenden Sicherheitsvorkehrungen der von Ihnen<br />
verwendeten Chemikalien vertraut.<br />
Lumineszierende Nanopartikel<br />
B1: Darstellung von ZnO in Ethanol<br />
4,4 g Zinkacetatdihydrat werden in 200 mL Ethanol (absolut) unter Rückflussbedingungen<br />
gelöst (90 °C, Temperaturkontrolle!). Informieren Sie sich im Vorfeld<br />
zum Aufbau einer Syntheseapparatur unter Rückflussbedingungen!<br />
Separat werden 70 mL einer 0,2 M NaOH Lösung in Ethanol hergestellt (0,56 g<br />
NaOH-Pulver auf 70 mL) (Im Ultraschallbad lösen). Die Zn(Ac) 2 Lösung wird auf 40°C<br />
abgekühlt. Während des Abkühlens (bei ca. 60 °C) wird die NaOH Lösung zur ZnAc 2<br />
11
Lösung zugegeben <strong>und</strong> die gesamte Lösung für 120 min bei 40 °C gerührt<br />
(Temperaturkontrolle!). Kontrollieren Sie die Dispersion auf Eintrübung während des<br />
Rührens.<br />
Nach 120 Minuten wird eine Probe entnommen <strong>und</strong> die Größe der gebildeten<br />
Partikel mittels dynamischer Lichtsstreuung untersucht. Bestimmen Sie die<br />
Absorptionsbande der Partikel mittels UV/Vis Spektroskopie.<br />
Auswertung zu B1:<br />
Bestimmen Sie die Größe der Partikel in Dispersion mittels DLS. Weshalb<br />
sind die gebildeten Partikel in der Dispersion mit bloßem Auge nicht<br />
erkennbar?<br />
Bestimmen Sie die Absorptionsbande der Partikel mittels UV/Vis<br />
Spektroskopie.<br />
Beobachten Sie die Fluoreszenz unter UV- Bestrahlung. Notieren Sie die<br />
Farbe. Bei welcher Wellenlänge würde die Fluoreszenzbande in einem<br />
Fluoreszenzspektrum liegen? Wie kommt die Lumineszenz der ZnO-Partikel<br />
zustande.<br />
B2: Isolierung der ZnO-Nanopartikel<br />
Die Partikeldispersion wird mit ca. 4 Vol.-% Oleylamin versetzt. Es bildet sich ein<br />
weißer Niederschlag, der durch Zentrifugation von der überstehenden Lösung<br />
abgetrennt werden kann. Nach zweimaligem Waschen mit Ethanol wird der<br />
Niederschlag auf einem Filterpapier bei Raumtemperatur getrocknet <strong>und</strong> gewogen.<br />
Ein UV/Vis Spektrum <strong>und</strong> ein Röntgendiffraktogramm des Feststoffs werden<br />
aufgenommen.<br />
Auswertung zu B2:<br />
Bestimmen Sie die Ausbeute an ZnO Nanopartikeln im Verhältnis zur<br />
eingesetzten Eduktmenge. Wodurch kann die Ausbeuteberechnung zu<br />
höheren Werten verfälscht werden?<br />
12
Bestimmen Sie die Lage der Absorptionsbande der ZnO-Nanopartikel.<br />
Vergleichen Sie diese mit dem Ergebnis des makrokristallinen Materials (siehe<br />
B4). Erklären Sie den Effekt, der für die Verschiebung der Bande<br />
verantwortlich ist.<br />
Werten Sie das aufgenommene Röntgendiffraktogramm hinsichtlich der<br />
Reinheit des Produktes, Zuordnung der Röntgenreflexe <strong>und</strong> Größe der partikel<br />
aus.<br />
B3: Redispergierung der ZnO-Partikel<br />
Der in Versuch B2 erhaltene Feststoff kann in Pentan redispergiert werden. Zur<br />
Redispergierung werden 10 g Pentan zu 0,3 g des Feststoffs gegeben <strong>und</strong> daraus<br />
durch Schütteln eine klare Dispersion gebildet. Die Größe der gebildeten Partikel<br />
wird mittels dynamischer Lichtstreuung untersucht.<br />
Durch Tauchbeschichtung (per Hand) werden dünne Schichten auf Objetträgergläser<br />
aufgetragen. Zur Vorbereitung der Glassubstrate werden Objetträgergläser (Na-<br />
Silikatgläser) in Aceton im Ultraschallbad vorbehandelt. Der beschichtete<br />
Objektträger wird anschließend in einen auf 500 °C vorgeheizten Kammerofen<br />
überführt <strong>und</strong> dort für 10 min belassen. Nach dem Abkühlen wird mit einem<br />
Digitalmultimeter der elektrische Widerstand der erzeugten Schicht gemessen. Die<br />
Lumineszenz der Schicht wird unter UV-Bestrahlung beobachtet.<br />
Auswertung zu B3:<br />
Bestimmen Sie die Größe der redispergierten ZnO-Partikel in der DLS.<br />
War eine agglomerationsfreie Redispergierung erfolgreich (Vergleich mit DLS<br />
Daten aus Versuch B1)?<br />
B4: ZnO Bulk Material<br />
2,2g Zinkacetatdihydrat werden in 100mL Wasser gelöst. Zu dieser Lösung werden<br />
unter Rühren 60 mL einer 0,4 M NaOH Lösung (in H 2 O) gegeben. Es fällt ein weißer<br />
13
Niederschlag von Zn(OH) 2 . Der Niederschlag wird über einem Büchnertrichter<br />
abgesaugt <strong>und</strong> der noch etwas feuchte Rückstand in einen Pyrolantiegel gegeben.<br />
Man erwärmt langsam mit dem Brenner. Die Verbrennung beginnt am Tiegelrand<br />
<strong>und</strong> schreitet – unter Aufglühen - bis zur Tiegelmitte fort. Es entsteht Zinkoxid. Nach<br />
weitgehender Abkühlung wird der Pyrolantiegel mit dem Produkt in einen<br />
Kammerofen überführt <strong>und</strong> auf 50 0°C erhitzt. Nach 60 Minuten kann der Tiegel aus<br />
dem Ofen entnommen werden <strong>und</strong> auf Raumtemperatur abgekühlt werden.<br />
Bestimmen Sie die Lage der Absorptionsbande mittels UV/Vis Spektroskopie.<br />
Auswertung zu B4:<br />
Bestimmen Sie die Ausbeute an erhaltenem Produkt im Verhältnis zur<br />
eingesetzten Menge Edukt.<br />
Vergleichen Sie die Lage der Absorptionsbande aus der UV/Vis Spektroskopie<br />
mit den von Ihnen hergestellten ZnO Nanopartikeln.<br />
Leitfähige Dünnschichten (Tag 2)<br />
C1: Leitfähige Schichten aus ZnO:Al<br />
2,2 g Zinkacetatdihydrat <strong>und</strong> 1 mL 3-Amino-1-propanol werden in 14 mL Ethanol<br />
(absolut) gelöst. 0,2 g AlCl 3 in 4 mL Ethanol werden zur Dotierung zugegeben. Die<br />
Lösung wird in eine Küvette für eine Tauschbeschichtung überführt. Zur<br />
Vorbereitung der Glassubstrate werden Objetträgergläser (Na-Silikatgläser) 15 min in<br />
Aceton im Ultraschallbad vorbehandelt. Die vorbehandelten Glassubstrate werden an<br />
einer Tauschbeschichtungsanlage fixiert <strong>und</strong> in die Küvette mit der hergestellten<br />
Zn/Al-Lösung getaucht. Bei einer Geschwindigkeit von 6 mm/s werden die<br />
Glassubstrate aus der Lösung gezogen <strong>und</strong> direkt im Anschluss in einen<br />
Kammerofen überführt, der auf eine T von 500 °C vorgeheizt wurde. Die Proben<br />
werden für 10 min. im Ofen belassen <strong>und</strong> anschließend auf Raumtemperatur<br />
abgekühlt. Das Beschichtungsverfahren (inkl. Tempern) wird noch zweimal<br />
wiederholt. Mit einem Digitalmultimeter wird der elektrische Widerstand der<br />
14
erzeugten Schicht gemessen. Die Transparenz der Probe wird mittels UV/Vis<br />
Spektroskopie bestimmt.<br />
C2: Leitfähige Schichten aus ZnO:Sb<br />
In einem Maßkolben werden 0,95 g (5 mmol) SnCl2 in 15 ml absoluten Ethanol<br />
aufgelöst <strong>und</strong> auf 80 °C erhitzt. Für die Dotierung mit Antimon werden 0,5 ml einer<br />
0,5 M ethanolischen SbCl3-Lösung zur ethanolischen SnCl 2 -Lösung gegeben <strong>und</strong> für<br />
5 min gerührt. Nach Zutropfen von 0,58 g (5 mmol) Diacetonalkohol wird das<br />
Reaktionsgemisch mit absolutem Ethanol auf 25 ml aufgefüllt. Dieses Gemisch wird<br />
anschließend so lange bei 80 °C erwärmt, bis der eventuell entstandene<br />
Niederschlag vollständig war. Die erkaltete Vorläuferlösung wird durch einen PVDF<br />
Die Vorläuferlösung wird in eine Küvette gefüllt, der präparierte Objektträger<br />
komplett eingetaucht <strong>und</strong> anschließend mit einer Geschwindigkeit von 2,4 mm/sec<br />
aus der Flüssigkeit herausgezogen. Dabei sollte darauf geachtet werden, dies<br />
möglichst ohne Erschütterungen <strong>und</strong> Luftströme zu gestalten, um Inhomogenitäten<br />
auf der Schicht zu vermeiden. Nachdem die Lösung getrocknet ist wird das Substrat<br />
10 min bei 600 °C getempert werden. Zur Verbesserung der Leitfähigkeit wird die<br />
Beschichtung mehrfach wiederholt. Es werden mit dieser Prozedur transparente <strong>und</strong><br />
leitfähige Substrate erhalten. Mit einem Digitalmultimeter wird der elektrische<br />
Widerstand der erzeugten Schicht gemessen. Die Transparenz der Probe wird<br />
mittels UV/Vis Spektroskopie bestimmt.<br />
Auswertung zu C1 <strong>und</strong> C2:<br />
Vergleichen Sie die Leitfähigkeit der in Versuch C3 erhaltenen Schichten mit<br />
der Leitfähigkeit der dotierten Schichten.<br />
Wodurch kommt die Leitfähigkeit beim ZnO:Al zustande?<br />
ZnO:Al wird als transparent leitfähiges Oxid in dünnen Schichten auf<br />
Glassubstraten industriell vertrieben. Informieren Sie sich über andere TCO<br />
(transparent conductive oxide) Materialien, welche Oxide finden hauptsächlich<br />
Anwendung in der Photovoltaikbranche?<br />
15
Empfohlene Literatur:<br />
L. Spanhel, M. A. Anderson, J. Am. Chem. Soc. 1991, 113, 2826-33.<br />
H. Weller, Angew. Chem. 1993, 105, 43-55.<br />
A. van Dijken, E. A. Meulenkamp, D. Vanmaekelbergh, A. Meijerink, J. Lumin.<br />
2000, 90, 123-128.<br />
A. van Dijken, E. A. Meulenkamp, D. Vanmaekelbergh, A. Meijerink, J. Lumin.<br />
2000, 87-89, 454-456.<br />
16
„Größenquantisierungseffekt <strong>und</strong> Metal-Organic<br />
Frameworks“<br />
(2 <strong>Praktikum</strong>stage)<br />
a)<br />
b) c) d)<br />
e)<br />
BiOI Nanopartikel mit verschiedenen<br />
Partikeldurchmesser<br />
Cu 3 (BTC) 2 (Cu:blau, C: grau, O: rot)<br />
Der Einsatz von Nanopartikeln unterschiedlichster Zusammensetzung ist heutzutage<br />
nicht nur für die Forschung von großem Interesse, sondern bereits aus vielen<br />
Bereichen des alltäglichen Lebens längst nicht mehr wegzudenken. Winzige<br />
anorganische Partikel werden zur Verbesserung der Qualität vielen industriellen<br />
Produkten in der Baustoffindustrie, der Kosmetikindustrie, in Farben <strong>und</strong> auch in<br />
Lebensmitteln zugesetzt. Nasschemisch hergestellte Halbleiter-Nanopartikeldispersionen<br />
haben den Vorteil, dass sie einfach hergestellt werden können <strong>und</strong> ihre<br />
Bandlücke durch die Syntheseparameter gut kontrollierbar ist.<br />
Informieren Sie sich im Vorfeld dieses Versuchs anhand der angegebenen<br />
Literaturstellen bzw. einschlägiger Fachbücher über folgende Versuchsinhalte:<br />
Halbleiter-Nanopartikel; u.a. was besagt der Größenquantisierungseffekt<br />
Möglichkeiten zur Synthese von Nanopartikeln (Mikroemulsionen,<br />
Phasentransfer, kontrollierter Fällung)<br />
Untersuchung von Nanopartikeln mit der Röntgenpulverdiffraktometrie:<br />
Warum kann diese Methode angewendet werden <strong>und</strong> welche Informationen<br />
sind ableitbar (Kristallinität); woran können nanoskalige Phasen erkannt<br />
werden; Kristallitgrößenbestimmung nach Scherrer!<br />
17
weitere Charakterisierung von Nanopartikeln <strong>und</strong> -kompositen mit Hilfe von<br />
UV/VIS-Spektroskopie <strong>und</strong> Dynamischer Lichtstreuung sowie mikroskopischen<br />
(Rasterelektronenmikroskopie, Rasterkraftmikroskopie) Methoden<br />
Machen Sie sich mit den Reaktionen/Strukturen sowie Gefahrenpotentialen<br />
<strong>und</strong> den daraus resultierenden Sicherheitsvorkehrungen der von Ihnen<br />
verwendeten Chemikalien vertraut.<br />
Veranschaulichung des Größenquantisierungseffekts<br />
D1: Darstellung von Bismutoxyiodid<br />
Zunächst werden wässrige Lösungen von KI (M = 166,0 g/mol) <strong>und</strong> Bi(NO 3 ) 3<br />
(Pentahydrat: M = 485,07 g/mol) in der jeweiligen Konzentration von c = 0,1 mol/l<br />
hergestellt (je 10 ml). Um das schwerlösliche Bi(NO 3 ) 3 als BiO + in Wasser lösen zu<br />
können, wird es mit stöchiometrischen Mengen Mannit unter Zugabe von maximal<br />
1-2 Tropfen Wasser verrieben, bis eine breiige Masse entsteht, die im Anschluss<br />
unter Rühren gelöst werden kann. Im Anschluss daran werden die Mikroemulsionen<br />
mit Einstellung der entsprechenden R W -Werte 2 <strong>und</strong> 8 hergestellt. Für R w = 2 erfolgt<br />
der zweifache Ansatz. Es werden dafür n-Heptan <strong>und</strong> die jeweilige wässrige Lösung<br />
vorgelegt <strong>und</strong> tropfenweise Marlophen NP5 (RO(CH 2 CH 2 O) x H, x = 5, R =<br />
nonylphenyl, M = 440 g/mol) unter ständigem Rühren hinzugegeben, bis die Lösung<br />
klar <strong>und</strong> transparent erscheint. Anschließend wird die zusätzlich nötige Menge<br />
Marlophen NP5 zum Einstellen der gewünschten Rw-Werte berechnet <strong>und</strong><br />
zugegeben. Man erhält somit pro Rw-Wert je eine Mikroemulsion mit Bi(NO 3 ) 3·5H 2 O<br />
<strong>und</strong> eine weitere Mikroemulsion mit KI. Die Zusammensetzungen der<br />
Mikroemulsionen sind in der folgenden Tabelle aufgeführt.<br />
R W -Wert Wässrige Heptan [g] Viskosität cP]<br />
Phase [g]<br />
2 0,5 15 1,354<br />
8 1 30 0,788<br />
18
Die notwendige Menge Tensid wird über die Formel für den R w -Wert berechnet:<br />
n(H O)<br />
R 2<br />
w<br />
n(Tensid)<br />
Zur Charakterisierung der Mizellgröße werden die jeweiligen Mikroemulsionen<br />
mittels DLS untersucht. Dazu werden ja 5 ml der Lösung verwendet.<br />
Der Einfluss der unterschiedlichen R W -Werte wird bereits an der Färbung der<br />
Mikroemulsionen nach Zusammengabe deutlich. Zur Kontrolle der Mizellgrößen<br />
werden erneut DLS-Messungen nach fünf Minuten rühren durchgeführt. Des<br />
Weiteren werden von diesen Lösungen UV/Vis-Spektren aufgenommen. Nach einer<br />
Woche Rühren werden die Bismutoxyiodide abzentrifugiert, mehrfach mit Heptan<br />
<strong>und</strong> Ethanol gewaschen <strong>und</strong> mittels Röntgenpulverdiffraktometrie charakterisiert.<br />
Des Weiteren soll zur Verdeutlichung des Größenquantisierungseffektes<br />
makrokristallines Bismutoxyiodid hergestellt werden. Dazu werden 1 g<br />
Bi(NO 3 ) 3·5H 2 O in 1,5 g Eisessig gelöst. Die Lösung wird unter Rühren in eine kalte<br />
Lösung von 0,35 g KI <strong>und</strong> 0,5 g Natriumacetat-Trihydrat in 20 ml Wasser gegeben.<br />
Der ziegelrote Niederschlag wird abfiltriert, gewaschen <strong>und</strong> getrocknet. Das Produkt<br />
wird ebenfalls mittels Röntgenpulverdiffraktometrie charakterisiert.<br />
Auswertung zu D1:<br />
Stellen Sie die angewendeten Synthesestrategien vor <strong>und</strong> beschreiben Sie die<br />
verwendete Stabilisierungstechnik (BiOI)<br />
Interpretieren (sowie ggf. vergleichen) Sie die erhaltenen Ergebnisse:<br />
Dynamische Lichtstreuung: Beurteilen Sie die Qualität der erhaltenen<br />
Partikelgrößenverteilung graphisch (Größe + PDI) <strong>und</strong> vergleichen Sie die<br />
Ergebnisse aus der Mikroemulsionsmethode in den einzelnen<br />
Mikroemulsionen vor <strong>und</strong> nach der Zusammengabe.<br />
Röntgendiffraktometrie: Vergleichen Sie die Röntgendiffraktogramme der<br />
Nanopartikel. Ordnen Sie die Reflexe den entsprechenden Phasen zu. Führen<br />
Sie eine Kristallitgrößenberechnung nach Scherrer durch.<br />
19
D<br />
Kristallit<br />
<br />
B<br />
K<br />
cos <br />
Kristallit<br />
Danach berechnet sich der Kristallitdurchmesser D aus der Halbwertsbreite B<br />
(in Radianten) eines bestimmten Reflexes (bei dem Beugungswinkel ). Der<br />
Formfaktor K hat einen Wert zwischen 0,87 <strong>und</strong> 1,39 <strong>und</strong> ist 0,9 für<br />
kugelförmige Kristallite. Schätzen Sie die Reflexverbreiterung B<br />
gegebenenfalls aus der graphischen Darstellung der Diffraktogramme ab.<br />
Welche Effekte können zusätzlich zu einer Reflexverbreiterung führen <strong>und</strong><br />
müssen daher in einer sorgfältigen Analyse berücksichtigt werden?<br />
Vergleichen Sie den mittels DLS bestimmten Partikeldurchmesser mit den<br />
ermittelten Kristallitgrößen aus der Scherrergleichung.<br />
UV/VIS –Spektroskopie: Werten Sie die UV/VIS-Spektren hinsichtlich der<br />
Größe der Bandlücke für die verschiedenen BiOI-Ansätze aus.<br />
Empfohlene Literatur:<br />
<br />
Vorlesung Prof. Kaskel „Anorganische Materialien SS 2013“, davon<br />
besonders das Kapitel „Nanomaterialien VL 8“ bzw. „Nanokomposites VL<br />
11“, http://www.chm.tu-dresden.de/ac1/vorlesungen.shtml<br />
<br />
Henle, J., et al., Nanosized BiOX (X = Cl, Br, I) Particles Synthesized in<br />
Reverse Microemulsions. Chem. Mater. 2007, 19, 366-373.<br />
<br />
Henle, J., et al., Preparation of photochromic transparent BiOX (X = Cl,<br />
I)/PLA nanocomposite materials via microemulsion polymerization. J.<br />
Mater. Chem. 2007, 17, 4964-4971<br />
Synthese von Metal-Organic Frameworks<br />
Poröse Substanzen stoßen seit einigen Jahren auf ein enormes Interesse seitens der<br />
<strong>Chemie</strong>, der Physik <strong>und</strong> der Materialwissenschaften. Die Synthese <strong>und</strong><br />
Charakterisierung von kontinuierlichen ein-, zwei- <strong>und</strong> dreidimensionalen Netzwerken<br />
war Gegenstand intensiver <strong>und</strong> erfolgreicher Untersuchungen. Eingehend erforscht<br />
20
wurden Koordinationsverbindungen mit kontinuierlichen Strukturen, insbesondere<br />
solche, deren Rückgrat aus Metallionen (häufig Übergangsmetallionen) als<br />
Konnektoren <strong>und</strong> Liganden (N-, O-Donoren) als Linkern aufgebaut sind („Koordinationspolymere“).<br />
Metal-Organic Frameworks (MOFs) weisen sehr große Oberflächen <strong>und</strong> Mikroporenvolumina<br />
auf. Die Einsatzmöglichkeiten für solche Verbindungen, insbesondere in<br />
der Stofftrennung, der Gasspeichung <strong>und</strong> der heterogenen Katalyse als Katalysator<br />
selbst oder auch als Trägermaterial, zeichnen sich bereits ab.<br />
Im Rahmen dieses <strong>Praktikum</strong>s sollen die Gr<strong>und</strong>lagen synthetischer Arbeiten zur Herstellung<br />
<strong>und</strong> Anwendung poröser Materialien sowie deren analytische Untersuchungen<br />
einführend dargelegt werden. Hierbei sollen MOFs synthetisiert <strong>und</strong> mithilfe<br />
der Röntgenpulverdiffraktometrie sowie Stickstoffphysisorptionsmessungen untersucht<br />
werden.<br />
Informieren Sie sich im Vorfeld dieses Versuchs anhand der angegebenen<br />
Literaturstellen bzw. einschlägiger Fachbücher über folgende Versuchsinhalte:<br />
Informieren Sie sich vorab über den Aufbau von MOFs! Welche Arten von<br />
Linkern <strong>und</strong> Konnektoren sind Ihnen bekannt? Legen Sie dabei besonderen<br />
Wert auf die Verbindungen Cu 3 (BTC) 2 <strong>und</strong> FeBTC-Gel, da Sie diese im<br />
<strong>Praktikum</strong> herstellen <strong>und</strong> untersuchen werden!<br />
Wie kann man poröse Stoffe nach UIPAC einteilen? Welche Klassifikation gibt<br />
es für die verschiedenen Isothermentypen? Welche Messprinzipien für<br />
Adsorptionsuntersuchungen sind Ihnen bekannt?<br />
Informieren Sie sich über Gr<strong>und</strong>lagen der Röntgenpulverdiffraktometrie!<br />
E1: Darstellung von Cu 3 (BTC) 2 (H 2 O) 3 * x H 2 O<br />
Es werden 2,05 g Cu(NO 3 ) 2 ⋅ 3 H 2 O in 20 ml Wasser <strong>und</strong> 1,34 g Trimesinsäure in 40<br />
ml EtOH gelöst. Die beiden Lösungen gibt man in eine 100 ml Schottflasche. Der<br />
Ansatz wird im Trockenschrank bei 80 °C für eine Woche erhitzt. Nach Abkühlung<br />
auf Raumtemperatur wird das Lösungsmittel entfernt, die Kristalle mit Ethanol/H 2 O<br />
21
gewaschen <strong>und</strong> bei 80 °C im Trockenschrank getrocknet. Die Probe wird mithilfe der<br />
Röntgenpulverdiffraktometrie sowie einer Stickstoffphysisorptionsmessung untersucht.<br />
E2: Synthese eines FeBTC-Gels<br />
Eine Lösung bestehend aus 0,84 g Trimesinsäure in 20 ml Ethanol wird zu einer<br />
Lösung aus 2,42 g Fe(NO 3 ) 3 · 9 H 2 O in 20 ml Ethanol gegeben. Das erhaltene Gel<br />
wird 3 Tage mittels Soxhlet-Extraktion gereinigt <strong>und</strong> anschließend im<br />
Trockenschrank bei 80 °C für 4 Tage getrocknet. Die Probe wird mithilfe der<br />
Röntgenpulverdiffraktometrie sowie einer Stickstoffphysisorptionsmessung untersucht.<br />
Auswertung zu E1 <strong>und</strong> E2:<br />
Beschreiben Sie kurz die von Ihnen durchgeführten Synthesen <strong>und</strong> Methoden.<br />
Werten Sie die Ergebnisse der Synthesen anhand der Charakterisierungsmethoden<br />
aus (Röntgenpulverdiffraktometrie, Stickstoffphysisorption).<br />
Geben Sie die spezifische Oberflächen der gemessenen Probe an <strong>und</strong> stellen<br />
Sie die Isothermen grafisch dar. Diskutieren Sie die erhaltenen Ergebnisse.<br />
Vergleichen Sie Ihre Werte mit denen der Literatur.<br />
Empfohlene Literatur:<br />
S. Kaskel, Nachrichten aus der <strong>Chemie</strong> 2005, 53, 394.<br />
S. Kitagawa et al., Angew. Chem. 2004, 116, 2388. (Übersichtsartikel)<br />
K. Schlichte et al., Micropor. Mesopor. Mat., 2004, 73, 81.<br />
M. Lohe, M. Rose, S. Kaskel, Chem. Commun., 2009, 6056.<br />
22
Allgemeine Hinweise zur Protokollanfertigung<br />
Kurze Aufgabenstellung zu jedem Versuch<br />
Versuchsablauf (nachvollziehbar) mit ausführlichen Stichpunkten beschreiben<br />
Keine gr<strong>und</strong>legende Methodenvorstellung (DLS, UV/Vis… )<br />
Ausführliche Auswertung (Ergebnisse/Diskussion)<br />
Kurze Zusammenfassung am Ende<br />
23