Effekt selektiver und nicht selektiver nichtsteroidaler Antiphlogistika ...
Effekt selektiver und nicht selektiver nichtsteroidaler Antiphlogistika ... Effekt selektiver und nicht selektiver nichtsteroidaler Antiphlogistika ...
Material und Methoden 3.3.4.3 Cyclooxygenase 2 Für die immunhistochemische Darstellung der COX-2 wurden in Bouin fixierte Gewebeschnitte verwendet. Nach Entparaffinieren, Überführung in das wässrige Milieu und Blockierung der endogenen Peroxidase mit Hilfe von 3%igem H 2 O 2 (E. Merck KGaA, Darmstadt, Deutschland) wurden die Schnitte drei mal fünf Minuten in PBS gewaschen und anschließend für 10 Minuten in 96-99 °C heißem Ethylendiamintetraacetatpuffer (EDTA-Puffer) zur Demaskierung des Antigens verbracht. Nach Abkühlen auf 60-65 °C erfolgte ein einmaliges Spülen mit PBS und anschließend eine 20-minütige Inkubation mit normalem Ziegenserum um nichtspezifische Antikörperbindungen zu verhindern. Die folgende Inkubation des Primärantikörpers (COX-2, Klon SP21, monoklonal, Kaninchen, Thermo Fisher Scientific GmbH, Dreieich, Deutschland) in einer Dosierung von 1:50 erfolgte über Nacht im Kühlschrank (4 °C), wie in Tabelle1 dargestellt. Am nächsten Tag wurde nach dreimaligem Spülen mit PBS der Sekundärantikörper (Envision Rabbit, aus der Ziege, DAKO, Hamburg, Deutschland), der in einer ready to use Verdünnung vorlag, zugegeben und für 30 Minuten belassen. Nach erneutem Spülen in PBS wurden die Schnitte mit dem chromogenen System DAB (BioGenex, San Ramon, California, USA) unter mikroskopischer Kontrolle bis zu einer adäquaten Farbreaktion behandelt. Nach 10-minütigem Spülen unter fließendem Leitungswasser und Dehydratation wurden die Schnitte mit Eukitt (O. Kindler GmbH, Freiburg, Deutschland) eingedeckt. Die Negativ-Kontrollen wurden mit 1%igem BSA in PBS anstatt des Primärantikörpers inkubiert. Als Isotypenkontrolle wurde IgG aus Kaninchenserum (DAKO, Hamburg, Deutschland) eingesetzt. 72
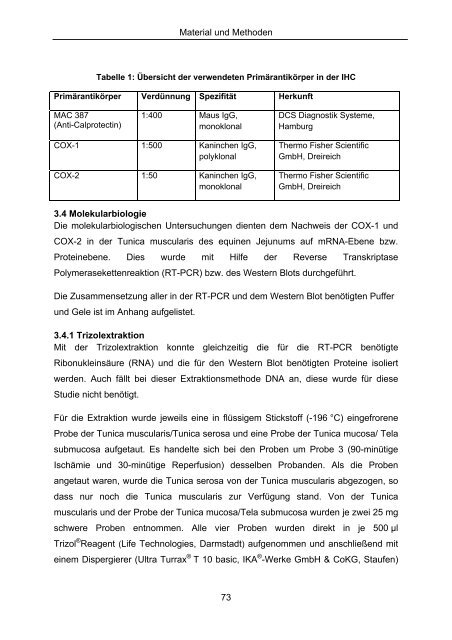
Material und Methoden Tabelle 1: Übersicht der verwendeten Primärantikörper in der IHC Primärantikörper Verdünnung Spezifität Herkunft MAC 387 (Anti-Calprotectin) 1:400 Maus IgG, monoklonal DCS Diagnostik Systeme, Hamburg COX-1 1:500 Kaninchen IgG, polyklonal COX-2 1:50 Kaninchen IgG, monoklonal Thermo Fisher Scientific GmbH, Dreireich Thermo Fisher Scientific GmbH, Dreireich 3.4 Molekularbiologie Die molekularbiologischen Untersuchungen dienten dem Nachweis der COX-1 und COX-2 in der Tunica muscularis des equinen Jejunums auf mRNA-Ebene bzw. Proteinebene. Dies wurde mit Hilfe der Reverse Transkriptase Polymerasekettenreaktion (RT-PCR) bzw. des Western Blots durchgeführt. Die Zusammensetzung aller in der RT-PCR und dem Western Blot benötigten Puffer und Gele ist im Anhang aufgelistet. 3.4.1 Trizolextraktion Mit der Trizolextraktion konnte gleichzeitig die für die RT-PCR benötigte Ribonukleinsäure (RNA) und die für den Western Blot benötigten Proteine isoliert werden. Auch fällt bei dieser Extraktionsmethode DNA an, diese wurde für diese Studie nicht benötigt. Für die Extraktion wurde jeweils eine in flüssigem Stickstoff (-196 °C) eingefrorene Probe der Tunica muscularis/Tunica serosa und eine Probe der Tunica mucosa/ Tela submucosa aufgetaut. Es handelte sich bei den Proben um Probe 3 (90-minütige Ischämie und 30-minütige Reperfusion) desselben Probanden. Als die Proben angetaut waren, wurde die Tunica serosa von der Tunica muscularis abgezogen, so dass nur noch die Tunica muscularis zur Verfügung stand. Von der Tunica muscularis und der Probe der Tunica mucosa/Tela submucosa wurden je zwei 25 mg schwere Proben entnommen. Alle vier Proben wurden direkt in je 500 µl Trizol ® Reagent (Life Technologies, Darmstadt) aufgenommen und anschließend mit einem Dispergierer (Ultra Turrax ® T 10 basic, IKA ® -Werke GmbH & CoKG, Staufen) 73
- Seite 23 und 24: Literatur 2 Literatur 2.1 Histologi
- Seite 25 und 26: Literatur 2.2.2 Makroskopische und
- Seite 27 und 28: Literatur ein geringer Anstieg von
- Seite 29 und 30: Literatur Studien am equinen Jejunu
- Seite 31 und 32: Literatur Darmschichten des equinen
- Seite 33 und 34: Literatur beschrieben. In mehreren
- Seite 35 und 36: Literatur Jejunum bzw. am Colon der
- Seite 37 und 38: Literatur der Jejunumkontraktilitä
- Seite 39 und 40: Literatur anschließend einer Kolik
- Seite 41 und 42: Literatur der COX-1 (CHANDRASEKHARA
- Seite 43 und 44: Literatur 2.4.2.2 Induzierbarkeit
- Seite 45 und 46: Literatur konstitutive Expression d
- Seite 47 und 48: Literatur Magen- und Dünndarmmucos
- Seite 49 und 50: Literatur 2. Bei NSAIDs mit einer C
- Seite 51 und 52: Literatur Peritonitis beschrieben (
- Seite 53 und 54: Literatur beobachtet wurde. Die Amp
- Seite 55 und 56: Literatur führen. Ein Eingriff der
- Seite 57 und 58: Literatur Zeichen für defekte Tigh
- Seite 59 und 60: Literatur Nierenrindennekrose und e
- Seite 61 und 62: Material und Methoden 3 Material un
- Seite 63 und 64: Material und Methoden alle 20 Minut
- Seite 65 und 66: Material und Methoden Desoxygenieru
- Seite 67 und 68: Material und Methoden Zum Anlegen d
- Seite 69 und 70: Material und Methoden 3.3 Histologi
- Seite 71 und 72: Material und Methoden 3.3.3 Histolo
- Seite 73: Material und Methoden (BioGenex, Sa
- Seite 77 und 78: Material und Methoden 2. Waschen De
- Seite 79 und 80: Material und Methoden Tunica muscul
- Seite 81 und 82: Material und Methoden 2. Proteinpr
- Seite 83 und 84: Material und Methoden von Santa Cru
- Seite 85 und 86: Material und Methoden Es wurden in
- Seite 87 und 88: Material und Methoden Anschließend
- Seite 89 und 90: Material und Methoden 2. Beurteilun
- Seite 91 und 92: Ergebnisse RM RM A IM B RM IM LM C
- Seite 93 und 94: Ergebnisse Abb. 10: Eosinophile Gra
- Seite 95 und 96: Ergebnisse Abb. 12: Eosinophile Gra
- Seite 97 und 98: Ergebnisse Zellen festgestellt, ohn
- Seite 99 und 100: Ergebnisse einzelnen Schichten eine
- Seite 101 und 102: Ergebnisse Wie in den durch Ischäm
- Seite 103 und 104: Ergebnisse Längsmuskelschicht, Tun
- Seite 105 und 106: Ergebnisse Zusammenfassend ist Folg
- Seite 107 und 108: Ergebnisse 4.2.1.3 Quantifizierung
- Seite 109 und 110: Ergebnisse Abb. 20: Vergleich des E
- Seite 111 und 112: Ergebnisse Abb. 22: Vergleich des E
- Seite 113 und 114: Ergebnisse Abb. 24: Vergleich des E
- Seite 115 und 116: Ergebnisse Abb. 26: Vergleich des E
- Seite 117 und 118: Ergebnisse RM RM IM LM A IM B RM IM
- Seite 119 und 120: Ergebnisse Zellen vom Typ A festges
- Seite 121 und 122: Ergebnisse RM RM A B RM IM LM C LM
- Seite 123 und 124: Ergebnisse RM IM RM LM A B IM RM IM
Material <strong>und</strong> Methoden<br />
Tabelle 1: Übersicht der verwendeten Primärantikörper in der IHC<br />
Primärantikörper Verdünnung Spezifität Herkunft<br />
MAC 387<br />
(Anti-Calprotectin)<br />
1:400 Maus IgG,<br />
monoklonal<br />
DCS Diagnostik Systeme,<br />
Hamburg<br />
COX-1 1:500 Kaninchen IgG,<br />
polyklonal<br />
COX-2 1:50 Kaninchen IgG,<br />
monoklonal<br />
Thermo Fisher Scientific<br />
GmbH, Dreireich<br />
Thermo Fisher Scientific<br />
GmbH, Dreireich<br />
3.4 Molekularbiologie<br />
Die molekularbiologischen Untersuchungen dienten dem Nachweis der COX-1 <strong>und</strong><br />
COX-2 in der Tunica muscularis des equinen Jejunums auf mRNA-Ebene bzw.<br />
Proteinebene. Dies wurde mit Hilfe der Reverse Transkriptase<br />
Polymerasekettenreaktion (RT-PCR) bzw. des Western Blots durchgeführt.<br />
Die Zusammensetzung aller in der RT-PCR <strong>und</strong> dem Western Blot benötigten Puffer<br />
<strong>und</strong> Gele ist im Anhang aufgelistet.<br />
3.4.1 Trizolextraktion<br />
Mit der Trizolextraktion konnte gleichzeitig die für die RT-PCR benötigte<br />
Ribonukleinsäure (RNA) <strong>und</strong> die für den Western Blot benötigten Proteine isoliert<br />
werden. Auch fällt bei dieser Extraktionsmethode DNA an, diese wurde für diese<br />
Studie <strong>nicht</strong> benötigt.<br />
Für die Extraktion wurde jeweils eine in flüssigem Stickstoff (-196 °C) eingefrorene<br />
Probe der Tunica muscularis/Tunica serosa <strong>und</strong> eine Probe der Tunica mucosa/ Tela<br />
submucosa aufgetaut. Es handelte sich bei den Proben um Probe 3 (90-minütige<br />
Ischämie <strong>und</strong> 30-minütige Reperfusion) desselben Probanden. Als die Proben<br />
angetaut waren, wurde die Tunica serosa von der Tunica muscularis abgezogen, so<br />
dass nur noch die Tunica muscularis zur Verfügung stand. Von der Tunica<br />
muscularis <strong>und</strong> der Probe der Tunica mucosa/Tela submucosa wurden je zwei 25 mg<br />
schwere Proben entnommen. Alle vier Proben wurden direkt in je 500 µl<br />
Trizol ® Reagent (Life Technologies, Darmstadt) aufgenommen <strong>und</strong> anschließend mit<br />
einem Dispergierer (Ultra Turrax ® T 10 basic, IKA ® -Werke GmbH & CoKG, Staufen)<br />
73