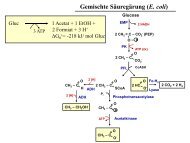
Mikrobiologische Übung FI, Teil 2b - Mikrobiologie und Weinforschung
Mikrobiologische Übung FI, Teil 2b - Mikrobiologie und Weinforschung
Mikrobiologische Übung FI, Teil 2b - Mikrobiologie und Weinforschung
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
enötigte Substanzen:<br />
- 0,1% SDS aus 10% Stammlösung<br />
- Chloroform (Abzug!)<br />
- ONPG-Lösung (4 mg/ml in H 2 0, am Versuchstag frisch ansetzen)<br />
- 1M Na 2 CO 3<br />
Vorgehensweise:<br />
Der Test wird in kurzen Reagenzgläsern durchgeführt, pro Kultur 4<br />
Parallelbestimmungen (3 x mit Kultur, 1 x mit Medium für den Blindwert). Für alle<br />
Testansätze kann der -Gal-Puffer (Reaktionspuffer mit 2-Mercaptoethanol), SDS<br />
<strong>und</strong> Chloroform in die kurzen Reagenzgläser vorgelegt werden (siehe Durchführung).<br />
Achtung: noch keine Bakterienkultur hinzugeben!!<br />
WICHTIG:<br />
Der Enzymtest wird zunächst nur mit der Lactosekultur durchgeführt! Erst wenn die<br />
Lactose-Messreihe abgeschlossen ist, wird der Test mit der Glucose- <strong>und</strong> der<br />
Glucose-/Lactosekultur parallel begonnen.<br />
Durchführung:<br />
- 0,8 ml -Gal-Puffer (im Abzug vorlegen)<br />
- + 3 Tropfen Chloroform (mit Pasteurpipette im Abzug pipettieren!)<br />
- + 2 Tropfen 0,1% SDS (Pasteurpipette)<br />
bis hier für alle Ansätze vorbereiten<br />
Dann den -Galactosidase-Test starten (erst mit Lactosekultur):<br />
- + 0,2 ml Kultur (wichtig: unverdünnt aus vorbereitetem Eppi entnehmen!!!) bzw.<br />
0,2 ml M9-Medium (Blindwert)<br />
- 10 Sek<strong>und</strong>en mischen (vortexen)!!!!<br />
- 5 min bei Raumtemperatur inkubieren<br />
- Start der Reaktion durch Zugabe von 0,2 ml ONPG, gleichzeitig Zeitnahme<br />
starten, Ansatz kurz vortexen<br />
- die nächsten Proben im Abstand von 15 sec starten, Reihenfolge beachten!!!<br />
- Inkubation bei RT bis eine deutlich sichtbare gelbe Farbe zu sehen ist.<br />
- Stopp durch Zugabe von 0,5 ml Na 2 CO 3 (wieder 15 sec Abstand <strong>und</strong> Reihenfolge<br />
einhalten! Zeit notieren!)<br />
- kurz vortexen, ins Eisbad stellen<br />
- in Eppendorfcups kippen <strong>und</strong> 5 min zentrifugieren<br />
- den Überstand in eine Glasküvette pipettieren (ca. 0,8 ml, nicht kippen) <strong>und</strong> die<br />
Extinktion der Proben (Testansatz mit Kultur bzw. Testansatz mit Medium =<br />
Blindprobe) bei 420nm messen.<br />
19