Mikrobiologische Übung FI, Teil 2b - Mikrobiologie und Weinforschung
Mikrobiologische Übung FI, Teil 2b - Mikrobiologie und Weinforschung
Mikrobiologische Übung FI, Teil 2b - Mikrobiologie und Weinforschung
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Mikrobiologische</strong> <strong>Übung</strong><br />
<strong>FI</strong>, <strong>Teil</strong> <strong>2b</strong><br />
Identifizierung, Wachstum<br />
<strong>und</strong> Regulation<br />
WS 2013/14<br />
<strong>Mikrobiologie</strong> <strong>und</strong> <strong>Weinforschung</strong><br />
Johannes Gutenberg-Universität<br />
Mainz<br />
1
Hinweise zur <strong>Mikrobiologische</strong>n <strong>Übung</strong> <strong>FI</strong>, <strong>Teil</strong> <strong>2b</strong><br />
1. Inhalt: Einführung in quantitatives Arbeiten in der <strong>Mikrobiologie</strong>.<br />
2. Voraussetzung: Zulassung zum Studium der Biologie, Vordiplom oder<br />
Zwischenprüfung, <strong>Mikrobiologische</strong> Gr<strong>und</strong>vorlesung, <strong>Mikrobiologische</strong> <strong>Übung</strong> <strong>FI</strong>, <strong>Teil</strong> 1<br />
oder Äquivalenzbescheinigung.<br />
3. Zeit: Beginn: 9 00 Uhr<br />
4. Anweisungen der MitarbeiterInnen sind unbedingt Folge zu leisten.<br />
5. Die Versuchsansätze sind eindeutig zu beschriften.<br />
6. Die Protokolle sind am angegebenen Tag abzugeben: Protokolle müssen freitags eine<br />
Woche nach Ende der jeweiligen <strong>FI</strong> <strong>Übung</strong>, <strong>Teil</strong> 2 abgegeben werden. Nach einer weiteren<br />
Woche können die Protokolle zur Überarbeitung abgeholt werden. Vier Wochen nach Ende<br />
der F I <strong>Übung</strong> muß die endgültige Version abgegeben sein. Jeder Student erstellt ein Protokoll<br />
zu Versuch 5 (Wachstum) oder Versuch 6 (Induktion der ß-Galaktosidase), sodaß pro<br />
Zweiergruppe zu beiden Versuchen ein Protokoll vorliegt. Die Einteilung wird von den<br />
Betreuern vorgenommen. Auf dem Protokoll Gruppennummer, Parallele, <strong>und</strong> Gruppenpartner<br />
angeben <strong>und</strong> vermerken, wer das Protokoll verfasst hat!<br />
Zu Versuch 7 wird von jedem Studenten ein Kurzprotokoll erstellt (siehe Versuchsvorschrift),<br />
das von den Betreuern abgezeichnet wird.<br />
7. Das Protokoll (Erstabgabe) wird bewertet (0 bis max. 4 Punkte). Für den Schein sind 50 %<br />
der max. Punktzahl aus Klausur <strong>und</strong> Protokoll erforderlich (Summe beider Punkte !).<br />
8. Jede(r) <strong>Übung</strong>steilnehmerIn hat den Arbeitsplatz sauber zu hinterlassen.<br />
Entsprechend den Anweisungen der/des <strong>Übung</strong>sleiterIn (oder VertreterIn) sind<br />
Versuchsansätze zu versorgen <strong>und</strong> zu entsorgen.<br />
9. Das Fernbleiben von der <strong>Übung</strong> ist möglichst früh im Sekretariat (Tel.: 39-22662) oder<br />
dem/der <strong>Übung</strong>sleiter/in mitzuteilen. Ein Attest ist vorzulegen. Fehlzeiten von mehr als 1<br />
Tag im <strong>Teil</strong> 2a/b müssen nachgeholt werden. Mehr als einmaliges Fernbleiben von den<br />
<strong>Übung</strong>en ohne glaubhafte Entschuldigung schließt die <strong>Teil</strong>nahme am Abschlußtest aus.<br />
10. Am Ende der <strong>Übung</strong> erfolgt ein schriftlicher Abschlußtest. Der <strong>Übung</strong>sschein wird<br />
ausgegeben, wenn aus Versuchsdurchführung, Protokollen, Kolloquien <strong>und</strong> dem<br />
Abschlußtest hervorgeht, daß die Leistungen ausreichen. Bei nicht ausreichenden<br />
Leistungen kann der Abschlußtest wiederholt werden. Wird dieser Nachtest schuldhaft<br />
versäumt, gilt die <strong>Übung</strong> als nicht bestanden.<br />
11. Über die Gefahrenstoffverordnung <strong>und</strong> Sicherheitsmaßnahmen wurde ich - soweit es<br />
die <strong>Übung</strong> betrifft - informiert.<br />
12. Bezüglich der Gefahrenstoffverordnung gelten Studentinnen als Arbeitnehmerinnen.<br />
Somit stehen besonders werdende <strong>und</strong> stillende Mütter unter dem Schutz des § 26 der<br />
Gefahrenstoffverordnung. Deswegen sollen Schwangere oder junge Mütter sich zu<br />
Beginn der <strong>Übung</strong> mit dem/der <strong>Übung</strong>sleiterIn in Verbindung setzen.<br />
Hiermit bestätige ich von den Hinweisen zur mikrobiologischen <strong>Übung</strong>, insbesondere der<br />
Punkte 9, 10 <strong>und</strong> 11, Kenntnis genommen <strong>und</strong> eine Kopie der <strong>Übung</strong>sanleitung erhalten zu<br />
haben.<br />
Mainz, den: Unterschrift: <strong>Übung</strong>steilnehmer/In:________________<br />
2
Sicherheitstechnische Richtlinien<br />
1. Mäntel, Taschen usw. sind im Spind abzulegen.<br />
2. Mitzubringen sind ein Edding 3000 schwarz, Baumwollkittel,<br />
Feuerzeug <strong>und</strong> ein Vorhängeschloß.<br />
3. Essen, Trinken, Rauchen ist am Arbeitsplatz nicht erlaubt. Das<br />
Mitbringen von Nahrungsmitteln in die Arbeitsräume ist nicht<br />
zugelassen.<br />
4. Das Tragen eines hochgeschlossenen Baumwollkittels mit<br />
langen Ärmeln ist unbedingt erforderlich.<br />
5. Lange Haare müssen hochgeb<strong>und</strong>en werden (Haare dürfen<br />
nicht nach vorne fallen können).<br />
6. Das Tragen von offenen Schuhen ist unzulässig. Das Tragen<br />
von OP-Schuhen <strong>und</strong> ähnlichen ohne Riemen ist nicht<br />
zugelassen.<br />
7. Das Pipettieren mit dem M<strong>und</strong> ist nicht zugelassen.<br />
8. Das Tragen von Kontaktlinsen ist mit dem Augenarzt<br />
abzusprechen.<br />
9. Sollte bei einer <strong>Übung</strong>steilnehmerin eine Schwangerschaft<br />
vorliegen, muß dies dem / der <strong>Übung</strong>sleiterIn unbedingt zu<br />
Beginn mitgeteilt werden.<br />
10. Generell müssen alle Mikroorganismen nach Ende des<br />
Versuches abgetötet werden.<br />
11. Alle Substanzen müssen entsprechend ihrer<br />
Zusammensetzung entsorgt werden (Absprache mit den<br />
MitarbeiternInnen).<br />
12. Im Einzelfalle informiert der/die <strong>Übung</strong>sleiterIn am <strong>Übung</strong>stag<br />
über sicherheitstechnische Maßnahmen.<br />
13. Nach Beendigung der Arbeiten sind die Hände zu waschen.<br />
3
<strong>FI</strong>, <strong>Teil</strong> <strong>2b</strong>: Identifizierung, Wachstum <strong>und</strong> Regulation<br />
Stoff zur Vorbereitung <strong>und</strong> für die Abschlußklausur<br />
• Skript<br />
• Vorlesung zum <strong>FI</strong><br />
• Fuchs, Allgemeine <strong>Mikrobiologie</strong> (Thieme, 8. Auflage, 2007)<br />
S. 169-176; 202-219; 223-226; 500-506; 150-151<br />
oder: entsprechende Kap. Aus ‚Brock, Biology of Microorgansims’<br />
• Lehrbücher der Chemie:<br />
Puffergleichung, Molarität, Konzentration; Lambert-Beersches Gesetz,<br />
Extinlktioskoeffizient<br />
2. Woche: Versuch 5 Wachstum von Escherichia coli mit Glucose oder Acetat<br />
Versuch 6 Induktion der -Galactosidase von Escherichia coli<br />
Versuch 7 Antibiotika<br />
Lösungen <strong>und</strong> Medien für Versuche Nr. 5 bis 7<br />
Die Lösungen <strong>und</strong> Medien sind vor Beginn der Versuche Nr. 5 bis 8 anzusetzen. Die<br />
Mengen sind für 11 Gruppen berechnet. Wenn nicht anders angegeben, Lösungen<br />
<strong>und</strong> Medien durch Autoklavieren sterilisieren. Die genauen Angaben zur<br />
Zusammensetzung der Lösungen <strong>und</strong> Medien sind bei den einzelnen Versuchen zu<br />
finden!<br />
Bei Versuchen 5 + 6 alle Lösungen auf 11 Gefäße (10 Gruppen + 1 mReserve)!!<br />
1) Lösungen <strong>und</strong> Medien<br />
Versuch 5 (Wachstum)<br />
11 x 5 ml 0.1 M Na-Acetat<br />
11 x 100 ml H 2 O<br />
11 x 5 ml 10 % AHC<br />
11 x 5 ml 10 mM CaCl 2<br />
11 x 5 ml 1 M MgSO 4<br />
11 x 5 ml 0.1 M Glucose<br />
11 x 25 ml 10 x M9-Salzlösung<br />
Versuche 5 + 6<br />
Versuch 6 (Induktion)<br />
11 x 250 ml H 2 O<br />
11 x 5 ml 0.1 M Lactose (sterilfiltrieren!)<br />
11 x 25 ml Reaktionspuffer -Gal, pH 7,0<br />
(nicht autoklavieren; bei 4°C lagern)<br />
11 x 2,5 ml 0.1 % SDS (unsteril), aus 10 % Stammlösung ansetzen<br />
11 x 25 ml 1 M Na 2 CO 3 (unsteril)<br />
4
Versuch 7 (Antibiotika)<br />
11 x 2 Platten mit dicker LB-Agarschicht à 40 ml (Lochtest)<br />
88 x 12 ml Standard I-Agar in Röhrchen (für 8 x 4 Gradientenplatten)<br />
11 x 2 große Platte Standard I-Agar (1.5%) (25 ml) (Chromatographie)<br />
22 x 25 ml Standard I mit 0.7% Agar in großen Reagenzgläsern<br />
(Chromatographie)<br />
12 x 2 ml 3 % NH 4 Cl in Reagenzgläsern<br />
11 x 10 ml H 2 O in Reagenzgläsern<br />
11 x 2 ml H 2 O in Reagenzgläsern<br />
B) Gefäße (für 8 Gruppen, sterilisieren)<br />
Versuch 5 (Wachstum)<br />
22 x Erlenmeyerkolben mit Alufolie abgedeckt, 100 ml<br />
14 x Meßzylinder 50 ml<br />
sterile Glaspipetten gemischt (1 ml, 2 ml, 5 ml, 10 ml): alle vorhandenen Glaspipetten<br />
in Blechdosen sterilisieren<br />
Versuch 6 (Induktion)<br />
15 x Meßzylinder (100 ml)<br />
55 x Reagenzgläser<br />
Glaspipetten<br />
Versuch 7 (Antibiotika)<br />
55 x Reagenzgläser<br />
Glaspipetten<br />
80 x Chromatographiestreifen (Schnittmuster beim Assistenten erfragen)<br />
Stichworte zur Vorbereitung der Versuche 5 bis 7 (Theorie)<br />
Allgemeines<br />
- Berechnung Molaritäten, Konzentration, etc.<br />
- Puffergleichung<br />
- Lambert-Beersches Gesetz<br />
- Extinktionskoeffizient<br />
5. Wachstum von Escherichia coli mit Glucose oder Acetat<br />
- Wachstumsgleichung<br />
- Bestimmung , t d<br />
- Zellertrag Y Glucose<br />
5
- OD-Messung<br />
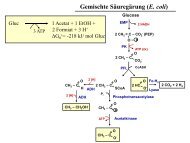
- Stoffwechsel Acetat <strong>und</strong> Glucose<br />
- Glyoxylatzyklus<br />
- Anaplerotische Reaktionen<br />
- PEP-Carboxylase<br />
- PEP-Carboxykinase<br />
6. Induktion der -Galactosidase<br />
- ’ONPG’-Test (Reaktion, Testbedingungen)<br />
- lac Operon<br />
- Lactosestoffwechsel<br />
- Diauxie<br />
- Glucoserepression bei E. coli<br />
- cyclo AMP, CPR (CAP) Protein<br />
- -Galactosidase<br />
- Lac-Repressor<br />
- Glucose-Phosphotransferasesystem<br />
7. Antibiotika<br />
- Wichtige Antibiotikagruppen<br />
- -Lactamantibiotika<br />
- Resistenzmechanismen<br />
- Angriffspunkte Antibiotika<br />
6
5. Wachstum von Escherichia coli mit Glucose oder Acetat<br />
Bitte zur Vorbereitung Fragen S. 14 beantworten<br />
In dem Experiment wird das aerobe Wachstum von E. coli mit Glucose oder Acetat<br />
als Substrat untersucht. Das Wachstum erfolgt in statischer Kultur (Batchkultur) <strong>und</strong><br />
wird anhand der optischen Dichte verfolgt. Aus den beiden Wachstumskurven sollen<br />
verschiedene Wachstumsparameter berechnet werden (Wachstumsrate µ,<br />
Verdopplungszeit t d , Zellertrag Y Glc ), die es ermöglichen das Wachstum auf jedem<br />
der beiden Substrate zu bewerten <strong>und</strong> miteinander zu vergleichen.<br />
Angewandte Methoden:<br />
1. Trübungsmessung <strong>und</strong> Bestimmung der optischen Dichte (OD):<br />
Anhand von Trübungsmessungen im Photometer kann das Wachstum einer<br />
Bakterienkultur verfolgt werden. Hierzu wird jeweils 1 ml der wachsenden Kultur<br />
entnommen <strong>und</strong> in eine Küvette überführt. Im Photometer wird ein Lichtstrahl durch<br />
die Bakterienkultur geschickt, dessen Restintensität nach Durchstrahlen der Kultur<br />
vom Gerät gemessen wird.<br />
Bakterienzellen unterscheiden sich deutlich in ihrem Brechungsindex von dem<br />
umgebenden wässrigen Medium. Wegen der resultierenden Lichtstreuung sieht eine<br />
Bakterienkultur trüb aus. Bis zu einer bestimmten Zelldichte (OD 578 0,5), bei der<br />
sich die Bakterienzellen gegenseitig zu beschatten beginnen, ist die Trübung<br />
proportional der Zellzahl. Die Trübung kann im Photometer wie eine Absorption<br />
gemessen werden. Häufig wird die OD bei 578 nm, 600 nm oder 650 nm gemessen,<br />
weil die meisten Bakterien bei diesen Wellenlängen keine Lichtabsorption besitzen.<br />
Die OD wird gegen Luft als Referenz gemessen. Von diesem Wert wird die OD von<br />
unbewachsenem Medium (=Blindwert) abgezogen.<br />
2. Glucosebestimmung:<br />
Die Bestimmung des Substratverbrauchs während des Wachstums stellt ein<br />
wichtiges Instrument zur Charakterisierung des bakteriellen Stoffwechsels dar. In<br />
diesem Versuch soll der Glucoseverbrauch von E. coli während des aeroben<br />
Wachstums mit Glucose bestimmt werden. Hierzu dient ein enzymatischer Test. Um<br />
den Glucoseverbrauch zu bestimmen, werden zu Anfang der Zucht (t 0 ) <strong>und</strong> am Ende,<br />
wenn die Bakterien in der stationären Phase sind, Proben von 0,5 ml Kultur<br />
entnommen <strong>und</strong> abzentrifugiert. Der Überstand kann in den enzymatischen Test<br />
eingesetzt werden <strong>und</strong> der Glucoseverbrauch kann bestimmt werden. Zusammen mit<br />
den berechneten Parametern aus der Wachstumskurve kann der Zellertrag Y Glc<br />
berechnet werden. Dieser gibt Auskunft darüber wie viel g Zellmasse pro Mol<br />
verbrauchtem Substrat gebildet werden können.<br />
7
Versuchsablauf:<br />
Vor Beginn: Einteilen der Photometer!<br />
1. Ansetzen von M9 Medium (sterile Glaspipetten):<br />
jede Gruppe setzt 50 ml M9 Medium an<br />
Rezept für 1 Liter angegeben, zuerst umrechnen auf 50 ml<br />
alle Reagenzien wurden bereits am Montag angesetzt <strong>und</strong> autoklaviert<br />
2. Ansetzen der Zuchten E. coli mit Glucose oder Acetat:<br />
Es werden in sterilen Erlenmeyerkolben je eine Zucht mit M9-Medium plus<br />
Glucose <strong>und</strong> eine Zucht mit M9-Medium plus Acetat angesetzt. Das<br />
Gesamtvolumen jeder Kultur soll 15 ml betragen. Die Endkonzentration an<br />
Glucose bzw. Acetat soll 3 mM sein. Somit muss berechnet werden, wieviel<br />
der jeweiligen Stammlösung (= 0,1 M) im Gesamtvolumen enthalten sein<br />
muss, um auf die erforderlich Endkonzentration zu kommen.<br />
Nach Zugabe von M9-Medium <strong>und</strong> der C-Quelle (Glucose oder Acetat) wird<br />
der Kolben mit 1 ml Inokulum beimpft. Hierzu werden Vorkulturen (VK) von E.<br />
coli ausgegeben, die über Nacht entweder mit Glucose oder Acetat gezüchtet<br />
wurden. Jeweils die entsprechende VK wird für die Kultur verwendet.<br />
Kulturansätze:<br />
M9-Medium:<br />
Glucose oder Acetat:<br />
Inokulum<br />
gesamt<br />
x ml<br />
x ml (Endkonz. 3 mM)<br />
1 ml<br />
15 ml<br />
3. Beginn der Wachstumskurve:<br />
Unmittelbar nach Ansetzen der Kulturen werden die Proben für die<br />
Wachstumskurve (immer mit sterilen Glaspipetten arbeiten) entnommen.<br />
Wichtig: vor Entnahme Kulturen schwenken, um Inhalt gleichmäßig zu<br />
verteilen.<br />
Von der Glucosezucht werden 1,5 ml steril entnommen. 1 ml davon ist zur<br />
Bestimmung der OD, 0,5 ml davon werden direkt in einem Eppendorf-Cup<br />
abzentrifugiert <strong>und</strong> der Überstand in ein neues Eppendorf-Cup dekantiert. Der<br />
Überstand wird bis zur Glucosebestimmung eingefroren. Von der Acetatzucht<br />
wird nur 1 ml zur Bestimmung der OD entnommen.<br />
Die Kulturen werden bis zur nächsten Messung bei 37°C unter Schütteln im<br />
Wasserbad inkubiert.<br />
8
4. Messen der Proben:<br />
Für die Wachstumskurve wird von der Glucosezucht alle 30 Minuten 1 ml<br />
Probe entnommen (steril, Glaspipette) <strong>und</strong> von der Acetatzucht alle 60<br />
Minuten.<br />
Die OD wird sowohl ohne Verdünnung der Kultur <strong>und</strong> bei einer OD 0,5 nach<br />
geeigneter Verdünnung mit Medium ( OD in der Küvette muss < 0,5 sein!)<br />
bestimmt. In die Wertetabellen sollen die unverdünnten <strong>und</strong> gegebenenfalls auch<br />
die verdünnten Werte samt Verdünnungsfaktor eingetragen werden.<br />
Im Anschluss an das Ansetzen der Zuchten ist jeweils ein Praktikant pro Gruppe<br />
verantwortlich für die Wachstumskurve, der andere für die Glucosebestimmung (s.<br />
Seite 11).<br />
Material zur Zellzucht:<br />
Stamm:<br />
Vorkulturen:<br />
Zuchtmedium:<br />
E. coli AN387 („Wildtyp“, K-12 Derivat)<br />
Von E. coli AN387 werden frische Vorkulturen (VK)<br />
ausgegeben, die mit Glucose oder Acetat über Nacht<br />
gezüchtet wurden.<br />
M9-Medium<br />
Pro Gruppe werden 50 ml M9 Medium steril in einem<br />
Messzylinder angesetzt.<br />
- 100 ml/l M9 10 x –Salzlösung: Na 2 HPO 4 60 g/l<br />
KH 2 PO 4 30 g/l<br />
NH 4 Cl 10 g/l<br />
NaCl 5 g/l<br />
- 10 ml/l CaCl 2 (10 mM)<br />
- 1 ml/l MgSO 4 (1 M)<br />
- 10 ml/l Säurehydrolysiertes Casein (=AHC, 10%)<br />
nach Zusatz aller Lösungen im Messzylinder auf 50 ml mit sterilem H 2 O auffüllen<br />
<strong>und</strong> mischen (schwenken)<br />
C-Quelle: D-Glucose (0,1 M)<br />
Na-Acetat pH 7 (0,1 M)<br />
9
Wachstum mit Glucose<br />
Blindwert (nur M9-Medium): OD 578 :<br />
0<br />
min<br />
30<br />
min<br />
60<br />
min<br />
90<br />
min<br />
120<br />
min<br />
150<br />
min<br />
180<br />
min<br />
210<br />
min<br />
240<br />
min<br />
OD 578 unverdünnt<br />
minus BW<br />
OD 578 verdünnt<br />
minus BW<br />
Verdünnungsfaktor<br />
OD 578 Endwert<br />
Wachstum mit Acetat<br />
OD 578 unverdünnt<br />
minus BW<br />
OD 578 verdünnt<br />
minus BW<br />
Verdünnungsfaktor<br />
0 min 60 min 120 min 180 min 240 min<br />
OD 578 Endwert<br />
10
5. Glucosebestimmung mit Glucoseoxidase (GOD) <strong>und</strong> Peroxidase (POD)<br />
(Bergmeyer, Methoden der enzymatischen Analyse)<br />
jeweils 1 Praktikant aus jeder Gruppe verantwortlich<br />
Lösungen:<br />
NaP i -Puffer<br />
700 mg Na 2 HPO 4 x 2 H 2 O<br />
360 mg NaH 2 PO 4 x H 2 O<br />
auf 50 ml auffüllen (davon 500 µl für GOD abzweigen)<br />
Glucoseoxidase (GOD)<br />
Menge reicht für 50 Tests, haltbar bei 4°C<br />
400 Units GOD (aus Schimmelpilz, Grad II) in 500 µl NaP i -Puffer<br />
lösen (Lösung 2-3 Tage stabil bei 4°C)<br />
Glucosereagenz<br />
50 ml NaP i -Puffer<br />
200 Units POD (aus Meerettich, Grad II)<br />
25 mg ABTS, Diammoniumsalz<br />
5 Tropfen Chloroform<br />
Glucosestandard 500 µM Glucose x H 2 O in 500 ml Messkolben ansetzen<br />
die benötigte Glucosemenge muss über das Molekulargewicht<br />
(s. Verpackung) berechnet werden<br />
Testprinzip:<br />
In diesem enzymatischen Test wird die Glucosekonzentration photometrisch<br />
bestimmt. Dabei wird Glucose durch die Glucoseoxidase oxidiert. Das hierbei<br />
gebildete H 2 O 2 oxidiert in der Folgereaktion ABTS. Das oxidierte ABTS ist gefärbt<br />
<strong>und</strong> absorbiert im Photometer bei 436 nm. Da pro Mol Glucose auch 1 Mol ABTS<br />
oxidiert <strong>und</strong> somit bestimmbar wird, ist die gemessen Absorption proportional zum<br />
Glucosegehalt der Lösung.<br />
GOD<br />
Glucose + O 2 + H 2 O Gluconat + H 2 O 2<br />
POD<br />
H 2 O 2 + ABTS red ABTS ox + 2 H 2 O<br />
GOD:<br />
POD:<br />
ABTS:<br />
Glucoseoxidase<br />
Peroxidase<br />
2,2’-Azino-di-3-ethylbenzthiazolinsulfonat<br />
11
Praktische Durchführung:<br />
Die Glucosebestimmung wird in Eppendorf-Cups durchgeführt.<br />
Pipettierschema:<br />
Start der Reaktion:<br />
1 ml Glucosereagenz<br />
50 µl Probe*<br />
10 µl GOD<br />
mischen <strong>und</strong> im Wasserbad bei 37°C 30 Minuten inkubieren.<br />
Die Ansätze werden anschließend direkt im Photometer bei 436 nm gegen Luft<br />
immer in derselben Küvette gemessen.<br />
*Probe: entweder 50 µl t 0 oder t end<br />
Glucosestandard-Verdünnung.<br />
der Glucosezucht oder 50 µl einer<br />
Eichgerade:<br />
Zuerst wird eine Eichgerade erstellt mit bekannten Glucosekonzentrationen von<br />
0-500 µM. Diese Eichgerade dient dazu zu zeigen, dass in diesem Bereich die<br />
Glucosekonzentration proportional zu der gemessenen Extinktion bei 436 nm ist.<br />
Mit dem hergestellten Glucosestandard (s. Lösungen S. 11) wird eine<br />
Glucoseverdünnungsreihe erstellt, die anschließend als Probe in den Test eingesetzt<br />
wird (Doppelbestimmung).<br />
Glucosekonzentration 0 µM 100 µM 200 µM 300 µM 400 µM 500µM<br />
µl Glucosestandard<br />
(500 µM)<br />
µl H 2 O<br />
Es wird jeweils 1 ml der entsprechenden Verdünnung (0-500 µM Glucose) angesetzt.<br />
Die Messwerte werden in die Tabelle auf Seite 13 eingetragen.<br />
Aus den erhaltenen Werten werden für alle Konzentrationen Mittelwerte gebildet <strong>und</strong><br />
der Blindwert (= 0 µM Glucose) abgezogen. Die Eichgerade soll im Anschluss auf<br />
Millimeterpapier gezeichnet werden.<br />
12
Eichgerade Glucosebestimmung<br />
Gluc.<br />
Konzentration<br />
der<br />
Eichlösung<br />
E 436 (1)<br />
0 µM<br />
(=BW)<br />
100 µM 200 µM 300 µM 400 µM 500 µM<br />
E 436 (2)<br />
Mittelwert<br />
Mittelwert<br />
minus BW<br />
Nach Fertigstellen der Eichgeraden werden die Proben der Glucosezucht gemessen.<br />
Die zentrifugierten Kulturüberstände werden aufgetaut, homogenisiert <strong>und</strong> bis zur<br />
Verwendung auf Eis gehalten. Für diese Proben muss ein geeigneter<br />
Verdünnungsfaktor überlegt werden. Die zuvor erstellte Eichgerade zeigt, über<br />
welchen Bereich die Glucosekonzentration im Test proportional zur gemessenen<br />
Extinktion ist. Ist die Konzentration zu hoch, kann keine Aussage mehr über den<br />
Glucosegehalt gemacht werden. Die Glucosekonzentration muss also vor<br />
Durchführung des Tests abgeschätzt werden <strong>und</strong> die Probe entsprechend verdünnt<br />
werden. Die Verdünnungen werden mit H 2 0 hergestellt. Zur Kontrolle wird die<br />
Konzentration einer unbekannten Probe bestimmt, welche zuvor 1:10 <strong>und</strong> 1:20<br />
verdünnt wird. Alle Proben werden jeweils in Doppelbestimmung gemessen.<br />
Bestimmung des Glucosegehalts<br />
Anfang der Zucht Ende der Zucht Unbekannt Proben<br />
Verdünnung unverdünnt unverdünnt 1:10 1:20<br />
E 436 (1)<br />
E 436 (2)<br />
Mittelwert<br />
minus BW<br />
Glucosegehalt<br />
Bei Berechnung des Glucosegehalts muss der Verdünnungsfaktor berücksichtigt<br />
werden.<br />
13
Fragen (Zur Vorbereitung VOR dem Versuch als Hausaufgabe bearbeiten!) :<br />
Bitte lesen Sie das Skript zum Versuch aufmerksam durch <strong>und</strong> versuchen Sie dann,<br />
folgende Fragen zu beantworten (Evtl. Lehrbücher zu Rate ziehen).<br />
1) Zum Wachstum :<br />
Welche Stoffwechselwege spielen beim Wachstum mit Glucose eine wichtige<br />
Rolle für die Energiekonservierung von E.coli?<br />
Braucht E.coli beim Wachstum mit Acetat noch zusätzliche Stoffwechselwege?<br />
Wenn ja, welche? Wofür?<br />
Was würden Sie erwarten, mit welchem der beiden Substrate E. coli die höhere<br />
Wachstumsrate µ hat? Warum ?<br />
2) Zur Glucosebestimmung :<br />
Wie hoch ist die Glucosekonzentration der Batch-Kultur zum Startzeitpunkt (in<br />
mM)?<br />
Wie hoch ist die maximale Glucosekonzentration einer unbekannten Lösung, die<br />
wir mit unserer Eichgerade messen können (in mM)?<br />
Was ist also ein sinnvoller Verdünnungsfaktor für die Messung der<br />
Glucosekonzentration am Startzeitpunkt der Kultur?<br />
Warum soll man die Glucosekonzentration am Anfang <strong>und</strong> am Ende messen? Für<br />
welche Berechnungen benötigt man den Glucoseverbrauch? Siehe Auswertung!<br />
Protokoll:<br />
Einleitung (1 – 2 Seiten)<br />
- Stoffwechselwege unter beiden Bedingungen (Wachstum auf Glucose <strong>und</strong><br />
Acetat, welche Stoffwechselwege werden benötigt?)<br />
- Was machen wir in dem Versuch (Batchkulturen von E.coli mit Glucose bzw.<br />
Acetat, Messung der optischen Dichte, Erklärung der Wachstumsparameter µ, t d<br />
<strong>und</strong> Y, was ist bezüglich der Parameter als Ergebnis zu erwarten, wenn man die<br />
beiden Zuchten vergleicht)?<br />
- Beschattungseffekt der Zellen<br />
Material <strong>und</strong> Methoden siehe Skript<br />
Ergebnisse<br />
- Tabellen für die Wachstumskurven (Glucose <strong>und</strong> Acetat getrennt) mit Blindwert,<br />
Zeit, unverdünnten <strong>und</strong> verdünnten Messergebnissen, Verdünnungsfaktor <strong>und</strong><br />
den berechneten Endwerten<br />
- Wachstumskurve für Glucose jeweils verdünnt/unverdünnt in ein lineares<br />
Diagramm auftragen (beide Kurven in ein Diagramm)<br />
- Wachstumskurve für Glucose jeweils verdünnt/unverdünnt in ein<br />
halblogarithmisches Diagramm<br />
14
- Berechnung von µ <strong>und</strong> t d für Glucose<br />
µ = ln xt – ln xt0 / t-t 0<br />
t d = ln 2/ µ<br />
- Wachstumskurve für Acetat jeweils verdünnt/unverdünnt in ein lineares Diagramm<br />
auftragen<br />
- Wachstumskurve für Acetat jeweils verdünnt/unverdünnt in ein<br />
halblogarithmisches Diagramm<br />
- Berechnung von µ <strong>und</strong> t d für Acetat<br />
- Wertetabelle für Glucose-Eichgerade<br />
- Grafik: Eichgerade der Glucosebestimmung mit Geradengleichung <strong>und</strong> R 2 -Wert<br />
- Tabelle: Berechnung von Epsilon ABTS ox über Lambert-Beer’sches Gesetz mit allen<br />
5 Konz. der Eichgerade (Verdünnung der Glucose in der Küvette<br />
berücksichtigen), Durchschnittswert angeben.<br />
- Wertetabelle mit E 436 -Messwerten <strong>und</strong> berechneten Glucosekonzentrationen<br />
(mM):<br />
-Standard 500 µM (für die Berechnung der anderen Konzentrationen verwenden)<br />
-t 0 unverdünnt <strong>und</strong> 1:10 (Welcher berechnete Wert ist realistischer <strong>und</strong> warum?)<br />
-t end<br />
-unbek. Probe 1:10 <strong>und</strong> 1:20 (Welcher Wert ist realistischer <strong>und</strong> warum?)<br />
Rechenbeispiel für Glucosekonzentration angeben<br />
- Berechnung von Y Glucose anhand OD 578 – Zunahme <strong>und</strong> Glucoseverbrauch<br />
- Abschätzung von Y Acetat , d.h. Berechnung unter der Annahme, dass Acetat (3<br />
mM) vollständig verbraucht wird.<br />
Wieviel Zellmasse wird pro Mol Glucose gebildet? Zur Umrechnung von OD 578 in<br />
Zellmasse verwenden Sie den Wert von 300 mg Trockengewicht / L<br />
Kulturvolumen bei OD 578 = 1.<br />
Berechnen Sie die molaren Ertragskoeffizienten Y Glc (Y Glc = g Trockenzellen/ mol<br />
Glucose).<br />
Diskussion (1/2 bis 2 Seiten)<br />
Ergebnisse besprechen:<br />
- Vergleich von allen Wachstumskurven <strong>und</strong> Parametern.<br />
- Entsprechen die Ergebnisse den Erwartungen aus der Einleitung <strong>und</strong> Theorie ?<br />
Erklärung! Wenn nein, was könnte der Gr<strong>und</strong> dafür sein?<br />
15
6. Induktion der -Galactosidase von Escherichia coli<br />
Das Dissacharid Lactose kann erst nach Spaltung in die Hexoseabbauwege<br />
eingeschleust <strong>und</strong> umgesetzt werden:<br />
Lactose + H 2 O<br />
-Galactosidase<br />
D-Glucose + D-Galactose<br />
Das Lactose-(lac)-Operon von E. coli trägt die Information zur Synthese der Enzyme<br />
des Lactosestoffwechsels. Es umfasst den lac-Promotor, den lac-Operator <strong>und</strong> die<br />
Strukturgene für die -Galactosidase (lacZ), die Lactosepermease (lacY) <strong>und</strong> die<br />
Transacetylase (lacA). Die Expression der Strukturgene wird sehr genau reguliert. In<br />
Lactose-freiem Nährmedium bilden die Bakterien nur sehr wenige Moleküle der<br />
Lactose-verwertenden Enzyme. In einem Nährmedium, das Lactose als einzige<br />
Energiequelle enthält, kann die Konzentration der Enzyme um den Faktor 1000<br />
zunehmen.<br />
Das lac-Operon unterliegt einer negativen <strong>und</strong> einer positiven Transkriptionskontrolle.<br />
Die negative Regulation wird durch den Lac-Repressor bewirkt. Der Repressor<br />
verhindert in Abwesenheit von Lactose die Transkription. Die positive Kontrolle wird<br />
durch das Genaktivatorprotein CRP (= cycloAMP Rezeptor Protein) (CAP =<br />
Synonym) ausgeübt. Bei Fehlen von Glucose bildet die Zelle cycloAMP als<br />
"Hungersignal". Unter diesen Bedingungen aktiviert der CRP•cAMP Komplex die<br />
Transkription.<br />
In dem Praktikumsversuch wird die -Galactosidase-Aktivität von E. coli-Zellen<br />
bestimmt, die unter induzierenden <strong>und</strong> unter nicht induzierenden Bedingungen<br />
gezüchtet wurden. Dazu werden die Zellen in Minimalmedium gezüchtet, das als C-<br />
Quelle entweder nur Glucose, nur Lactose oder Glucose <strong>und</strong> Lactose enthält. Wenn<br />
die Kulturen eine OD 578 von 0,5 - 0,7 erreicht haben, kann die Aktivität der -<br />
Galactosidase der drei verschiedenen Zuchtansätze in einem enzymatischen Test<br />
bestimmt werden.<br />
Das Enzym ist nicht nur in der Lage, Lactose zu hydrolysieren, es hydrolysiert<br />
allgemein Substrate, die -1,4-verknüpfte Galactose-Moleküle enthalten. Daher kann<br />
zur Bestimmung der -Galactosidase-Aktivität als Substrat ortho-Nitrophenyl--Dgalactopyranosid<br />
(ONPG) verwendet werden. Die -Galactosidase spaltet ONPG in<br />
Galactose <strong>und</strong> o-Nitrophenol, dessen Extinktion bei 420nm gemessen werden kann.<br />
Um die -Galactosidaseaktivität hinreichend genau zu bestimmen, müssen<br />
mindestens 3 Messungen <strong>und</strong> 1 Blindwert pro Kultur durchgeführt werden. Die<br />
Aktivität des Enzyms wird in permeabilisierten Zellen bestimmt. Die Membranen der<br />
Bakterien werden dabei durch geringe Mengen Detergenz (SDS = Sodiumdodecylsulfat)<br />
<strong>und</strong> Lösungsmittel (Chloroform) für die Enzymsubstrate durchlässig<br />
gemacht, ohne dass die -Galactosidase geschädigt wird.<br />
.<br />
16
I. Zucht der Bakterien unter induzierenden <strong>und</strong> nicht induzierenden<br />
Bedingungen<br />
Stamm:<br />
E. coli AN387 („Wildtyp“, K12-Derivat)<br />
Vorkulturen: Von E. coli AN387 werden frische Vorkulturen (VK) ausgegeben, die mit<br />
folgenden C-Quellen gezüchtet wurden: Glucose, Lactose, Glucose <strong>und</strong><br />
Lactose<br />
Zuchtmedium:<br />
1. Medium: Pro Gruppe 100 ml Medium in einem sterilen 100 ml Messzylinder steril<br />
aus folgenden Zusätzen ansetzen:<br />
- 10 x M9-Salzlösung 10 ml<br />
- 10 mM CaCl 2 1ml<br />
- 1 M MgSO 4 0,1 ml<br />
- 10 % säurehydrolysiertes Casein 1 ml<br />
- mit sterilem Wasser auf 100 ml auffüllen<br />
Nach Zusatz aller Lösungen mischen!<br />
2. C-Quellen:<br />
Lösungen getrennt ansetzen <strong>und</strong> autoklavieren:<br />
- D-Glucose (0.1 M)<br />
- Lactose (0.1 M) (sterilfiltrieren !)<br />
3. Zuchtansätze:<br />
In 3 vorbereitete sterile Reagenzgläser werden folgende Lösungen pipettiert:<br />
Ansatz Medium C-Quelle Vorkultur<br />
A<br />
B<br />
5 ml<br />
Medium<br />
5 ml<br />
Medium<br />
+ 0,3 ml Gluc<br />
(0,1 M)<br />
C 5ml Medium + 0,3 ml Gluc<br />
(0,1 M)<br />
+ 0,3 ml Lac<br />
( 0,1 M)<br />
+ 0,3 ml Lac<br />
( 0,1 M)<br />
+ 0,15 ml VK Gluc<br />
+ 0,15 ml VK Lac<br />
+ 0,15 ml VK Gluc/Lac<br />
- Anschließende Inkubation der Hauptkulturen für etwa 1,5 h bei 37°C auf dem<br />
Schüttler.<br />
17
- nach 1,5 h Wachstum: Zuchtansätze in ein vorbereitete Eisbad stecken<br />
- Bestimmung der optischen Dichte von allen drei Kulturen (0,8 ml) sowie des M9-<br />
Medium für den Blindwert bei 578nm (Doppelbestimmungen!)<br />
- Für die Durchführung des -Galactosidase-Tests sollte die OD 578 der Kulturen<br />
nach Abzug des Blindwerts zwischen 0,5 – 0,8 liegen.<br />
- Für die Messung der optischen Dichte müssen Kulturen ab einer OD 578 > 0,5 so<br />
mit Medium verdünnt werden, dass die OD 578 wieder unter 0,5 liegt. Später muss<br />
über den Verdünnungsfaktor die endgültige optische Dichte berechnet werden.<br />
- In den anschließenden -Galactosidase-Test werden dann die unverdünnten<br />
Kulturen eingesetzt.<br />
Wichtig: Für den -Galactosidase-Test von jeder Kultur 1 ml in ein<br />
Eppendorfgefäß füllen, gut beschriften <strong>und</strong> auf Eis halten!!!<br />
Tabelle zum Eintragen: Bestimmung der optischen Dichte bei 578nm nach 1,5 h Wachstum bei 37°C<br />
Kultur<br />
A) Glucose<br />
OD 578<br />
unverdünnt<br />
OD 578<br />
verdünnt<br />
Verdünnungsfaktor<br />
Blindwert OD578<br />
B) Lactose<br />
C) Glucose/Lactose<br />
II. -Galactosidase-Bestimmung mit ONPG (o-Nitrophenylgalactosid)<br />
Lösungen:<br />
- Reaktionspuffer (nicht autoklavieren, Lagerung bei 4°C): 0,1M KP i pH 7,0<br />
10 mM KCl<br />
1 mM MgCl 2<br />
am Versuchstag pro Gruppe benötigtes Volumen (+ Reserve) des<br />
Reaktionspuffers für alle Testansätze berechnen, Puffer entnehmen <strong>und</strong> mit 2,7<br />
ml/l 2-Mercaptoethanol versetzen (im Abzug!)<br />
Reaktionspuffer + Mercaptoethanol = -Gal-Puffer<br />
18
enötigte Substanzen:<br />
- 0,1% SDS aus 10% Stammlösung<br />
- Chloroform (Abzug!)<br />
- ONPG-Lösung (4 mg/ml in H 2 0, am Versuchstag frisch ansetzen)<br />
- 1M Na 2 CO 3<br />
Vorgehensweise:<br />
Der Test wird in kurzen Reagenzgläsern durchgeführt, pro Kultur 4<br />
Parallelbestimmungen (3 x mit Kultur, 1 x mit Medium für den Blindwert). Für alle<br />
Testansätze kann der -Gal-Puffer (Reaktionspuffer mit 2-Mercaptoethanol), SDS<br />
<strong>und</strong> Chloroform in die kurzen Reagenzgläser vorgelegt werden (siehe Durchführung).<br />
Achtung: noch keine Bakterienkultur hinzugeben!!<br />
WICHTIG:<br />
Der Enzymtest wird zunächst nur mit der Lactosekultur durchgeführt! Erst wenn die<br />
Lactose-Messreihe abgeschlossen ist, wird der Test mit der Glucose- <strong>und</strong> der<br />
Glucose-/Lactosekultur parallel begonnen.<br />
Durchführung:<br />
- 0,8 ml -Gal-Puffer (im Abzug vorlegen)<br />
- + 3 Tropfen Chloroform (mit Pasteurpipette im Abzug pipettieren!)<br />
- + 2 Tropfen 0,1% SDS (Pasteurpipette)<br />
bis hier für alle Ansätze vorbereiten<br />
Dann den -Galactosidase-Test starten (erst mit Lactosekultur):<br />
- + 0,2 ml Kultur (wichtig: unverdünnt aus vorbereitetem Eppi entnehmen!!!) bzw.<br />
0,2 ml M9-Medium (Blindwert)<br />
- 10 Sek<strong>und</strong>en mischen (vortexen)!!!!<br />
- 5 min bei Raumtemperatur inkubieren<br />
- Start der Reaktion durch Zugabe von 0,2 ml ONPG, gleichzeitig Zeitnahme<br />
starten, Ansatz kurz vortexen<br />
- die nächsten Proben im Abstand von 15 sec starten, Reihenfolge beachten!!!<br />
- Inkubation bei RT bis eine deutlich sichtbare gelbe Farbe zu sehen ist.<br />
- Stopp durch Zugabe von 0,5 ml Na 2 CO 3 (wieder 15 sec Abstand <strong>und</strong> Reihenfolge<br />
einhalten! Zeit notieren!)<br />
- kurz vortexen, ins Eisbad stellen<br />
- in Eppendorfcups kippen <strong>und</strong> 5 min zentrifugieren<br />
- den Überstand in eine Glasküvette pipettieren (ca. 0,8 ml, nicht kippen) <strong>und</strong> die<br />
Extinktion der Proben (Testansatz mit Kultur bzw. Testansatz mit Medium =<br />
Blindprobe) bei 420nm messen.<br />
19
Tabelle zum Eintragen: Bestimmung der Extinktion bei 420 nm <strong>und</strong> Inkubationsdauer der Testansätze<br />
Kultur E 420 Zeit [min]<br />
1 2 3 BW E 420<br />
Lactose<br />
Glucose/Lactose<br />
Glucose<br />
Berechnung der-Galactosidaseaktivität in Miller-Units :<br />
Für die Bestimmung der spezifischen Aktivität müssen folgende Werte bestimmt<br />
werden:<br />
- die OD 578 der Kultur, die in den Test eingesetzt wird <strong>und</strong> die OD 578 des M9-<br />
Medium<br />
- die Inkubationsdauer des Testansatzes vom Start durch ONPG-Zugabe bis zum<br />
Stopp durch die Natriumcarbonatzugabe (in ganzen Minuten)<br />
- Die E 420 des Testansatzes mit Kultur <strong>und</strong> die E 420 eines identisch behandelten<br />
Blindwertansatzes mit Medium<br />
Aktivität (Miller-Units) =<br />
1000 x (E 420 Probe – E 420 Blindwert )<br />
Zeit [min] x V Probe [ml] x (OD 578 Probe – OD 578 Medium )<br />
V Probe : Kulturvolumen (ml), das in den Test eingesetzt wurde.<br />
E 420 Probe : Extinktion des Probenansatzes bei 420 nm<br />
E 420 Bw : Extinktion des identisch behandelten Blindwertansatzes<br />
20
Fragen:<br />
1. Welche Aktivität der -Galactosidase von E. coli (niedrig - mittel – hoch) erwarten<br />
Sie bei Zucht auf folgenden Substraten:<br />
- Lactose<br />
- Glucose:<br />
- Glycerin<br />
- Lactose plus Glucose<br />
- Lactose plus Glycerin:<br />
2. Formulieren Sie die Reaktionsgleichung (mit Strukturformeln), die zur Messung<br />
der -Galactosidase im optischen Test verwendet wird.<br />
3. Erklären Sie die Bedeutung folgender Zusätze im -Galactosidasetest:<br />
- Chloroform<br />
- SDS<br />
- Na 2 CO 3<br />
Protokoll:<br />
Einleitung:<br />
- Aufbau des lac-Operons<br />
- positive <strong>und</strong> negative Regulation<br />
- Diauxie<br />
- Phosphotransferasesystem<br />
- Versuchsziel<br />
Material <strong>und</strong> Methode:<br />
- siehe Skript<br />
Ergebnisse:<br />
- Tabellarische Darstellung aller gemessenen Werte<br />
- Miller-Units für alle Messreihen berechnen <strong>und</strong> in einer Tabelle zusammenfassen<br />
(Miller-Units r<strong>und</strong>en)<br />
- Eine Bespielrechnung angeben<br />
Diskussion:<br />
- Für alle drei getesteten Wachstumsbedingungen den Zustand am Promotor<br />
beschreiben.<br />
- Was für Aktivitäten hat man unter den jeweiligen Bedingungen erwartet? Stimmen<br />
die Erwartungen mit den Ergebnissen überein? Falls nicht, wieso?<br />
21
7. Chromatographie von Penicillin-G-Natrium-Salz<br />
Antibiotika sind von lebenden Organismen gebildete Wirkstoffe, die das Wachstum<br />
von Mikroorganismen hemmen (Bakteriostatika) oder sie abtöten (Bakterizide). Sie<br />
wirken in geringen Konzentrationen.<br />
Zur Feststellung des Wirkungsspektrums von Antibiotika können eine Reihe von<br />
Tests durchgeführt werden, so der Strich-, Loch-, Zylinder- oder Blättchentest. Mit<br />
diesen Tests kann die Kulturflüssigkeit eines antibiotikumbildenden Stammes oder<br />
reine Antibiotikumlösung untersucht werden. Wird das Wachstum eines Keims<br />
gehemmt oder verhindert, entsteht um den Wirkstoff ein Hof (s. Kurs I). In der Praxis<br />
spielt die Empfindlichkeit eines Bakteriums auf den Wirkstoff eine bedeutende Rolle.<br />
Dies wird in der Hemmstoffverdünnungsreihe getestet (s. Kurs I). Die o. a. genannten<br />
Methoden können quantitativ <strong>und</strong> qualitativ durchgeführt werden. Da die gängigen<br />
Methoden bereits durchgeführt wurden, soll hier eine Methode zur Charakterisierung<br />
von Antibiotika angewendet werden.<br />
Zur Charakterisierung einer Substanz gehört unter anderem die Feststellung seiner<br />
Löslichkeit. Das Löslichkeitsverhalten gibt Hinweise auf die Möglichkeit einer<br />
Abtrennung der Substanz aus der Nährlösung des Produzenten.<br />
In einem Lösungsmittel sind die <strong>Teil</strong>chen entweder als Ion oder ungeladen als<br />
Molekül enthalten. Bei den Molekülen gibt es 2 Grenzfälle:<br />
a) polare Moleküle, in denen die Elektronen ungleichmäßig verteilt sind, so daß sie<br />
einen Dipol bilden.<br />
b) apolare Moleküle, die eine gleichmäßige Elektronenverteilung aufweisen. Von den<br />
Lösungsmitteln ist Wasser polar. Bei Verbindungen, die polare <strong>und</strong> apolare<br />
Gruppen in unterschiedlichem Verhältnis aufweisen, gibt es alle Übergänge bis<br />
zum völlig apolaren Lösungsmittel. Die Löslichkeit ist abhängig von der Polarität<br />
des Lösungsmittels <strong>und</strong> des zu lösenden Stoffes.<br />
Bei der Chromatographie ist die Wanderungsstrecke einer Substanz von deren<br />
Löslichkeit im Lösungsmittel <strong>und</strong> der stationären Phase abhängig. (Die Adsorption<br />
wird bei dieser Betrachtung vernachlässigt.) In Lösungsmitteln unterschiedlicher<br />
Polarität soll die Wanderungsgeschwindigkeit von Penicillin durch Chromatographie<br />
auf Papierstreifen bestimmt werden. Es sollen folgende Lösungsmittel verwendet<br />
werden: Wasser, 3 % NH 4 Cl, Aceton, Ethylacetat <strong>und</strong> Trichlormethan. Das<br />
Lösungsverhalten von Penicillin-G-Na-Salz soll untersucht werden. Der Nachweis<br />
des Antibiotikums erfolgt durch Auflegen der Chromatogramme auf Doppelschicht-<br />
Testplatten, die mit Staphylococcus carnosus beimpft sind. Die Lage des<br />
Hemmhofes ist abhängig von der Löslichkeit des Penicillins im Lösungsmittel. Je<br />
geringer die Löslichkeit, desto weniger weit wandert das Penicillin.<br />
Durchführung<br />
1. Auf der Startlinie des Chromatographiestreifens 2 l einer 170 E/ml (entspricht 10 -<br />
1 -Verdünnung vom Versuch “Gradientenplatte”) enthaltenden Penicillinlösung mit<br />
Hilfe einer 10 µl Pipette auftragen <strong>und</strong> trocknen lassen.<br />
22
2. Chromatographiestreifen in beschriftete <strong>und</strong> 2 ml Lösungsmittel enthaltende<br />
Reagenzgläser hängen (Startlinie unten) <strong>und</strong> mit Stopfen verschließen.<br />
Gruppe 1: Gruppe 2:<br />
<br />
Wasser Wasser<br />
3% NH 4 CI Methanol<br />
Aceton Ethylacetat<br />
Trichlormethan Trichlormethan<br />
Zunehmend apolar Zunehmend<br />
3. Weichagar verflüssigen, auf 50°C abkühlen (25 ml)<br />
4. Mit 2 ml einer 24 St<strong>und</strong>en alten Staphylococcenkultur beimpfen <strong>und</strong> gleichmäßig<br />
über die Gr<strong>und</strong>schicht auf der Petrischale mit Nähragar verteilen, fest werden<br />
lassen.<br />
5. Auf der Plattenunterseite beschriften (Laufmittel) <strong>und</strong> Strich ziehen, um<br />
Chromatogramme auf eine Startlinie zu legen.<br />
6. Chromatographiestreifen entnehmen, auf Alufolie legen, trocknen (an der<br />
Flamme!).<br />
7. Die Streifen an den Enden so zurechtschneiden, daß sie auf die Platte passen.<br />
Die gut getrockneten Chromatogramme werden vorsichtig mittels abgeflammter<br />
Pinzette auf die beschriftete Platte gelegt (genügend Abstand derselben beachten)<br />
(je 2 Streifen auf eine Platte).<br />
8. Die Platte wird 24 Std. bei 37°C bebrütet.<br />
Auswertung:<br />
Es wird graphisch dargestellt, wo sich die Mittelpunkte der Hemmhöfe befinden.<br />
Berechnung der R f -Werte (R f -Wert = Laufstrecke Hemmhofmitte / Laufmittelfront).<br />
23
Skizze der Platten mit Chromatographiestreifen <strong>und</strong> Lage der Hemmhöfe (bitte eintragen):<br />
R f -Wert:<br />
Laufstrecke Hemmhofmitte: = mm<br />
Laufmittelfront = mm<br />
R f -Wert =<br />
R f -Wert:<br />
Laufstrecke Hemmhofmitte: = mm<br />
Laufmittelfront = mm<br />
R f -Wert =<br />
R f -Wert:<br />
Laufstrecke Hemmhofmitte: = mm<br />
Laufmittelfront = mm<br />
R f -Wert =<br />
R f -Wert:<br />
Laufstrecke Hemmhofmitte: = mm<br />
Laufmittelfront = mm<br />
R f -Wert =<br />
24
Medien <strong>und</strong> Reagenzien:<br />
Standard I (Fertigpräparat der Fa. MERCK) mit 1,5 % Agar für Gr<strong>und</strong>schicht <strong>und</strong><br />
0,7 % für Weichagar<br />
Penicillin-G-Na-Salz 1700 E/ml (~ 1 mg/ml)<br />
Lösungsmittel<br />
Wasser<br />
3 % NH 4 Cl<br />
Aceton<br />
Methanol<br />
Essigsäureethylester = Ethylacetat<br />
Trichlormethan = Chloroform<br />
Chromatographiepapierstreifen: 0,6 cm breit, 19 cm lang; Start 5 cm vom Rand,<br />
Frontlinie<br />
8 cm vom Rand entfernt.<br />
Große Petrischale ( 14 cm)<br />
Organismus: 24 St<strong>und</strong>enkultur von Staphylococcus carnosus.<br />
Antibiotika-Test<br />
Die Beobachtung von Hemmhöfen in einem Bakterienrasen um Kolonien von<br />
Antibiotikabildner wird im Screening-Verfahren benutzt, um Antibiotikabildner zu<br />
isolieren. Durch Variation der Methode können auch Wirkungsspektren von<br />
Antibiotika ermittelt <strong>und</strong> Aussagen über die Wirkung gegen Teststämme gemacht<br />
werden.<br />
1. Der Lochtest: Zur Bestimmung der Wirkung eines Antibiotikums auf verschiedene<br />
Mikroorganismen eignet sich der Lochtest. In der Mitte einer Nähragarplatte wird<br />
ein Loch ausgestanzt, in das Antibiotikumlösung pipettiert wird. Die zu testenden<br />
Organismen werden radial strichförmig aufgetragen, s. Abb.<br />
Anstelle der Antibiotikumlösung kann ein antibiotikumbildender Organismus in der<br />
Mitte der Nähragarplatte geimpft werden. Erst nach Wachstum der Kolonie des<br />
Antibiotikumbildners werden die zu prüfenden Organismen aufgetragen. (wird nicht<br />
durchgeführt)<br />
25
Durchführung<br />
1) Plattenunterseite beschriften:<br />
E. coli, Staphylococcus carnosus, Micrococcus luteus, Pseudomonas stutzeri<br />
2) Loch mit Korkbohrer 1 cm aus Agarschicht stanzen, mit Impföse herausstechen<br />
3) Testkeime entsprechend der Abbildung ausstreichen<br />
4) In Loch a) 1 Tropfen steriles Wasser pipettieren, Kontrollplatte<br />
b) 1 Tropfen Penicillinlösung pipettieren (1700 E/ml)<br />
5) Plattenoberseite beschriften: Name, Datum, Kontrollplatte bzw. Versuchsplatte.<br />
6) Beide Petrischalen werden 24 Std. bei 37°C bebrütet.<br />
Auswertung<br />
Je näher die Organismen zum Antibiotikum wachsen, desto geringer ist dessen Wirksamkeit.<br />
Mit dem Test kann auf einer Platte die Wirkung eines Antibiotikums auf<br />
mehrere Organismen geprüft werden.<br />
__________________________________________________________<br />
Abstand (Wachstum) in mm vom Zentrum<br />
a) Wasser b) Penicillin<br />
__________________________________________________________<br />
E. coli<br />
S. carnosus<br />
M. luteus<br />
Ps. stutzeri<br />
__________________________________________________________<br />
2. Gradientenplatte:<br />
Die Verwendung dieses Tests beschränkt sich auf die Überprüfung isolierter<br />
Antibiotika <strong>und</strong> betrifft immer nur ein Antibiotikum in verschiedenen<br />
Konzentrationen gegenüber einem Testorganismus. Ursprünglich wurde dieser<br />
Test zur Mutantenauslese verwendet. Heute wird durch Auflegen eines mit einem<br />
zweiten Antibiotikum getränkten Papierstreifen die synergistische Wirkung von<br />
Antibiotika ermittelt. In eine schräggestellte Petrischale wird Nähragar ohne<br />
Antibiotikum gegossen. Nach Erstarren der Agarschicht wird die Platte waagerecht<br />
gestellt <strong>und</strong> eine zweite antibiotikumhaltige Nähragarschicht darüber gegossen.<br />
Auf der einen Seite ist praktisch nur Nähragar, auf der anderen Seite Nähragar mit<br />
Antibiotikum, s. Abb.<br />
Nähragar<br />
Nähragar mit Antibiotikum<br />
26
Durchführung<br />
1) Petrischale schräg stellen (Pipette oder ähnliches), 12 ml verflüssigten Standard I<br />
Agar ausgießen, Agarschicht fest werden lassen.<br />
2) Antibiotikumsverdünnungsreihe herstellen:<br />
Die Konzentration in der Ausgangslösung beträgt 1 mg/ml (= 1700 E / ml). Aus der<br />
Verdünnungsstufe 10 -1 soll eine weitere Verdünnung auf 10 -2 erfolgen.<br />
3) Petrischale waagerecht stellen, von der höchsten Verdünnungsstufe ausgehend<br />
dem verflüssigten Agar 0,1 ml Penicillinlösung bzw. für die Kontrolle 0,1 ml<br />
Wasser zugeben, ausgießen, Agarschicht erstarren lassen.<br />
4) 0,1 ml Staphylococcenkultur mit Glaspipette herausnehmen <strong>und</strong> ausplattieren.<br />
5) Petrischale beschriften<br />
6) Platten 24 Std. bei 37°C bebrüten.<br />
Auswertung:<br />
Je nach Ausmaß des Bakterienrasens oder der Häufigkeit vereinzelter Kolonien<br />
können Rückschlüsse auf die Wirksamkeit des Antibiotikums bzw. die Häufigkeit<br />
resistenter Keime gezogen werden.<br />
Skizzieren Sie die Wachstumszonen für die Platten mit den verschiedenen<br />
Antibiotikakonzentrationen (Antibiotikagradienten einzeichnen !)<br />
Penicillin:<br />
0 E / ml 17 E / ml 170 E / ml 1700 E / ml<br />
Stoffgradient<br />
steigende Konz.<br />
27