ATOMBINDUNG (GF) - Chemistry @ KSO
ATOMBINDUNG (GF) - Chemistry @ KSO ATOMBINDUNG (GF) - Chemistry @ KSO
1 KSO ATOMBINDUNG (GF) Skript Atombindung (GF) – V1.0 12/12 | © MMo, edited by Bor
- Seite 2 und 3: 2 INHALTSVERZEICHNIS "ATOMBINDUNG"
- Seite 4 und 5: 4 geschafft haben, sondern weil es
- Seite 6 und 7: 6 Die Wolken der zweiten und der h
- Seite 8 und 9: 8 3. Bildung einer Atombindung Um d
- Seite 10 und 11: 10 des anderen. Die zwei einfach be
- Seite 12 und 13: 12 Aufgabe X Zeichnen Sie die Lewis
- Seite 14 und 15: 14 6. Die räumliche Struktur von M
- Seite 16 und 17: 16 8. Die Halogen-Moleküle Den Hal
- Seite 18 und 19: 18 11. Die räumliche Struktur von
1<br />
<strong>KSO</strong><br />
<strong>ATOMBINDUNG</strong> (<strong>GF</strong>)<br />
Skript Atombindung (<strong>GF</strong>) – V1.0 12/12 | © MMo, edited by Bor
2<br />
INHALTSVERZEICHNIS<br />
"<strong>ATOMBINDUNG</strong>"<br />
1. Einleitung……………………………......................................................................... 03<br />
2. Das Kugelwolkenmodell………......................................................................... 03<br />
2.1 Einleitung…………………………................................................................ 03<br />
2.2 Die Elektronenwolke….………................................................................. 03<br />
2.3 Regeln für das Kugelwolkenmodell......................................................... 04<br />
2.4 Die Kugelwolken der ersten elf Elemente................................................ 05<br />
3. Bildung einer Atombindung........................................................................... 08<br />
3.1 Das Wasserstoff-Molekül...................................................................... 08<br />
3.2 Das Fluor-Molekül................................................................................ 09<br />
3.3 Das Fluorwasserstoff-Molekül................................................................10<br />
4. Die Lewis-Formel........................................................................................... 11<br />
4.1 Einleitung............................................................................................ 11<br />
4.2 Einzelne Atome in Lewis-Schreibweise.................................................... 11<br />
4.3 Moleküle in Lewis-Schreibweise............................................................. 12<br />
5. Die Molekülbausätze..................................................................................... 13<br />
6. Die räumliche Struktur von Molekülen .......................................................... 14<br />
7. Die Edelgasregel............................................................................................ 15<br />
8. Die Halogen-Moleküle................................................................................... 16<br />
9. Die Doppelbindung........................................................................................ 16<br />
10. Die Dreifachbindung.................................................................................... 17<br />
11. Die räumliche Struktur von Molekülen II...................................................... 18
3<br />
1. Einleitung<br />
Bisher wurden Stoffe betrachtet, welche entweder nur aus Metall-Atomen (siehe<br />
„metallische Bindung“) oder aus Metall- und Nichtmetall-Atomen (siehe „Salze,<br />
Ionenbindung“) aufgebaut sind. Die dritte Gruppe der Stoffe, die Moleküle, machen aber<br />
nicht nur den anzahlmässig grössten Teil an<br />
Verbindungen aus, sondern sind zusätzlich für das<br />
Leben auf der Erde von essentieller Bedeutung.<br />
Denken Sie dabei schon nur an sich selber. Wie Sie<br />
vielleicht schon wissen, bestehen Sie zu 60 % bis<br />
70 % aus Wasser, dem wohl bekanntesten Vertreter der Moleküle.<br />
Sie haben bereits gelernt, dass Moleküle ausschliesslich aus Nichtmetallen aufgebaut sind.<br />
Um zu verstehen, aus welchem Grund überhaupt eine Bindung zwischen zwei Nichtmetall-<br />
Atomen zustande kommen kann, muss im nächsten Abschnitt kurz auf ein neues<br />
Atommodell eingegangen werden.<br />
2. Das Kugelwolkenmodell<br />
2.1 Einleitung<br />
Das letzte Atommodell, welches wir behandelt haben, war das Bohr‘sche Atommodell.<br />
Aufgabe I<br />
Was sind die Kernaussagen des Bohr‘schen Atommodells? Zeichnen und beschriften Sie ein<br />
Atom aufgrund der Erkenntnisse von Bohr.<br />
Bei diesem Modell umkreisen die Elektronen den Kern wie die Planeten die Sonne. Die<br />
daraus resultierende „Zielscheibe“ ist zwar recht anschaulich und zum Beschreiben der<br />
Metall- und Ionenbindung noch geeignet, um die Sachverhalte bei der<br />
Elektronenpaarbindung zu beschreiben, versagt dieses Modell jedoch.<br />
2.2 Die Elektronenwolke<br />
Elektronen sind keine Planeten. Sie kreisen nicht um den Kern. Sie bewegen sich überhaupt<br />
nicht auf bestimmten Bahnen. Ihre Bewegung kann nicht vorausgesagt werden wie die eines<br />
Planeten oder einer Gewehrkugel. Nicht weil die Wissenschaftler das bisher noch nicht
4<br />
geschafft haben, sondern weil es grundsätzlich unmöglich ist. Das mag unverständlich<br />
klingen. Das Problem dabei ist, dass Elektronen sowohl Wellen als auch Teilchen sind. Auf<br />
dieses Phänomen soll aber hier nicht weiter eingegangen werden.<br />
Zwar lässt sich die Bewegung eines Elektrons nicht voraussagen, wohl aber die<br />
Wahrscheinlichkeit, mit der es an einem bestimmten Punkt angetroffen werden kann. Für<br />
jeden Punkt im Raum kann die Aufenthaltswahrscheinlichkeit des Elektrons berechnet<br />
werden. Daraus ergibt sich der Raum, in welchem sich das Elektron mit einer<br />
Wahrscheinlichkeit von 90 % aufhält. Man nennt diesen Raum Elektronenwolke oder<br />
Orbital.<br />
Wie kann man aber eine solche Elektronenwolke darstellen?<br />
Stellen Sie sich vor, man könnte das Elektron im Atom fotografieren<br />
und man würde viele Momentaufnahmen machen. Auf jeder wäre<br />
das Elektron an einem anderen Ort zu sehen, als kleiner schwarzer<br />
Punkt auf einem durchsichtigen Film. Legt man nun all diese Filme<br />
übereinander, so erkennt man eine Wolke von Punkten. Dort, wo<br />
die Punkte dichter liegen, befindet sich das Elektron häufiger, wo sie<br />
weiter voneinander entfernt liegen, ist das Elektron seltener<br />
anzutreffen. Elektronenwolken besitzen also dichtere und weniger<br />
Bild: Atombau, Leitprogramm der ETHZ<br />
dichte Stellen. Nach aussen nimmt ihre Dichte ab, sie haben aber keine scharfe Begrenzung.<br />
Aufgabe II<br />
Diskutieren Sie mit dem Nachbarn oder der Nachbarin über das eben Gelernte. Versuchen<br />
Sie das Zustandekommen eines Orbitals zu beschreiben.<br />
2.3 Regeln für das Kugelwolkenmodell<br />
Um Elektronenwolken darstellen zu können, existieren einige Regeln. Diese Regeln werden<br />
nachstehend noch eingehend geübt.<br />
1. Die Elektronenwolken sind kugelförmig.<br />
2. Pauli-Prinzip: Eine Wolke kann höchstens zwei Elektronen enthalten.<br />
3. Die erste Schale besteht aus einer Wolke, in deren Zentrum sich der Kern befindet.<br />
4. Die äusserste Schale besteht aus höchstens vier Wolken und kann somit höchstens<br />
acht Elektronen enthalten.
5<br />
5. Hund'sche Regel: Doppelt mit Elektronen besetzte Wolken kommen nur vor, wenn<br />
die übrigen Wolken der Schale mindestens einfach besetzt sind.<br />
6. Die Elektronen in den Wolken stossen sich gegenseitig ab. Wenn die Wolken<br />
Elektronen enthalten, ordnen sie sich deshalb innerhalb der Schale so an, dass sie<br />
einen möglichst grossen Abstand voneinander haben.<br />
Mit diesen sechs Regeln können Sie für alle Atome ableiten, wie diese im Kugelwolkenmodell<br />
darzustellen sind. Dies werden wir im Folgenden für die Atome mit den Ordnungszahlen 1<br />
bis 11 versuchen. Sie müssen sich dazu einzig und alleine wieder daran erinnern, wie viele<br />
Elektronen auf welcher Schale vorkommen (können). Die Nummerierung der Regeln müssen<br />
Sie nicht auswendig können, jedoch sollten Sie die Regeln zur Darstellung beherrschen.<br />
2.4 Die Kugelwolken der ersten elf Elemente<br />
Aufgabe III<br />
Zeichnen Sie die fehlenden Kugelwolkenmodelle. Malen Sie die Elektronenwolken mit<br />
verschiedenen Farben aus, je nachdem wie viele Elektronen sie enthalten, z.B. halb besetzte<br />
Elektronenwolken mit hellblau, doppelt besetzte mit dunkelblau. Lösungen liegen auf.<br />
Wasserstoff<br />
Das Wasserstoff-Atom besitzt ein Elektron. Es bewegt<br />
sich in einer Kugelwolke, in deren Zentrum sich der<br />
Kern befindet (Regel 3).<br />
Helium<br />
Das Helium-Atom besitzt zwei Elektronen, die sich in der gleichen Wolke<br />
bewegen. Diese Wolke bildet die innerste Elektronenschale, die nun voll<br />
besetzt ist (Regeln 2, 3).<br />
Lithium<br />
Das dritte Elektron des Lithium-Atoms bewegt sich in<br />
einer weiter aussen gelegenen Wolke, die zur zweiten<br />
Schale gehört.
6<br />
Die Wolken der zweiten und der höheren Schalen befinden sich in ständiger Bewegung um<br />
den Atomrumpf. Aus diesem Grund wirken die Atome nach aussen wie Kugeln, was durch<br />
die gestrichelten Linien in den Abbildungen angedeutet ist.<br />
Beryllium<br />
Im Beryllium-Atom bewegen sich die beiden Elektronen der zweiten Schale in<br />
zwei Wolken (Regel 5). Da sich diese gegenseitig abstossen, liegen sie<br />
einander gegenüber (Regel 6). Die äusseren Elektronenwolken und der<br />
Atomrumpf liegen also auf einer Geraden, d.h. sie sind linear angeordnet.<br />
Bor<br />
Die zweite Schale des Bor-Atoms enthält drei einfach besetzte Wolken (Regel<br />
5), die wegen der gegenseitigen Abstossung (Regel 6) ein gleichseitiges<br />
Dreieck bilden. Dies ist eine trigonale Anordnung.<br />
Kohlenstoff<br />
Das C-Atom enthält vier einfach besetzte Wolken in der zweiten Schale. Auf<br />
Grund der Abstossung sind die Abstände zwischen ihnen gleich gross. Sie sind<br />
somit tetraedrisch angeordnet, d. h. sie liegen an den Ecken eines Tetraeders.<br />
Stickstoff<br />
Da die äusserste Schale höchstens vier Elektronenwolken enthalten kann<br />
(Regel 4), ist im Stickstoff-Atom, welches fünf Valenzelektronen besitzt, eine<br />
der vier äusseren Wolken doppelt besetzt (Regel 5). Die vier Wolken sind<br />
wiederum tetraedrisch angeordnet (Regel 6).<br />
Sauerstoff<br />
Von den vier tetraedrisch angeordneten Wolken der zweiten Schale sind im<br />
Sauerstoff-Atom zwei doppelt besetzt.<br />
Fluor<br />
Von den vier tetraedrisch angeordneten Wolken der zweiten Schale sind im<br />
Fluor-Atom drei doppelt besetzt.<br />
Neon<br />
Mit vier doppelt besetzten Wolken ist die äusserste Schale des Neon-Atoms<br />
gefüllt.
7<br />
Natrium<br />
Da das elfte Elektron des Natrium-Atoms in der zweiten Schale keinen Platz<br />
mehr findet, bewegt es sich in einer noch weiter aussen gelegenen Wolke, die<br />
zur dritten Schale gehört. Die Elektronenanordnung ähnelt derjenigen des<br />
Lithiums, der Unterschied besteht darin, dass der Atomrumpf nicht nur eine,<br />
sondern bereits zwei Schalen enthält.<br />
Aufgabe IV<br />
Dies ist eine Zusatzübung. Wenn Sie Aufgabe III bereits vollständig gelöst haben, können Sie,<br />
bis alle soweit sind, die Elemente mit den Ordnungszahlen 12 bis 18 im Kugelwolkenmodell<br />
auf ein separates Blatt skizzieren.<br />
Anmerkungen!<br />
Mit dem Kugelwolkenmodell können die ersten zwanzig Atome ohne<br />
Probleme gezeichnet werden. Bei den nachfolgenden Atomen<br />
funktioniert das Kugelwolkenmodell nicht mehr ohne Weiteres (siehe<br />
dazu auch Skript „Das Periodensystem der Elemente“).<br />
In diesem Skript wird zudem nur die Atombindung betrachtet. Diese<br />
kann ausschliesslich zwischen Nichtmetallen erfolgen. Die<br />
Kugelwolkenmodelle der Atome bis zum zwanzigsten Element können<br />
zwar gezeichnet werden, nachstehend sind aber nur die<br />
Kugelwolkenmodelle der Nichtmetalle von Bedeutung.
8<br />
3. Bildung einer Atombindung<br />
Um die Bildung einer Atombindung im Detail zu verstehen, gehen wir zunächst vom<br />
einfachsten Molekül, dem Wasserstoff-Molekül, bestehend aus zwei Wasserstoff-Atomen,<br />
aus und erweitern dann mit den dort gewonnenen Erkenntnissen auf alle möglichen<br />
Atombindungen.<br />
3.1 Das Wasserstoff-Molekül<br />
Nähern sich zwei Wasserstoff-Atome einander (und dies geschieht zufällig!), so kann es zu<br />
einer Durchdringung, auch Überlappung genannt, der beiden Kugelwolken kommen.<br />
Ab einer genügend kleinen Distanz treten danach (!)<br />
Wechselwirkungen zwischen den einzelnen<br />
Bilder: www.u-helmich.de<br />
Elementarteilchen der beiden Atome auf. Dabei treten<br />
anziehende, aber auch abstossende Kräfte auf.<br />
Aufgabe V<br />
Zwischen welchen Elementarteilchen treten anziehende Kräfte auf? Zwischen welchen<br />
abstossende?<br />
Beim Auftragen der Energie gegen den Abstand der beiden Atomkerne in einer Grafik<br />
resultiert das folgende Bild. Die Grafik ist von rechts nach links zu lesen.
9<br />
Bild: wps.prenhall.com<br />
Insgesamt erfolgt aus der Überlappung der beiden Elektronenwolken eine Energieabgabe.<br />
Die dabei frei werdende Energie nennt man Bindungsenergie. Sie muss auch aufgewendet<br />
werden, um die beiden Atome im Molekül wieder zu trennen (= Spaltungsenergie).<br />
Bei der Bildung einer Atombindung wird immer Energie frei!<br />
Aufgabe VI<br />
Diskutieren Sie mit dem Pultnachbarn oder der Pultnachbarin die Grafik in der letzten<br />
Abbildung. Gehen Sie dabei auf zwei Fragen ein und halten Sie die Antworten darauf fest.<br />
- Wieso fällt die Kurve in der Mitte ab?<br />
- Aus welchem Grund steigt die Kurve links so stark an?<br />
3.2 Das Fluor-Molekül<br />
Die Bildung eines Fluor-Moleküls lässt sich in der gleichen Weise wie beim Wasserstoff-<br />
Molekül verstehen.<br />
Aufgabe VII<br />
Zeichnen Sie ein Fluor-Atom im Kugelwolkenmodell.<br />
Jedes Fluor-Atom besitzt auf der äussersten Schale neben den drei doppelt besetzten<br />
Wolken eine einfach besetzte Wolke. Wenn sich zwei Fluor-Atome einander genügend<br />
nähern, geraten die Valenzelektronen des einen Atoms in den jeweiligen Anziehungsbereich
10<br />
des anderen. Die zwei einfach besetzten Wolken überlagern sich. Die beiden Elektronen in<br />
den sich überlagernden Wolken werden von beiden Atomrümpfen in gleicher Weise<br />
angezogen. Eine Fluor-Fluor-Atombindung, und damit ein Fluor-Molekül, hat sich<br />
ausgebildet.<br />
Aufgabe VIII<br />
Zeichnen Sie ein Fluor-Molekül im Kugelwolkenmodell.<br />
3.3 Das Fluorwasserstoff-Molekül<br />
Nun existieren nicht nur Moleküle zwischen Atomen desselben Elementes, auch zwischen<br />
Atomen verschiedener Elemente kann es zur Ausbildung eines Moleküls kommen. So ist dies<br />
z.B. der Fall beim Fluorwasserstoff-Molekül. Die einfach besetzte Wolke des Wasserstoff-<br />
Atoms kann sich mit der einfach besetzten Wolke des Fluor-Atoms überlagern. Auch auf<br />
diese Weise kann ein Molekül entstehen.<br />
Aufgabe IX<br />
Zeichnen Sie ein Fluorwasserstoff-Molekül mit Hilfe des Kugelwolkenmodells.
11<br />
4. Die Lewisformel<br />
4.1 Einleitung<br />
In Molekülen halten die einzelnen Atome nach der Theorie des amerikanischen<br />
Chemikers Gilbert Newton Lewis (1875 – 1946) durch die<br />
Elektronenpaarbindung, auch Atombindung genannt, zusammen. Diese Bindung<br />
zeichnet sich durch (mindestens) ein gemeinsames Elektronenpaar aus. Dieses<br />
kann auch als bindendes Elektronenpaar bezeichnet werden, die Bindung als<br />
kovalente Bindung.<br />
Das Kugelwolkenmodell lässt sich sehr gut verwenden, um das Zustandekommen einer<br />
Atombindung zu erklären. Sie haben aber bei Aufgaben VIII und IX sicherlich gemerkt, dass<br />
das Zeichnen eines Moleküls mit Hilfe des Kugelwolkenmodells sehr mühsam werden kann.<br />
Vor allem wenn Sie dabei bedenken, dass die obigen Moleküle aus nur je zwei Atomen<br />
bestehen, was die Ausnahme ist.<br />
Lewis hatte dieses Problem bereits erkannt und einen Vorschlag zu einer vereinfachten<br />
Schreibweise vorgeschlagen. Noch bis heute wird intensiv von dieser Schreibweise Gebrauch<br />
gemacht.<br />
Bild:<br />
www.chemistry.msu.edu<br />
4.2 Einzelne Atome in Lewis-Schreibweise<br />
Nach Lewis lassen sich die einzelnen Valenzelektronen eines Atoms als Punkte am<br />
Elementsymbol und die Elektronenpaare auch als Striche darstellen. Die ersten beiden<br />
Elemente des Periodensystems sehen in der Lewis-Schreibweise, auch Lewisformel genannt,<br />
wie folgt aus.<br />
H∙<br />
He: , besser He|<br />
Beim Wasserstoff-Atom wird das einzelne Valenzelektron als Punkt oben, rechts, links oder<br />
unten an das Elementsymbol gezeichnet. Beim Helium-Atom befinden sich die beiden<br />
Valenzelektronen in derselben Elektronenwolke und werden aus diesem Grund auch auf<br />
derselben Seite des Elementsymbols gezeichnet. Da die beiden Elektronen sich in der<br />
gleichen Elektronenwolke befinden und aus diesem Grund ein so genanntes Elektronenpaar<br />
ausbilden, wird dies meist als Strich an Stelle der beiden Punkte gezeichnet.
12<br />
Aufgabe X<br />
Zeichnen Sie die Lewisformeln für die Elemente mit den Ordnungszahlen 3 bis 18. Beachten<br />
Sie dabei, dass Sie die Hund‘sche Regel einhalten.<br />
Die Lewisformel wird ausschliesslich zum Beschreiben der kovalenten Bindung eingesetzt.<br />
Diese vereinfachte Schreibweise funktioniert bei den Nichtmetallen, bei den Halbmetallen<br />
und bei den Metallen der Hauptgruppen. Bei den Metallen der Nebengruppen,<br />
Lanthanoiden und Actinoiden würde diese Schreibweise versagen und wird dort unter<br />
anderem aus diesem Grund nicht benützt. Noch fehlen uns aber die Lewisformeln einiger<br />
Nichtmetalle.<br />
Aufgabe XI<br />
Zeichnen Sie die restlichen Nichtmetall-Atome in der Lewis-Schreibweise.<br />
4.3 Moleküle in Lewis-Schreibweise<br />
Mit der Lewis-Schreibweise können sehr einfach die Bindungsverhältnisse in Molekülen<br />
wiedergegeben werden. Vergessen Sie dabei nie, die voll besetzten Orbitale zu zeichnen.<br />
Diese voll besetzten Orbitale werden als nichtbindende Elektronenpaare bezeichnet.<br />
Aufgabe XII<br />
Zeichnen Sie das Fluorwasserstoff-Molekül in der Lewis-Schreibweise.<br />
Aufgabe XIII<br />
Zeichnen Sie ein Molekül in Lewis-Schreibweise mit nachstehender Anzahl an Nichtmetall-<br />
Atomen.<br />
a.) 1 x H, 1 x Br b.) 2 x Br c.) 2 x H, 1 x O<br />
d.) 4 x H, 1 x C e.) 1 x N, 3 x H f.) 2 x C, 6 x H<br />
Aufgabe XIV (Zusatz)<br />
Erfinden Sie zusammen mit dem Pultnachbarn oder der Pultnachbarin weitere Moleküle.<br />
Halten Sie die Anzahl an gebrauchten Atomen und die Lewisformel hier unten fest.
13<br />
5. Die Molekülbausätze<br />
In den Chemiezimmern liegen links neben dem Korpus Molekülbausätze, mit Hilfe welcher<br />
Moleküle nicht nur immer auf dem Papier sondern auch „in Realität“ gebastelt werden<br />
können. Wann immer in Zukunft auf die Molekülbausätze verwiesen wird, können Sie Sich<br />
einen Bausatz holen gehen. Tragen Sie Sorge dazu! Ich gehe davon aus, dass diese dann am<br />
Ende der Lektion wieder vollständig dort abgelegt werden.<br />
Einzelne Bindungen werden durch die grünen Röhrchen dargestellt.<br />
In den Bausätzen entsprechen die Farben folgenden Atomen:<br />
schwarz: Kohlenstoff weiss: Wasserstoff<br />
gelb: Schwefel rot: Sauerstoff<br />
Blau und Grün können nach Belieben für ein anderes Nichtmetall eingesetzt werden.<br />
Aufgabe XV<br />
Basteln Sie Sich zu zweit die Moleküle der Aufgaben XIII und XIV. Erfinden Sie danach<br />
weitere Moleküle und halten diese mit einer Lewisformel fest.
14<br />
6. Die räumliche Struktur von Molekülen I<br />
Die Lewisformeln, wie Sie oben eingeführt wurden, geben nur die gegenseitige Verknüpfung<br />
der Atome wieder und liefern kein Bild der Struktur, d.h. des räumlichen Baus der Moleküle.<br />
Mit Hilfe von geeigneten Experimenten lässt sich jedoch die dreidimensionale Anordnung<br />
der Atome in einem Molekül ermitteln.<br />
Beim Basteln der obigen Moleküle haben Sie schon stillschweigend eine dreidimensionale<br />
Struktur vorausgesetzt. Wie lässt sich aber eine solche Struktur ohne aufwendige<br />
Experimente voraussagen?<br />
Aufgabe XVI<br />
Zeichnen Sie den Plan von der Tafel ab und basteln Sie das Zielgebilde.<br />
Aufgabe XVII<br />
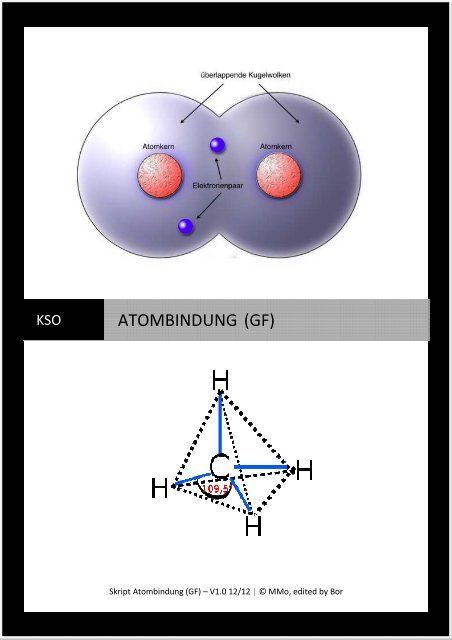
Bauen Sie ein CH 4 -Molekül.<br />
Das CH 4 -Molekül besitzt vier bindende Elektronenpaare. Durch die<br />
gegenseitige Abstossung ordnen sie sich räumlich so an, dass sie den<br />
grösstmöglichen Abstand voneinander einnehmen. Dies ergibt eine<br />
tetraedrische [griech. tetráedron = Vierflächner] Anordnung. Sie<br />
können diese erkennen, wenn Sie alle Ecken des Moleküls<br />
miteinander verbinden. Der Winkel zwischen den Bindungen<br />
entspricht 109.5°, man bezeichnet ihn als Tetraederwinkel.<br />
Bild: www.math.unibas.ch<br />
Diese Erkenntnis wird auch, zumindest zu einem Teil, beim Schreiben der Lewisformeln<br />
wiedergegeben. So wird z. B. das Wasser-Molekül H 2 O nicht linear sondern gewinkelt<br />
gezeichnet (Erklärung folgt im späteren Verlauf dieses Skripts).
15<br />
Aufgabe XVIII<br />
Zeichnen Sie die Lewisformeln der folgenden Moleküle. Versuchen Sie dabei auch die<br />
räumliche Struktur zu berücksichtigen.<br />
a.) H 2 O b.) CH 2 Cl 2 c.) CBr 4<br />
d.) C 2 H 6 e.) C 3 H 8 f.) H 2 S<br />
7. Die Edelgasregel<br />
Aufgabe XIX<br />
Zeichnen Sie die vier Halogenwasserstoff-Moleküle mit einer Lewisformel.<br />
In den Halogenwasserstoff-Molekülen enthalten die Hüllen der Wasserstoff-Atome zwei<br />
Elektronen wie die Atome des Heliums, die Atomrümpfe der Halogen-Atome sind jeweils von<br />
acht Elektronen umgeben wie die Atome der Edelgase. Diese Zahlen ergeben sich, wenn<br />
man das bindende Elektronenpaar jeweils den beiden gebundenen Atomen zuordnet. Diese<br />
Regel, dass die bindenden und nichtbindenden Elektronenpaare zusammen um ein Atom<br />
immer identisch mit der Anzahl an Valenzelektronen des entsprechenden Edelgas-Atoms<br />
sein müssen, muss immer erfüllt sein. Diese Regel wird als Edelgasregel<br />
bezeichnet.<br />
Sie kann veranschaulicht werden, indem um ein Atom und dessen bindende<br />
und nichtbindende Elektronenpaare mit einem Kreis markiert werden.<br />
H<br />
F<br />
Aufgabe XX<br />
Zeigen Sie bei der Aufgabe XVIII die Erfüllung der Edelgasregel, indem Sie die bindenden und<br />
nichtbindenden Elektronenpaare um ein Atom mit einem Kreis markieren.
16<br />
8. Die Halogen-Moleküle<br />
Den Halogen-Atomen fehlt je ein Elektron, damit diese die Edelgasregel erfüllen können. In<br />
den Reinstoffen der Halogene kommen ausschliesslich Halogen-Atome vor. Diese verbinden<br />
sich sofort miteinander zu einem Halogen-Molekül. So erfüllen sie die Edelgasregel.<br />
Aufgabe XXI<br />
Zeichnen Sie alle Halogen-Moleküle, bestehend aus nur einer Atomsorte, mit einer<br />
Lewisformel und zeigen Sie die Erfüllung der Edelgasregel auf.<br />
9. Die Doppelbindung<br />
Sauerstoff-Atome besitzen zwei doppelt besetzte und zwei einfach besetzte<br />
Elektronenwolken. Auch hier kommen im Reinstoff ausschliesslich Sauerstoff-Atome vor.<br />
Diese besitzen, wie die Halogen-Atome, noch nicht acht Elektronen. Im Fall von Sauerstoff<br />
passiert ähnliches wie bei der Bildung eines Halogen-Moleküls. Treffen sich zufällig zwei<br />
Sauerstoff-Atome, können sich zwei Wolken überlappen, eine kovalente Bindung ist<br />
entstanden. Die beiden Sauerstoff-Atome besitzen aber auch nach der Ausbildung dieser<br />
Atombindung immer noch je ein einzelnes Elektron in einer Elektronenwolke. Das<br />
Einfachste, was in diesem Fall passieren kann, ist eine Überlappung der beiden<br />
Elektronenwolken und so die Bildung einer weiteren Atombindung. Die beiden Atome im<br />
Molekül verbinden nun zwei Einfachbindungen, also eine Doppelbindung.<br />
Aufgabe XXII<br />
Bauen Sie mit Hilfe der Bausätze die folgenden Moleküle und zeichnen Sie deren<br />
Lewisformel. Benutzen Sie zum Stecken einer Doppelbindung die flexiblen, durchsichtigen<br />
Stäbchen.<br />
a.) O 2 b.) CO 2 c.) C 2 H 4 d.) HCOOH
17<br />
10. Die Dreifachbindung<br />
Einige Nichtmetall-Atome besitzen mehr als zwei einfach besetzte Elektronenwolken. Sie<br />
sind deshalb imstande, mehr als zwei Bindungen einzugehen, unter anderem auch mit dem<br />
gleichen Atom.<br />
Aufgabe XXIII<br />
Bauen Sie mit Hilfe der Bausätze die folgenden Moleküle und zeichnen Sie deren<br />
Lewisformel. Benutzen Sie auch zum Stecken einer Dreifachbindung die flexiblen,<br />
durchsichtigen Stäbchen.<br />
a.) N 2 b.) C 2 H 2 c.) HCN<br />
Aufgabe XXIV (Zusatz)<br />
Zeigen Sie bei den Molekülen der Aufgaben XXII und XXIII die Erfüllung der Edelgasregel.
18<br />
11. Die räumliche Struktur von Molekülen II<br />
Wir haben bereits festgestellt, dass Moleküle nur in den seltensten Fällen zweidimensional<br />
aufgebaut sind, und uns eine mögliche dreidimensionale Struktur angeschaut. Nachfolgend<br />
sollen einige Strukturen von Molekülen noch genauer eingeführt werden.<br />
Aufgabe XXV<br />
Bauen Sie das CO 2 -, das CH 4 -, das NH 3 -, das C 2 H 4 - und das H 2 O-Molekül und vergleichen Sie<br />
deren räumliche Strukturen miteinander.<br />
linear:<br />
Die drei Atome des Kohlenstoffdioxid-Moleküls, CO 2 , liegen in einer<br />
Reihe. Die Winkel zwischen den beiden C = O-Doppelbindungen betragen<br />
180°. Die Anordnung wird als linear bezeichnet.<br />
O C O<br />
planar:<br />
Im Ethen-Molekül, C 2 H 4 , liegen alle Atome in einer Ebene. Diese<br />
Anordnung wird als planar bezeichnet.<br />
H<br />
C<br />
H<br />
H<br />
C<br />
H<br />
tetraedrisch: Das Methan-Molekül, CH 4 , wurde schon behandelt. Die Winkel zwischen<br />
den C - H-Bindungen betragen 109.5°. Die Struktur wird als tetraedrisch<br />
bezeichnet.<br />
H<br />
H<br />
H<br />
C<br />
H<br />
pyramidal:<br />
Im Ammoniak-Molekül, NH 3 , ist eine Wolke doppelt mit Elektronen<br />
besetzt. Diese nichtbindenden Elektronenpaare beanspruchen einen<br />
grösseren Raum als die bindenden Elektronenpaare. Dies führt zu einem<br />
geringfügig kleineren Winkel zwischen den Bindungen von 107°. Diese<br />
Anordnung wird als pyramidal bezeichnet.<br />
H N H<br />
H<br />
gewinkelt:<br />
Auch im Wasser-Molekül, H 2 O, führen die beiden nichtbindenden<br />
Elektronenpaare zu einem verringertem Bindungswinkel von 104°.<br />
Diese Anordnung wird als gewinkelt bezeichnet.<br />
H O H
19<br />
Aufgabe XXVI<br />
Bauen Sie folgende Moleküle und geben Sie die Bindungsverhältnisse wieder. Zeichnen Sie<br />
auch die Lewisformeln.<br />
a.) HCN b.) C 2 H 2 Br 2 c.) C 3 H 8 d.) H 2 S<br />
e.) CH 2 O f.) H 3 CNH 2 g.) H 3 COH h.) PCl 3<br />
i.) H 3 CCOOH j.) C 2 H<br />
Übung<br />
Gehen Sie die Theorie nochmals durch und Fragen Sie ihre(n) Tischnachbar(in) alle<br />
möglichen Begriffe aus diesem Kapitel ab. Versuchen Sie zusammen zu beschreiben, was der<br />
jeweilige Begriff aussagt.<br />
Setzen Sie sich abschliessend mit den Bildern auf dem Titelblatt auseinander und probieren<br />
Sie einen Bezug zur Theorie herzustellen.