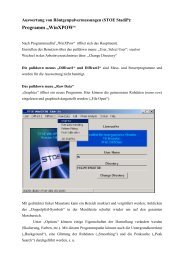
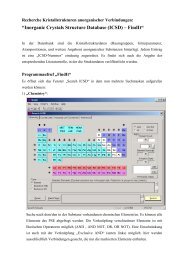
Praktikum „Anorganische Chemie für Lehramtskandidaten ...
Praktikum „Anorganische Chemie für Lehramtskandidaten ...
Praktikum „Anorganische Chemie für Lehramtskandidaten ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Praktikum</strong> <strong>„Anorganische</strong> <strong>Chemie</strong> <strong>für</strong> <strong>Lehramtskandidaten</strong>“ / Hauptstudium<br />
Das <strong>Praktikum</strong> findet über einen Zeitraum von fünf Wochen an jeweils einem Tag pro Woche<br />
statt. Es dient der Vertiefung bzw. Erweiterung der im Grundstudium erworbenen Kenntnisse und<br />
Fähigkeiten beim präparativen und analytischen Arbeiten. Es werden Versuche zur Darstellung<br />
und zur Charakterisierung anorganischer Substanzen durchgeführt. In der Regel wird in der<br />
letzten Präparatestufe der Ausgangsstoff wieder zurückgewonnen. Auf diesem Wege lernen die<br />
Studenten unterschiedliche Reaktionstypen und Verbindungsklassen kennen. Das Prinzip der<br />
Synthese in geschlossenen Kreisläufen soll u. a. Anregungen <strong>für</strong> die spätere selbständige Planung<br />
von Schulversuchen unter Berücksichtigung von Aspekten des Umweltschutzes und des<br />
sparsamen Umgangs mit Chemikalien vermitteln. Die Konzeption der Stoffkreisläufe zur <strong>Chemie</strong><br />
des Kupfers, Nickels und Cobalts erfolgte in Anlehnung an eine Publikation von V. Wiskamp et<br />
al. in <strong>Chemie</strong> in unserer Zeit 27(1993)48.<br />
Die zum Einsatz gelangenden physikalisch-chemischen Untersuchungsmethoden sind nur eine<br />
kleine Auswahl der Vielzahl von zur Charakterisierung von anorganischen Festkörpern<br />
verwendeten Methoden. Kenntnisse über weitere Methoden sind im Selbststudium und durch<br />
gegenseitige Information zu erwerben.<br />
Vor Beginn der praktischen Arbeiten findet eine <strong>Praktikum</strong>seinführung und<br />
Sicherheitsunterweisung statt. Informieren Sie sich bitte unabhängig davon über einige<br />
grundsätzliche Inhalte des Chemikaliengesetzes, der Gefahrstoffverordnung und der Technischen<br />
Regeln <strong>für</strong> Gefahrstoffe sowie über allgemeine Richtlinien <strong>für</strong> die Arbeit im Labor ( Jander,<br />
Blasius: Lehrbuch der analytischen und präparativen anorganischen <strong>Chemie</strong>, Auflage 1995,<br />
S.141-161). Zur Vorbereitung auf die jeweiligen <strong>Praktikum</strong>saufgaben gehört neben den<br />
Informationen über zu verwendende Synthese- und Charakterisierungsmethoden auch das<br />
Vertrautmachen mit den Eigenschaften der verwendeten Substanzen einschließlich ihrer R- und<br />
S-Sätze. Die entsprechenden Angaben sind Bestandteil der Protokolle.<br />
<strong>Praktikum</strong>sbegleitend finden in enger Anlehnung an die <strong>Praktikum</strong>saufgaben vier Seminar statt:<br />
1. Komplexverbindungen - Bindung, Struktur und Eigenschaften<br />
2. Thermische Analyse<br />
3. Strukturuntersuchung mit Röntgenstrahlung<br />
4. Syntheseprinzipien in der Anorganischen <strong>Chemie</strong><br />
Im vierten Seminar informieren sich die <strong>Praktikum</strong>steilnehmer durch Kurzvorträge gegenseitig<br />
über die jeweils durchgeführten Synthesen und die Eigenschaften der erhaltenen Produkte. Ziel<br />
des Seminars sind verallgemeinernde Aussagen über Syntheseprinzipien und die Vertiefung von<br />
Kenntnissen über ausgewählte (insbesondere anwendungsrelevante) Festkörpereigenschaften.<br />
Literatur:<br />
G. Brauer, Handbuch der präparativen anorganischen <strong>Chemie</strong>,<br />
Emke Verlag, Stuttgart 1975<br />
G. Jander, E. Blasius, Einführung in das anorganisch-chemische <strong>Praktikum</strong>,<br />
S.Hirzel Verlag, Stuttgart 1990<br />
G. Jander, E. Blasius, Lehrbuch der analytischen und präparativen<br />
anorganischen <strong>Chemie</strong>, S. Hirzel Verlag, Stuttgart 1995<br />
D. F. Shriver, P. W. Atkins, C. H. Langford, Anorganische <strong>Chemie</strong> - ein weiterführendes<br />
Lehrbuch, VCH, 1992<br />
A. R. West, Grundlagen der Festkörperchemie, VCH, 1992
2<br />
<strong>Chemie</strong> im Kreislauf ( Versuchsanleitungen s. u.)<br />
Cobaltkreislauf Kupferkreislauf Nickelkreislauf Eisenkreislauf<br />
CoCl 2 CuSO 4 NiCl 2 (NH 4 ) 2 Fe(SO 4 ) 2 • 6 H 2 O<br />
[Co(NH 3 ) 6 ]Cl 3 Cu(NH 3 ) 4 SO 4 Ni(NH 3 ) 6 Cl 2 Fe(C 2 O 4 ) x 2 H 2 O<br />
Co(CH 3 COO) . 2 4H 2 O K 2 [Cu(C 2 O 4 ) 2 ] NiCO 3 [K 3 Fe(C 2 O 4 ) 3 ] • 3 H 2 O<br />
(Zn,Co)(C 2 O 4 ) CuO Ni(CH 3 COO) 2 Fe 2 O 3<br />
ZnCo 2 O 4 CuCl 2 Ni(COO) 2 Fe(acac) 3<br />
K 3 [Co(NO 2 ) 6 ] Cu NiO Fe(NO 3 ) 3<br />
CoCl 2 CuCl NiCl 2 (NH 4 ) 2 Fe(SO 4 ) 2 • 6 H 2 O<br />
CuCl 2<br />
CuCO 3<br />
CuSO 4<br />
Fakultatives Versuchsangebot<br />
Für ergänzende und fakultative Versuche steht in einem begrenzten Umfang weitere Zeit zur<br />
Verfügung. Hier<strong>für</strong> können Versuche aus dem nachstehenden Angebot ausgewählt werden.<br />
Thénards Blau<br />
a.) Eine innige Mischung von 2 g Al 2 (SO 4 ) 3 ⋅ 18 H 2 O und 300 mg CoCl 2 ⋅ 6 H 2 O wird in einem<br />
Porzellantiegel langsam erwärmt, bis das Kristallwasser verdampft ist. Nach Abkühlen wird<br />
nochmals gut gemörsert und nun 30 bis 60 min auf Rotglut erhitzt. Nach dem Abkühlen wird der<br />
Schmelzkuchen mit verd. Salzsäure versetzt, bis nur noch ein leuchtend blauer Rückstand von<br />
CoAl 2 O 4 nicht in Lösung gegangen ist. Dieser wird abfiltriert, mit Wasser gewaschen und im<br />
Trockenschrank bei 100 °C getrocknet.<br />
b.) Zu einem stöchiometrischen Gemenge von CoO und Al 2 O 3 setzt man die 1,5fache<br />
Gewichtsmenge KCl zu und erhitzt im Pyrolantiegel auf 1100°C. Nach dem Abkühlen wird die<br />
erhaltene Schmelze mit Wasser ausgekocht, der Rückstand mit Wasser gewaschen und bei 60°C<br />
getrocknet.<br />
Literatur: Brauer (Auflage 1981), Band 3, S. 1699.<br />
Rinmanns Grün<br />
2g Zinkoxid und 200 mg CoCl 2 ⋅ 6 H 2 O werden innig gemischt und in einem Porzellantiegel<br />
langsam erwärmt. zunächst verdampft das Kristallwasser, dann wird etwa 15 bis 30 min bis zur<br />
gelinden Rotglut erhitzt, wobei sich die Mischung hellgrün färbt. Man lässt abkühlen, wäscht das<br />
Pulver (ZnCo 2 O 4 ) gründlich mit Wasser aus und trocknet es im Trockenschrank bei 100 °C.<br />
Literatur: V. Wiskamp, R. Bauer, K. Trageser, V. Wenzel, <strong>Chemie</strong> in unserer Zeit 27(1993)48.<br />
2
3<br />
Alchimistengold<br />
Man nehme ein Becherglas, in welchem einige 10 Cent-Münzen am Rand aufgestellt sind. Die<br />
Münzen werden mit einer schwach essigsauren Lösung von CuSO 4 (Massenanteil 1 bis 2 %) und<br />
NaCl (Massenanteil 10%) in Wasser bedeckt. Dabei soll die Flüssigkeit mindestens 1 cm über die<br />
Oberkante der Münzen reichen. Nach kurzer Zeit überzieht sich das Messing vom Rand her mit<br />
einem Kupferspiegel. Man sieht den Kupferüberzug gut, wenn man das Becherglas “von außen”<br />
betrachtet, die zur Mitte des Becherglases zeigende Münzseite sieht dagegen unverkupfert aus.<br />
Erklären Sie diesen überraschenden Befund! Nach einiger Zeit sind alle Messingschichten<br />
verkupfert, was man beim Herausnehmen der Münzen feststellen kann.<br />
Literatur: R. Lemke, Chemkon 3(1993)84; W. Jansen, Chemkon 4(1994)85.<br />
Das Kupferiodid-Gleichgewicht<br />
Man gibt in ein Reagensglas zu ca. 2 ml einer 1M Kupfersulfatlösung etwa 6 ml 1M KI-Lösung<br />
hinzu. Es bildet sich eine braune Suspension (Reaktionsgleichung?). Gibt man nun etwa 5 ml<br />
Pentan hinzu, setzt einen Stopfen auf und schüttelt kräftig durch, so erkennt man, dass sich die<br />
Pentanschicht violett färbt. Am Boden des Reagensglases erkennt man jetzt einen weißen<br />
Niederschlag. Man gibt nun etwa 5 ml Ammoniaklösung (Massenanteil NH 3 : 25%) und schüttelt<br />
wiederum kräftig durch. Die wässrige Phase wird nun intensiv blauviolett (Reaktionsgleichung?).<br />
Erklären Sie den Versuchsablauf unter Berücksichtigung folgender konditioneller<br />
Standardelektrodenpotentiale U o’ H : Cu/Cu ++ (aq): +0,34 V, Cu/Cu(NH 3 ) ++ 4 : -0,12 V.<br />
Literatur: W. van der Veer, P. de Rijke, Chemkon 6(1996)25.<br />
Anregungen <strong>für</strong> weitere Anorganisch-chemische Experimente:<br />
Blei- und Kupfergewinnung im Rahmen eines anorganischen <strong>Praktikum</strong>s<br />
Literatur: V. Wiskamp, H. Lüdtke, R. Gruehn, <strong>Chemie</strong> in unserer Zeit 30(1996)19.<br />
Aufarbeitung anorganischer Reste aus der organischen Synthese<br />
Literatur: V. Wiskamp, <strong>Chemie</strong> in unserer Zeit 29(1995)211.<br />
Eisen-, Calcium- und Kupfer-Kreisläufe<br />
Literatur: V. Kramb, W. Proske, V. Wiskamp, Naturwissenschaft im Unterricht-<strong>Chemie</strong><br />
7(1996)9. (weitere Versuche zu Kreisläufen ebenfalls in Heft 32)<br />
Silberrückgewinnung aus Röntgenfilmen<br />
Literatur: V. Kramb, A. Nickel, V. Wiskamb, Chemkon (1995)113.<br />
Löslichkeit von Kohlendioxid in Wasser - ein verblüffendes Experiment<br />
Literatur: W. van der Veer, P. deRijke, Chemkon (1994)83.<br />
3
4<br />
Seminare<br />
1. Seminar: Komplexverbindungen - Bindung, Struktur und Eigenschaften<br />
• Grundzüge der Ligandenfeldtheorie<br />
• Magnetische Eigenschaften von Komplexverbindungen<br />
• Optische Eigenschaften und spektrochemische Reihe<br />
• Koordinationszahl und Symmetrie<br />
• Thermodynamische und kinetische Stabilität von Komplexverbindungen<br />
• Besprechung der im <strong>Praktikum</strong> synthetisierten Komplexverbindungen<br />
Literatur: Atkins u. a.:Anorganische <strong>Chemie</strong>, Kap. 7,<br />
Christen, Meyer: Allg. u. Anorg. <strong>Chemie</strong>, Kap.6<br />
2. Seminar: Thermische Analyse<br />
• Thermodynamische Grundlagen<br />
• Methoden (DSC, DTA, TG, DTG)<br />
• Auswertung von Ergebnissen thermischer Analysen (insbesondere selbst synthetisierte<br />
Proben)<br />
Literatur: Autorenkollektiv: Analytikum , 9. Auflage 1994, Kap. 7: Thermische Analyse<br />
M. Otto: Analytische <strong>Chemie</strong>, Kap. 2.8. Thermische Methoden<br />
West: Festkörperchemie, Kap. 4.3.<br />
3. Seminar: Strukturuntersuchung mit Röntgenstrahlung<br />
• Kristallsysteme und Bravaisgitter<br />
• Wiederholung ausgewählter Kristallstrukturen<br />
• Röntgenbeugungs-Techniken<br />
• Prinzipieller Gang einer Röntgenstrukturanalyse<br />
• Auswertung des Röntgenpulverdiffraktogramms der vom Student synthetisierten Probe<br />
Literatur: West: Festkörperchemie, Kap. 1.1., 1.2., 1.3 exemplarisch, Kap. 3.<br />
zur Ergänzung: Atkins u. a.:Anorganische <strong>Chemie</strong>, Kap. 4, Kap. 18.<br />
4. Seminar: Syntheseprinzipien in der Anorganischen <strong>Chemie</strong><br />
Im Mittelpunkt des Seminars stehen die von den Studenten durchgeführten Synthesen<br />
(Kurzvorträge zur gegenseitigen Information). Ziel des Seminars sind einige verallgemeinernde<br />
Aussagen zum Seminarthema:<br />
• Wiederholende Behandlung von Reaktionen in Elektrolytlösungen (Chem. Gleichgewichte)<br />
• Reaktionen unter Beteiligung einer festen Phase und einer Gasphase<br />
• Reaktionen unter Beteiligung einer festen und einer flüssigen Phase (Lösung bzw.<br />
Schmelzphase)<br />
• Fest-fest-Reaktionen<br />
• Elektrische und magnetische Eigenschaften ausgewählter Festkörper<br />
Literatur: Atkins u. a.: Anorganische <strong>Chemie</strong>, Kap. 8.<br />
West: Festkörperchemie, Kap. 7, Kap. 8.1., 8.2. (auszugsweise)<br />
4
5<br />
<strong>Chemie</strong> des Cobalts<br />
1. <strong>Praktikum</strong>stag:<br />
C 1: [Co(NH 3 ) 6 ]Cl 3<br />
In einer Waschflasche gibt man zu 10 g Cobalt(II)chloridhexahydrat und 6,7 g<br />
Ammoniumchlorid 8 ml Wasser und schüttelt so lange, bis sich fast alles gelöst hat. Hierauf fügt<br />
man 20 ml konz. Ammoniak sowie 1 g Aktivkohle zu und saugt Sauerstoff durch das<br />
Reaktionsgemisch. Der Sauerstoffstrom darf nicht zu kräftig sein, da sonst der Ammoniakgehalt<br />
der Lösung verringert wird. Gegebenenfalls ergänzt man Verluste durch Zugabe einiger Milliliter<br />
konz. NH 3 .<br />
Sobald die anfänglich rote Lösung gelbbraun geworden ist (nach 30-45 min), wird das<br />
ausgefallene Komplexsalz zusammen mit der Aktivkohle abgenutscht. [Co(NH 3 ) 6 ]Cl 3 wird in<br />
1%iger Salzsäure in der Hitze gelöst (möglichst wenig Überschuss!). Die noch heiße Lösung<br />
filtriert man durch einen Faltenfilter.<br />
Aus der Lösung wird der Hexaamminkomplex durch Zusatz von 15 ml konz. Salzsäure und<br />
Abkühlung auf 0°C ausgefällt. Das Produkt wird abgenutscht, nach Entnahme der Mutterlauge<br />
zuerst mit 60%igem, dann mit wenig 96%igem Ethanol säurefrei gewaschen und an der Luft<br />
getrocknet.<br />
C 2. Zerstörung des Hexaamminkomplexes und Herstellung einer Cobaltchloridlösung<br />
Nach Auswage des nach C1 erhaltenen Co-Komplexes wird dieser in die vereinigten<br />
Mutterlaugen gegeben. Durch Zugabe von 10%iger NaOH wird die Lösung stark alkalisch<br />
gemacht (Gesamtverbrauch an NaOH etwa 50 bis 100 ml - in Abhängigkeit vom HCl-Gehalt der<br />
Mutterlaugen) und bis zum Verschwinden des Ammoniakgeruchs unter Rühren gekocht (der<br />
Vorgang nimmt 1 - 2 Stunden, u. U. auch noch längere Zeit, in Anspruch). Verdampftes Wasser<br />
wird von Zeit zu Zeit ersetzt. Es bildet sich schwarzes Cobaltoxidhydrat. Nach Erkalten der<br />
Suspension wird der Niederschlag abgesaugt und mit Wasser gut gewaschen. Das klare Filtrat<br />
wird in den Ausguss gegeben. Der Filterrückstand wird in etwa 10 ml halbkonzentrierter<br />
Salzsäure gelöst. Anschließend wird bis fast zur Trockne abgeraucht und mit etwa 50 ml Wasser<br />
aufgenommen.<br />
Auswertung: Achten Sie während des gesamten Löse-Abrauch-Löse-Prozesses auf die<br />
Farbänderungen.<br />
Ermitteln Sie durch Wägung die Versuchsausbeute!<br />
Begründen Sie die Farbunterschiede zwischen der Ausgangslösung und der<br />
Mutterlauge des Hexaamminkomplexes!<br />
[Co(NH 3 ) 6 ]Cl 3 ist diamagnetisch. Begründen Sie das anomal magnetische<br />
Verhalten!<br />
Vergleichen Sie die Bedingungen bei der Zersetzung des Komplexes mit denen bei<br />
der Zersetzung von Hexaamminnickel(II)chlorid und geben Sie eine Erklärung <strong>für</strong><br />
das unterschiedliche Verhalten!<br />
2. <strong>Praktikum</strong>stag<br />
C 3: Herstellung einer Cobaltacetatlösung und Gehaltsbestimmung<br />
Die im Versuch C2 erhaltene Lösung wird zum Sieden erhitzt. Anschließend wird in kleinen<br />
Portionen Soda hinzugefügt, bis das basische Cobaltcarbonat vollständig gefällt ist. Das Carbonat<br />
5
6<br />
wird abgesaugt, gründlich mit Wasser gewaschen und in der gerade notwendigen Menge einer<br />
Eisessig/ Wasser-Mischung (1:1) in der Hitze gelöst.<br />
Nach Abkühlung wird mit Wasser auf genau 100 ml verdünnt. Von der Lösung werden genau 5<br />
ml abpipettiert, welche im Maßkolben nach Zusatz von einigen Tropfen HNO 3 wiederum auf 100<br />
ml aufgefüllt werden. Von der erhaltenen Lösung werden mehrere 10 ml Proben<br />
komplexometrisch gegen Murexid titriert.<br />
Auswertung: Ermitteln Sie den Co-Gehalt in den verbleibenden 95 ml der konzentrierten Co-<br />
Acetat-Lösung und errechnen Sie die <strong>für</strong> den unter C4 beschriebenen<br />
Mischfällprozess erforderliche Menge an Zn(CH 3 COO) 2 . 2 H 2 O (Molverhältnis<br />
Co : Zn = 2 : 1)!<br />
3. <strong>Praktikum</strong>stag<br />
C 4: Mischfällung von Zn-Co-Oxalat<br />
Die nach C3 erhaltene Lösung von Cobaltacetat wird in ein Becherglas überführt und die zur<br />
Erzeugung einer Lösung mit dem Molverhältnis Co : Zn = 2 : 1 erforderliche Menge Zinkacetat<br />
hinzugefügt. Nach dessen Auflösung und guter Durchmischung wird die Lösung aus einer<br />
Bürette langsam in eine auf 60°C erwärmte etwa 0,5 molare Oxalsäurelösung getropft. Die<br />
Menge der Oxalsäure ist auf einen 5%igen Überschuss berechnet. Beim Zutropfen soll sich die<br />
Temperatur der Lösung möglichst wenig ändern. Nach Zugabe von wenigen ml Metallsalzlösung<br />
beginnt die Abscheidung schwerlöslicher Oxalatmischkristalle. Wenn die Fällung beendet ist,<br />
wird weitere 20 min bei 60°C gerührt. Die abgekühlte Suspension wird filtriert, das<br />
Oxalatfällprodukt mit Wasser, danach mit wenig Ethanol gewaschen und an der Luft getrocknet.<br />
Auswertung: Warum könnte eine Umkehrung des Zutropfens (Oxalsäure zu Metallsalz)<br />
eventuell schlechtere Fällprodukte im Hinblick auf eine Spinellbildung durch<br />
Zersetzung bei relativ niedriger Temperatur bringen?<br />
Thermische Analyse des Mischfällproduktes (Raumtemperatur bis 700°C),<br />
Zuordnung der DTA- und TG(DTG)-Effekte, Formulierung von Reaktionsgleichungen<br />
<strong>für</strong> die einzelnen Schritte der thermischen Zersetzung und Vergleich von<br />
theoretischen und experimentell ermittelten Masseverlusten.<br />
C 5. Thermische Zersetzung des Zn-Co-Oxalates<br />
Das Produkt aus C4 wird in einen Pyrolantiegel eingewogen und langsam mit dem Brenner<br />
erwärmt. Die Zersetzung beginnt am Tiegelrand und schreitet - unter Aufglühen - bis zur<br />
Tiegelmitte fort. Es entsteht ein nahezu schwarzes Zersetzungsprodukt. Nach weitgehender<br />
Abkühlung wird der Pyrolantiegel mit dem Produkt in einen Kammerofen überführt und auf<br />
700°C erhitzt. Nach Erreichen der Solltemperatur bleibt die Probe noch 2 Stunden im Ofen und<br />
wird anschließend auf Raumtemperatur gekühlt (Abschalten des Ofens). Zur Aufnahme eines<br />
Röntgenpulverdiffraktogramms wird eine entsprechende Probenmenge abgefüllt.<br />
Auswertung: Ermitteln Sie den Masseverlust bei der thermischen Zersetzung und vergleichen<br />
Sie mit den Ergebnissen der thermischen Analyse!<br />
Aufnahme des Rötgenpulverdiffraktogramms von ZnCo 2 O 4 (2Θ = 10....100°).<br />
Informieren Sie sich über die Struktur von ZnCo 2 O 4 !<br />
Was ist Rinmanns Grün?<br />
6
7<br />
4. <strong>Praktikum</strong>stag<br />
C 6: K 3 [Co(NO 2 ) 6 ]<br />
Das nach C5 erhaltene ZnCo 2 O 4 mit Spinellstruktur wird mit dem etwa dreifachen (im Vergleich<br />
zur theoretisch benötigten) Menge konzentrierter HCl in einem Becherglas in der Siedehitze<br />
gelöst (Abzug!). Die Lösung wird bis zur Trockne abgeraucht. Anschließend wird der Rückstand<br />
mit Wasser aufgenommen (falls keine vollständige Auflösung eintritt, werden wenige Tropfen<br />
verdünnter Schwefelsäure zugesetzt). Die erhaltene Lösung wird in einem Eisbad auf 0°C<br />
abgekühlt, mit einigen Tropfen Eisessig angesäuert und mit einer möglichst konzentrierten (!)<br />
wässrigen Lösung von 6 g KNO 2 pro 1 g an eingesetztem ZnCo 2 O 4 versetzt. Nach etwa einer<br />
Stunde wird der gebildete Cobaltkomplex abgesaugt, mit mehreren kleinen Portionen Wasser und<br />
zuletzt mit wenig Ethanol gewaschen und an der Luft oder im Trockenschrank bei 40 bis 50°C<br />
getrocknet.<br />
Auswertung: Beobachten Sie die Farbveränderungen während der gesamten Reaktionsfolge und<br />
geben Sie eine Erklärung, informieren Sie sich in diesem Zusammenhang über den<br />
Begriff “spektrochemische Reihe”!<br />
Formulieren Sie die Reaktionsgleichungen der ablaufenden Reaktionen!<br />
Informieren Sie sich im Zusammenhang mit dem sauren Aufschluß über<br />
allgemeine Säure-Base-Konzepte, insbesondere Oxidotropie!<br />
Werten Sie das Röntgenpulverdiffraktogramm der Probe C5 aus:<br />
Computersgestützte Phasenanalyse, Zuordnung aller Reflexe, Ermittlung der<br />
Gitterkonstante von ZnCo 2 O 4 !<br />
Bestimmen Sie die Ausbeute <strong>für</strong> den Reaktionsschritt C6!<br />
5. <strong>Praktikum</strong>stag<br />
C 7: Rückgewinnung von CoCl 2 . 6H 2 O<br />
Das in C6 gewonnene Hexanitrocobaltat wird in 10%ige Natronlauge gegeben (5 ml NaOH-<br />
Lösung pro 1g Komplex) und 30 bis 45 min gekocht. Verdampftes Wasser wird von Zeit zu Zeit<br />
ersetzt. Es bildet sich schwarzes Cobaltoxidhydrat. Nach einem halbstündigen Nachrühren bei<br />
Raumtemperatur wird abgesaugt und mit Wasser gut gewaschen. Das klare Filtrat wird<br />
verworfen. Den Filterrückstand löst man in möglichst wenig halbkonzentrierter Salzsäure und<br />
dampft unter dem Abzug langsam bis fast zur Trockne ein. Man läßt erkalten und ein bis zwei<br />
Tage mit Filtrierpapier abgedeckt unter dem Abzug stehen. Das Produkt wird zerkleinert und bis<br />
zur erneuten Verwendung in eine Pulverflasche abgefüllt.<br />
Auswertung: Ermittlung der Ausbeute bezüglich des gesamten Reaktionszyklus.<br />
Bei welchen Reaktionsschritten treten die größten Verluste auf?<br />
Diskutieren Sie den gesamten Reaktionszyklus und machen Sie Vorschläge <strong>für</strong><br />
eine Modifizierung und/oder Ausdehnung auf weitere Substanzen!<br />
7
1<br />
<strong>Praktikum</strong> <strong>„Anorganische</strong> <strong>Chemie</strong> <strong>für</strong> <strong>Lehramtskandidaten</strong>“ /<br />
Hauptstudium<br />
Das <strong>Praktikum</strong> findet über einen Zeitraum von fünf Wochen an jeweils einem Tag pro Woche<br />
statt. Es dient der Vertiefung bzw. Erweiterung der im Grundstudium erworbenen Kenntnisse<br />
und Fähigkeiten beim präparativen und analytischen Arbeiten. Es werden Versuche zur<br />
Darstellung und zur Charakterisierung anorganischer Substanzen durchgeführt. In der Regel<br />
wird in der letzten Präparatestufe der Ausgangsstoff wieder zurückgewonnen. Auf diesem<br />
Wege lernen die Studenten unterschiedliche Reaktionstypen und Verbindungsklassen kennen.<br />
Das Prinzip der Synthese in geschlossenen Kreisläufen soll u. a. Anregungen <strong>für</strong> die spätere<br />
selbständige Planung von Schulversuchen unter Berücksichtigung von Aspekten des<br />
Umweltschutzes und des sparsamen Umgangs mit Chemikalien vermitteln. Die Konzeption<br />
der Stoffkreisläufe zur <strong>Chemie</strong> des Kupfers, Nickels und Cobalts erfolgte in Anlehnung an<br />
eine Publikation von V. Wiskamp et al. in <strong>Chemie</strong> in unserer Zeit 27(1993)48.<br />
Die zum Einsatz gelangenden physikalisch-chemischen Untersuchungsmethoden sind nur<br />
eine kleine Auswahl der Vielzahl von zur Charakterisierung von anorganischen Festkörpern<br />
verwendeten Methoden. Kenntnisse über weitere Methoden sind im Selbststudium und durch<br />
gegenseitige Information zu erwerben.<br />
Vor Beginn der praktischen Arbeiten findet eine <strong>Praktikum</strong>seinführung und<br />
Sicherheitsunterweisung statt. Informieren Sie sich bitte unabhängig davon über einige<br />
grundsätzliche Inhalte des Chemikaliengesetzes, der Gefahrstoffverordnung und der<br />
Technischen Regeln <strong>für</strong> Gefahrstoffe sowie über allgemeine Richtlinien <strong>für</strong> die Arbeit im<br />
Labor ( Jander, Blasius: Lehrbuch der analytischen und präparativen anorganischen <strong>Chemie</strong>,<br />
Auflage 1995, S.141-161). Zur Vorbereitung auf die jeweiligen <strong>Praktikum</strong>saufgaben gehört<br />
neben den Informationen über zu verwendende Synthese- und Charakterisierungsmethoden<br />
auch das Vertrautmachen mit den Eigenschaften der verwendeten Substanzen einschließlich<br />
ihrer R- und S-Sätze. Die entsprechenden Angaben sind Bestandteil der Protokolle.<br />
<strong>Praktikum</strong>sbegleitend finden in enger Anlehnung an die <strong>Praktikum</strong>saufgaben vier Seminar<br />
statt:<br />
1. Komplexverbindungen - Bindung, Struktur und Eigenschaften<br />
2. Thermische Analyse<br />
3. Strukturuntersuchung mit Röntgenstrahlung<br />
4. Syntheseprinzipien in der Anorganischen <strong>Chemie</strong><br />
Im vierten Seminar informieren sich die <strong>Praktikum</strong>steilnehmer durch Kurzvorträge<br />
gegenseitig über die jeweils durchgeführten Synthesen und die Eigenschaften der erhaltenen<br />
Produkte. Ziel des Seminars sind verallgemeinernde Aussagen über Syntheseprinzipien und<br />
die Vertiefung von Kenntnissen über ausgewählte (insbesondere anwendungsrelevante)<br />
Festkörpereigenschaften.<br />
Literatur:<br />
G. Brauer, Handbuch der präparativen anorganischen <strong>Chemie</strong>,<br />
Emke Verlag, Stuttgart 1975<br />
G. Jander, E. Blasius, Einführung in das anorganisch-chemische <strong>Praktikum</strong>,<br />
S.Hirzel Verlag, Stuttgart 1990<br />
G. Jander, E. Blasius, Lehrbuch der analytischen und präparativen<br />
anorganischen <strong>Chemie</strong>, S. Hirzel Verlag, Stuttgart 1995<br />
D. F. Shriver, P. W. Atkins, C. H. Langford, Anorganische <strong>Chemie</strong> - ein weiterführendes<br />
Lehrbuch, VCH, 1992<br />
A. R. West, Grundlagen der Festkörperchemie, VCH, 1992<br />
1
2<br />
<strong>Chemie</strong> im Kreislauf ( Versuchsanleitungen s. u.)<br />
Cobaltkreislauf Kupferkreislauf Nickelkreislauf Eisenkreislauf<br />
CoCl 2 CuSO 4 NiCl 2 (NH 4 ) 2 Fe(SO 4 ) 2 • 6 H 2 O<br />
[Co(NH 3 ) 6 ]Cl 3 Cu(NH 3 ) 4 SO 4 Ni(NH 3 ) 6 Cl 2 Fe(C 2 O 4 ) x 2 H 2 O<br />
Co(CH 3 COO) . 2 4H 2 O K 2 [Cu(C 2 O 4 ) 2 ] NiCO 3 [K 3 Fe(C 2 O 4 ) 3 ] • 3 H 2 O<br />
(Zn,Co)(C 2 O 4 ) CuO Ni(CH 3 COO) 2 Fe 2 O 3<br />
ZnCo 2 O 4 CuCl 2 Ni(COO) 2 Fe(acac) 3<br />
K 3 [Co(NO 2 ) 6 ] Cu NiO Fe(NO 3 ) 3<br />
CoCl 2 CuCl NiCl 2 (NH 4 ) 2 Fe(SO 4 ) 2 • 6 H 2 O<br />
CuCl 2<br />
CuCO 3<br />
CuSO 4<br />
Fakultatives Versuchsangebot<br />
Für ergänzende und fakultative Versuche steht in einem begrenzten Umfang weitere Zeit zur<br />
Verfügung. Hier<strong>für</strong> können Versuche aus dem nachstehenden Angebot ausgewählt werden.<br />
Thénards Blau<br />
a.) Eine innige Mischung von 2 g Al 2 (SO 4 ) 3 ⋅ 18 H 2 O und 300 mg CoCl 2 ⋅ 6 H 2 O wird in<br />
einem Porzellantiegel langsam erwärmt, bis das Kristallwasser verdampft ist. Nach Abkühlen<br />
wird nochmals gut gemörsert und nun 30 bis 60 min auf Rotglut erhitzt. Nach dem Abkühlen<br />
wird der Schmelzkuchen mit verd. Salzsäure versetzt, bis nur noch ein leuchtend blauer<br />
Rückstand von CoAl 2 O 4 nicht in Lösung gegangen ist. Dieser wird abfiltriert, mit Wasser gewaschen<br />
und im Trockenschrank bei 100 °C getrocknet.<br />
b.) Zu einem stöchiometrischen Gemenge von CoO und Al 2 O 3 setzt man die 1,5fache<br />
Gewichtsmenge KCl zu und erhitzt im Pyrolantiegel auf 1100°C. Nach dem Abkühlen wird<br />
die erhaltene Schmelze mit Wasser ausgekocht, der Rückstand mit Wasser gewaschen und bei<br />
60°C getrocknet.<br />
Literatur: Brauer (Auflage 1981), Band 3, S. 1699.<br />
Rinmanns Grün<br />
2g Zinkoxid und 200 mg CoCl 2 ⋅ 6 H 2 O werden innig gemischt und in einem Porzellantiegel<br />
langsam erwärmt. zunächst verdampft das Kristallwasser, dann wird etwa 15 bis 30 min bis<br />
zur gelinden Rotglut erhitzt, wobei sich die Mischung hellgrün färbt. Man lässt abkühlen,<br />
wäscht das Pulver (ZnCo 2 O 4 ) gründlich mit Wasser aus und trocknet es im Trockenschrank<br />
bei 100 °C.<br />
Literatur: V. Wiskamp, R. Bauer, K. Trageser, V. Wenzel, <strong>Chemie</strong> in unserer Zeit<br />
27(1993)48.<br />
2
3<br />
Alchimistengold<br />
Man nehme ein Becherglas, in welchem einige 10 Cent-Münzen am Rand aufgestellt sind.<br />
Die Münzen werden mit einer schwach essigsauren Lösung von CuSO 4 (Massenanteil 1 bis 2<br />
%) und NaCl (Massenanteil 10%) in Wasser bedeckt. Dabei soll die Flüssigkeit mindestens 1<br />
cm über die Oberkante der Münzen reichen. Nach kurzer Zeit überzieht sich das Messing vom<br />
Rand her mit einem Kupferspiegel. Man sieht den Kupferüberzug gut, wenn man das<br />
Becherglas “von außen” betrachtet, die zur Mitte des Becherglases zeigende Münzseite sieht<br />
dagegen unverkupfert aus. Erklären Sie diesen überraschenden Befund! Nach einiger Zeit<br />
sind alle Messingschichten verkupfert, was man beim Herausnehmen der Münzen feststellen<br />
kann.<br />
Literatur: R. Lemke, Chemkon 3(1993)84; W. Jansen, Chemkon 4(1994)85.<br />
Das Kupferiodid-Gleichgewicht<br />
Man gibt in ein Reagensglas zu ca. 2 ml einer 1M Kupfersulfatlösung etwa 6 ml 1M KI-<br />
Lösung hinzu. Es bildet sich eine braune Suspension (Reaktionsgleichung?). Gibt man nun<br />
etwa 5 ml Pentan hinzu, setzt einen Stopfen auf und schüttelt kräftig durch, so erkennt man,<br />
dass sich die Pentanschicht violett färbt. Am Boden des Reagensglases erkennt man jetzt<br />
einen weißen Niederschlag. Man gibt nun etwa 5 ml Ammoniaklösung (Massenanteil NH 3 :<br />
25%) und schüttelt wiederum kräftig durch. Die wässrige Phase wird nun intensiv blauviolett<br />
(Reaktionsgleichung?).<br />
Erklären Sie den Versuchsablauf unter Berücksichtigung folgender konditioneller<br />
Standardelektrodenpotentiale U o’ H : Cu/Cu ++ (aq): +0,34 V, Cu/Cu(NH 3 ) ++ 4 : -0,12 V.<br />
Literatur: W. van der Veer, P. de Rijke, Chemkon 6(1996)25.<br />
Anregungen <strong>für</strong> weitere Anorganisch-chemische Experimente:<br />
Blei- und Kupfergewinnung im Rahmen eines anorganischen <strong>Praktikum</strong>s<br />
Literatur: V. Wiskamp, H. Lüdtke, R. Gruehn, <strong>Chemie</strong> in unserer Zeit 30(1996)19.<br />
Aufarbeitung anorganischer Reste aus der organischen Synthese<br />
Literatur: V. Wiskamp, <strong>Chemie</strong> in unserer Zeit 29(1995)211.<br />
Eisen-, Calcium- und Kupfer-Kreisläufe<br />
Literatur: V. Kramb, W. Proske, V. Wiskamp, Naturwissenschaft im Unterricht-<strong>Chemie</strong><br />
7(1996)9. (weitere Versuche zu Kreisläufen ebenfalls in Heft 32)<br />
Silberrückgewinnung aus Röntgenfilmen<br />
Literatur: V. Kramb, A. Nickel, V. Wiskamb, Chemkon (1995)113.<br />
Löslichkeit von Kohlendioxid in Wasser - ein verblüffendes Experiment<br />
Literatur: W. van der Veer, P. deRijke, Chemkon (1994)83.<br />
3
4<br />
Seminare<br />
1. Seminar: Komplexverbindungen - Bindung, Struktur und Eigenschaften<br />
• Grundzüge der Ligandenfeldtheorie<br />
• Magnetische Eigenschaften von Komplexverbindungen<br />
• Optische Eigenschaften und spektrochemische Reihe<br />
• Koordinationszahl und Symmetrie<br />
• Thermodynamische und kinetische Stabilität von Komplexverbindungen<br />
• Besprechung der im <strong>Praktikum</strong> synthetisierten Komplexverbindungen<br />
Literatur: Atkins u. a.:Anorganische <strong>Chemie</strong>, Kap. 7,<br />
Christen, Meyer: Allg. u. Anorg. <strong>Chemie</strong>, Kap.6<br />
2. Seminar: Thermische Analyse<br />
• Thermodynamische Grundlagen<br />
• Methoden (DSC, DTA, TG, DTG)<br />
• Auswertung von Ergebnissen thermischer Analysen (insbesondere selbst synthetisierte<br />
Proben)<br />
Literatur: Autorenkollektiv: Analytikum , 9. Auflage 1994, Kap. 7: Thermische Analyse<br />
M. Otto: Analytische <strong>Chemie</strong>, Kap. 2.8. Thermische Methoden<br />
West: Festkörperchemie, Kap. 4.3.<br />
3. Seminar: Strukturuntersuchung mit Röntgenstrahlung<br />
• Kristallsysteme und Bravaisgitter<br />
• Wiederholung ausgewählter Kristallstrukturen<br />
• Röntgenbeugungs-Techniken<br />
• Prinzipieller Gang einer Röntgenstrukturanalyse<br />
• Auswertung des Röntgenpulverdiffraktogramms der vom Student synthetisierten Probe<br />
Literatur: West: Festkörperchemie, Kap. 1.1., 1.2., 1.3 exemplarisch, Kap. 3.<br />
zur Ergänzung: Atkins u. a.:Anorganische <strong>Chemie</strong>, Kap. 4, Kap. 18.<br />
4. Seminar: Syntheseprinzipien in der Anorganischen <strong>Chemie</strong><br />
Im Mittelpunkt des Seminars stehen die von den Studenten durchgeführten Synthesen<br />
(Kurzvorträge zur gegenseitigen Information). Ziel des Seminars sind einige<br />
verallgemeinernde Aussagen zum Seminarthema:<br />
• Wiederholende Behandlung von Reaktionen in Elektrolytlösungen (Chem.<br />
Gleichgewichte)<br />
• Reaktionen unter Beteiligung einer festen Phase und einer Gasphase<br />
• Reaktionen unter Beteiligung einer festen und einer flüssigen Phase (Lösung bzw.<br />
Schmelzphase)<br />
• Fest-fest-Reaktionen<br />
• Elektrische und magnetische Eigenschaften ausgewählter Festkörper<br />
Literatur: Atkins u. a.: Anorganische <strong>Chemie</strong>, Kap. 8.<br />
West: Festkörperchemie, Kap. 7, Kap. 8.1., 8.2. (auszugsweise)<br />
4
5<br />
<strong>Chemie</strong> des Eisens<br />
1. <strong>Praktikum</strong>stag:<br />
D 1: Fe(C 2 O 4 ) x 2 H 2 O<br />
In einem Messkolben werden 50 ml einer Oxalsäurelösung durch Auflösung 5 g<br />
Oxalsäuredihydrat in Wasser hergestellt. Anschließend löst man 7,5 g (NH 4 ) 2 Fe(SO 4 ) 2 • 6 H 2 O<br />
(„Mohr’sches Salz“) unter Erwärmen in 25 ml Wasser. Zu der erhaltenen Fe(II)-Lösung<br />
werden unter Rühren und weiterem Erwärmen langsam 30 ml der vorher bereiteten<br />
Oxalsäurelösung hinzugefügt (die verbleibende Oxalsäurelösung wird <strong>für</strong> Versuch D 2<br />
aufbewahrt). Die erhaltene Suspension wird bis zum Sieden erhitzt, danach auf etwa 60°C<br />
abgekühlt und noch etwa 20 min bei dieser Temperatur gerührt. Es bildet sich gelbes<br />
Eisen(II)oxalat-dihydrat. Der Niederschlag wird durch einen Büchnertrichter filtriert,<br />
zunächst mit kaltem Wasser, dann mit Aceton gewaschen, scharf abgesaugt und nach<br />
Ausbreiten auf einem Filtrierpapier an der Luft getrocknet.<br />
Auswertung: Ermitteln Sie durch Wägung die Versuchsaubeute und behalten Sie ca. 100 mg<br />
des Niederschlags <strong>für</strong> eine thermische Analyse zurück!<br />
Thermische Analyse des Eisen(II)oxalatdihydrats (Raumtemperatur bis<br />
700°C), Zuordnung der DTA- und TG (DTG)-Effekte, Formulierung von<br />
Reaktionsgleichungen <strong>für</strong> die einzelnen Schritte der thermischen Zersetzung<br />
und Vergleich der theoretischen und experimentell ermittelten<br />
Massedifferenzen.<br />
D 2: [K 3 Fe(C 2 O 4 ) 3 ] • 3 H 2 O<br />
Zur Darstellung des Komplexes wird das nach D 1 erhaltene Eisen(II)oxalat-dihydrat in einer<br />
vorher erwärmten 1,8 M Kaliumoxalatlösung suspendiert (Herstellung der Lösung durch<br />
Auflösen von 5 g Kaliumoxalatmonohydrat in 15 ml Wasser, bei einer 95%-igen Ausbeute an<br />
Fe(II)oxalatdihydrat benötigt man 15 ml, die erforderliche stöchiometrische Menge ist aus der<br />
tatsächlichen Ausbeute zu berechnen – siehe auch unten stehende Reaktionsgleichungen). Die<br />
Suspension wird bei 40°C tropfenweise mit 12-13 ml einer 3%-igen H 2 O 2 -Lösung versetzt<br />
und anschließend zum Sieden erhitzt, wobei ein brauner Niederschlag von Fe(OH) 3 ausfällt.<br />
Zur siedenden Mischung werden nun in einem Guss 10 ml der unter D 1 hergestellten<br />
Oxalsäurelösung zugegeben. Wenn erforderlich, wird tropfenweise weitere Oxalsäurelösung<br />
zur siedenden Lösung hinzugefügt, bis diese völlig klar ist. Man berechne sich jedoch zuvor<br />
die benötigte Menge an Oxalsäure <strong>für</strong> die tatsächliche Ausbeute, um einen Überschuss zu<br />
vermeiden. Es laufen folgende Reaktionen ab:<br />
6 FeC 2 O 4 • 2 H 2 O + 3 H 2 O 2 + 6 K 2 C 2 O 4 → 4 K 3 [Fe(C 2 O 4 ) 3 ] + 2 Fe(OH) 3 + 12 H 2 O<br />
2 Fe(OH) 3 + 3 H 2 C 2 O 4 + 3 K 2 C 2 O 4 → 2 K 3 [Fe(C 2 O 4 ) 3 ] + 6 H 2 O<br />
Die grüne Lösung wird mit 15 ml Ethanol versetzt und im Dunkeln (Kristallisierschale in<br />
Alufolie einpacken) bis zum nächsten <strong>Praktikum</strong>stag zur Kristallisation im Laborschrank<br />
stehen gelassen.<br />
Auswertung: Informieren Sie sich über die magnetischen Eigenschaften der hergestellten<br />
Komplexverbindung und erklären Sie diese auf der Grundlage der<br />
Ligandenfeldtheorie!<br />
5
6<br />
2. <strong>Praktikum</strong>stag:<br />
D 3: Fe 2 O 3<br />
Das am vorangegangenen <strong>Praktikum</strong>stag präparierte Kaliumtrisoxalatoferrat wird abgesaugt,<br />
erst mit wenig kaltem Wasser und dann mit Ethanol gewaschen und getrocknet. Etwa 200mg<br />
Kaliumtrisoxalatoferrat werden <strong>für</strong> spätere Versuche lichtgeschützt aufgehoben<br />
(Untersuchungen zur Lichtempfindlichkeit). Die Hauptmenge wird gemörsert, nochmals<br />
gewogen und im Porzellantiegel über der Brennerflamme erhitzt. Beobachten Sie die<br />
Vorgänge während der ablaufenden Zersetzung und deuten Sie diese. Hat sich eine<br />
durchgängig rotbraune Schicht gebildet, so lässt man den Porzellantiegel abkühlen. Nach dem<br />
Erkalten wird mit einem Spatel die Kruste aufgekratzt. Befindet sich noch grünliche Substanz<br />
im Tiegel, wird erneut gemörsert und der Zersetzungsvorgang etwa 20 min bei 600 °C im<br />
Muffelofen fortgesetzt. Nach dem Erkalten wird das Gemisch mehrmals gründlich mit<br />
warmen Wasser und schließlich mit Ethanol gewaschen und im Trockenschrank bei ca. 150<br />
°C getrocknet. Prüfen Sie nach dem Trocknen die Substanz auf Carbonat! Bei einem positiven<br />
Nachweis wird nochmals gewaschen.<br />
Auswertung: Ermitteln Sie die Ausbeute an Fe 2 O 3 !<br />
Welche Farbe hat Ihre Substanz nach der Zersetzung und welche Komponenten<br />
sind in ihr enthalten?<br />
Ermitteln Sie den theoretischen Masseverlust bei der Zersetzung und<br />
vergleichen Sie mit dem experimentellen Ergebnis!<br />
Aufnahme des Röntgenpulverdiffraktogramms von Fe 2 O 3<br />
D 4: Kaliumtrisoxalatoferrat(III) als chemisches Aktinometer<br />
Kaliumtrisoxalatoferrat(III)-Lösungen können als chemisches Aktinometer verwendet<br />
werden. Chemische Aktinometer sind integrierende Empfänger, bei denen die<br />
Strahlungsmenge durch den Stoffumsatz einer photochemischen Reaktion bestimmt wird.<br />
Unter dem Einfluss von Licht läuft folgende Reaktion ab:<br />
2 Fe(C 2 O 4 ) 3<br />
3-<br />
→ 2 Fe 2+ + 5 C 2 O 4<br />
2-<br />
+ 2 CO 2<br />
Das entstandene Fe(II) wird als o-Phenanthrolinkomplex colorimetrisch bestimmt.<br />
Zur qualitativen Untersuchung der Lichtempfindlichkeit werden 0,3 g Kaliumtrisoxalatoferrat(III)-trihydrat<br />
(K 3 Fe(C 2 O 4 ) 3 • 3H 2 O) in einem 100 ml – Messkolben in etwa<br />
50ml Wasser gelöst. Nach Zugabe von 10 ml einer 0,1N Schwefelsäure und 5 ml<br />
Phenanthrolinlösung (0,12%ig) wird mit Wasser bis zur Markierung aufgefüllt. Bei allen<br />
Operationen ist eine stärkere Lichteinstrahlung auf die Lösung zu vermeiden. Deshalb wird<br />
die Lösung an einem wenig erleuchteten Platz hergestellt und der Messkolben wird bis dicht<br />
unter den Eichstrich mit Alufolie eingewickelt.<br />
Je 10 ml der Lösung werden in einem Reagenzglas<br />
a) 10 min dem diffusen Tageslicht ausgesetzt,<br />
b) 2 min mit einer UV-Lampe bestrahlt und danach 8 min im Dunkeln aufbewahrt,<br />
c) 10min im Dunkeln aufbewahrt.<br />
Anschließend wird die Farbe der Lösungen verglichen.<br />
Auswertung: Formulieren Sie die Reaktionsgleichung <strong>für</strong> die Komplexbildung mit o-<br />
Phenanthrolin und ziehen Sie Schlussfolgerungen aus dem Farbvergleich!<br />
6
7<br />
3. <strong>Praktikum</strong>stag<br />
D 5: Fe(acac) 3<br />
Das im Versuch D 3 erhaltene Fe 2 O 3 wird im dreifachen Überschuss an konz. Salzsäure in der<br />
Hitze gelöst. Nach vollständiger Auflösung wird mit Wasser auf ca. 250 ml verdünnt und<br />
das Eisen unter ständigem Rühren mit 25%-igem Ammoniak das Hydroxid gefällt. Die<br />
Suspension wird noch etwa 10 min nahe am Sieden gehalten. Anschließend wird das<br />
ausgefallene Eisenhydroxid in einen Büchner-Trichter überführt, abgesaugt und gründlich mit<br />
warmem Wasser, dem einige Tropfen NH 3 -Lösung zugesetzt wurden, gewaschen. Nach<br />
gutem Absaugen wird der noch feuchte Niederschlag in ein Becherglas überführt und in etwa<br />
100 ml Wasser aufgeschlämmt. Nach Zusatz von Acetylaceton im 100%igen Überschuss wird<br />
unter Rühren auf 70°C erwärmt und 30 min bei dieser Temperatur temperiert. Danach wird<br />
zur Vervollständigung der Kristallisation im Eisbad abgekühlt, das Produkt abfiltriert und an<br />
der Luft getrocknet.<br />
Auswertung: Das Produkt wird ausgewogen und die Ausbeute berechnet.<br />
Warum ist Trisacetylacetonato-Eisen (III) gut in organischen Lösungsmitteln<br />
löslich?<br />
4. <strong>Praktikum</strong>stag<br />
D 6: Herstellung einer Fe(NO 3 ) 3 -Lösung und Ermittlung des Fe-Gehaltes<br />
In einem hohen 600 ml Becherglas werden 30 ml konz. HNO 3 vorgelegt und nach Zusatz von<br />
etwas Trisacetylacetonato-Eisen (III) langsam erwärmt (Abzug, Heizplatte mit<br />
Magnetrührer!). Nach kurzer Zeit setzt eine heftige Reaktion ein, erkenntlich an der<br />
Entwicklung nitroser Gase. Nach dem Abklingen wird das restliche Acetylacetonat<br />
portionsweise mit dem Löffelspatel in die Lösung eingetragen. Danach wird die Salpetersäure<br />
bis nahezu zur Trockne abgeraucht und der Rückstand mit Wasser aufgenommen. Bei zu<br />
starkem Abrauchen müssen zur vollständigen Auflösung des Rückstandes gegebenenfalls<br />
wieder einige Tropfen Salpetersäure zugefügt werden.<br />
Die erhaltene Fe(NO 3 ) 3 -Lösung wird in einem Messkolben auf 100 ml mit Wasser aufgefüllt.<br />
Zur Ermittlung des Fe-Gehaltes der Lösung werden je nach Ausbeute an Acetylacetonat im<br />
Versuch D 5 fünf bis zehn ml entnommen und auf 100 ml verdünnt. Die Lösung soll <strong>für</strong> eine<br />
Rücktitration unter Verwendung von 0,01 M EDTA-Lsg. sowie 0,01 M Pb(NO 3 ) 2 -Lsg. mit<br />
Xylenolorange als Indikator geeignet sein. Der Farbumschlag erfolgt von gelb nach violett.<br />
Die ermittelte Stoffmenge an Eisen dient als Grundlage <strong>für</strong> die benötigten Stoffmengen an<br />
Ammoniumsulfat, Eisen und Schwefelsäure zur Rückgewinnung des Mohr’schen Salzes.<br />
5. <strong>Praktikum</strong>stag<br />
D 7: Rückgewinnung des Mohr’schen Salzes<br />
Die nach D 6 verbliebene Menge an Fe(NO 3 ) 3 -Lösung mit bekanntem Gehalt wird in ein<br />
Becherglas überführt. Nach Vedünnung auf etwa 250 ml wird wie in Versuch D 5 mit 25%-<br />
igem Ammoniak Eisen(III)hydroxid gefällt, abgesaugt und gewaschen, anschließend im<br />
Trockenschrank getrocknet. Das weitgehend getrocknete Eisenhydroxid wird in ein<br />
Becherglas überführt und mit einer berechneten Menge an 10%-iger Schwefelsäure<br />
aufgenommen. Anschließend wird Eisenpulver in geringem Überschuss zugesetzt und bis<br />
zum Anspringen der Reaktion gegebenenfalls etwas erhitzt. Ist die Redox-Reaktion<br />
7
8<br />
abgeschlossen, wird das überschüssige Eisenpulver abfiltriert und die berechnete Menge<br />
Ammoniumsulfat hinzugegeben. Den Kristallisationsbeginn kann man durch Kühlen im<br />
Eisbad unterstützen. Die Lösung muss zur Vervollständigung der Kristallisation u. U. über<br />
Nacht stehen bleiben. Die jeweils benötigten Stoffmengen werden unter Zugrundelegung der<br />
nachstehenden Reaktionsgleichung berechnet:<br />
2 Fe(OH) 3 + 3 H 2 SO 4 + Fe + 3 (NH 4 ) 2 SO 4 → 3 (NH 4 ) 2 Fe(SO 4 ) 2 + 6 H 2 O<br />
Nach Vervollständigung der Kristallisation wird das Mohr’sche Salz abgesaugt, mit Aceton<br />
gewaschen und getrocknet.<br />
Auswertung: Die Ausbeuten <strong>für</strong> die letzte Präparatestufe sowie <strong>für</strong> den Gesamtzyklus sind<br />
zu berechnen<br />
Um welchen Faktor muss die Ausbeute korrigiert werden, um den tatsächlichen<br />
Verlust im durchgeführten Kreislauf zu bestimmen?<br />
Bei eventuell am 3. und 4. <strong>Praktikum</strong>stag auftretenden Leerlaufzeiten kann in Absprache mit<br />
dem Assistenten ein Versuch aus dem fakultativen Versuchsangebot durchgeführt werden.<br />
8
<strong>Praktikum</strong> <strong>„Anorganische</strong> <strong>Chemie</strong> <strong>für</strong> <strong>Lehramtskandidaten</strong>“ / Hauptstudium<br />
Das <strong>Praktikum</strong> findet über einen Zeitraum von fünf Wochen an jeweils einem Tag pro Woche<br />
statt. Es dient der Vertiefung bzw. Erweiterung der im Grundstudium erworbenen Kenntnisse und<br />
Fähigkeiten beim präparativen und analytischen Arbeiten. Es werden Versuche zur Darstellung<br />
und zur Charakterisierung anorganischer Substanzen durchgeführt. In der Regel wird in der<br />
letzten Präparatestufe der Ausgangsstoff wieder zurückgewonnen. Auf diesem Wege lernen die<br />
Studenten unterschiedliche Reaktionstypen und Verbindungsklassen kennen. Das Prinzip der<br />
Synthese in geschlossenen Kreisläufen soll u. a. Anregungen <strong>für</strong> die spätere selbständige Planung<br />
von Schulversuchen unter Berücksichtigung von Aspekten des Umweltschutzes und des<br />
sparsamen Umgangs mit Chemikalien vermitteln. Die Konzeption der Stoffkreisläufe zur <strong>Chemie</strong><br />
des Kupfers, Nickels und Cobalts erfolgte in Anlehnung an eine Publikation von V. Wiskamp et<br />
al. in <strong>Chemie</strong> in unserer Zeit 27(1993)48.<br />
Die zum Einsatz gelangenden physikalisch-chemischen Untersuchungsmethoden sind nur eine<br />
kleine Auswahl der Vielzahl von zur Charakterisierung von anorganischen Festkörpern<br />
verwendeten Methoden. Kenntnisse über weitere Methoden sind im Selbststudium und durch<br />
gegenseitige Information zu erwerben.<br />
Vor Beginn der praktischen Arbeiten findet eine <strong>Praktikum</strong>seinführung und<br />
Sicherheitsunterweisung statt. Informieren Sie sich bitte unabhängig davon über einige<br />
grundsätzliche Inhalte des Chemikaliengesetzes, der Gefahrstoffverordnung und der Technischen<br />
Regeln <strong>für</strong> Gefahrstoffe sowie über allgemeine Richtlinien <strong>für</strong> die Arbeit im Labor ( Jander,<br />
Blasius: Lehrbuch der analytischen und präparativen anorganischen <strong>Chemie</strong>, Auflage 1995,<br />
S.141-161). Zur Vorbereitung auf die jeweiligen <strong>Praktikum</strong>saufgaben gehört neben den<br />
Informationen über zu verwendende Synthese- und Charakterisierungsmethoden auch das<br />
Vertrautmachen mit den Eigenschaften der verwendeten Substanzen einschließlich ihrer R- und<br />
S-Sätze. Die entsprechenden Angaben sind Bestandteil der Protokolle.<br />
<strong>Praktikum</strong>sbegleitend finden in enger Anlehnung an die <strong>Praktikum</strong>saufgaben vier Seminar statt:<br />
1. Komplexverbindungen - Bindung, Struktur und Eigenschaften<br />
2. Thermische Analyse<br />
3. Strukturuntersuchung mit Röntgenstrahlung<br />
4. Syntheseprinzipien in der Anorganischen <strong>Chemie</strong><br />
Im vierten Seminar informieren sich die <strong>Praktikum</strong>steilnehmer durch Kurzvorträge gegenseitig<br />
über die jeweils durchgeführten Synthesen und die Eigenschaften der erhaltenen Produkte. Ziel<br />
des Seminars sind verallgemeinernde Aussagen über Syntheseprinzipien und die Vertiefung von<br />
Kenntnissen über ausgewählte (insbesondere anwendungsrelevante) Festkörpereigenschaften.<br />
Literatur:<br />
G. Brauer, Handbuch der präparativen anorganischen <strong>Chemie</strong>,<br />
Emke Verlag, Stuttgart 1975<br />
G. Jander, E. Blasius, Einführung in das anorganisch-chemische <strong>Praktikum</strong>,<br />
S.Hirzel Verlag, Stuttgart 1990<br />
G. Jander, E. Blasius, Lehrbuch der analytischen und präparativen<br />
anorganischen <strong>Chemie</strong>, S. Hirzel Verlag, Stuttgart 1995<br />
D. F. Shriver, P. W. Atkins, C. H. Langford, Anorganische <strong>Chemie</strong> - ein weiterführendes<br />
Lehrbuch, VCH, 1992<br />
A. R. West, Grundlagen der Festkörperchemie, VCH, 1992<br />
<strong>Chemie</strong> im Kreislauf ( Versuchsanleitungen s. u.)
2<br />
Cobaltkreislauf Kupferkreislauf Nickelkreislauf Eisenkreislauf<br />
CoCl 2 CuSO 4 NiCl 2 (NH 4 ) 2 Fe(SO 4 ) 2 • 6 H 2 O<br />
[Co(NH 3 ) 6 ]Cl 3 Cu(NH 3 ) 4 SO 4 Ni(NH 3 ) 6 Cl 2 Fe(C 2 O 4 ) x 2 H 2 O<br />
Co(CH 3 COO) . 2 4H 2 O K 2 [Cu(C 2 O 4 ) 2 ] NiCO 3 [K 3 Fe(C 2 O 4 ) 3 ] •<br />
3 H 2 O<br />
(Zn,Co)(C 2 O 4 ) CuO Ni(CH 3 COO) 2 Fe 2 O 3<br />
ZnCo 2 O 4 CuCl 2 Ni(COO) 2 Fe(acac) 3<br />
K 3 [Co(NO 2 ) 6 ] Cu NiO Fe(NO 3 ) 3<br />
CoCl 2 CuCl NiCl 2 (NH 4 ) 2 Fe(SO 4 ) 2 • 6 H 2 O<br />
CuCl 2<br />
CuCO 3<br />
CuSO 4<br />
Fakultatives Versuchsangebot<br />
Für ergänzende und fakultative Versuche steht in einem begrenzten Umfang weitere Zeit zur<br />
Verfügung. Hier<strong>für</strong> können Versuche aus dem nachstehenden Angebot ausgewählt werden.<br />
Thénards Blau<br />
a.) Eine innige Mischung von 2 g Al 2 (SO 4 ) 3 ⋅ 18 H 2 O und 300 mg CoCl 2 ⋅ 6 H 2 O wird in einem<br />
Porzellantiegel langsam erwärmt, bis das Kristallwasser verdampft ist. Nach Abkühlen wird<br />
nochmals gut gemörsert und nun 30 bis 60 min auf Rotglut erhitzt. Nach dem Abkühlen wird der<br />
Schmelzkuchen mit verd. Salzsäure versetzt, bis nur noch ein leuchtend blauer Rückstand von<br />
CoAl 2 O 4 nicht in Lösung gegangen ist. Dieser wird abfiltriert, mit Wasser gewaschen und im<br />
Trockenschrank bei 100 °C getrocknet.<br />
b.) Zu einem stöchiometrischen Gemenge von CoO und Al 2 O 3 setzt man die 1,5fache<br />
Gewichtsmenge KCl zu und erhitzt im Pyrolantiegel auf 1100°C. Nach dem Abkühlen wird die<br />
erhaltene Schmelze mit Wasser ausgekocht, der Rückstand mit Wasser gewaschen und bei 60°C<br />
getrocknet.<br />
Literatur: Brauer (Auflage 1981), Band 3, S. 1699.<br />
Rinmanns Grün<br />
2g Zinkoxid und 200 mg CoCl 2 ⋅ 6 H 2 O werden innig gemischt und in einem Porzellantiegel<br />
langsam erwärmt. zunächst verdampft das Kristallwasser, dann wird etwa 15 bis 30 min bis zur<br />
gelinden Rotglut erhitzt, wobei sich die Mischung hellgrün färbt. Man lässt abkühlen, wäscht das<br />
Pulver (ZnCo 2 O 4 ) gründlich mit Wasser aus und trocknet es im Trockenschrank bei 100 °C.<br />
Literatur: V. Wiskamp, R. Bauer, K. Trageser, V. Wenzel, <strong>Chemie</strong> in unserer Zeit 27(1993)48.<br />
Alchimistengold<br />
2
3<br />
Man nehme ein Becherglas, in welchem einige 10 Cent-Münzen am Rand aufgestellt sind. Die<br />
Münzen werden mit einer schwach essigsauren Lösung von CuSO 4 (Massenanteil 1 bis 2 %) und<br />
NaCl (Massenanteil 10%) in Wasser bedeckt. Dabei soll die Flüssigkeit mindestens 1 cm über die<br />
Oberkante der Münzen reichen. Nach kurzer Zeit überzieht sich das Messing vom Rand her mit<br />
einem Kupferspiegel. Man sieht den Kupferüberzug gut, wenn man das Becherglas “von außen”<br />
betrachtet, die zur Mitte des Becherglases zeigende Münzseite sieht dagegen unverkupfert aus.<br />
Erklären Sie diesen überraschenden Befund! Nach einiger Zeit sind alle Messingschichten<br />
verkupfert, was man beim Herausnehmen der Münzen feststellen kann.<br />
Literatur: R. Lemke, Chemkon 3(1993)84; W. Jansen, Chemkon 4(1994)85.<br />
Das Kupferiodid-Gleichgewicht<br />
Man gibt in ein Reagensglas zu ca. 2 ml einer 1M Kupfersulfatlösung etwa 6 ml 1M KI-Lösung<br />
hinzu. Es bildet sich eine braune Suspension (Reaktionsgleichung?). Gibt man nun etwa 5 ml<br />
Pentan hinzu, setzt einen Stopfen auf und schüttelt kräftig durch, so erkennt man, dass sich die<br />
Pentanschicht violett färbt. Am Boden des Reagensglases erkennt man jetzt einen weißen<br />
Niederschlag. Man gibt nun etwa 5 ml Ammoniaklösung (Massenanteil NH 3 : 25%) und schüttelt<br />
wiederum kräftig durch. Die wässrige Phase wird nun intensiv blauviolett (Reaktionsgleichung?).<br />
Erklären Sie den Versuchsablauf unter Berücksichtigung folgender konditioneller<br />
Standardelektrodenpotentiale U H o’ : Cu/Cu ++ (aq): +0,34 V, Cu/Cu(NH 3 ) 4 ++ : -0,12 V.<br />
Literatur: W. van der Veer, P. de Rijke, Chemkon 6(1996)25.<br />
Anregungen <strong>für</strong> weitere Anorganisch-chemische Experimente:<br />
Blei- und Kupfergewinnung im Rahmen eines anorganischen <strong>Praktikum</strong>s<br />
Literatur: V. Wiskamp, H. Lüdtke, R. Gruehn, <strong>Chemie</strong> in unserer Zeit 30(1996)19.<br />
Aufarbeitung anorganischer Reste aus der organischen Synthese<br />
Literatur: V. Wiskamp, <strong>Chemie</strong> in unserer Zeit 29(1995)211.<br />
Eisen-, Calcium- und Kupfer-Kreisläufe<br />
Literatur: V. Kramb, W. Proske, V. Wiskamp, Naturwissenschaft im Unterricht-<strong>Chemie</strong><br />
7(1996)9. (weitere Versuche zu Kreisläufen ebenfalls in Heft 32)<br />
Silberrückgewinnung aus Röntgenfilmen<br />
Literatur: V. Kramb, A. Nickel, V. Wiskamb, Chemkon (1995)113.<br />
Löslichkeit von Kohlendioxid in Wasser - ein verblüffendes Experiment<br />
Literatur: W. van der Veer, P. deRijke, Chemkon (1994)83.<br />
Seminare<br />
3
4<br />
1. Seminar: Komplexverbindungen - Bindung, Struktur und Eigenschaften<br />
• Grundzüge der Ligandenfeldtheorie<br />
• Magnetische Eigenschaften von Komplexverbindungen<br />
• Optische Eigenschaften und spektrochemische Reihe<br />
• Koordinationszahl und Symmetrie<br />
• Thermodynamische und kinetische Stabilität von Komplexverbindungen<br />
• Besprechung der im <strong>Praktikum</strong> synthetisierten Komplexverbindungen<br />
Literatur: Atkins u. a.:Anorganische <strong>Chemie</strong>, Kap. 7,<br />
Christen, Meyer: Allg. u. Anorg. <strong>Chemie</strong>, Kap.6<br />
2. Seminar: Thermische Analyse<br />
• Thermodynamische Grundlagen<br />
• Methoden (DSC, DTA, TG, DTG)<br />
• Auswertung von Ergebnissen thermischer Analysen (insbesondere selbst synthetisierte<br />
Proben)<br />
Literatur: Autorenkollektiv: Analytikum , 9. Auflage 1994, Kap. 7: Thermische Analyse<br />
M. Otto: Analytische <strong>Chemie</strong>, Kap. 2.8. Thermische Methoden<br />
West: Festkörperchemie, Kap. 4.3.<br />
3. Seminar: Strukturuntersuchung mit Röntgenstrahlung<br />
• Kristallsysteme und Bravaisgitter<br />
• Wiederholung ausgewählter Kristallstrukturen<br />
• Röntgenbeugungs-Techniken<br />
• Prinzipieller Gang einer Röntgenstrukturanalyse<br />
• Auswertung des Röntgenpulverdiffraktogramms der vom Student synthetisierten Probe<br />
Literatur: West: Festkörperchemie, Kap. 1.1., 1.2., 1.3 exemplarisch, Kap. 3.<br />
zur Ergänzung: Atkins u. a.:Anorganische <strong>Chemie</strong>, Kap. 4, Kap. 18.<br />
4. Seminar: Syntheseprinzipien in der Anorganischen <strong>Chemie</strong><br />
Im Mittelpunkt des Seminars stehen die von den Studenten durchgeführten Synthesen<br />
(Kurzvorträge zur gegenseitigen Information). Ziel des Seminars sind einige verallgemeinernde<br />
Aussagen zum Seminarthema:<br />
• Wiederholende Behandlung von Reaktionen in Elektrolytlösungen (Chem. Gleichgewichte)<br />
• Reaktionen unter Beteiligung einer festen Phase und einer Gasphase<br />
• Reaktionen unter Beteiligung einer festen und einer flüssigen Phase (Lösung bzw.<br />
Schmelzphase)<br />
• Fest-fest-Reaktionen<br />
• Elektrische und magnetische Eigenschaften ausgewählter Festkörper<br />
Literatur: Atkins u. a.: Anorganische <strong>Chemie</strong>, Kap. 8.<br />
West: Festkörperchemie, Kap. 7, Kap. 8.1., 8.2. (auszugsweise)<br />
4
5<br />
<strong>Chemie</strong> des Kupfers<br />
1. <strong>Praktikum</strong>stag<br />
A 1: [Cu(NH 3 ) 4 ]SO 4 ⋅ H 2 O<br />
10 g CuSO 4 ⋅ 5H 2 O werden unter Erwärmen in 20 ml H 2 O gelöst und mit 40 ml konz. Ammoniaklösung<br />
versetzt. (Ein intermediär gebildeter Niederschlag von Cu(OH) 2 geht wieder in Lösung.)<br />
Die klare, tiefblaue Lösung wird langsam unter Rühren in 60 ml Ethanol eingetragen.<br />
Dabei fällt der Cu-Amminkomplex in Form blauer Kristalle aus. Er wird abgesaugt und dreimal<br />
mit jeweils 4 ml Ethanol ausgewaschen. Man saugt 5 bis 10 Minuten Luft durch den<br />
Filterkuchen. Danach ist der ausreichend trocken. Der isolierte Komplex wird in Versuch A2<br />
weiterverarbeitet, seine Mutterlauge im Versuch A4.<br />
Auswertung: Begründen Sie die Farbänderung der Lösung bei der Bildung des<br />
Amminkomplexes (Ligandenfeldtheorie, spektrochemische Reihe)!<br />
A 2: K 2 [Cu(C 2 O 4 ) 2 ] ⋅ 2 H 2 O<br />
Warum wird die Löslichkeit des Komplexes durch Zusatz von Ethanol<br />
herabgesetzt?<br />
Das gesamte Produkt aus Versuch A1 wird verwendet und der Ansatz entsprechend umgerechnet:<br />
24,4 g K 2 C 2 O 4 ⋅ H 2 O werden in 80 ml Wasser in der Siedehitze gelöst. Zu der heißen Lösung<br />
gibt man tropfenweise eine Lösung von 8 g [Cu(NH 3 ) 4 ]SO 4 ⋅ H 2 O in 20 ml Wasser, dem einige<br />
Tropfen konz. NH 3 zugesetzt sind. Man lässt langsam auf Zimmertemperatur abkühlen, wobei<br />
türkisblaue Kristalle ausfallen. Dann gibt man tropfenweise Schwefelsäure zu, bis die tiefblaue<br />
Farbe der überstehenden Lösung (unumgesetzter Cu-Amminkomplex) verschwunden ist und lässt<br />
zur Vervollständigung der Kristallisation noch etwa 30 min stehen. Anschließend werden die<br />
Kristalle abgesaugt, mit wenig Eiswasser gewaschen, zwischen Filtrierpapier trockengepresst und<br />
über Nacht im Exsikkator über Blaugel getrocknet. Das kristalline Produkt wird im Versuch A 3<br />
weiterverwendet, die Mutterlauge im Versuch A 4.<br />
Auswertung: DTA/TG des Oxalatkomplexes, Zuordnung der thermischen Effekte, Formulierung<br />
der Reaktionsgleichungen <strong>für</strong> die thermische Zersetzung und Vergleich der<br />
theoretischen und experimentell ermittelten Massendifferenzen<br />
2. <strong>Praktikum</strong>stag<br />
A 3: Cu-Gewinnung aus K 2 [Cu(C 2 O 4 ) 2 ] ⋅ 2 H 2 O<br />
Das gesamte Produkt aus Versuch A2 wird in einen Porzellantiegel eingewogen. Man erwärmt<br />
langsam mit dem Brenner. Die Verbrennung beginnt am Tiegelrand und schreitet - gelegentlich<br />
unter Aufglühen - bis zur Tiegelmitte fort. Es entsteht CuO (Reaktionsgleichung!). Man entfernt<br />
den Brenner, lässt auf Raumtemperatur abkühlen und gibt den Tiegelinhalt in ein Becherglas.<br />
Darin wird er vorsichtig mit halbkonzentrierter Salzsäure versetzt. (Reaktionsgleichungen!). Die<br />
tiefgrüne Lösung wird innerhalb von 30 Minuten portionsweise mit Eisenpulver (0,2g Fe pro<br />
1,0g K 2 [Cu(C 2 O 4 ) 2 ] ⋅ 2 H 2 O) versetzt. gegebenenfalls muss etwas HCl nachdosiert werden, um<br />
den pH-Wert im sauren Bereich zu halten und um überschüssiges Eisen zu FeCl 2 zu oxidieren.<br />
Die Vollständigkeit der Auflösung von überschüssigem Fe erkennt man an der Beendigung der<br />
Gasentwicklung. Die ausgefallenen Kupferflocken werden abfiltriert, mit verdünnter Salzsäure<br />
5
6<br />
gewaschen, im Trockenschrank getrocknet und im Versuch A5 weiterverwendet. Das Filtrat wird<br />
durch Zugabe von etwas Eisenpulver auf Vollständigkeit der Cu-Zementation geprüft. Danach<br />
wird mit Natronlauge neutralisiert, filtriert und das durch die Fe 2+ -Ionen nur noch schwach grün<br />
gefärbte Filtrat in den Ausguss gegeben.<br />
Auswertung: Beobachten Sie den Verlauf der Zersetzung des Oxalatokomplexes genau und<br />
ziehen Sie Schlussfolgerungen bezüglich der Wärmetönung der ablaufenden<br />
Reaktionen!<br />
Welche Reaktionsprodukte erwarten Sie bei Durchführung der Zersetzung des<br />
Komplexes in Stickstoffatmosphäre?<br />
Vertiefen Sie Ihre Kenntnisse über Redoxreaktionen durch das Studium von<br />
Kapitel 8 im Lehrbuch AC von Shriver, Atkins und Langford!<br />
A4: Cu-Gewinnung aus den Mutterlaugen von Versuch A1 und A2<br />
Die Mutterlauge aus dem Versuch A1 wird weitgehend eingedampft, um den Alkohol zu vertreiben.<br />
Das Konzentrat wird zu der Mutterlauge aus dem Versuch A2 gegeben. Es wird mit HCl<br />
angesäuert. Danach werden so lange kleine Mengen Eisenpulver zugegeben, bis kein Cu-Metall<br />
mehr ausfällt. Ein eventuell auftretender weißer Konzentrationsniederschlag wird durch<br />
Erwärmen und gegebenenfalls Verdünnung mit Wasser in Lösung gebracht. Das Kupfer wird wie<br />
in A3 isoliert und in Versuch A5 weiterverwendet. Sollte die Cu- Probe noch sichtlich durch<br />
anhaftende schwerlösliche Niederschläge verunreinigt sein (um welche Verbindung kann es sich<br />
handeln?), wird sie vor der Vereinigung mit der Probe aus A3 mit wenig konzentrierter HCl<br />
ausgekocht und nochmals wie in A3 isoliert.<br />
Auswertung: Ausbeuteberechnung , Aufnahme des Röntgenpulverdiffraktogramms von Kupfer<br />
aus den Versuchen A3 und A4 ( 2Θ = 10....100°).<br />
3. <strong>Praktikum</strong>stag<br />
Dichtebestimmung des erhaltenen Kupfers.<br />
Auswertung: Sie erhalten die Röntgenpulverdiffraktogramme der in A3 und A4 hergestellten<br />
Kupferproben. Werten Sie diese unter folgenden Gesichtspunkten aus:<br />
-Reinheit der Produkte<br />
-Zuordnung der Röntgenreflexe (rechnergestützte Phasenanalyse)<br />
-Indizierung der Cu-Reflexe<br />
-Berechnung der Gitterparameter<br />
-Ermittlung der “Röntgendichte” und Vergleich mit der experimentell ermittelten<br />
Dichte.<br />
4. <strong>Praktikum</strong>stag<br />
A5: CuCl<br />
Die aus den Versuchen A3 und A4 erhaltenen Cu-Mengen werden vollständig verwendet. Der<br />
Ansatz wird entsprechend umgerechnet:<br />
5 g CuSO 4 ⋅ 5 H 2 O und 2,6 g NaCl werden in 40 ml konz. HCl gelöst. Man gibt 1,4 g<br />
Kupferpulver hinzu und hält den Ansatz am Sieden (Siedestab und Uhrglas verwenden). Die<br />
6
7<br />
tiefgrüne Färbung verschwindet, der Ansatz wird hellgelb bis farblos, die Kupfermenge nimmt<br />
deutlich ab. Es bildet sich der Chlorokomplex des einwertigen Kupfers, der als Natriumsalz<br />
Na[CuCl 2 ] zunächst in Lösung gehalten wird.<br />
In einem Becherglas werden während der Kochzeit bereits 300 ml Wasser, dem einige Körnchen<br />
Natriumsulfit zugesetzt sind (warum?), vorgelegt und im Eisbad gekühlt.<br />
Die Reaktionslösung filtriert man direkt in das eisgekühlte Wasser. Weißes CuCl fällt aus, wird<br />
abgesaugt und mit ganz wenig Ethanol trockengewaschen. Es wird in Versuch A6 weiterverwendet.<br />
Die Mutterlauge kann - falls sie weitgehend farblos ist - in den Ausguss gegeben<br />
werden. Ist sie jedoch von nicht reduziertem Cu 2+ noch blaugrün gefärbt, wird etwas<br />
Wasserstoffperoxidlösung zugegeben, mit Soda auf einen pH von 11 bis 13 gebracht und<br />
gekocht. Ausgefallenes CuCO 3 /CuO wird mit event. vorhandenem CuCO 3 /CuO-Niederschlag aus<br />
dem Recyclingversuch A6 zu Kupfervitriol aufgearbeitet.<br />
Auswertung: Formulieren Sie die Reaktionsgleichung <strong>für</strong> die Bildung von CuCl!<br />
Wie bezeichnet man derartige Reaktionen?<br />
Berechnen Sie die Gleichgewichtskonstante der Gesamtreaktion und diskutieren<br />
Sie das Ergebnis! ( U H o Werte: Cu/Cu + : 0,55V; Cu + /Cu ++ : 0,15V; pK L (CuCl) = 6 )<br />
Etwa 100 mg des trockenen Niederschlags werden in wenig verdünnter<br />
Schwefelsäure unter Zugabe von 1 ml 30%igem H 2 O 2 gelöst und in einem<br />
Maßkolben auf 100 ml aufgefüllt. Durch komplexometrische Cu-Bestimmung<br />
wird die Zusammensetzung der Probe A5 überprüft. Alternativ kann in Absprache<br />
mit dem Assistenten auch eine Chloridbestimmung erfolgen.<br />
5. <strong>Praktikum</strong>stag<br />
A6: Rückgewinnung von CuSO 4 ⋅ 5 H 2 O<br />
Das CuCl aus Versuch A5 wird in halbkonzentrierter HCl suspendiert (5 ml pro 1 g CuCl). Durch<br />
Einleiten von Luft wird das einwertige Kupfer zu zweiwertigem oxidiert und geht als CuCl 2 in<br />
Lösung. (Die Oxidation kann - wenn man Zeit sparen will - auch durch Zutropfen von 2 ml H 2 O 2<br />
(30%ig) pro 1 g CuCl erfolgen.) Durch tropfenweises Zugeben von konz. Natronlauge wird ein<br />
pH-Wert von 6 bis 7 eingestellt. Dann werden einige Spatelspitzen Soda zugegeben. In der<br />
Siedehitze fällt basisches CuCO 3 aus. Dies wird abgesaugt, gründlich mit Wasser gewaschen,<br />
anschließend wieder in wenig Wasser aufgeschlämmt und mit der gerade nötigen Menge konz.<br />
Schwefelsäure in der Siedehitze zu Sulfat gelöst. Die Lösung wird weitgehend eingeengt. Aus<br />
der heißgesättigten Lösung kristallisiert CuSO 4 ⋅ 5 H 2 O beim Abkühlen im Eisbad aus. Die<br />
Mutterlauge wird abdekantiert und bei einem späteren Recyclingversuch mit verwertet. Die<br />
großen Kristalle werden kurz mit wenig Eiswasser abgewaschen und im Exsikkator über Blaugel<br />
getrocknet.<br />
Auswertung: Bestimmen Sie die Ausbeute und setzen Sie diese in Beziehung zur Gesamtmenge<br />
der eingesetzten Cu-Verbindungen! Diskutieren Sie das Ergebnis: Bei welchen<br />
Reaktionsstufen treten die größten Substanzverluste auf? Machen Sie Vorschläge<br />
<strong>für</strong> eine eventuell andere Gestaltung des Reaktionszyklus oder auch dessen<br />
Ausdehnung auf weitere Verbindungen mit interessanten Eigenschaften!<br />
7
<strong>Praktikum</strong> <strong>„Anorganische</strong> <strong>Chemie</strong> <strong>für</strong> <strong>Lehramtskandidaten</strong>“ / Hauptstudium<br />
Das <strong>Praktikum</strong> findet über einen Zeitraum von fünf Wochen an jeweils einem Tag pro Woche<br />
statt. Es dient der Vertiefung bzw. Erweiterung der im Grundstudium erworbenen Kenntnisse und<br />
Fähigkeiten beim präparativen und analytischen Arbeiten. Es werden Versuche zur Darstellung<br />
und zur Charakterisierung anorganischer Substanzen durchgeführt. In der Regel wird in der<br />
letzten Präparatestufe der Ausgangsstoff wieder zurückgewonnen. Auf diesem Wege lernen die<br />
Studenten unterschiedliche Reaktionstypen und Verbindungsklassen kennen. Das Prinzip der<br />
Synthese in geschlossenen Kreisläufen soll u. a. Anregungen <strong>für</strong> die spätere selbständige Planung<br />
von Schulversuchen unter Berücksichtigung von Aspekten des Umweltschutzes und des<br />
sparsamen Umgangs mit Chemikalien vermitteln. Die Konzeption der Stoffkreisläufe zur <strong>Chemie</strong><br />
des Kupfers, Nickels und Cobalts erfolgte in Anlehnung an eine Publikation von V. Wiskamp et<br />
al. in <strong>Chemie</strong> in unserer Zeit 27(1993)48.<br />
Die zum Einsatz gelangenden physikalisch-chemischen Untersuchungsmethoden sind nur eine<br />
kleine Auswahl der Vielzahl von zur Charakterisierung von anorganischen Festkörpern<br />
verwendeten Methoden. Kenntnisse über weitere Methoden sind im Selbststudium und durch<br />
gegenseitige Information zu erwerben.<br />
Vor Beginn der praktischen Arbeiten findet eine <strong>Praktikum</strong>seinführung und<br />
Sicherheitsunterweisung statt. Informieren Sie sich bitte unabhängig davon über einige<br />
grundsätzliche Inhalte des Chemikaliengesetzes, der Gefahrstoffverordnung und der Technischen<br />
Regeln <strong>für</strong> Gefahrstoffe sowie über allgemeine Richtlinien <strong>für</strong> die Arbeit im Labor ( Jander,<br />
Blasius: Lehrbuch der analytischen und präparativen anorganischen <strong>Chemie</strong>, Auflage 1995,<br />
S.141-161). Zur Vorbereitung auf die jeweiligen <strong>Praktikum</strong>saufgaben gehört neben den<br />
Informationen über zu verwendende Synthese- und Charakterisierungsmethoden auch das<br />
Vertrautmachen mit den Eigenschaften der verwendeten Substanzen einschließlich ihrer R- und<br />
S-Sätze. Die entsprechenden Angaben sind Bestandteil der Protokolle.<br />
<strong>Praktikum</strong>sbegleitend finden in enger Anlehnung an die <strong>Praktikum</strong>saufgaben vier Seminar statt:<br />
1. Komplexverbindungen - Bindung, Struktur und Eigenschaften<br />
2. Thermische Analyse<br />
3. Strukturuntersuchung mit Röntgenstrahlung<br />
4. Syntheseprinzipien in der Anorganischen <strong>Chemie</strong><br />
Im vierten Seminar informieren sich die <strong>Praktikum</strong>steilnehmer durch Kurzvorträge gegenseitig<br />
über die jeweils durchgeführten Synthesen und die Eigenschaften der erhaltenen Produkte. Ziel<br />
des Seminars sind verallgemeinernde Aussagen über Syntheseprinzipien und die Vertiefung von<br />
Kenntnissen über ausgewählte (insbesondere anwendungsrelevante) Festkörpereigenschaften.<br />
Literatur:<br />
G. Brauer, Handbuch der präparativen anorganischen <strong>Chemie</strong>,<br />
Emke Verlag, Stuttgart 1975<br />
G. Jander, E. Blasius, Einführung in das anorganisch-chemische <strong>Praktikum</strong>,<br />
S.Hirzel Verlag, Stuttgart 1990<br />
G. Jander, E. Blasius, Lehrbuch der analytischen und präparativen<br />
anorganischen <strong>Chemie</strong>, S. Hirzel Verlag, Stuttgart 1995<br />
D. F. Shriver, P. W. Atkins, C. H. Langford, Anorganische <strong>Chemie</strong> - ein weiterführendes<br />
Lehrbuch, VCH, 1992<br />
A. R. West, Grundlagen der Festkörperchemie, VCH, 1992<br />
<strong>Chemie</strong> im Kreislauf ( Versuchsanleitungen s. u.)
2<br />
Cobaltkreislauf Kupferkreislauf Nickelkreislauf Eisenkreislauf<br />
CoCl 2 CuSO 4 NiCl 2 (NH 4 ) 2 Fe(SO 4 ) 2 • 6 H 2 O<br />
[Co(NH 3 ) 6 ]Cl 3 Cu(NH 3 ) 4 SO 4 Ni(NH 3 ) 6 Cl 2 Fe(C 2 O 4 ) x 2 H 2 O<br />
Co(CH 3 COO) . 2 4H 2 O K 2 [Cu(C 2 O 4 ) 2 ] NiCO 3 [K 3 Fe(C 2 O 4 ) 3 ] •<br />
3 H 2 O<br />
(Zn,Co)(C 2 O 4 ) CuO Ni(CH 3 COO) 2 Fe 2 O 3<br />
ZnCo 2 O 4 CuCl 2 Ni(COO) 2 Fe(acac) 3<br />
K 3 [Co(NO 2 ) 6 ] Cu NiO Fe(NO 3 ) 3<br />
CoCl 2 CuCl NiCl 2 (NH 4 ) 2 Fe(SO 4 ) 2 • 6 H 2 O<br />
CuCl 2<br />
CuCO 3<br />
CuSO 4<br />
Fakultatives Versuchsangebot<br />
Für ergänzende und fakultative Versuche steht in einem begrenzten Umfang weitere Zeit zur<br />
Verfügung. Hier<strong>für</strong> können Versuche aus dem nachstehenden Angebot ausgewählt werden.<br />
Thénards Blau<br />
a.) Eine innige Mischung von 2 g Al 2 (SO 4 ) 3 ⋅ 18 H 2 O und 300 mg CoCl 2 ⋅ 6 H 2 O wird in einem<br />
Porzellantiegel langsam erwärmt, bis das Kristallwasser verdampft ist. Nach Abkühlen wird<br />
nochmals gut gemörsert und nun 30 bis 60 min auf Rotglut erhitzt. Nach dem Abkühlen wird der<br />
Schmelzkuchen mit verd. Salzsäure versetzt, bis nur noch ein leuchtend blauer Rückstand von<br />
CoAl 2 O 4 nicht in Lösung gegangen ist. Dieser wird abfiltriert, mit Wasser gewaschen und im<br />
Trockenschrank bei 100 °C getrocknet.<br />
b.) Zu einem stöchiometrischen Gemenge von CoO und Al 2 O 3 setzt man die 1,5fache<br />
Gewichtsmenge KCl zu und erhitzt im Pyrolantiegel auf 1100°C. Nach dem Abkühlen wird die<br />
erhaltene Schmelze mit Wasser ausgekocht, der Rückstand mit Wasser gewaschen und bei 60°C<br />
getrocknet.<br />
Literatur: Brauer (Auflage 1981), Band 3, S. 1699.<br />
Rinmanns Grün<br />
2g Zinkoxid und 200 mg CoCl 2 ⋅ 6 H 2 O werden innig gemischt und in einem Porzellantiegel<br />
langsam erwärmt. zunächst verdampft das Kristallwasser, dann wird etwa 15 bis 30 min bis zur<br />
gelinden Rotglut erhitzt, wobei sich die Mischung hellgrün färbt. Man lässt abkühlen, wäscht das<br />
Pulver (ZnCo 2 O 4 ) gründlich mit Wasser aus und trocknet es im Trockenschrank bei 100 °C.<br />
Literatur: V. Wiskamp, R. Bauer, K. Trageser, V. Wenzel, <strong>Chemie</strong> in unserer Zeit 27(1993)48.<br />
2
3<br />
Alchimistengold<br />
Man nehme ein Becherglas, in welchem einige 10 Cent-Münzen am Rand aufgestellt sind. Die<br />
Münzen werden mit einer schwach essigsauren Lösung von CuSO 4 (Massenanteil 1 bis 2 %) und<br />
NaCl (Massenanteil 10%) in Wasser bedeckt. Dabei soll die Flüssigkeit mindestens 1 cm über die<br />
Oberkante der Münzen reichen. Nach kurzer Zeit überzieht sich das Messing vom Rand her mit<br />
einem Kupferspiegel. Man sieht den Kupferüberzug gut, wenn man das Becherglas “von außen”<br />
betrachtet, die zur Mitte des Becherglases zeigende Münzseite sieht dagegen unverkupfert aus.<br />
Erklären Sie diesen überraschenden Befund! Nach einiger Zeit sind alle Messingschichten<br />
verkupfert, was man beim Herausnehmen der Münzen feststellen kann.<br />
Literatur: R. Lemke, Chemkon 3(1993)84; W. Jansen, Chemkon 4(1994)85.<br />
Das Kupferiodid-Gleichgewicht<br />
Man gibt in ein Reagensglas zu ca. 2 ml einer 1M Kupfersulfatlösung etwa 6 ml 1M KI-Lösung<br />
hinzu. Es bildet sich eine braune Suspension (Reaktionsgleichung?). Gibt man nun etwa 5 ml<br />
Pentan hinzu, setzt einen Stopfen auf und schüttelt kräftig durch, so erkennt man, dass sich die<br />
Pentanschicht violett färbt. Am Boden des Reagensglases erkennt man jetzt einen weißen<br />
Niederschlag. Man gibt nun etwa 5 ml Ammoniaklösung (Massenanteil NH 3 : 25%) und schüttelt<br />
wiederum kräftig durch. Die wässrige Phase wird nun intensiv blauviolett (Reaktionsgleichung?).<br />
Erklären Sie den Versuchsablauf unter Berücksichtigung folgender konditioneller<br />
Standardelektrodenpotentiale U H o’ : Cu/Cu ++ (aq): +0,34 V, Cu/Cu(NH 3 ) 4 ++ : -0,12 V.<br />
Literatur: W. van der Veer, P. de Rijke, Chemkon 6(1996)25.<br />
Anregungen <strong>für</strong> weitere Anorganisch-chemische Experimente:<br />
Blei- und Kupfergewinnung im Rahmen eines anorganischen <strong>Praktikum</strong>s<br />
Literatur: V. Wiskamp, H. Lüdtke, R. Gruehn, <strong>Chemie</strong> in unserer Zeit 30(1996)19.<br />
Aufarbeitung anorganischer Reste aus der organischen Synthese<br />
Literatur: V. Wiskamp, <strong>Chemie</strong> in unserer Zeit 29(1995)211.<br />
Eisen-, Calcium- und Kupfer-Kreisläufe<br />
Literatur: V. Kramb, W. Proske, V. Wiskamp, Naturwissenschaft im Unterricht-<strong>Chemie</strong><br />
7(1996)9. (weitere Versuche zu Kreisläufen ebenfalls in Heft 32)<br />
Silberrückgewinnung aus Röntgenfilmen<br />
Literatur: V. Kramb, A. Nickel, V. Wiskamb, Chemkon (1995)113.<br />
Löslichkeit von Kohlendioxid in Wasser - ein verblüffendes Experiment<br />
Literatur: W. van der Veer, P. deRijke, Chemkon (1994)83.<br />
3
4<br />
Seminare<br />
1. Seminar: Komplexverbindungen - Bindung, Struktur und Eigenschaften<br />
• Grundzüge der Ligandenfeldtheorie<br />
• Magnetische Eigenschaften von Komplexverbindungen<br />
• Optische Eigenschaften und spektrochemische Reihe<br />
• Koordinationszahl und Symmetrie<br />
• Thermodynamische und kinetische Stabilität von Komplexverbindungen<br />
• Besprechung der im <strong>Praktikum</strong> synthetisierten Komplexverbindungen<br />
Literatur: Atkins u. a.:Anorganische <strong>Chemie</strong>, Kap. 7,<br />
Christen, Meyer: Allg. u. Anorg. <strong>Chemie</strong>, Kap.6<br />
2. Seminar: Thermische Analyse<br />
• Thermodynamische Grundlagen<br />
• Methoden (DSC, DTA, TG, DTG)<br />
• Auswertung von Ergebnissen thermischer Analysen (insbesondere selbst synthetisierte<br />
Proben)<br />
Literatur: Autorenkollektiv: Analytikum , 9. Auflage 1994, Kap. 7: Thermische Analyse<br />
M. Otto: Analytische <strong>Chemie</strong>, Kap. 2.8. Thermische Methoden<br />
West: Festkörperchemie, Kap. 4.3.<br />
3. Seminar: Strukturuntersuchung mit Röntgenstrahlung<br />
• Kristallsysteme und Bravaisgitter<br />
• Wiederholung ausgewählter Kristallstrukturen<br />
• Röntgenbeugungs-Techniken<br />
• Prinzipieller Gang einer Röntgenstrukturanalyse<br />
• Auswertung des Röntgenpulverdiffraktogramms der vom Student synthetisierten Probe<br />
Literatur: West: Festkörperchemie, Kap. 1.1., 1.2., 1.3 exemplarisch, Kap. 3.<br />
zur Ergänzung: Atkins u. a.:Anorganische <strong>Chemie</strong>, Kap. 4, Kap. 18.<br />
4. Seminar: Syntheseprinzipien in der Anorganischen <strong>Chemie</strong><br />
Im Mittelpunkt des Seminars stehen die von den Studenten durchgeführten Synthesen<br />
(Kurzvorträge zur gegenseitigen Information). Ziel des Seminars sind einige verallgemeinernde<br />
Aussagen zum Seminarthema:<br />
• Wiederholende Behandlung von Reaktionen in Elektrolytlösungen (Chem. Gleichgewichte)<br />
• Reaktionen unter Beteiligung einer festen Phase und einer Gasphase<br />
• Reaktionen unter Beteiligung einer festen und einer flüssigen Phase (Lösung bzw.<br />
Schmelzphase)<br />
• Fest-fest-Reaktionen<br />
• Elektrische und magnetische Eigenschaften ausgewählter Festkörper<br />
Literatur: Atkins u. a.: Anorganische <strong>Chemie</strong>, Kap. 8.<br />
West: Festkörperchemie, Kap. 7, Kap. 8.1., 8.2. (auszugsweise)<br />
4
5<br />
<strong>Chemie</strong> des Nickels<br />
1. <strong>Praktikum</strong>stag<br />
B 1: [Ni(NH 3 ) 6 ]Cl 2<br />
8 g NiCl 2 . 6 H 2 O werden in einem Becherglas in 6 ml Wasser gelöst. Dann werden 16 ml<br />
konzentrierte Ammoniaklösung, welche zusätzlich mit NH 4 Cl gesättigt ist, hinzugefügt. Dabei<br />
erwärmt sich die Lösung stark und färbt sich dunkelblau (evtl. etwas NH 3 - Lösung<br />
nachdosieren!). Die Flüssigkeit wird im Eisbad abgekühlt. Dabei bildet sich ein blauvioletter<br />
Niederschlag. Zur Vervollständigung der Reaktion fügt man tropfenweise noch 5 – 10 ml<br />
konzentrierte NH 3 -Lösung zu und beobachtet, ob weiterer Amminkomplex ausfällt. Der<br />
blauviolette Niederschlag wird über einen Büchner-Trichter abgesaugt, mit wenig konzentrierter<br />
Ammoniaklösung und anschließend mit wenig Alkohol gewaschen und an der Luft getrocknet.<br />
Kristalle und Mutterlauge werden im Versuch B2 weiterverwendet.<br />
Auswertung: Ermitteln Sie durch Wägung die Versuchsausbeute!<br />
Begründen Sie die Farbänderung der Lösung bei der Bildung des<br />
Amminkomplexes (spektrochemische Reihe)!<br />
Hexaamminnickel(II)chlorid ist paramagnetisch. Geben Sie hier<strong>für</strong> eine Erklärung<br />
auf der Grundlage einer ligandenfeldtheoretischen Betrachtung!<br />
B 2: Ni(CH 3 COO) 2 . 4 H 2 O<br />
Das isolierte [Ni(NH 3 ) 6 ]Cl 2 aus Versuch B1 wird in seine Mutterlauge gegeben. Man füllt mit<br />
Wasser auf ein Gesamtvolumen von 60 ml auf, erhitzt zum Sieden und trägt 8 g Soda in kleinen<br />
Portionen ein. Aus der ursprünglich violetten Lösung fällt ein hellgrüner Niederschlag von<br />
basischem Nickelcarbonat aus. Es muss so lange gekocht werden, bis die Lösung weitgehend<br />
farblos ist (Freisetzung von NH 3, Dauer 30 bis 45 min). Der Niederschlag wird abgesaugt und in<br />
mehreren Portionen mit insgesamt 150 ml Wasser gewaschen. Er wird weitgehend<br />
trockengesaugt, in ein Becherglas überführt, mit einer Mischung aus 6 ml Eisessig und 6 ml<br />
Wasser versetzt und in der Siedehitze gelöst (CO 2 -Entwicklung). Anschließend wird auf<br />
Raumtemperatur abgekühlt. Sobald sich die ersten Kristalle gebildet haben, wird das Becherglas<br />
zur Vervollständigung der Kristallisation in ein Eisbad gestellt. Die Kristalle werden nach etwa<br />
einer halben Stunde abgesaugt, mit 3 bis 4 ml Eiswasser in kleinen Portionen gewaschen,<br />
weitgehend trockengesaugt und im Exsikkator über Blaugel getrocknet. Die Kristalle werden im<br />
Versuch B3, die Mutterlauge im Versuch B5 weiterverwendet.<br />
Auswertung: Überprüfung der Zusammensetzung von Nickelacetat durch komplexometrische<br />
Titration von Nickel.<br />
Formulieren Sie Reaktionsgleichungen <strong>für</strong> die ablaufenden Reaktionen und diskutieren<br />
Sie den Einfluss der Reaktionsbedingungen auf die Gleichgewichtslage!<br />
5
6<br />
2. <strong>Praktikum</strong>stag<br />
B 3: Ni(C 2 O 4 ) . 2 H 2 O<br />
Etwa 100 mg des Produktes B2 werden genau eingewogen, in Wasser gelöst und in einem<br />
Maßkolben auf 50 ml aufgefüllt. Zur Bestimmung des Ni-Gehaltes werden mehrere 10 ml -<br />
Proben unter Verwendung von Murexid als Indikator komplexometrisch titriert. Auf der<br />
Grundlage des Analysenergebnisses wird die <strong>für</strong> die Fällung von Nickeloxalat benötigte Menge<br />
an Oxalsäure ermittelt.<br />
Das nach Entnahme der Analysenprobe verbleibende Nickelacetat wird in einer solchen Menge<br />
Wasser gelöst, dass eine etwa 0,2 molare Lösung entsteht. Die zur Fällung benötigte Menge<br />
Oxalsäuredihydrat (5 % Überschuß) wird ebenfalls in Wasser gelöst. Die Wassermenge soll so<br />
bemessen sein, daß eine etwa 0,5 molare Lösung entsteht. Zur Fällung wird die<br />
Nickelacetatlösung auf 60°C erwärmt. Unter Beibehaltung dieser Temperatur wird die<br />
Oxalsäurelösung langsam aus einer Bürette zugetropft. Nach Beendigung der Zugabe wird noch<br />
etwa 30 min bei 60°C gerührt, anschließend auf Raumtemperatur abgekühlt und der Niederschlag<br />
über einen Büchner-Trichter abfiltriert. Das Auswaschen erfolgt mit wenig Wasser, anschließend<br />
mit etwas Alkohol. Das erhaltene Nickeloxalat wird an der Luft getrocknet. Das farblose Filtrat<br />
wird in den Ausguss gegeben.<br />
Auswertung: Vergleich des Ergebnisses der Nickelacetatanalyse mit dem Erwartungswert,<br />
Ausbeuteberechnung <strong>für</strong> Nickeloxalat,<br />
Thermische Analyse des Nickeloxalates (Raumtemperatur bis 700°C), Zuordnung<br />
der DTA- und TG(DTG)- Effekte, Formulierung der Reaktionsgleichungen <strong>für</strong> die<br />
einzelnen Schritte der thermischen Zersetzung und Vergleich der theoretischen<br />
und experimentell ermittelten Massendifferenzen.<br />
3. <strong>Praktikum</strong>stag<br />
B 4: Thermische Zersetzung von Nickeloxalat zu NiO<br />
Das gesamte Produkt aus Versuch B3 wird in einem Pyrolantiegel eingewogen. Man erwärmt<br />
langsam mit dem Brenner. Die Verbrennung beginnt am Tiegelrand und schreitet - unter<br />
Aufglühen - bis zur Tiegelmitte fort. Es entsteht Nickeloxid. Merken Sie sich die Farbe des<br />
Produktes! Nach weitgehender Abkühlung wird der Pyrolantiegel mit dem Produkt in einen<br />
Kammerofen überführt und auf 1100°C erhitzt. Zwischenzeitlich wird der Tiegel bei etwa 750°C<br />
kurz aus dem Ofen entnommen, nach weitgehender Abkühlung die Farbe des Produktes<br />
registriert und anschließend sofort wieder in den Ofen gestellt. Nach Erreichen der<br />
Solltemperatur verbleibt die Probe noch 60 min im Ofen und wird anschließend aus dem heißen<br />
Ofen entnommen. Nach sofortiger Abkühlung auf Raumtemperatur sollte das Produkt eine grüne<br />
Farbe haben.<br />
Auswertung: Beobachten Sie den Verlauf der Zersetzung des Oxalates genau und ziehen Sie<br />
Schlussfolgerungen bezüglich der Wärmetönung der ablaufenden Reaktionen!<br />
Ermitteln Sie den Masseverlust bei der thermischen Zersetzung und vergleichen<br />
Sie mit den Ergebnissen der thermischen Analyse!<br />
Wie deuten Sie die Farbänderung beim Tempern des Zersetzungsproduktes?<br />
Informieren Sie sich über die magnetischen Eigenschaften von NiO, studieren Sie<br />
hierzu Kapitel 8 des LB Festkörperchemie von West!<br />
6
7<br />
Aufnahme des Röntgenpulverdiffraktogramms von NiO ( 2Θ = 10...100 °)<br />
4. <strong>Praktikum</strong>stag<br />
B 5: Rückgewinnung von NiCl 2 . 6 H 2 O<br />
Das im Versuch B5 erhaltene NiO wird in ein Becherglas überführt, pro 1 g NiO mit 8 ml<br />
konzentrierter Salzsäure versetzt, unter Erhitzen gelöst und bis fast zur Trockne abgeraucht. Der<br />
Reaktionsansatz sollte bis zur völligen Austrocknung noch einige Tage unter dem Abzug<br />
belassen werden. Anschließend wird ausgewogen und der auf diese Weise zurückgewonnene<br />
Ausgangsstoff zur weiteren Verwendung dem Assistenten übergeben. In ähnlicher Weise kann<br />
die Mutterlauge aus Versuch B2 durch mehrmaliges Abrauchen mit kleinen Mengen<br />
konzentrierter Salzsäure wieder in den Ausgangsstoff überführt werden.<br />
Auswertung: Sie erhalten das Röntgenpulverdiffraktogramm des NiO. Werten Sie unter<br />
folgenden Gesichtspunkten aus:<br />
-Reinheit des Produktes<br />
-Zuordnung der Röntgenreflexe (rechnergestützte Phasenanalyse)<br />
-Indizierung der NiO-Reflexe<br />
-Berechnung der Gitterparameter<br />
5. <strong>Praktikum</strong>stag<br />
Auswertung: Bestimmen Sie die Ausbeute des wiedergewonnenen Ausgangsstoffes und setzen<br />
Sie diese in Beziehung zur eingesetzten Nickelchloridmenge!<br />
Diskutieren Sie das Ergebnis: Bei welchen Reaktionsstufen treten die größten<br />
Substanzverluste auf? Machen Sie Vorschläge <strong>für</strong> eine eventuell andere<br />
Gestaltung des Reaktionszyklus oder auch dessen Ausdehnung auf weitere<br />
Verbindungen mit interessanten Eigenschaften!<br />
B 6: Durchführung eines Versuches aus dem fakultativen Angebot<br />
In Abhängigkeit von der noch zur Verfügung stehenden Zeit wird in Absprache mit dem<br />
Assistenten ein Versuch aus den untenstehenden Beispielen ausgewählt, nach entsprechender<br />
Vorbereitung durchgeführt und mit Protokoll ausgewertet.<br />
7