Grundwissen 9. Klasse - Gymnasium Waldkraiburg
Grundwissen 9. Klasse - Gymnasium Waldkraiburg Grundwissen 9. Klasse - Gymnasium Waldkraiburg
Grundwissen Chemie 9 (NTG) Molekülstruktur und Stoffeigenschaften 13 Erkläre an den räumlich korrekten Strukturformeln des Wassermoleküls und des Kohlenstoffdioxidmoleküls den Unterschied zwischen einer „polaren Atombindung“ und einem „permanenten Dipol“! In beiden Molekülen sind polare Atombindungen vorhanden. Die bindenden Elektronen sind zum elektronegativeren Partner verschoben. Dieser erhält eine negative Partialladung, der andere Partner eine positive Partialladung. Im Wasser-Molekül kommt es zu einer unsymmetrischen Ladungsverteilung, die Ladungsschwerpunkte der positiven und negativen Partialladungen fallen nicht zusammen. Das Wasser-Molekül ist ein polares Molekül, ein Dipol. Das Kohlenstoffdioxid-Molekül besitzt eine symmetrische Ladungsverteilung. Die Ladungsverschiebungen der beiden polaren C–O-Bindungen sind in dem linearen Molekül genau entgegengesetzt gerichtet und heben sich so in ihrer Wirkung auf. Das Kohlenstoffdioxid-Molekül ist trotz polarer Atombindungen kein Dipol. Grundwissen Chemie 9 (NTG) Molekülstruktur und Stoffeigenschaften 14 HBr, H 2 O Welche der angegebenen Moleküle sind permanente Dipole? Chlor, Hydrogenbromid, Methan, Wasser, Wasserstoff, Kohlenstoffdioxid Gib von diesen Molekülen jeweils die Lewisformel (Valenzstrichformel) an!
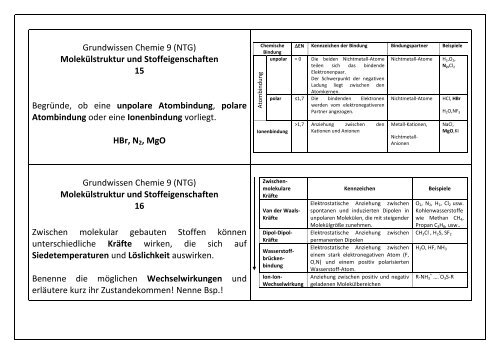
Atombindung Grundwissen Chemie 9 (NTG) Molekülstruktur und Stoffeigenschaften 15 Begründe, ob eine unpolare Atombindung, polare Atombindung oder eine Ionenbindung vorliegt. HBr, N 2 , MgO Chemische EN Kennzeichen der Bindung Bindungspartner Beispiele Bindung unpolar = 0 Die beiden Nichtmetall-Atome Nichtmetall-Atome H 2 ,O 2 , teilen sich das bindende N 2 ,Cl 2 Elektronenpaar. Der Schwerpunkt der negativen Ladung liegt zwischen den Atomkernen. polar ≤1,7 Die bindenden Elektronen Nichtmetall-Atome HCl, HBr werden vom elektronegativeren Partner angezogen. H 2 O,NF 3 Ionenbindung >1,7 Anziehung zwischen den Kationen und Anionen Metall-Kationen, Nichtmetall- Anionen NaCl, MgO,KI Grundwissen Chemie 9 (NTG) Molekülstruktur und Stoffeigenschaften 16 Zwischen molekular gebauten Stoffen können unterschiedliche Kräfte wirken, die sich auf Siedetemperaturen und Löslichkeit auswirken. Benenne die möglichen Wechselwirkungen und erläutere kurz ihr Zustandekommen! Nenne Bsp.! Zwischenmolekulare Kräfte Van der Waals- Kräfte Dipol-Dipol- Kräfte Wasserstoffbrückenbindung Ion-Ion- Wechselwirkung Kennzeichen Elektrostatische Anziehung zwischen spontanen und induzierten Dipolen in unpolaren Molekülen, die mit steigender Molekülgröße zunehmen. Elektrostatische Anziehung zwischen permanenten Dipolen Elektrostatische Anziehung zwischen einem stark elektronegativen Atom (F, O,N) und einem positiv polarisierten Wasserstoff-Atom. Anziehung zwischen positiv und negativ geladenen Molekülbereichen Beispiele O 2 , N 2 , H 2 , Cl 2 usw. Kohlenwasserstoffe wie Methan CH 4 , Propan C 3 H 8 , usw.. CH 3 Cl , H 2 S, SF 2 H 2 O, HF, NH 3 R-NH 3 + …. - O 3 S-R
- Seite 1 und 2: Chemie 9 (NTG) In der Jahrgangsstuf
- Seite 3 und 4: Grundwissen Chemie 9 (NTG) Qualitat
- Seite 5 und 6: Grundwissen Chemie 9 (NTG) Quantita
- Seite 7: Grundwissen Chemie 9 (NTG) Molekül
- Seite 11 und 12: Grundwissen Chemie 9 (NTG) Molekül
- Seite 13 und 14: Grundwissen Chemie 9 NTG S-B-Chemie
- Seite 15 und 16: Grundwissen Chemie 9 NTG S-B-Chemie
- Seite 17 und 18: Grundwissen Chemie 9 NTG Redoxchemi
- Seite 19 und 20: Grundwissen Chemie 9 NTG Redoxchemi
Atombindung<br />
<strong>Grundwissen</strong> Chemie 9 (NTG)<br />
Molekülstruktur und Stoffeigenschaften<br />
15<br />
Begründe, ob eine unpolare Atombindung, polare<br />
Atombindung oder eine Ionenbindung vorliegt.<br />
HBr, N 2 , MgO<br />
Chemische EN Kennzeichen der Bindung Bindungspartner Beispiele<br />
Bindung<br />
unpolar = 0 Die beiden Nichtmetall-Atome Nichtmetall-Atome H 2 ,O 2 ,<br />
teilen sich das bindende<br />
N 2 ,Cl 2<br />
Elektronenpaar.<br />
Der Schwerpunkt der negativen<br />
Ladung liegt zwischen den<br />
Atomkernen.<br />
polar ≤1,7 Die bindenden Elektronen Nichtmetall-Atome HCl, HBr<br />
werden vom elektronegativeren<br />
Partner angezogen.<br />
H 2 O,NF 3<br />
Ionenbindung<br />
>1,7 Anziehung zwischen den<br />
Kationen und Anionen<br />
Metall-Kationen,<br />
Nichtmetall-<br />
Anionen<br />
NaCl,<br />
MgO,KI<br />
<strong>Grundwissen</strong> Chemie 9 (NTG)<br />
Molekülstruktur und Stoffeigenschaften<br />
16<br />
Zwischen molekular gebauten Stoffen können<br />
unterschiedliche Kräfte wirken, die sich auf<br />
Siedetemperaturen und Löslichkeit auswirken.<br />
Benenne die möglichen Wechselwirkungen und<br />
erläutere kurz ihr Zustandekommen! Nenne Bsp.!<br />
Zwischenmolekulare<br />
Kräfte<br />
Van der Waals-<br />
Kräfte<br />
Dipol-Dipol-<br />
Kräfte<br />
Wasserstoffbrückenbindung<br />
Ion-Ion-<br />
Wechselwirkung<br />
Kennzeichen<br />
Elektrostatische Anziehung zwischen<br />
spontanen und induzierten Dipolen in<br />
unpolaren Molekülen, die mit steigender<br />
Molekülgröße zunehmen.<br />
Elektrostatische Anziehung zwischen<br />
permanenten Dipolen<br />
Elektrostatische Anziehung zwischen<br />
einem stark elektronegativen Atom (F,<br />
O,N) und einem positiv polarisierten<br />
Wasserstoff-Atom.<br />
Anziehung zwischen positiv und negativ<br />
geladenen Molekülbereichen<br />
Beispiele<br />
O 2 , N 2 , H 2 , Cl 2 usw.<br />
Kohlenwasserstoffe<br />
wie Methan CH 4 ,<br />
Propan C 3 H 8 , usw..<br />
CH 3 Cl , H 2 S, SF 2<br />
H 2 O, HF, NH 3<br />
R-NH 3 + …. - O 3 S-R