Grundwissen 9. Klasse - Gymnasium Waldkraiburg
Grundwissen 9. Klasse - Gymnasium Waldkraiburg
Grundwissen 9. Klasse - Gymnasium Waldkraiburg
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Grundwissen</strong><br />
Chemie 9 NTG<br />
Redoxchemie<br />
32<br />
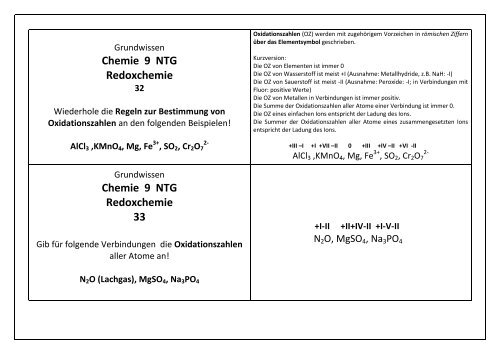
Wiederhole die Regeln zur Bestimmung von<br />
Oxidationszahlen an den folgenden Beispielen!<br />
AlCl 3 ,KMnO 4 , Mg, Fe 3+ , SO 2 , Cr 2 O 7<br />
2-<br />
<strong>Grundwissen</strong><br />
Chemie 9 NTG<br />
Redoxchemie<br />
33<br />
Gib für folgende Verbindungen die Oxidationszahlen<br />
aller Atome an!<br />
Oxidationszahlen (OZ) werden mit zugehörigem Vorzeichen in römischen Ziffern<br />
über das Elementsymbol geschrieben.<br />
Kurzversion:<br />
Die OZ von Elementen ist immer 0<br />
Die OZ von Wasserstoff ist meist +I (Ausnahme: Metallhydride, z.B. NaH: -I)<br />
Die OZ von Sauerstoff ist meist -II (Ausnahme: Peroxide: -I; in Verbindungen mit<br />
Fluor: positive Werte)<br />
Die OZ von Metallen in Verbindungen ist immer positiv.<br />
Die Summe der Oxidationszahlen aller Atome einer Verbindung ist immer 0.<br />
Die OZ eines einfachen Ions entspricht der Ladung des Ions.<br />
Die Summer der Oxidationszahlen aller Atome eines zusammengesetzten Ions<br />
entspricht der Ladung des Ions.<br />
+III –I +I +VII –II 0 +III +IV –II +VI -II<br />
AlCl 3 ,KMnO 4 , Mg, Fe 3+ , SO 2 , Cr 2 O 7<br />
2-<br />
+I-II<br />
+II+IV-II +I-V-II<br />
N 2 O, MgSO 4 , Na 3 PO 4<br />
N 2 O (Lachgas), MgSO 4 , Na 3 PO 4